План лекции l






























 План лекции l 1. Нейродегенеративные заболевания. Определение, основные нейродегенеративные заболевания человека l 2. Болезнь Альцгеймера. Этиология, патогенез, принципы патогенетической терапии l 3. Болезнь Паркинсона и паркинсонизм. Классификация, этиология, патогенез, принципы патогенетической терапии l 4. Прионные болезни. Нормальные и инфекционные прионные белки. Патогенез прионных болезней. Профилактика и лечение прионных болезней
План лекции l 1. Нейродегенеративные заболевания. Определение, основные нейродегенеративные заболевания человека l 2. Болезнь Альцгеймера. Этиология, патогенез, принципы патогенетической терапии l 3. Болезнь Паркинсона и паркинсонизм. Классификация, этиология, патогенез, принципы патогенетической терапии l 4. Прионные болезни. Нормальные и инфекционные прионные белки. Патогенез прионных болезней. Профилактика и лечение прионных болезней
 Нейродегенеративные заболевания Определение l Нейродегенеративные заболевания – это заболевания возникающие в результате дегенерации и гибели клеток ЦНС, приводящие к разрыву связей между отделами ЦНС, дисбалансу в синтезе или прекращению синтеза и выделения соответствующих нейромедиаторов и, как следствие этих процессов, вызывающие нарушение координации движений, памяти и мыслительных способностей человека
Нейродегенеративные заболевания Определение l Нейродегенеративные заболевания – это заболевания возникающие в результате дегенерации и гибели клеток ЦНС, приводящие к разрыву связей между отделами ЦНС, дисбалансу в синтезе или прекращению синтеза и выделения соответствующих нейромедиаторов и, как следствие этих процессов, вызывающие нарушение координации движений, памяти и мыслительных способностей человека
 l. К нейродегенеративным заболеваниям у человека относятся: болезнь Альцгеймера, паркинсонизм (в том числе – первичный паркинсонизм, или болезнь Паркинсона), боковой амиотрофический склероз, хорея Хантингтона, а также ряд «прионных болезней» : болезнь Крейтцфельда-Якоба, Куру, смертельная семейная бессоннница. Наиболее известная прионная болезнь у животных – «коровье бешенство» - губчатая энцефалопатия (у человека- это особая форма болезни Крейтцфельда-Якоба)
l. К нейродегенеративным заболеваниям у человека относятся: болезнь Альцгеймера, паркинсонизм (в том числе – первичный паркинсонизм, или болезнь Паркинсона), боковой амиотрофический склероз, хорея Хантингтона, а также ряд «прионных болезней» : болезнь Крейтцфельда-Якоба, Куру, смертельная семейная бессоннница. Наиболее известная прионная болезнь у животных – «коровье бешенство» - губчатая энцефалопатия (у человека- это особая форма болезни Крейтцфельда-Якоба)
 l Нейродегенеративные заболевания характеризуются длительным латентным периодом развития (от 6 - 8 до 15 – 20 лет), отсутствием действенных патогенетических методов лечения и абсолютно смертельным исходом, при условии, что пациент не погибает от какого либо патологического процесса, в своем развитии опередившего течение конкретного нейродегенеративного заболевания.
l Нейродегенеративные заболевания характеризуются длительным латентным периодом развития (от 6 - 8 до 15 – 20 лет), отсутствием действенных патогенетических методов лечения и абсолютно смертельным исходом, при условии, что пациент не погибает от какого либо патологического процесса, в своем развитии опередившего течение конкретного нейродегенеративного заболевания.
 Рональд Рейган, 40 президент США (1980 – 1988 гг. ). Скончался 6 июня 2004 года в возрасте 93 лет от болезни Альцгеймера
Рональд Рейган, 40 президент США (1980 – 1988 гг. ). Скончался 6 июня 2004 года в возрасте 93 лет от болезни Альцгеймера
 Известный немецкий патолог и гисто- лог. Образование получил в Вюрцбурге и в Берлине. После защиты докторской диссертации в Вюрцбурге работал во Франкфурте-на-Майне. Затем по пригла- шению известного немецкого психиатра Э. Крепелина – в его клинике сначала в Гейдельберге, а затем в Мюнхене, где его коллегами по работе были выдающиеся патологи и гистологи Ф. Ниссль и К. Брод- ман. В 1906 году на съезде психиатров в Алоис Альцгеймер Тюбингеме Альцгеймер сообщил об открытой им новой болезни – особом (Альцхаймер) виде старческого слабоумия, начинав- 1864 – 1915 шегося значительно раньше, чем обыч- ное сенильное слабоумие. По предложению Э. Крепелина ( в 1912 году ) болезнь получила название по имени автора (современное название – деменция Альцгеймеровского типа)
Известный немецкий патолог и гисто- лог. Образование получил в Вюрцбурге и в Берлине. После защиты докторской диссертации в Вюрцбурге работал во Франкфурте-на-Майне. Затем по пригла- шению известного немецкого психиатра Э. Крепелина – в его клинике сначала в Гейдельберге, а затем в Мюнхене, где его коллегами по работе были выдающиеся патологи и гистологи Ф. Ниссль и К. Брод- ман. В 1906 году на съезде психиатров в Алоис Альцгеймер Тюбингеме Альцгеймер сообщил об открытой им новой болезни – особом (Альцхаймер) виде старческого слабоумия, начинав- 1864 – 1915 шегося значительно раньше, чем обыч- ное сенильное слабоумие. По предложению Э. Крепелина ( в 1912 году ) болезнь получила название по имени автора (современное название – деменция Альцгеймеровского типа)
 Распространенность болезни Альцгеймера 1. Заболеваемость увеличивается с возрастом: 30 - 59 лет – 0, 02%; 60 – 69 лет – 0, 03%; 70 – 79 лет – 3, 1%; 80 – 89 лет – 10, 6%. 2. Женщины болеют в 3 – 5 раз чаще, чем мужчины. 3. Если не будет найдено радикальных средств борьбы с болезнью Альцгеймера, то прогнозируются следующие данные заболеваемости: к 2025 году в мире будет 2025 году 22 млн. больных, а к 2050 году – 45 млн. 22 млн. 2050 году – 45 млн больных (больше, чем предполагаемое число онкологических больных).
Распространенность болезни Альцгеймера 1. Заболеваемость увеличивается с возрастом: 30 - 59 лет – 0, 02%; 60 – 69 лет – 0, 03%; 70 – 79 лет – 3, 1%; 80 – 89 лет – 10, 6%. 2. Женщины болеют в 3 – 5 раз чаще, чем мужчины. 3. Если не будет найдено радикальных средств борьбы с болезнью Альцгеймера, то прогнозируются следующие данные заболеваемости: к 2025 году в мире будет 2025 году 22 млн. больных, а к 2050 году – 45 млн. 22 млн. 2050 году – 45 млн больных (больше, чем предполагаемое число онкологических больных).
 Болезнь Альцгеймера. Симптоматика - Прогрессирующее нарушение памяти (процесс нарушение памяти выпадения памяти – от настоящего к прошлому) и способности к абстрактному мышлению - Депрессия, дезориентация во времени и Депрессия пространстве - Нарушение способности к концентрации внимания и коммуникабельности внимания - Прогрессирующая умственная деградация и умственная деградация деперсонализация - Разрушение социальной функции и социальной функции способности выполнять работу - Смерть в течение 5 – 20 лет от начала Смерть заболевания
Болезнь Альцгеймера. Симптоматика - Прогрессирующее нарушение памяти (процесс нарушение памяти выпадения памяти – от настоящего к прошлому) и способности к абстрактному мышлению - Депрессия, дезориентация во времени и Депрессия пространстве - Нарушение способности к концентрации внимания и коммуникабельности внимания - Прогрессирующая умственная деградация и умственная деградация деперсонализация - Разрушение социальной функции и социальной функции способности выполнять работу - Смерть в течение 5 – 20 лет от начала Смерть заболевания
 Классификация болезни Альцгеймера - Пресенильная деменция альцгеймеровского типа (заболевание в возрасте до 65 лет; возможны случаи заболевания в 30 – 35 лет); - Сенильная деменция альцгеймеровского типа (заболевание в возрасте после 65 лет); - Деменция смешанного типа (атипичная болезнь Альцгеймера; сочетание признаков классической БА и сосудистой деменции).
Классификация болезни Альцгеймера - Пресенильная деменция альцгеймеровского типа (заболевание в возрасте до 65 лет; возможны случаи заболевания в 30 – 35 лет); - Сенильная деменция альцгеймеровского типа (заболевание в возрасте после 65 лет); - Деменция смешанного типа (атипичная болезнь Альцгеймера; сочетание признаков классической БА и сосудистой деменции).
 Генетика болезни Альцгеймера Гены, ответственные за развитие «семейных» Гены (пресенильных) форм болезни Альцгеймера: (пресенильных) - 21 хромосома – ген белка амилоидного предшественника (бета-АРР). Ген этого типа ответственен за 3 – 5% всех пресенильных форм болезни; - 14 хромосома – ген-пресенелин-1 (PSN-1). Ген PSN-1) ответственен за 60 – 70% всех пресенильных форм болезни; - 1 хромосома – ген-пресенелин-2 (PSN-2). Это наиболее редкое проявление пресенильной формы болезни. Пресенильные формы болезни Альцгеймера проявляются в возрасте 30 – 65 лет. лет
Генетика болезни Альцгеймера Гены, ответственные за развитие «семейных» Гены (пресенильных) форм болезни Альцгеймера: (пресенильных) - 21 хромосома – ген белка амилоидного предшественника (бета-АРР). Ген этого типа ответственен за 3 – 5% всех пресенильных форм болезни; - 14 хромосома – ген-пресенелин-1 (PSN-1). Ген PSN-1) ответственен за 60 – 70% всех пресенильных форм болезни; - 1 хромосома – ген-пресенелин-2 (PSN-2). Это наиболее редкое проявление пресенильной формы болезни. Пресенильные формы болезни Альцгеймера проявляются в возрасте 30 – 65 лет. лет
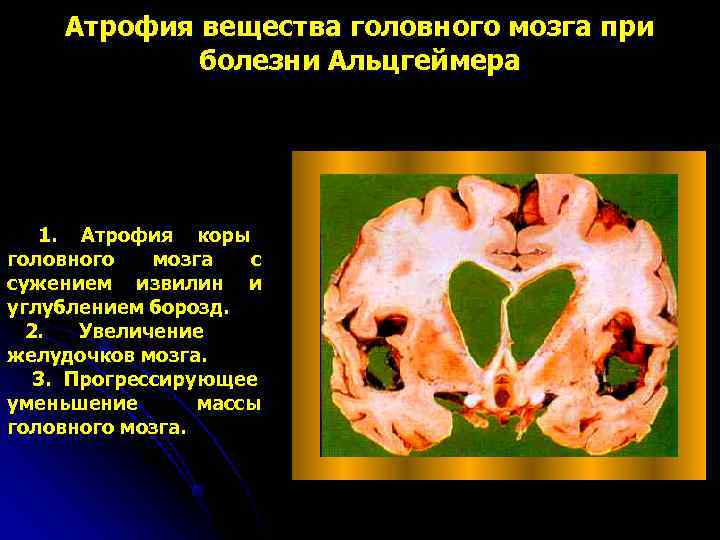
 Атрофия вещества головного мозга при болезни Альцгеймера 1. Атрофия коры головного мозга с сужением извилин и углублением борозд. 2. Увеличение желудочков мозга. 3. Прогрессирующее уменьшение массы головного мозга.
Атрофия вещества головного мозга при болезни Альцгеймера 1. Атрофия коры головного мозга с сужением извилин и углублением борозд. 2. Увеличение желудочков мозга. 3. Прогрессирующее уменьшение массы головного мозга.
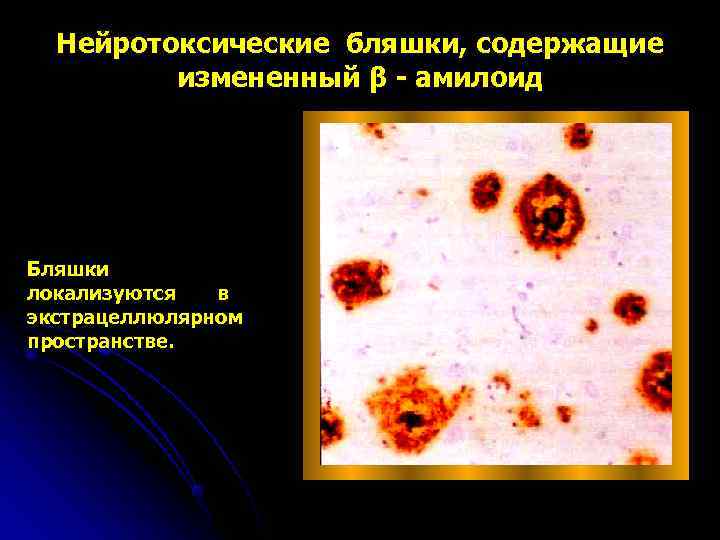
 Нейротоксические бляшки, содержащие измененный β - амилоид Бляшки локализуются в экстрацеллюлярном пространстве.
Нейротоксические бляшки, содержащие измененный β - амилоид Бляшки локализуются в экстрацеллюлярном пространстве.
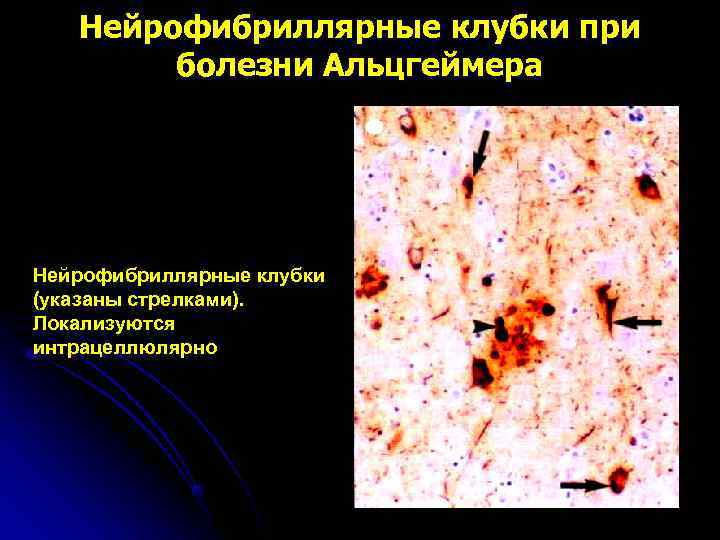
 Нейрофибриллярные клубки при болезни Альцгеймера Нейрофибриллярные клубки (указаны стрелками). Локализуются интрацеллюлярно
Нейрофибриллярные клубки при болезни Альцгеймера Нейрофибриллярные клубки (указаны стрелками). Локализуются интрацеллюлярно
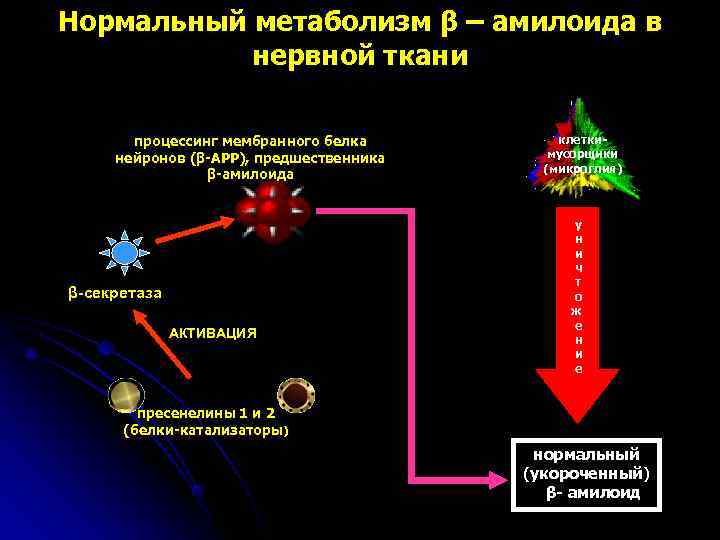
 Нормальный метаболизм β – амилоида в нервной ткани процессинг мембранного белка клетки- нейронов (β-АРР), предшественника мусорщики (микроглия) β-амилоида у н и ч т β-секретаза о ж е АКТИВАЦИЯ н и е пресенелины 1 и 2 (белки-катализаторы) нормальный (укороченный) β- амилоид
Нормальный метаболизм β – амилоида в нервной ткани процессинг мембранного белка клетки- нейронов (β-АРР), предшественника мусорщики (микроглия) β-амилоида у н и ч т β-секретаза о ж е АКТИВАЦИЯ н и е пресенелины 1 и 2 (белки-катализаторы) нормальный (укороченный) β- амилоид
 Функции нормального и измененного тау-белка нейронов l Тау-белок и белок тубулин в норме скрепляют и стабилизируют микротрубочки нейронов. l При их избыточном фосфорилировании эти белки теряют способность стабилизировать микротрубочки, они скручиваются в парные спирали (нейрофибриллярные клубки) и перестают транспортировать питательные и регуляционные вещества (трофогены), образующиеся в нейронах. Нейроны гибнут.
Функции нормального и измененного тау-белка нейронов l Тау-белок и белок тубулин в норме скрепляют и стабилизируют микротрубочки нейронов. l При их избыточном фосфорилировании эти белки теряют способность стабилизировать микротрубочки, они скручиваются в парные спирали (нейрофибриллярные клубки) и перестают транспортировать питательные и регуляционные вещества (трофогены), образующиеся в нейронах. Нейроны гибнут.
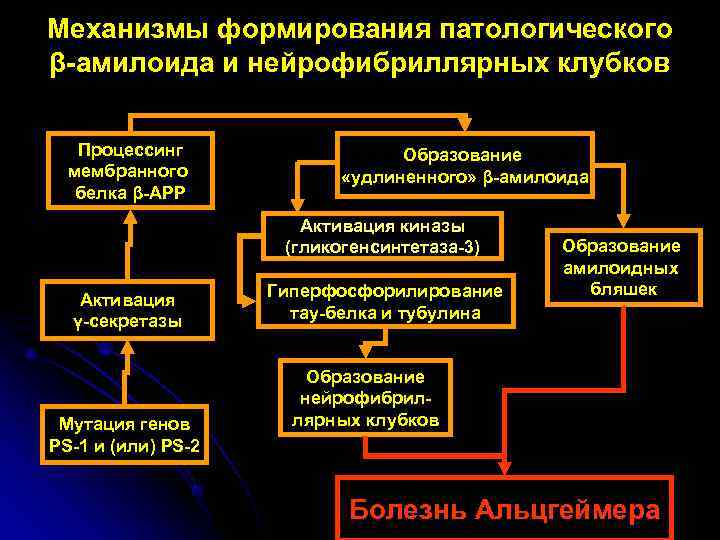
 Механизмы формирования патологического β-амилоида и нейрофибриллярных клубков Процессинг Образование мембранного «удлиненного» β-амилоида белка β-АРР Активация киназы (гликогенсинтетаза-3) Образование амилоидных Гиперфосфорилирование бляшек Активация γ-секретазы тау-белка и тубулина Образование нейрофибрил- Мутация генов лярных клубков PS-1 и (или) PS-2 Болезнь Альцгеймера
Механизмы формирования патологического β-амилоида и нейрофибриллярных клубков Процессинг Образование мембранного «удлиненного» β-амилоида белка β-АРР Активация киназы (гликогенсинтетаза-3) Образование амилоидных Гиперфосфорилирование бляшек Активация γ-секретазы тау-белка и тубулина Образование нейрофибрил- Мутация генов лярных клубков PS-1 и (или) PS-2 Болезнь Альцгеймера
 Факторы, усугубляющие развитие болезни Альцгеймера 1. Хронический психоэмоциональный стресс 2. Нарушение метаболизма глюкозы в ЦНС; Нарушение метаболизма глюкозы церебральный ацидоз 3. Экзогенная недостаточность альфа- токоферола (витамина Е) и, вследствие этого, токоферола ослабление контроля над свободно- радикальными процессами в головном мозгу 4. Усиление процессов перекисного окисления Усиление липидов и нарушение структурной организации липидов мембран нейронов 5. Динамические нарушения мозгового кровообращения 6. Микроинсульты на фоне атеросклероза Микроинсульты сосудов головного мозга.
Факторы, усугубляющие развитие болезни Альцгеймера 1. Хронический психоэмоциональный стресс 2. Нарушение метаболизма глюкозы в ЦНС; Нарушение метаболизма глюкозы церебральный ацидоз 3. Экзогенная недостаточность альфа- токоферола (витамина Е) и, вследствие этого, токоферола ослабление контроля над свободно- радикальными процессами в головном мозгу 4. Усиление процессов перекисного окисления Усиление липидов и нарушение структурной организации липидов мембран нейронов 5. Динамические нарушения мозгового кровообращения 6. Микроинсульты на фоне атеросклероза Микроинсульты сосудов головного мозга.
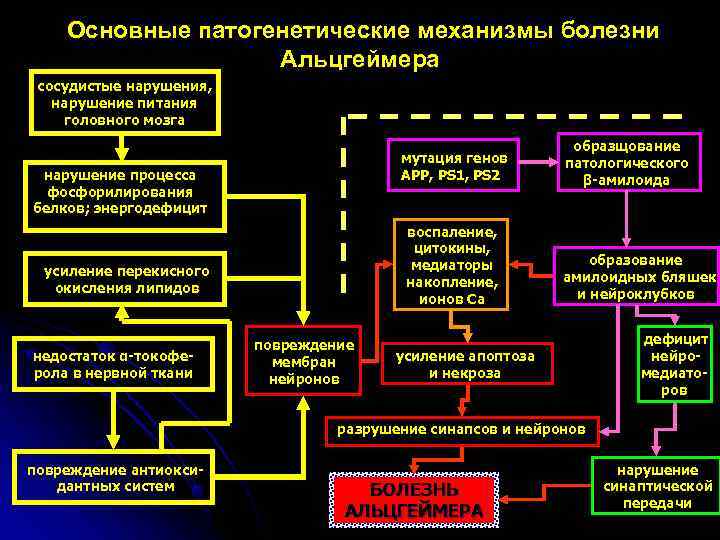
 Основные патогенетические механизмы болезни Альцгеймера сосудистые нарушения, нарушение питания головного мозга образщование мутация генов патологического нарушение процесса APP, PS 1, PS 2 β-амилоида фосфорилирования белков; энергодефицит воспаление, цитокины, медиаторы образование усиление перекисного амилоидных бляшек окисления липидов накопление, ионов Са и нейроклубков повреждение дефицит недостаток α-токофе- мембран усиление апоптоза нейро- рола в нервной ткани нейронов и некроза медиато- ров разрушение синапсов и нейронов повреждение антиокси- нарушение дантных систем БОЛЕЗНЬ синаптической передачи АЛЬЦГЕЙМЕРА
Основные патогенетические механизмы болезни Альцгеймера сосудистые нарушения, нарушение питания головного мозга образщование мутация генов патологического нарушение процесса APP, PS 1, PS 2 β-амилоида фосфорилирования белков; энергодефицит воспаление, цитокины, медиаторы образование усиление перекисного амилоидных бляшек окисления липидов накопление, ионов Са и нейроклубков повреждение дефицит недостаток α-токофе- мембран усиление апоптоза нейро- рола в нервной ткани нейронов и некроза медиато- ров разрушение синапсов и нейронов повреждение антиокси- нарушение дантных систем БОЛЕЗНЬ синаптической передачи АЛЬЦГЕЙМЕРА
 Принципы патогенетической терапии 1. Антиамилоидная терапия (снижение нейротоксических свойств бета-амилоида; снижение его продукции, например, применение фенсерина). 2. Предупреждение дефицита нейромедиаторов в ЦНС (холиномиметические и адреномиметические средства; ингибиторы ацетилхолинэстеразы). 3. Восполнение недостаточности других нейротрансмитерных систем (серотонинергической, глутаматергической). 4. Нейропротективная терапия (антиоксиданты и нейротрофики, в частности, церебролизин, актовегин). 5. Вазоактивные препараты (вазодилататоры). 6. Противовоспалительная терапия. 7. Препараты, снижающие уровень холестерина крови (в частности, статины).
Принципы патогенетической терапии 1. Антиамилоидная терапия (снижение нейротоксических свойств бета-амилоида; снижение его продукции, например, применение фенсерина). 2. Предупреждение дефицита нейромедиаторов в ЦНС (холиномиметические и адреномиметические средства; ингибиторы ацетилхолинэстеразы). 3. Восполнение недостаточности других нейротрансмитерных систем (серотонинергической, глутаматергической). 4. Нейропротективная терапия (антиоксиданты и нейротрофики, в частности, церебролизин, актовегин). 5. Вазоактивные препараты (вазодилататоры). 6. Противовоспалительная терапия. 7. Препараты, снижающие уровень холестерина крови (в частности, статины).
 Пациент с болезнью Паркинсона. (рисунок из руководства 1886 г. , W. R. Gowers)
Пациент с болезнью Паркинсона. (рисунок из руководства 1886 г. , W. R. Gowers)
 l Паркинсонизм как самостоятельная нозологическая единица был впервые описан английским врачом Джеймсом Пркинсоном (1755 – 1824) в 1817 году е его книге «Эссе о дрожательном параличе» l Клиника Паркинсонизма включает основную триаду: тремор, регидность мускулатуры и акинезию. Кроме того, для Паркинсонизма характерны расстройство походки, вегетативные расстройства, боль. Для завершающей стадии болезни характерны потеря памяти и деменция
l Паркинсонизм как самостоятельная нозологическая единица был впервые описан английским врачом Джеймсом Пркинсоном (1755 – 1824) в 1817 году е его книге «Эссе о дрожательном параличе» l Клиника Паркинсонизма включает основную триаду: тремор, регидность мускулатуры и акинезию. Кроме того, для Паркинсонизма характерны расстройство походки, вегетативные расстройства, боль. Для завершающей стадии болезни характерны потеря памяти и деменция
 Классификация Паркинсонизма l Первичный паркинсонизм (идиопатический, болезнь Паркинсона) - генетически обусловленная форма раннего паркинсонизма, а также ювенильный паркинсонизм, не имеющий генетической обусловленности l Вторичный паркинсонизм – клиническое проявление ряда самостоятельных заболеваний и поражений ЦНС: атеросклероза, инсультов, энцефалитов, интоксикаций, включая лекарственные интоксикации и повреждения
Классификация Паркинсонизма l Первичный паркинсонизм (идиопатический, болезнь Паркинсона) - генетически обусловленная форма раннего паркинсонизма, а также ювенильный паркинсонизм, не имеющий генетической обусловленности l Вторичный паркинсонизм – клиническое проявление ряда самостоятельных заболеваний и поражений ЦНС: атеросклероза, инсультов, энцефалитов, интоксикаций, включая лекарственные интоксикации и повреждения
 Первичный паркинсонизм разви- вается в возрасте до 40 лет Вторичный паркинсонизм харак- терен для возраста старше 60 лет Частота заболевания паркин- сонизмом – 150 -300 человек на 100 000 населения. В возрасте старше 60 лет паркинсонизм регистрирует- ся у 1 – 2% пациентов
Первичный паркинсонизм разви- вается в возрасте до 40 лет Вторичный паркинсонизм харак- терен для возраста старше 60 лет Частота заболевания паркин- сонизмом – 150 -300 человек на 100 000 населения. В возрасте старше 60 лет паркинсонизм регистрирует- ся у 1 – 2% пациентов
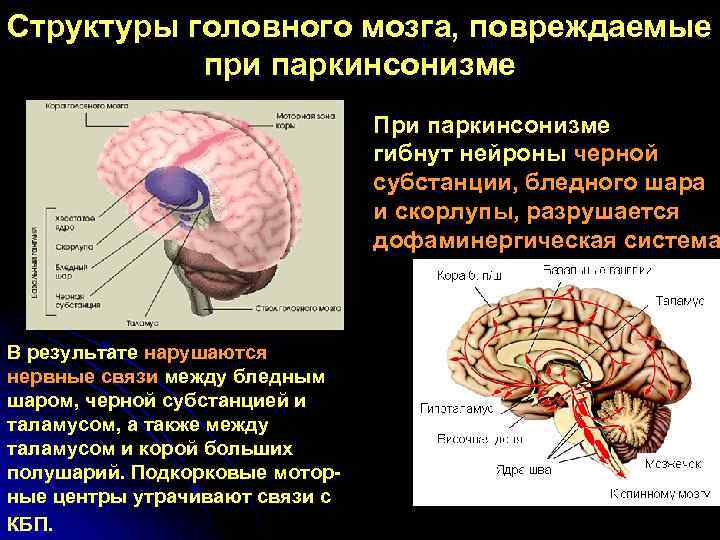
 Структуры головного мозга, повреждаемые при паркинсонизме При паркинсонизме гибнут нейроны черной субстанции, бледного шара и скорлупы, разрушается дофаминергическая система В результате нарушаются нервные связи между бледным шаром, черной субстанцией и таламусом, а также между таламусом и корой больших полушарий. Подкорковые мотор- ные центры утрачивают связи с КБП.
Структуры головного мозга, повреждаемые при паркинсонизме При паркинсонизме гибнут нейроны черной субстанции, бледного шара и скорлупы, разрушается дофаминергическая система В результате нарушаются нервные связи между бледным шаром, черной субстанцией и таламусом, а также между таламусом и корой больших полушарий. Подкорковые мотор- ные центры утрачивают связи с КБП.
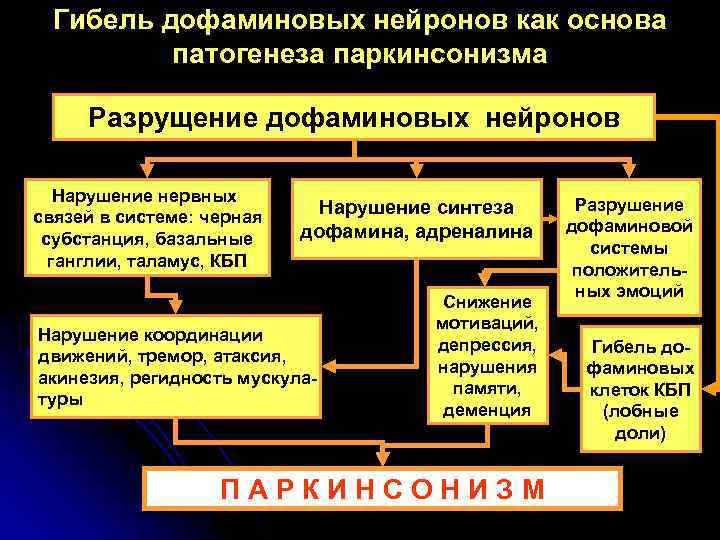
 Гибель дофаминовых нейронов как основа патогенеза паркинсонизма Разрущение дофаминовых нейронов Нарушение нервных Нарушение синтеза Разрушение связей в системе: черная дофамина, адреналина дофаминовой субстанция, базальные системы ганглии, таламус, КБП положитель- ных эмоций Снижение мотиваций, Нарушение координации депрессия, Гибель до- движений, тремор, атаксия, нарушения фаминовых акинезия, регидность мускула- памяти, клеток КБП туры деменция (лобные доли) П А Р К И Н С О Н И З М
Гибель дофаминовых нейронов как основа патогенеза паркинсонизма Разрущение дофаминовых нейронов Нарушение нервных Нарушение синтеза Разрушение связей в системе: черная дофамина, адреналина дофаминовой субстанция, базальные системы ганглии, таламус, КБП положитель- ных эмоций Снижение мотиваций, Нарушение координации депрессия, Гибель до- движений, тремор, атаксия, нарушения фаминовых акинезия, регидность мускула- памяти, клеток КБП туры деменция (лобные доли) П А Р К И Н С О Н И З М
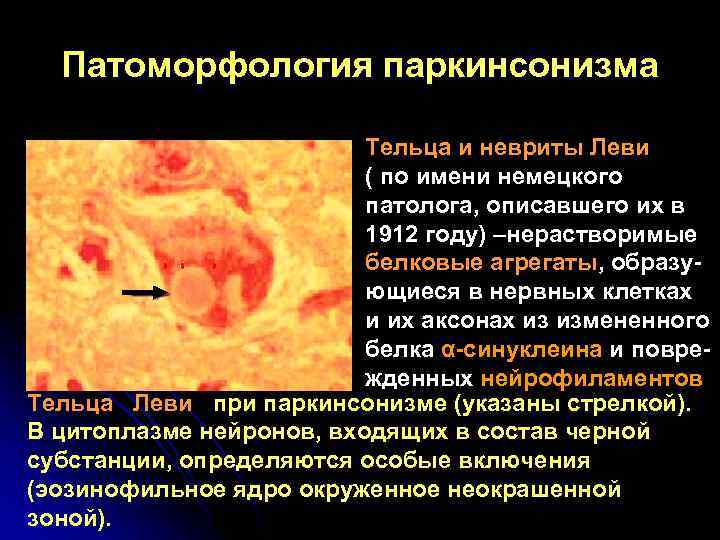
 Патоморфология паркинсонизма Тельца и невриты Леви ( по имени немецкого патолога, описавшего их в 1912 году) –нерастворимые белковые агрегаты, образу- ющиеся в нервных клетках и их аксонах из измененного белка α-синуклеина и повре- жденных нейрофиламентов Тельца Леви при паркинсонизме (указаны стрелкой). В цитоплазме нейронов, входящих в состав черной субстанции, определяются особые включения (эозинофильное ядро окруженное неокрашенной зоной).
Патоморфология паркинсонизма Тельца и невриты Леви ( по имени немецкого патолога, описавшего их в 1912 году) –нерастворимые белковые агрегаты, образу- ющиеся в нервных клетках и их аксонах из измененного белка α-синуклеина и повре- жденных нейрофиламентов Тельца Леви при паркинсонизме (указаны стрелкой). В цитоплазме нейронов, входящих в состав черной субстанции, определяются особые включения (эозинофильное ядро окруженное неокрашенной зоной).
 l . По химическому составу тельца и невриты Леви представляют собой комплекс, состоящий из измененного клеточного белка альфа-синуклеина и из фосфорилированных и подвергшихся частичному протеолизу белков нейрофиламентов, в норме формирующих цитоскелет аксонов. Наличие телец и невритов Леви нарушает метаболизм нейронов, препятствует нормальному аксональному транспорту веществ (трофогенов), образующихся в нервных клетках. l Образование телец Леви может провоцировать некроз клеток за счет нарушений их энергообразующей функции или индуцировать апоптоз.
l . По химическому составу тельца и невриты Леви представляют собой комплекс, состоящий из измененного клеточного белка альфа-синуклеина и из фосфорилированных и подвергшихся частичному протеолизу белков нейрофиламентов, в норме формирующих цитоскелет аксонов. Наличие телец и невритов Леви нарушает метаболизм нейронов, препятствует нормальному аксональному транспорту веществ (трофогенов), образующихся в нервных клетках. l Образование телец Леви может провоцировать некроз клеток за счет нарушений их энергообразующей функции или индуцировать апоптоз.
 Генетика первичного паркинсонизма (болезни Паркинсона) l 1. Рецессивные мутации гена белка паркина (PARKIN), а также генов DJ-1, PINK 1, в норме контролирующих процессинг соответствующих нейрональных белков, а также обеспечивающих защиту нейронов от поврежденных белков путем активации их лизиса соответствующими клеточными протеиназами. l 2. Мутации гена белка альфа-синуклеина, приводящие к изменению свойств альфа- синуклеина, благодаря чему он может образовывать патологические включения (агрегаты) в дофаминергических нейронах. l 3. Старение (снижение активности) или мутации генов белков-шаперонов, защищающих нейроны от деградировавших клеточных белков.
Генетика первичного паркинсонизма (болезни Паркинсона) l 1. Рецессивные мутации гена белка паркина (PARKIN), а также генов DJ-1, PINK 1, в норме контролирующих процессинг соответствующих нейрональных белков, а также обеспечивающих защиту нейронов от поврежденных белков путем активации их лизиса соответствующими клеточными протеиназами. l 2. Мутации гена белка альфа-синуклеина, приводящие к изменению свойств альфа- синуклеина, благодаря чему он может образовывать патологические включения (агрегаты) в дофаминергических нейронах. l 3. Старение (снижение активности) или мутации генов белков-шаперонов, защищающих нейроны от деградировавших клеточных белков.
 l Шапероны – универсальные белки, относящиеся к группе белков теплового шока. l Шапероны способны исправлять недостатки фолдирования ( «фолдинг» - сворачиание, конформирование) белков, предотвращают их агрегацию, способствуют удалению из клетки денатурированных белков
l Шапероны – универсальные белки, относящиеся к группе белков теплового шока. l Шапероны способны исправлять недостатки фолдирования ( «фолдинг» - сворачиание, конформирование) белков, предотвращают их агрегацию, способствуют удалению из клетки денатурированных белков
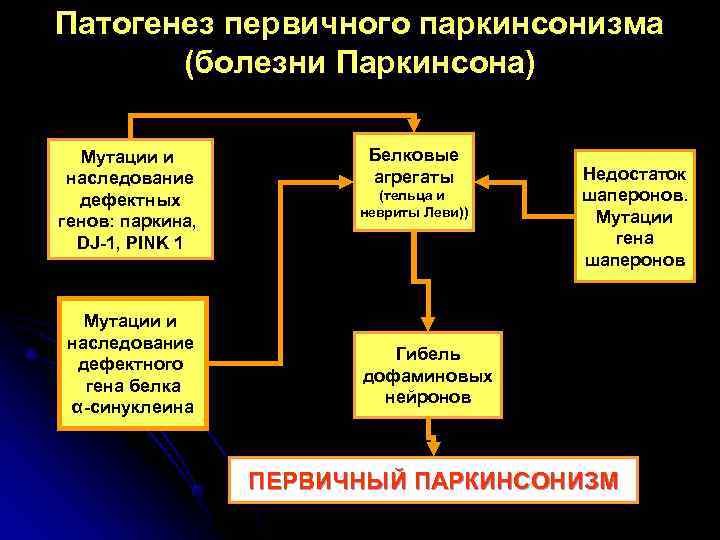
 Патогенез первичного паркинсонизма (болезни Паркинсона) Мутации и Белковые наследование агрегаты Недостаток дефектных (тельца и шаперонов. невриты Леви)) Мутации генов: паркина, DJ-1, PINK 1 гена шаперонов Мутации и наследование Гибель дефектного дофаминовых гена белка нейронов α-синуклеина ПЕРВИЧНЫЙ ПАРКИНСОНИЗМ
Патогенез первичного паркинсонизма (болезни Паркинсона) Мутации и Белковые наследование агрегаты Недостаток дефектных (тельца и шаперонов. невриты Леви)) Мутации генов: паркина, DJ-1, PINK 1 гена шаперонов Мутации и наследование Гибель дефектного дофаминовых гена белка нейронов α-синуклеина ПЕРВИЧНЫЙ ПАРКИНСОНИЗМ
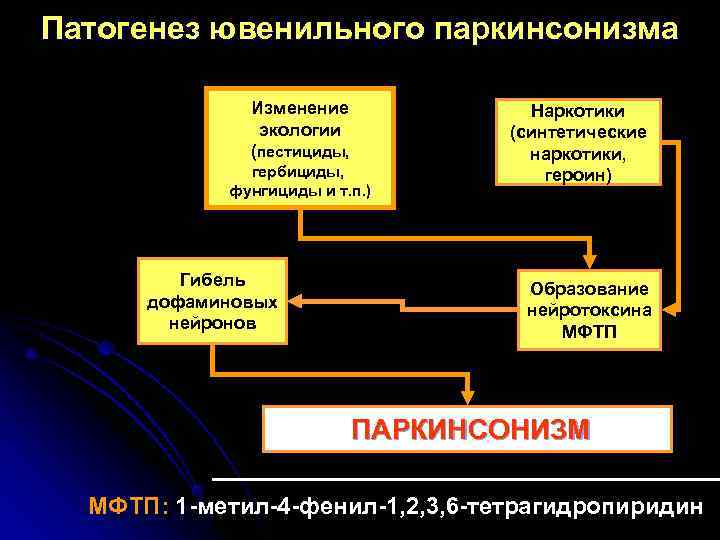
 Патогенез ювенильного паркинсонизма Изменение Наркотики экологии (синтетические (пестициды, наркотики, гербициды, героин) фунгициды и т. п. ) Гибель Образование дофаминовых нейротоксина нейронов МФТП ПАРКИНСОНИЗМ МФТП: 1 -метил-4 -фенил-1, 2, 3, 6 -тетрагидропиридин
Патогенез ювенильного паркинсонизма Изменение Наркотики экологии (синтетические (пестициды, наркотики, гербициды, героин) фунгициды и т. п. ) Гибель Образование дофаминовых нейротоксина нейронов МФТП ПАРКИНСОНИЗМ МФТП: 1 -метил-4 -фенил-1, 2, 3, 6 -тетрагидропиридин
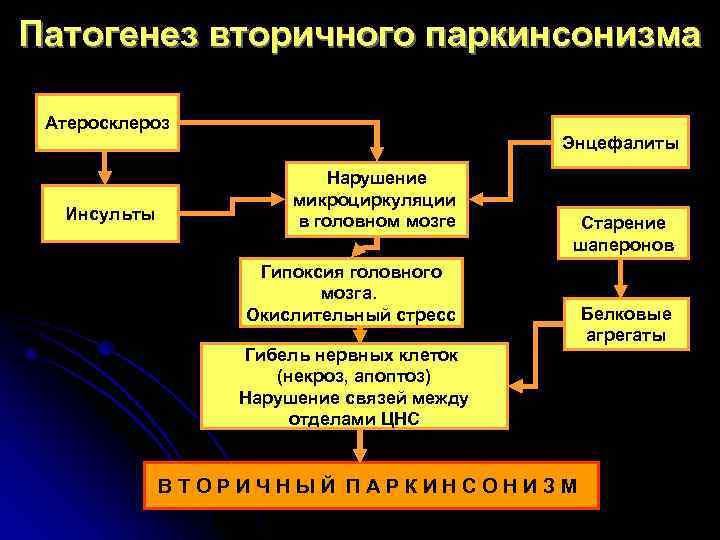
 Патогенез вторичного паркинсонизма Атеросклероз Энцефалиты Нарушение микроциркуляции Инсульты в головном мозге Старение шаперонов Гипоксия головного мозга. Окислительный стресс Белковые агрегаты Гибель нервных клеток (некроз, апоптоз) Нарушение связей между отделами ЦНС В Т О Р И Ч Н Ы Й П А Р К И Н С О Н И З М
Патогенез вторичного паркинсонизма Атеросклероз Энцефалиты Нарушение микроциркуляции Инсульты в головном мозге Старение шаперонов Гипоксия головного мозга. Окислительный стресс Белковые агрегаты Гибель нервных клеток (некроз, апоптоз) Нарушение связей между отделами ЦНС В Т О Р И Ч Н Ы Й П А Р К И Н С О Н И З М
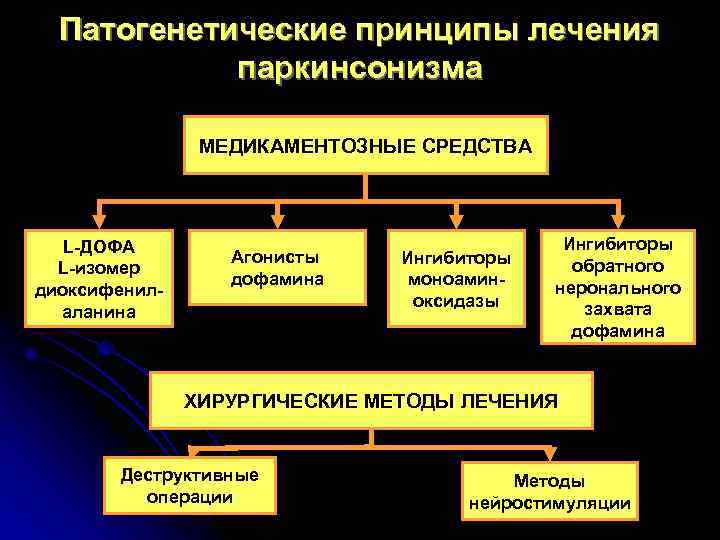
 Патогенетические принципы лечения паркинсонизма МЕДИКАМЕНТОЗНЫЕ СРЕДСТВА L-ДОФА Ингибиторы Агонисты Ингибиторы L-изомер обратного дофамина моноамин- диоксифенил- неронального оксидазы захвата аланина дофамина ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ Деструктивные Методы операции нейростимуляции
Патогенетические принципы лечения паркинсонизма МЕДИКАМЕНТОЗНЫЕ СРЕДСТВА L-ДОФА Ингибиторы Агонисты Ингибиторы L-изомер обратного дофамина моноамин- диоксифенил- неронального оксидазы захвата аланина дофамина ХИРУРГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ Деструктивные Методы операции нейростимуляции
 Нейрохирургические методы лечения болезни Паркинсона
Нейрохирургические методы лечения болезни Паркинсона
 Прионы - определение Прио ны (от англ. proteinaceous infectious particles — «белковые заразные частицы» ) - низкомолекулярные белки (27 -30 к. Да) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда животных, относящиеся к группе медленных инфекций, в частности, «трансмиссивных губкообразных энцефалопатий»
Прионы - определение Прио ны (от англ. proteinaceous infectious particles — «белковые заразные частицы» ) - низкомолекулярные белки (27 -30 к. Да) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда животных, относящиеся к группе медленных инфекций, в частности, «трансмиссивных губкообразных энцефалопатий»
 Прионные болезни человека l 1. Врожденные (генетически обусловленные) болезни: l - смертельная семейная бессонница; l - синдром Герстманна-Штреуселера- Шейнкера. l 2. Приобретенные болезни: l - болезнь куру. l 3. Болезни, которые могут быть и врожденными, и приобретенными: l - болезнь Крейтцфельда-Якоба.
Прионные болезни человека l 1. Врожденные (генетически обусловленные) болезни: l - смертельная семейная бессонница; l - синдром Герстманна-Штреуселера- Шейнкера. l 2. Приобретенные болезни: l - болезнь куру. l 3. Болезни, которые могут быть и врожденными, и приобретенными: l - болезнь Крейтцфельда-Якоба.
 Из истории изучения прионных болезней l 1. B. Sigurdsson (1954 г. ) – описал группу заболеваний животных (в том числе и болезнь скота «скрепи» ), которые получили название «медленных инфекций» l 2. D. Gajdusek, V. Zigas (1957 г. ) – описали заболевание (болезнь Куру), встречающиеся у папуасов Новой Гвинеи, исповедующих ритуальный каннибализм l 4. S. Prusiner (США, 1981 -1982 гг. ) – открыл, что болезнь животных, именуемая «скрепи» ( «губкообразная энцефалопатия» ), вызывается инфекционным белком - прионом
Из истории изучения прионных болезней l 1. B. Sigurdsson (1954 г. ) – описал группу заболеваний животных (в том числе и болезнь скота «скрепи» ), которые получили название «медленных инфекций» l 2. D. Gajdusek, V. Zigas (1957 г. ) – описали заболевание (болезнь Куру), встречающиеся у папуасов Новой Гвинеи, исповедующих ритуальный каннибализм l 4. S. Prusiner (США, 1981 -1982 гг. ) – открыл, что болезнь животных, именуемая «скрепи» ( «губкообразная энцефалопатия» ), вызывается инфекционным белком - прионом
 Лауреат Нобелевской Премии по биологии и медицине 1976 года Даниэль К. Гайдушек Нобелевская Премия присуждена «за открытия, касающиеся новых меха- низмов происхождения и распространения инфек- ционных заболеваний» (доказательство инфекци- онной природы болезни «куру» ) Даниэль К. Гайдушек Daniel Carleton Gajdusek (1923 – 2008)
Лауреат Нобелевской Премии по биологии и медицине 1976 года Даниэль К. Гайдушек Нобелевская Премия присуждена «за открытия, касающиеся новых меха- низмов происхождения и распространения инфек- ционных заболеваний» (доказательство инфекци- онной природы болезни «куру» ) Даниэль К. Гайдушек Daniel Carleton Gajdusek (1923 – 2008)
 Лауреат Нобелевской Премии в области биологии и медицины 1997 г. Стэнли Прузинер (Stnley B. Prusiner), США Нобелевская Премия присуждена «за вклад в изучение болезнетворного агента, вызывающего губчатую энцефалопатию или «коровье бешенство» , у крупного рогатого скота» (то есть, за открытие прионов)
Лауреат Нобелевской Премии в области биологии и медицины 1997 г. Стэнли Прузинер (Stnley B. Prusiner), США Нобелевская Премия присуждена «за вклад в изучение болезнетворного агента, вызывающего губчатую энцефалопатию или «коровье бешенство» , у крупного рогатого скота» (то есть, за открытие прионов)
 Медленные инфекции l Медленные инфекции (МИ) – заболевания, характеризующиеся следующими четырьмя признаками: l - длинный (месяцы и годы) инкубационный период; l - очень медленное развитие заболевания; l - специфичность поражения органов и тканей (в первую очередь – ЦНС); l - неизбежно смертельный исход. l МИ в процессе их изучения были разделены на две группы: l - МИ, вызываемые обычными вирусами; l - МИ, вызываемые «необычными вирусами» (позднее стало ясным, что речь идет об инфекционных белках-прионах)
Медленные инфекции l Медленные инфекции (МИ) – заболевания, характеризующиеся следующими четырьмя признаками: l - длинный (месяцы и годы) инкубационный период; l - очень медленное развитие заболевания; l - специфичность поражения органов и тканей (в первую очередь – ЦНС); l - неизбежно смертельный исход. l МИ в процессе их изучения были разделены на две группы: l - МИ, вызываемые обычными вирусами; l - МИ, вызываемые «необычными вирусами» (позднее стало ясным, что речь идет об инфекционных белках-прионах)
 Особенности нормальных прионных белков клетки l Нормальный прионный белок (Pr. PC – от «Prion Protein of Cell» ): l - у человека кодируются геном (PRNP), расположенным в коротком плече хромосомы 20; l - в нейронах ЦНС концентрация Pr. PC в 50 раз выше, чем в клетках других тканей; l - обеспечивает сохранение миелиновой оболочки аксонов нервных клеок; l - обепечивает регуляцию циркадианных (околосуточных) ритмов клетки.
Особенности нормальных прионных белков клетки l Нормальный прионный белок (Pr. PC – от «Prion Protein of Cell» ): l - у человека кодируются геном (PRNP), расположенным в коротком плече хромосомы 20; l - в нейронах ЦНС концентрация Pr. PC в 50 раз выше, чем в клетках других тканей; l - обеспечивает сохранение миелиновой оболочки аксонов нервных клеок; l - обепечивает регуляцию циркадианных (околосуточных) ритмов клетки.
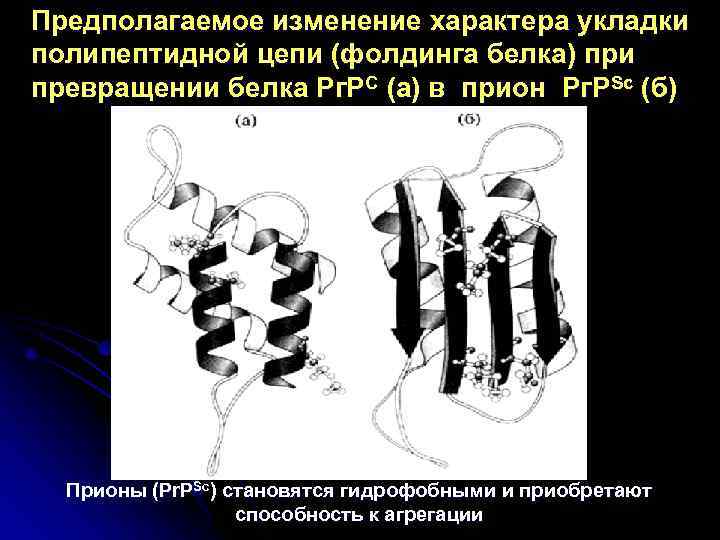
 Предполагаемое изменение характера укладки полипептидной цепи (фолдинга белка) при превращении белка Рг. РC (а) в прион Рг. РSc (б) Прионы (Pr. PSc) становятся гидрофобными и приобретают способность к агрегации
Предполагаемое изменение характера укладки полипептидной цепи (фолдинга белка) при превращении белка Рг. РC (а) в прион Рг. РSc (б) Прионы (Pr. PSc) становятся гидрофобными и приобретают способность к агрегации
 Особенности инфекционных прионных белков l Инфекционный прионный белок (Pr. PSc от названия одной из прионных болезней скота – «скрепи» - scrapie): l - переносчик прионных болезней (трансмиссивных губкообразных энцефалопатий); l - имеет высокую устойчивость к ультрафиолету, нагреванию, проникающей радиации, ультразвуку, клеточным протеазам; l - способен изменять конформацию нормальных клеточных прионовых белков, превращая их в Pr. PSc; l - не вызывает реакции иммунной системы (из за сходства с нормальными прионными белками); l - при накоплении на мембране клетки агрегируются, превращаются в амилоид, разрушает клетку и ее синапсы
Особенности инфекционных прионных белков l Инфекционный прионный белок (Pr. PSc от названия одной из прионных болезней скота – «скрепи» - scrapie): l - переносчик прионных болезней (трансмиссивных губкообразных энцефалопатий); l - имеет высокую устойчивость к ультрафиолету, нагреванию, проникающей радиации, ультразвуку, клеточным протеазам; l - способен изменять конформацию нормальных клеточных прионовых белков, превращая их в Pr. PSc; l - не вызывает реакции иммунной системы (из за сходства с нормальными прионными белками); l - при накоплении на мембране клетки агрегируются, превращаются в амилоид, разрушает клетку и ее синапсы
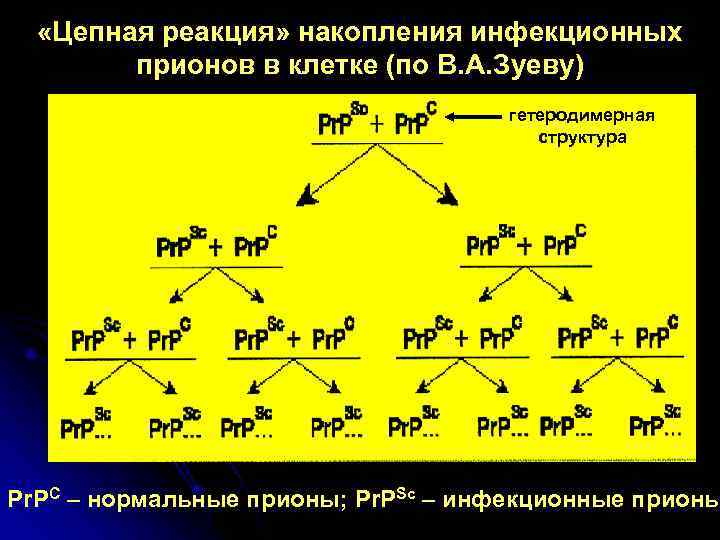
 «Цепная реакция» накопления инфекционных прионов в клетке (по В. А. Зуеву) гетеродимерная структура Pr. PC – нормальные прионы; Pr. PSc – инфекционные прионы
«Цепная реакция» накопления инфекционных прионов в клетке (по В. А. Зуеву) гетеродимерная структура Pr. PC – нормальные прионы; Pr. PSc – инфекционные прионы
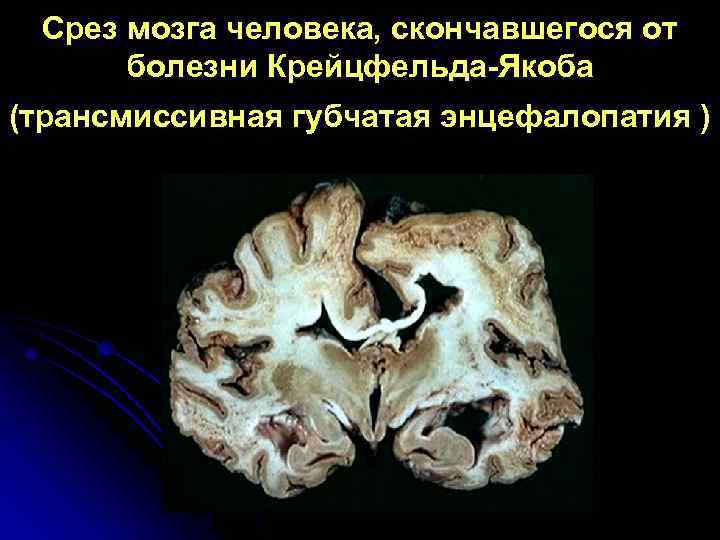
 Срез мозга человека, скончавшегося от болезни Крейцфельда-Якоба (трансмиссивная губчатая энцефалопатия )
Срез мозга человека, скончавшегося от болезни Крейцфельда-Якоба (трансмиссивная губчатая энцефалопатия )
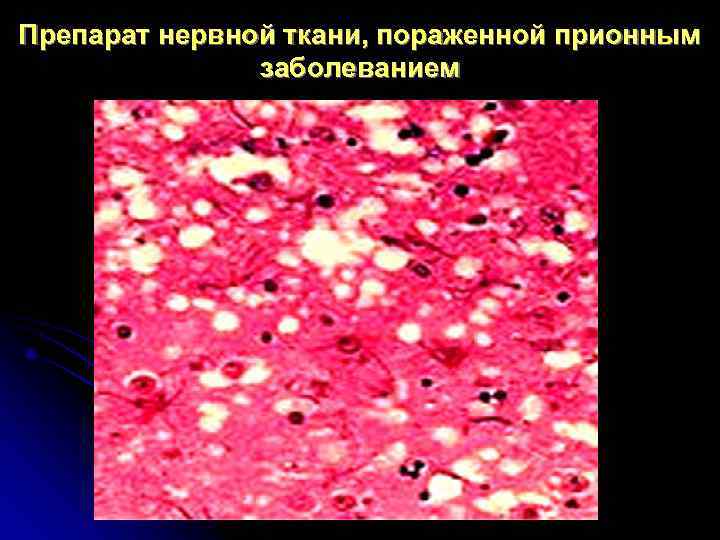
 Препарат нервной ткани, пораженной прионным заболеванием
Препарат нервной ткани, пораженной прионным заболеванием
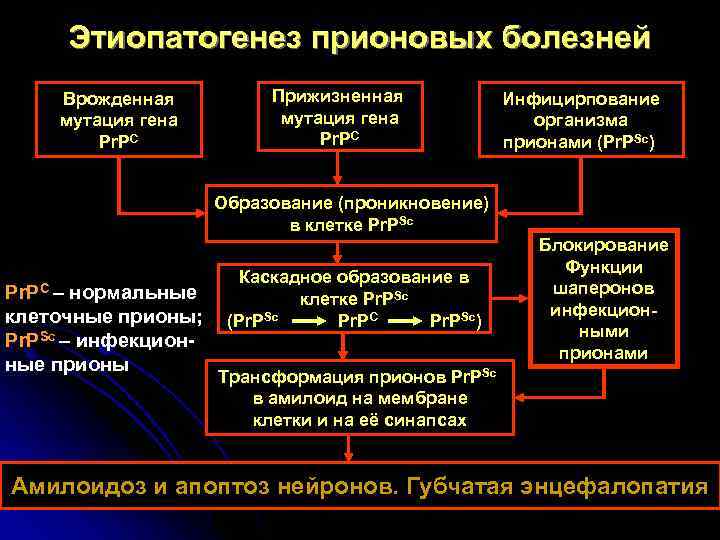
 Этиопатогенез прионовых болезней Врожденная Прижизненная Инфицирпование мутация гена организма Pr. PC прионами (Pr. PSc) Образование (проникновение) в клетке Pr. PSc Блокирование Функции Каскадное образование в Pr. PC – нормальные шаперонов клетке Pr. PSc клеточные прионы; инфекцион- (Pr. PSc Pr. PC Pr. PSc) ными Pr. PSc – инфекцион- прионами ные прионы Трансформация прионов Pr. PSc в амилоид на мембране клетки и на её синапсах Амилоидоз и апоптоз нейронов. Губчатая энцефалопатия
Этиопатогенез прионовых болезней Врожденная Прижизненная Инфицирпование мутация гена организма Pr. PC прионами (Pr. PSc) Образование (проникновение) в клетке Pr. PSc Блокирование Функции Каскадное образование в Pr. PC – нормальные шаперонов клетке Pr. PSc клеточные прионы; инфекцион- (Pr. PSc Pr. PC Pr. PSc) ными Pr. PSc – инфекцион- прионами ные прионы Трансформация прионов Pr. PSc в амилоид на мембране клетки и на её синапсах Амилоидоз и апоптоз нейронов. Губчатая энцефалопатия
 Профилактика и лечение прионных болезней l 1. Профилактика прионных инфекций: l - ограничение или запрещение на использование лекарственных средств, приготовленных из тканей крупного рогатого скота (в частности, приготовление гормональных препаратов из гипофиза животных): l - запрещение трансплантаций человеку твердой мозговой оболочки крупного рогатого скота. l 2. Лечение: l - радикальных мер и способов лечения человека, заболевшего одной из прионных болезней, не существует; l - в экспериментах на культуре ткани получены данные о том, что препарат брефелдин А, разрушающий клеточный аппарат Гольджи, препятствует синтезу Pr. PSc; l - блокаторы кальциевых каналов способствуют более длительному выживанию инфицированных животных
Профилактика и лечение прионных болезней l 1. Профилактика прионных инфекций: l - ограничение или запрещение на использование лекарственных средств, приготовленных из тканей крупного рогатого скота (в частности, приготовление гормональных препаратов из гипофиза животных): l - запрещение трансплантаций человеку твердой мозговой оболочки крупного рогатого скота. l 2. Лечение: l - радикальных мер и способов лечения человека, заболевшего одной из прионных болезней, не существует; l - в экспериментах на культуре ткани получены данные о том, что препарат брефелдин А, разрушающий клеточный аппарат Гольджи, препятствует синтезу Pr. PSc; l - блокаторы кальциевых каналов способствуют более длительному выживанию инфицированных животных

