Титрование Кривые титрования.ppt
- Количество слайдов: 45
 План лекции: 1. Окраска индикаторов 2. Титрование – скачок титрования. 3. Расчеты для построения кривых титрования 4. Примеры титрования 5. Ошибки титрования 5 а. Индикаторные погрешности 5 б. Ошибки определения объема
План лекции: 1. Окраска индикаторов 2. Титрование – скачок титрования. 3. Расчеты для построения кривых титрования 4. Примеры титрования 5. Ошибки титрования 5 а. Индикаторные погрешности 5 б. Ошибки определения объема
 Окраска метилового оранжевого 2
Окраска метилового оранжевого 2
 Метиловый красный 3
Метиловый красный 3
 Окраска фенолфталеина 4
Окраска фенолфталеина 4
 Окраска тимолфталпеина u Щелочная среда – дианион окрашен в синий цвет 5
Окраска тимолфталпеина u Щелочная среда – дианион окрашен в синий цвет 5
 Окраска фенолового красного 6
Окраска фенолового красного 6
 Интервал перехода индикаторов Фенолфталеин 8, 2 -10, 0 Метиловый оранжевый 3, 1 -4, 4 Метиловый красный 4, 2 -6, 2 7
Интервал перехода индикаторов Фенолфталеин 8, 2 -10, 0 Метиловый оранжевый 3, 1 -4, 4 Метиловый красный 4, 2 -6, 2 7
 Равновесие перехода индикатора u Интервал перехода окраски индикатора происходит не одновременно, а в определенном интервале р. Н. Поскольку в кислотно-основном титровании индикатор является чаще всего кислотой, равновесие можно описать константой. 8
Равновесие перехода индикатора u Интервал перехода окраски индикатора происходит не одновременно, а в определенном интервале р. Н. Поскольку в кислотно-основном титровании индикатор является чаще всего кислотой, равновесие можно описать константой. 8
 Из уравнения константы диссоциации 9
Из уравнения константы диссоциации 9
 р. Н перехода 10
р. Н перехода 10
 Показатель титрования u Значение р. Н, при котором заканчмвают титрование с тем или иным индикатором – p. T. u Величина показателя титрования находится примерно в середине интервала перехода окраски индикатора: например, у метилового оранжевого р. Т ≈ 4. 11
Показатель титрования u Значение р. Н, при котором заканчмвают титрование с тем или иным индикатором – p. T. u Величина показателя титрования находится примерно в середине интервала перехода окраски индикатора: например, у метилового оранжевого р. Т ≈ 4. 11
 Интервал перехода окраски индикаторов u. В среднем человеческий глаз замечает изменение окраски, когда концентрация одной окрашенной формы становится в 10 раз больше, чем другой. u Интервал перехода окраски индикатора зависит от: - температуры; 12
Интервал перехода окраски индикаторов u. В среднем человеческий глаз замечает изменение окраски, когда концентрация одной окрашенной формы становится в 10 раз больше, чем другой. u Интервал перехода окраски индикатора зависит от: - температуры; 12
 - ионной силы; присутствия в растворе посторонних веществ (например, этанола), влияющих на кислотноосновные свойства индикатора. u. У метилового оранжевого и других двухцветных индикаторов интервал перехода не зависит от концентрации индикатора в растворе 13
- ионной силы; присутствия в растворе посторонних веществ (например, этанола), влияющих на кислотноосновные свойства индикатора. u. У метилового оранжевого и других двухцветных индикаторов интервал перехода не зависит от концентрации индикатора в растворе 13
 Окраска индикатора при титровании u HCl+ Na. OH= Na. Cl + H 2 O u Индикатор – фенолфталеин, переход окраски бесцветный – кислая среда, малиновый – щелочная среда u 90%; 99, 9%, 100, 1% 14
Окраска индикатора при титровании u HCl+ Na. OH= Na. Cl + H 2 O u Индикатор – фенолфталеин, переход окраски бесцветный – кислая среда, малиновый – щелочная среда u 90%; 99, 9%, 100, 1% 14
 Степень оттитрованости u Степень оттитрованности называют отношение уже добавленного объема раствора титранта к тому его объему, который необходимо добавить для достижения точки эквивалентности 15
Степень оттитрованости u Степень оттитрованности называют отношение уже добавленного объема раствора титранта к тому его объему, который необходимо добавить для достижения точки эквивалентности 15
 Степень оттитрованости 16
Степень оттитрованости 16
 Кривая титрования u Кривая титрования представляет собой график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования. 17
Кривая титрования u Кривая титрования представляет собой график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования. 17
 Скачок титрования u Скачком титрования называют участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования – резкому изменению р. Н) вблизи точки эквивалентности(обычно в интервале значений степени оттитрованности 0, 999 -1, 001) 18
Скачок титрования u Скачком титрования называют участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования – резкому изменению р. Н) вблизи точки эквивалентности(обычно в интервале значений степени оттитрованности 0, 999 -1, 001) 18
 4 основных случая кислотноосновного титрования u В зависимости от природы определяемого вещества и титранта различают 4 основных случая кислотноосновного титрования и, соответственно, 4 типа кривых титрования: титрования сильной кислоты сильным основанием; титрования сильного основания сильной кислотой; титрования слабой кислоты сильным основанием; титрования слабого основания сильной кислотой. 19
4 основных случая кислотноосновного титрования u В зависимости от природы определяемого вещества и титранта различают 4 основных случая кислотноосновного титрования и, соответственно, 4 типа кривых титрования: титрования сильной кислоты сильным основанием; титрования сильного основания сильной кислотой; титрования слабой кислоты сильным основанием; титрования слабого основания сильной кислотой. 19
 Окраска индикатора при титровании u HCl+ Na. OH= Na. Cl + H 2 O u Индикатор – фенолфталеин, переход окраски бесцветный – кислая среда, малиновый – щелочная среда u 90%; 99, 9%, 100, 1% 20
Окраска индикатора при титровании u HCl+ Na. OH= Na. Cl + H 2 O u Индикатор – фенолфталеин, переход окраски бесцветный – кислая среда, малиновый – щелочная среда u 90%; 99, 9%, 100, 1% 20
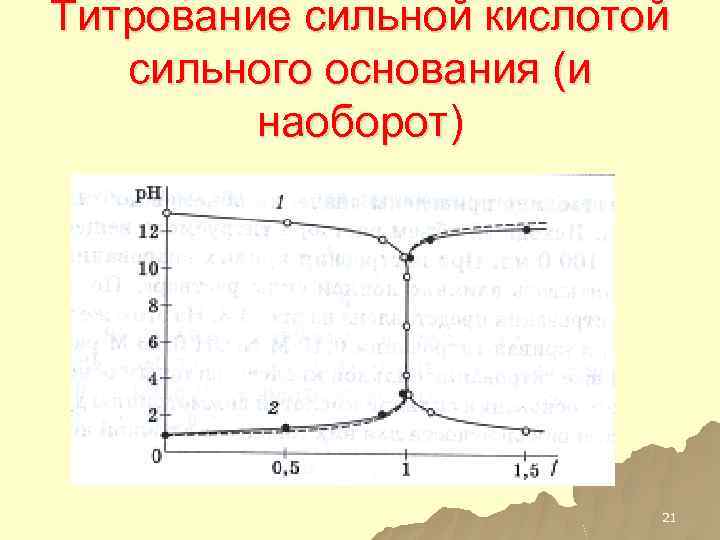 Титрование сильной кислотой сильного основания (и наоборот) 21
Титрование сильной кислотой сильного основания (и наоборот) 21
 Титрование слабого основания сильной кислотой u NH 3+ HCl= NH 4 Cl u Слабое основание – буфер – соль (гидролизованная) -кислота 22
Титрование слабого основания сильной кислотой u NH 3+ HCl= NH 4 Cl u Слабое основание – буфер – соль (гидролизованная) -кислота 22
 Титрование слабой кислоты сильным основанием u HCOOH+ Na. OH = HCOONa +H 2 O u Слабое кислота – буфер – соль (гидролизованная) – основание 23
Титрование слабой кислоты сильным основанием u HCOOH+ Na. OH = HCOONa +H 2 O u Слабое кислота – буфер – соль (гидролизованная) – основание 23
 Расчетныеформулы Расчетне формулы Расчетные формулы Для титрования слабой кислоты 24
Расчетныеформулы Расчетне формулы Расчетные формулы Для титрования слабой кислоты 24
 Слабая кислота, р. Н=2, 38 25
Слабая кислота, р. Н=2, 38 25
 Буферная смесь, р. Н=3, 75 26
Буферная смесь, р. Н=3, 75 26
 Слабое основание р. Н=8, 22 НCOOH 27
Слабое основание р. Н=8, 22 НCOOH 27
 Сильное основание р. Н=10, 7 OH 28
Сильное основание р. Н=10, 7 OH 28
 Слабое 29
Слабое 29
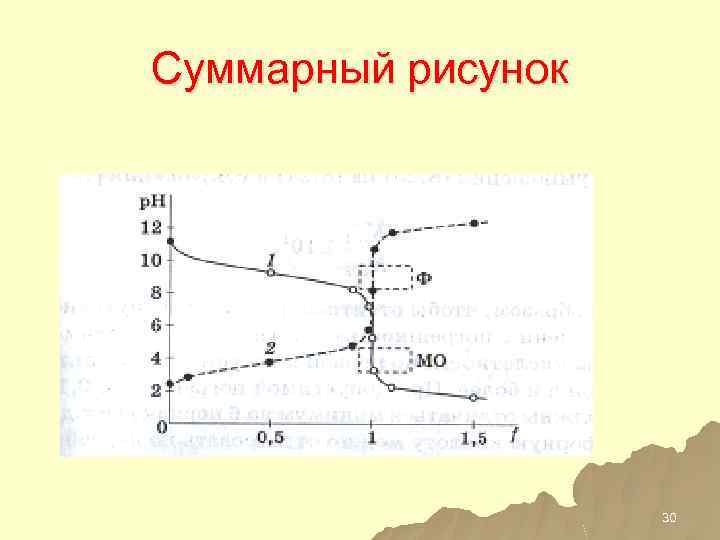 Суммарный рисунок 30
Суммарный рисунок 30
 Титрование многокислотных оснований 0, 10 М Na 2 CO 3 0, 10 М раствором HCl 31
Титрование многокислотных оснований 0, 10 М Na 2 CO 3 0, 10 М раствором HCl 31
 Буферная смесь 32
Буферная смесь 32
 Амфолит 33
Амфолит 33
 Буферная смесь, р. Н=6, 35 34
Буферная смесь, р. Н=6, 35 34
 Слабая кислота 35
Слабая кислота 35
 Сильная кислота 36
Сильная кислота 36
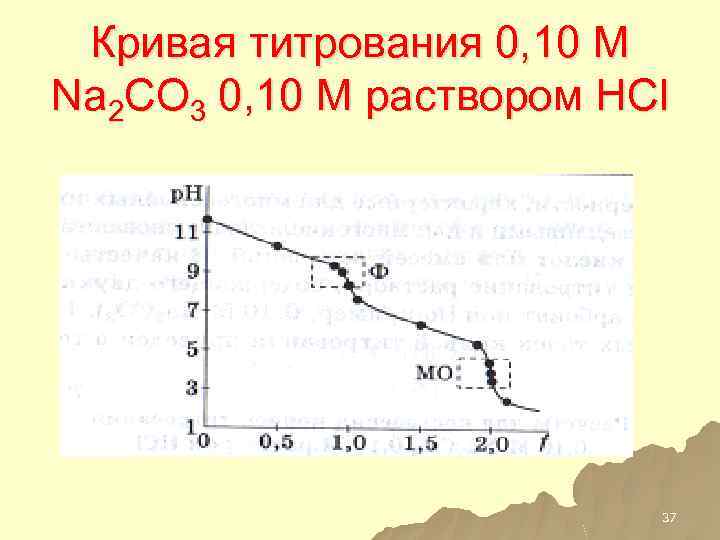 Кривая титрования 0, 10 М Na 2 CO 3 0, 10 М раствором HCl 37
Кривая титрования 0, 10 М Na 2 CO 3 0, 10 М раствором HCl 37
 Титрование многоосновных кислот 38
Титрование многоосновных кислот 38
 Преобразованнные уравнения 39
Преобразованнные уравнения 39
 Факторы, влияющие на величину скачка титрования u На величину скачка титрования при кислотно-основном титровании влияют следующие параметры: концентрация титруемого вещества и титранта, сила титруемой кислоты или основания, температура, а также ионная сила раствора. 40
Факторы, влияющие на величину скачка титрования u На величину скачка титрования при кислотно-основном титровании влияют следующие параметры: концентрация титруемого вещества и титранта, сила титруемой кислоты или основания, температура, а также ионная сила раствора. 40
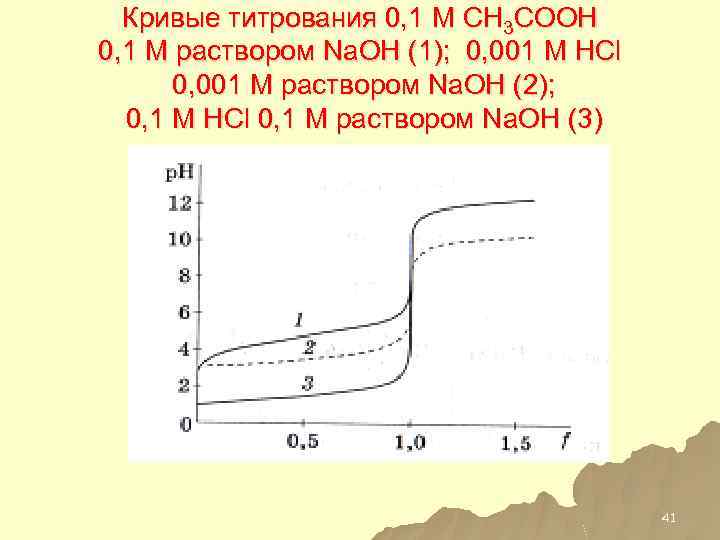 Кривые титрования 0, 1 М CH 3 COOH 0, 1 М раствором Na. OH (1); 0, 001 М HСl 0, 001 М раствором Na. OH (2); 0, 1 М HСl 0, 1 М раствором Na. OH (3) 41
Кривые титрования 0, 1 М CH 3 COOH 0, 1 М раствором Na. OH (1); 0, 001 М HСl 0, 001 М раствором Na. OH (2); 0, 1 М HСl 0, 1 М раствором Na. OH (3) 41
 Погрешности титрования u. К появлению погрешностей в титриметрических методах анализа могут приводить: использование неверно откалиброванной посуды, неправильная техника титрования, неточное считывание объема титранта, израсходованного для титрования, и т. д. 42
Погрешности титрования u. К появлению погрешностей в титриметрических методах анализа могут приводить: использование неверно откалиброванной посуды, неправильная техника титрования, неточное считывание объема титранта, израсходованного для титрования, и т. д. 42
 Индикаторные погрешности 43
Индикаторные погрешности 43
 Индикаторные погрешности u Систематические погрешности, обусловленные несовпадением точки эквивалентности и р. Т индикатора. 44
Индикаторные погрешности u Систематические погрешности, обусловленные несовпадением точки эквивалентности и р. Т индикатора. 44
 Титрование борной кислоты 45
Титрование борной кислоты 45


