3aa8ac62e38fdd89e1413274a3ff7c3e.ppt
- Количество слайдов: 26
 План – конспект урока химии в 9 -ом классе Учитель: Карпель Л. И.
План – конспект урока химии в 9 -ом классе Учитель: Карпель Л. И.
 Тема: Общие химические свойства металлов
Тема: Общие химические свойства металлов
 Цель: • Систематизировать сведения о химических свойствах металлов • Осознать химическую функцию металлов как восстановителей
Цель: • Систематизировать сведения о химических свойствах металлов • Осознать химическую функцию металлов как восстановителей
 Задачи: • Знать отношение металлов к неметаллам. • Взаимодействие с водой, кислотами, солями. • Научиться применять знания. • Формирование познавательного интереса.
Задачи: • Знать отношение металлов к неметаллам. • Взаимодействие с водой, кислотами, солями. • Научиться применять знания. • Формирование познавательного интереса.
 О б о р у д о в а н и е: Компьютер, проектор, экран
О б о р у д о в а н и е: Компьютер, проектор, экран
 Что характерно для атомов металлов?
Что характерно для атомов металлов?
 Для атомов металлов характерно: • Небольшое число электронов на внешнем слое. • С увеличением радиуса атома сила удерживания электронов на внешнем слое уменьшается
Для атомов металлов характерно: • Небольшое число электронов на внешнем слое. • С увеличением радиуса атома сила удерживания электронов на внешнем слое уменьшается
 Поэтому в химических реакциях атомы металлов отдают электроны и являются восстановителями.
Поэтому в химических реакциях атомы металлов отдают электроны и являются восстановителями.
 На пример: 0 - 1ē → Na+1 Na 0 Al 3ē → +3 Al
На пример: 0 - 1ē → Na+1 Na 0 Al 3ē → +3 Al
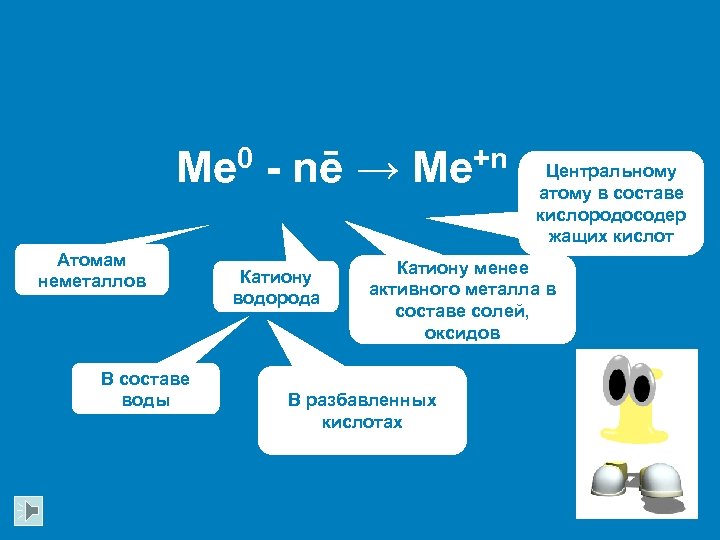 Me 0 - nē → Me+n Атомам неметаллов В составе воды Катиону водорода Центральному атому в составе кислородосодер жащих кислот Катиону менее активного металла в составе солей, оксидов В разбавленных кислотах
Me 0 - nē → Me+n Атомам неметаллов В составе воды Катиону водорода Центральному атому в составе кислородосодер жащих кислот Катиону менее активного металла в составе солей, оксидов В разбавленных кислотах
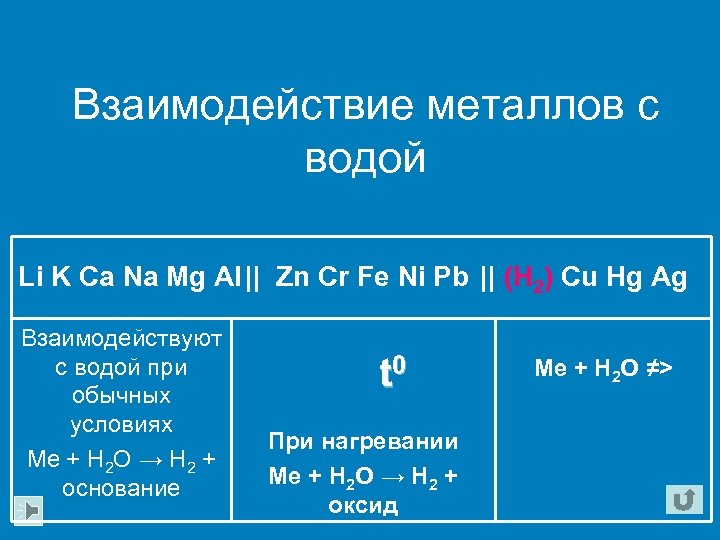 Взаимодействие металлов с водой Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || (H 2) Cu Hg Ag Взаимодействуют с водой при обычных условиях Me + H 2 O → H 2 + основание t 0 При нагревании Me + H 2 O → H 2 + оксид Me + H 2 O ≠>
Взаимодействие металлов с водой Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || (H 2) Cu Hg Ag Взаимодействуют с водой при обычных условиях Me + H 2 O → H 2 + основание t 0 При нагревании Me + H 2 O → H 2 + оксид Me + H 2 O ≠>
 З а п о м н и!!! С водой взаимодействует только амальгамированный алюминий (лишенный оксидной пленки)
З а п о м н и!!! С водой взаимодействует только амальгамированный алюминий (лишенный оксидной пленки)
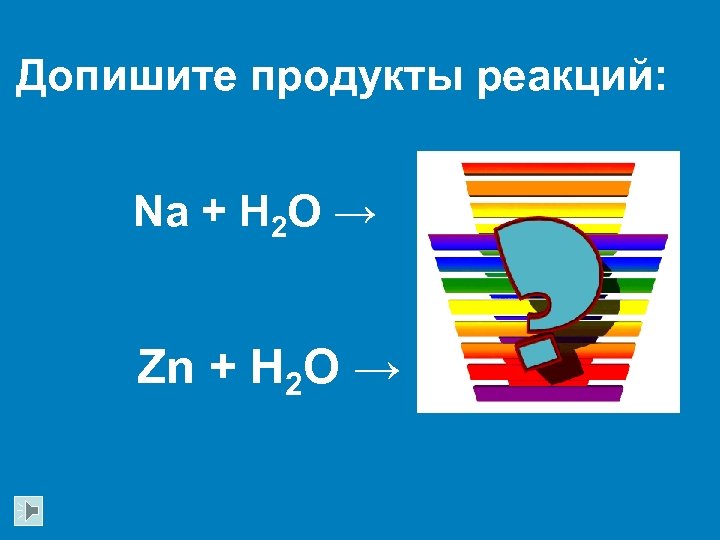 Допишите продукты реакций: Na + H 2 O → Zn + H 2 O →
Допишите продукты реакций: Na + H 2 O → Zn + H 2 O →
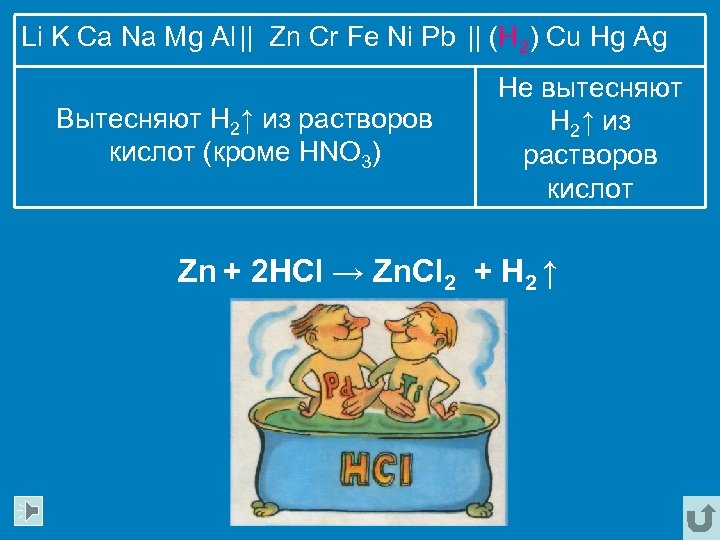 Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || (H 2) Cu Hg Ag Вытесняют H 2↑ из растворов кислот (кроме HNO 3) Не вытесняют H 2↑ из растворов кислот Zn + 2 HCl → Zn. Cl 2 + H 2 ↑
Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || (H 2) Cu Hg Ag Вытесняют H 2↑ из растворов кислот (кроме HNO 3) Не вытесняют H 2↑ из растворов кислот Zn + 2 HCl → Zn. Cl 2 + H 2 ↑
 Металлы могут восстанавливать и катионы менее активных металлов Zn 0 +Cu+2 Cl 2 → Cu 0 + Zn+2 Cl 2
Металлы могут восстанавливать и катионы менее активных металлов Zn 0 +Cu+2 Cl 2 → Cu 0 + Zn+2 Cl 2
 Все металлы на основании их восстановительной способности по отношению к ионам металлов в водных растворах расположены в Электрохимический ряд напряжений металлов Li K Ca Na Mg Al Zn Cr Fe Ni Pb H 2 Cu Hg Ag Увеличение восстановительных свойств
Все металлы на основании их восстановительной способности по отношению к ионам металлов в водных растворах расположены в Электрохимический ряд напряжений металлов Li K Ca Na Mg Al Zn Cr Fe Ni Pb H 2 Cu Hg Ag Увеличение восстановительных свойств
 Окислителями металлов являются неметаллы: Кислород, сера, галогены…
Окислителями металлов являются неметаллы: Кислород, сера, галогены…
 С кислородом воздуха легко взаимодействуют щелочные и щелочно-земельные металлы. 4 Li 0 + O 20 → 2 LI+120 -2
С кислородом воздуха легко взаимодействуют щелочные и щелочно-земельные металлы. 4 Li 0 + O 20 → 2 LI+120 -2
 Железо, цинк, медь окисляются только при нагревании 3 Fe + 2 O 2 → Fe 3 O 4 to
Железо, цинк, медь окисляются только при нагревании 3 Fe + 2 O 2 → Fe 3 O 4 to
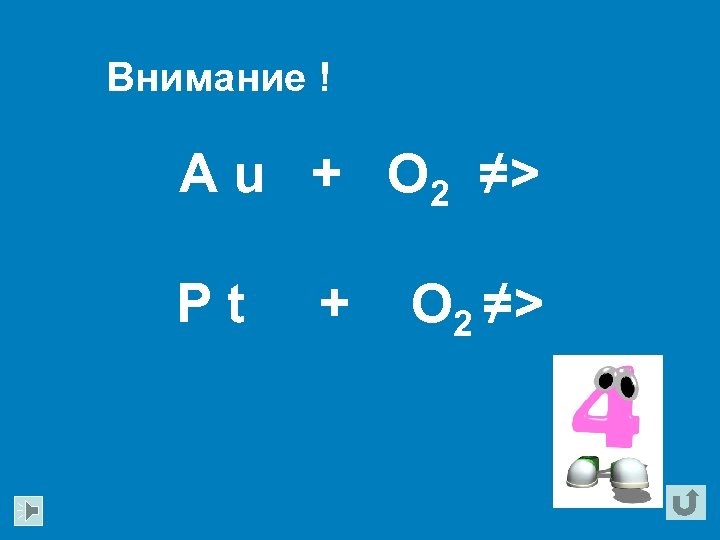 Внимание ! A u + O 2 ≠> Pt + O 2 ≠>
Внимание ! A u + O 2 ≠> Pt + O 2 ≠>
 Металлы с неметаллами образуют бинарные соединения Хлориды – Al. Cl 3 Сульфиды – Pb. S Фосфиды – Na 3 Р
Металлы с неметаллами образуют бинарные соединения Хлориды – Al. Cl 3 Сульфиды – Pb. S Фосфиды – Na 3 Р
 А теперь ты должен закрепить приобретенные знания, выполнив Упражнение УДАЧИ ТЕБЕ!!!
А теперь ты должен закрепить приобретенные знания, выполнив Упражнение УДАЧИ ТЕБЕ!!!
 Если ты испытываешь трудности при выполнении этих заданий то обратись к предыдущим слайдам!
Если ты испытываешь трудности при выполнении этих заданий то обратись к предыдущим слайдам!
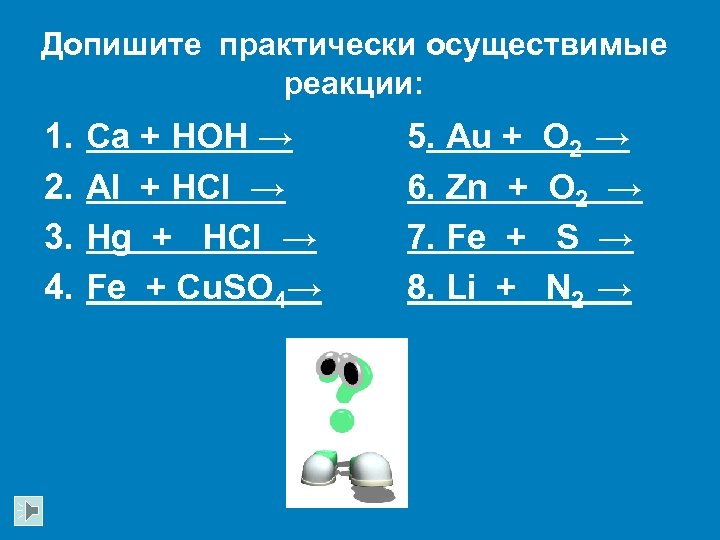 Допишите практически осуществимые реакции: 1. 2. 3. 4. Ca + HOH → Al + HCl → Hg + HCl → Fe + Cu. SO 4→ 5. Au + 6. Zn + 7. Fe + 8. Li + O 2 → S → N 2 →
Допишите практически осуществимые реакции: 1. 2. 3. 4. Ca + HOH → Al + HCl → Hg + HCl → Fe + Cu. SO 4→ 5. Au + 6. Zn + 7. Fe + 8. Li + O 2 → S → N 2 →
 Проверь себя!!! 2ē Ca + 2 HOH →Ca(OH)2 + H 2 6ē 2 Al + 6 HCl → 2 Al. Cl 3 + H 2 2ē Fe + Cu. SO 4 → Fe. SO 4 +Cu Ag + Cu. Cl 2 → не происходит Au + O 2 → не происходит 4ē 2 Zn + O 2 → 2 Zn. O 2ē Fe + S → Fe. S 6ē 6 Li + N 2 → 2 Li 3 N
Проверь себя!!! 2ē Ca + 2 HOH →Ca(OH)2 + H 2 6ē 2 Al + 6 HCl → 2 Al. Cl 3 + H 2 2ē Fe + Cu. SO 4 → Fe. SO 4 +Cu Ag + Cu. Cl 2 → не происходит Au + O 2 → не происходит 4ē 2 Zn + O 2 → 2 Zn. O 2ē Fe + S → Fe. S 6ē 6 Li + N 2 → 2 Li 3 N
 Дома обязательно поработай с учебником! § 8 Выполнить письменно упражнения: с. 37 № 4, № 2, № 5, № 6
Дома обязательно поработай с учебником! § 8 Выполнить письменно упражнения: с. 37 № 4, № 2, № 5, № 6


