аналитика срс.ppt
- Количество слайдов: 40


ПЛАН I. Введение II. а) Редокс индекаторы б) Специфические индикаторы в)Применяемые индекаторы в анализе лекарственных препаратов III. Заключение IV. Список литературы

Введение Окислительно-восстановительное титрование - это вещества с окислительно-восстановительными свойствами. Оксидиметрия – титранты являются окислителями. Редуциметрия – титранты являются восстановителями.

Методы редоксиметрического титрования по природе титранта: Перманганатометрия Дихроматометрия Йодиметрия Йодатометрия Хлорйодиметрия Броматометрия Бромометрия Нитритометрия Цериметрия Аскорбинометрия Титанометрия Хромометрия

Типы реакций, которые сопровождаются окислением-восстановлением: Определяемых веществ (например, ионов Fe (II) до ионов Fe (III)): Fe 2+ + Ce 4+ = Fe 3+ + Ce 3+, де Се 4+ - титрант реагентов, которые взаимодействуют с определяемыми реагентами стехиометрически (например, С 2 О 42 - - ионов, которые реагируют с Са 2+ - ионами с образованием осадка Са. С 2 О 4): Са 2+ + С 2 О 42 - = Са. С 2 О 4↓ 5 Са. С 2 О 4 + 2 Mn. O 4 - + 16 H+ = 5 Са 2+ + 10 СО 2 + 2 Mn 2+ + 8 H 2 О

Типы реакций, которые сопровождаются окислением-восстановлением: веществ, которые образуются в процессе взаимодействия кислых растворов персульфатов с йодидом калия: S 2 O 82 - +2 I- = 2 SO 42 - + I 2↓ I 2 + 2 S 2 O 32 - = S 4 O 62 - + 2 I ионов, которые обуславливают определенное значение р. Н среды, в котором количественно протекают редок-реакции : IO 3 - + 5 I- + 6 Н+ = 3 I 2 + 3 H 2 O йод, который выделился оттитровывают натрий тиосульфатом.

Требования к реакциям в редоксиметрии: Реакция должна проходить быстро (на скорость влияет ЭДС, Сох, Свосст. , температура, природа веществ, катализатор, среда). Реакция должна проходить стехиометрично. Реакция должна проходить количественно и до конца. Реакция должна проходить необратимо. Должна быть возможность фиксации точки эквивалентности. В условиях проведения титрования не должны проходить конкурирующие реакции.

ПРЯМАЯ РЕДОКСИМЕТРИЯ Условия применения: Взаимодействие реагирующих веществ специфично Реакция проходит стехиометрично Реакция проходит быстро (ЭДС≥ 0, 4 В) Константа равновесия достаточно высокая Возможность применения конкретного способа фиксации конечной точки титрования

ОБРАТНАЯ РЕДОКСИМЕТРИЯ Условия применения: реакция проходит очень медленно Mn. O 2 + H 2 C 2 O 4 + 3 H 3 O+ = Mn 2+ + избыток титранта 1 +2 CO 2+4 H 2 O 5 H 2 C 2 O 4 + 2 Mn. O 4 - + 6 H 3 O+ → 2 Mn 2+ остаток титрант 2 +10 CO 2 + 4 H 2 O титранта 1

НЕПРЯМАЯ РЕДОКСИМЕТРИЯ Условия применения: Окислительно-восстановительные реакции не всегда проходят стехиометрично или определяемое вещество и титрант не реагируют Cl. O- + 2 I- + 2 H 3 O+ = I 2 + Cl- + 3 H 2 O опред. вещ. заместитель Йод, который выделился (заместитель) потом титруют раствором натрий тиосульфата: І2 + 2 S 2 O 32 - = 2 I- + S 4 O 62 заместитель титрант

КРИВЫЕ ТИТРОВАНИЯ В РЕДОКСИМЕТРИИ Ох1 + n 1 e = Red 1 Ох2 + n 2 e = Red 2 Для каждой полуреакции в соответствии уравнением Нернста (при µ=0, ƒ ±=1): с Кривую титрования строят в координатах – электродный потенциал системы (Е, В) – объем титранта (V, мл) или степень оттитрованности (f).
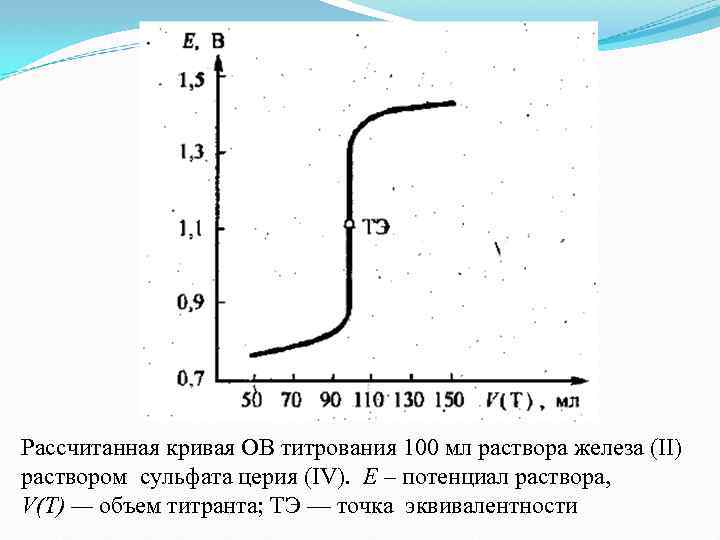
Рассчитанная кривая ОВ титрования 100 мл раствора железа (ІІ) раствором сульфата церия (IV). Е – потенциал раствора, V(T) — объем титранта; ТЭ — точка эквивалентности

На величину скачка титрования влияют природа вещества, которое титруют, и титранта (чем больше разница их стандартных потенциалов, тем больше скачок титрования) величина р. Н среды (если в полуреакциях окисления-восстановления принимают участие ионы гидрогена) Наличие скачка на кривой титрования можно использовать для точной фиксации точки эквивалентности с помощью индикаторов.

Способы фиксации точки эквивалентности в редоксиметрии безиндикаторное титрование, если титрант окрашен индикаторное титрование (разные индикаторы) физико-химические способы фиксации точки эквивалентности (потенциометрический, амперометрический, вольтамперометрический)

Индикаторы редоксиметрии Специфические (крахмал, тиоцианат на ионы железа (ІІІ)) Окислительно-восстановительные индикаторы или редокс-индикаторы Внешние индикаторы Необратимые специфические индикаторы

Редокс-индикаторы Окислительно-восстановительные индикаторы вещества, которые могут обратимо окислятся или восстанавливаться, окисленная и восстановленная формы имеют разную окраску Indox + ne = Indred окраска 1 окраска 2 где Е 0 – стандартный потенциал данной пары. Интервал перехода индикатора
![Окислительно-восстановительные индикаторы Индикатор Окраска Indox Окраска Indred Eo, при [H+] = 1 моль/л, В Окислительно-восстановительные индикаторы Индикатор Окраска Indox Окраска Indred Eo, при [H+] = 1 моль/л, В](https://present5.com/presentation/220654965_437239080/image-17.jpg)
Окислительно-восстановительные индикаторы Индикатор Окраска Indox Окраска Indred Eo, при [H+] = 1 моль/л, В Дифениламин синефиолетовый бесцветный + 0, 76 Фенилантранилов Красноая кислота фиолетовый бесцветный +1, 08 о-фенантролин. Fe 2+ комплекс (ферроин) красный +1, 06 бледно-голубой о, о΄-дифениламин сине-фиолетовый бесцветный -дикарбоновая кислота +1, 26 Дифениламиназосульфоновая кислота +0, 84 краснофиолетовая бесцветный

Правило выбора редокс-индикатора Чтобы окраска окислительно-восстановительного индикатора изменялась при титровании резко и индикаторная ошибка титрования была незначительной, интервал перехода индикатора должен находиться в пределах скачка потенциала на кривой титрования

Перманганатометрия Титрант: KMn. O 4 – втор. станд. раствор 4 Mn. O 4 - + 2 H 2 O = 4 Mn. O 2 + 3 O 2 + 4 OH Реакция метода: Mn. O 4 - + 8 H+ + 5 e = Mn 2+ + 4 H 2 O Стандартизация: по стандартных веществах H 2 C 2 O 4∙ 2 H 2 O, Na 2 C 2 O 4, As 2 O 3, KI, Fe, (NH 4)2 Fe(SO 4)2∙ 6 H 2 O, Na 2 S 2 O 3∙ 5 H 2 O (ГФУ) 2 Mn. O 4 - + 5 H 2 C 2 O 4 + 6 H+ = 2 Mn 2+ + 10 CO 2 + 8 H 2 O Среда: сульфатнокислая Индикаторы: без индикаторов (по появлению розовой окраски)

Условия титрования: в сильно кислой среде р. Н 7 Mn. O 4 - + 5 e + 8 H+ = Mn 2+ + 4 H 2 O, E =1, 51 B в нейтральной среде: Mn. O 4 - + 3 e + 2 H 2 O = Mn. O 2 + 4 OH-; Е =0, 60 B в сильно щелочной среде: Mn. O 4 - + e = Mn. O 42 -; Е = 0, 56 В 3 Mn. O 42 - + 2 Н 2 О = Mn. O 2 + 2 Mn. O 4 - + 4 OH Титрование проводят в очень кислых растворах. [Н+](H 2 SO 4)= 1 -2 моль/л. (HNO 3, HCl – не используют) Нагревание растворов Посуда только стеклянная (в т. ч. бюретки без резинового шланга)

Определяемые вещества в методе перманганатометрии восстановители: H 2 O 2, Fe (мет. ), Mg. O 2, Na. NO 2, карбоновые кислоты, соединения с гидразо-группами R–NH–NH–R и др. окислители: Fe 3+, Ce. IV, Mn. O 2, Pb. O 2, NO 3 -, Br. O 3 -, Cl. O 3, S 2 O 32 - и др.

Преимущества перманганатометрии не нужно индикатора возможность использования широкого интервала р. Н высокое значение E дешевый и доступный реагент возможность определения веществ, которые не имеют окислительно-восстановительных свойств

Недостатки перманганатометрии вторичный стандартный раствор неустойчивость стандартного раствора невозможно титровать в присутствии Cl- (для уменьшения скорости окисления хлорид-иона титрантом используют смесь Рейнгарда Циммермана H 2 SO 4+ Mn. SO 4 + Н 3 РO 4) часто необходимо нагревание строгое выдерживание условий, описанных в методике

Дихроматометрия Титрант: K 2 Cr 2 O 7 – перв. стандар. раствор; Cr. O 3 в CH 3 COOH (ледяная) Реакция метода: Cr 2 O 72 - + 14 H+ + 6 e = 2 Cr 3+ + 7 H 2 O E =1, 33 B Среда: кислая (сульфатная, хлоридная или фосфатная)

Дихроматометрия Индикаторы: - внутренние ox-red индикаторы: дифениламин, Nфенилантраниловая кислота, дифениламиносульфоновая кислота - хемилюминесцентные (силоксен) - внешние ox-red индикаторы: лейкометиленовый голубой

Дихроматометрия Определяемые вещества: восстановители – прямое титрование: Fe 2+, SO 32 -, I-, As. O 33 -, аскорбиновая кислота, глицерин, CH 3 OH окислители – обратное титрование: NO 3 -, Cl. O 3 -, Mn. O 4 - и др.

Преимущества дихроматометрии K 2 Cr 2 O 7 – первичный стандартный раствор – устойчивый во времени можно титровать в присутствии Cl Cr 2 O 72 - - медленно реагирует с органическими веществами, присутствующими в воде дистиллированной есть достаточно сильным окислителем и может окислять много органических веществ (этим отличается от І2) не требует нагревания используется для определения окислителей и восстановителей можно титровать 2 - и 3 -компонентные смеси в присутствии Н 3 РO 4 концентрированной

Недостатки дихроматометрии Окислитель более слабый, чем KMn. O 4 Медленное протекание реакции Необходимы индикаторы Часто обратное титрование, потому что невысокая скорость реакции

Йодометрия - метод определения окислителей Титрант: Na 2 S 2 O 3 втор. стандар. раствор Стандартизация: по стандартных растворах КІО 3, KBr. O 3 (ДФУ), K 2 Cr 2 O 72 - + 14 H+ + 6 I- = 3 I 2 + 2 Cr 3+ + 7 H 2 O I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 Реакция метода: 2І- + Ох = І2 + Red I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6

Особенности приготовления натрий тиосульфата и крахмала Na 2 S 2 O 3 + Na 2 CO 3 – стандартизируют через 1 день S 2 O 32 - + H 2 O + CO 2 = HCO 3 - + HSO 3 - + S 2 Na 2 S 2 O 3 + O 2 = 2 Na 2 SO 4 + 2 S S 2 O 32 - + H+ = HSO 3 - + S в присутствии S 2 O 32 - + O 2 = 2 SO 42 - + 2 S микроорганизмов разложение тиобактериями 1% крахмал стабилизирут с помощью Hg. I 2

Йодометрия Индикаторы: 1 % раствор крахмала (добавляют в конце титрования, когда окраска раствора станет соломенно-желтой, титруют до исчезновения синей окраски) Определяемые вещества: окислители - H 2 O 2, Na 2 O 2, Mg. O 2, Ba. O 2, Cu(II), K 2 Cr 2 O 7, KMn. O 4, Na 3 As. O 4, I 2.

Йодиметрия - метод определения восстановителей прямым титрованием йодом Титрант: І2 – втор. стандар. раствор Реакция метода: І2 + І- = [І3]І3 - + 2 е = 3І На свету 4І- + О 2 + 4 Н+ = 2І2 + 2 Н 2 О

Йодометрия Стандартизация: требование ГФУ І2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 по As 2 O 3: As 2 O 3 + 6 OH- = 2 As. O 33 - + 3 H 2 O As. O 33 - + 3 H+ = 3 H 3 As. O 3 + I 2 + H 2 O = H 3 As. O 4 + 2 HI

Условия йодометрического титрования титрование ведут на холоде в присутствии веществ, которые будут связывать продукты реакции р. Н 8 р. Н 9: І2 + 2 ОН- = І- + ІО- + Н 2 О р. Н 1: НІ + О 2 = 2І2 + 2 Н 2 О

Йодометрия Индикаторы: без индикатора (в т. э. желтая окраска І2, экстракция СНСl 3 или CCl 4 _- слабая розово-фиолетовая окраска) крахмал 1% до появления синей окраски (3 дня пригоден) Определяемые вещества: восстановители и вода (Фишер), As(III), Na 2 SO 3, Hg 2 Cl 2, анальгин, антипирин, аскорбиновая кислота, гидразины, изониазид, кофеин, метионин, сумма пеницилинов, К и Na соли бензилпеницилина, НСНО и др. Hg 2 Cl 2 + I 2 + 6 KI = 2 K 2[Hg. I 4] + 2 KCl

Йодометрическое определение воды по Фишеру Реактив Фишера SO 2 + I 2 + C 6 H 5 N в CH 3 OH Реакция метода: H 2 O + SO 2 + I 2 + 3 C 5 H 5 N = 2 C 5 H 5 NHI + C 5 H 5 NSO 3 + CH 3 OH = C 5 H 5 NHSO 4 CH 3 Автоматический титратор воды по Фишеру фирмы Mettler Toledo

Преимущества йодометрии используется для определения многих веществ наивысшая точность среди всех окислительновосстановительных методов можно титровать без индикатора возможны неводные растворы йода, потому что хорошо растворяется в органических растворителях

Недостатки йодометрии летучесть и вторичность стандартных растворов невозможно титровать в очень кислых и щелочных растворах часто необходимы специальные условия, потому что Е небольшой и реакции являются обратимыми часто обратное титрование иногда результаты искажаются через адсорбцию йода осадками изменение титра стандартных растворов порядок доливания нельзя нарушать
Применение в анализе лекарственных препаратов Метод йодометрии широко применяется в химическом анализе. Этим методом определяют соединения мышьяка (III); медь (II) в солях, рудах; многие органические лекарственные препараты – формалин, анальгин, аскорбиновую кислоту и др.

Список литературы: 1. Харитонов Ю. В. Аналитическая химия кн. 1, 2. М. , ВШ, 2001. 2. Цитович И. К. Курс аналитической химии. М. , 2004. 3. Васильев В. П. Аналитическая химия кн. 1, 2 М. , Дрофа, 2003 4. Основы аналитической химии. Практическое руководство. Под ред. Ю. А. Золотова- М. , Высшая школа, 2001. 5. Пономарев В. Д. Аналитическая химия, ч. 1, 2. М. , ВШ, 1982.
аналитика срс.ppt