5 растворы.ppt
- Количество слайдов: 23
 План. 1. Введение. Основные термины. 2. Типы растворов. 3. Процессы, происходящие при растворении. 4. Способы выражения концентрации растворов. 5. Растворы электролитов. Степень и константа диссоциации. 6. Диссоциация воды, р. Н, гидролиз солей. 7. Растворимость газов, твердых и жидких веществ в жидкостях. 8. Свойства разбавленных растворов.
План. 1. Введение. Основные термины. 2. Типы растворов. 3. Процессы, происходящие при растворении. 4. Способы выражения концентрации растворов. 5. Растворы электролитов. Степень и константа диссоциации. 6. Диссоциация воды, р. Н, гидролиз солей. 7. Растворимость газов, твердых и жидких веществ в жидкостях. 8. Свойства разбавленных растворов.
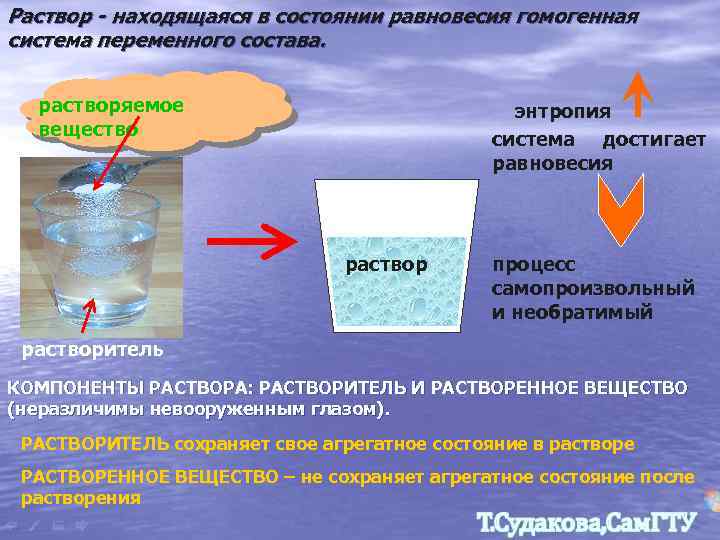 Раствор - находящаяся в состоянии равновесия гомогенная система переменного состава. растворяемое вещество энтропия система достигает равновесия раствор процесс самопроизвольный и необратимый растворитель КОМПОНЕНТЫ РАСТВОРА: РАСТВОРИТЕЛЬ И РАСТВОРЕННОЕ ВЕЩЕСТВО (неразличимы невооруженным глазом). РАСТВОРИТЕЛЬ сохраняет свое агрегатное состояние в растворе РАСТВОРЕННОЕ ВЕЩЕСТВО – не сохраняет агрегатное состояние после растворения
Раствор - находящаяся в состоянии равновесия гомогенная система переменного состава. растворяемое вещество энтропия система достигает равновесия раствор процесс самопроизвольный и необратимый растворитель КОМПОНЕНТЫ РАСТВОРА: РАСТВОРИТЕЛЬ И РАСТВОРЕННОЕ ВЕЩЕСТВО (неразличимы невооруженным глазом). РАСТВОРИТЕЛЬ сохраняет свое агрегатное состояние в растворе РАСТВОРЕННОЕ ВЕЩЕСТВО – не сохраняет агрегатное состояние после растворения
 водка Раствор спирта в воде, т. к. содержание спирта 40% спирт медицински й раствор воды в спирте, т. к. содержание спирта 96% В растворах электролитов электролит – всегда растворенное вещество: 98%-ый раствор H 2 SO 4 в H 2 O 40%-ый раствор Na. OH в H 2 O 1%-ый раствор Na. Cl в H 2 O Отличительные свойства растворов: 1) от смесей – гомогенность 2) от химических соединений – переменность состава, изменение свойств растворителя и растворенного вещества не носит радикального характера.
водка Раствор спирта в воде, т. к. содержание спирта 40% спирт медицински й раствор воды в спирте, т. к. содержание спирта 96% В растворах электролитов электролит – всегда растворенное вещество: 98%-ый раствор H 2 SO 4 в H 2 O 40%-ый раствор Na. OH в H 2 O 1%-ый раствор Na. Cl в H 2 O Отличительные свойства растворов: 1) от смесей – гомогенность 2) от химических соединений – переменность состава, изменение свойств растворителя и растворенного вещества не носит радикального характера.
 РАСТВОРЫ: ЖИДКИЕ И ТВЕРДЫЕ Жидкие: жидкость – газ (СО 2 в воде, HCl, NH 3 в воде) жидкость – жидкость (спирт С 2 Н 5 ОН в воде, бром Br 2 в воде, уксусная кислота СН 3 СООН в воде) жидкость – твердое вещество (соль KCl в воде, сахар в воде, йод I 2 в спирте). Твердый раствор - кристалл, кристаллическая решетка которого построена из двух или нескольких компонентов: сплавы металлов, солей, оксидов. растворы: - ионного типа (растворы электролитов), проводят электрический ток - молекулярного типа (растворы неэлектролитов), не проводят электрический ток.
РАСТВОРЫ: ЖИДКИЕ И ТВЕРДЫЕ Жидкие: жидкость – газ (СО 2 в воде, HCl, NH 3 в воде) жидкость – жидкость (спирт С 2 Н 5 ОН в воде, бром Br 2 в воде, уксусная кислота СН 3 СООН в воде) жидкость – твердое вещество (соль KCl в воде, сахар в воде, йод I 2 в спирте). Твердый раствор - кристалл, кристаллическая решетка которого построена из двух или нескольких компонентов: сплавы металлов, солей, оксидов. растворы: - ионного типа (растворы электролитов), проводят электрический ток - молекулярного типа (растворы неэлектролитов), не проводят электрический ток.
 РАСТВОРЫ: - концентрированные – содержание растворенного вещества свыше 5% массовых; - разбавленные – содержание до 5%. РАСТВОРЫ: насыщенные, ненасыщенные, РАСТВОРЫ пересыщенные. Раствор, содержащий при данной температуре максимально возможное количество растворенного вещества и находящийся в равновесии с избытком растворяемого вещества, называют насыщенным
РАСТВОРЫ: - концентрированные – содержание растворенного вещества свыше 5% массовых; - разбавленные – содержание до 5%. РАСТВОРЫ: насыщенные, ненасыщенные, РАСТВОРЫ пересыщенные. Раствор, содержащий при данной температуре максимально возможное количество растворенного вещества и находящийся в равновесии с избытком растворяемого вещества, называют насыщенным
 РАСТВОРИМОСТЬ - способность растворяться! Иногда: растворимость концентрация насыщенного раствора коэффициент растворимости – масса вещества, при растворении которой в 100 г растворителя при данной температуре, образуется насыщенный раствор ( зависит от температуры, при которой происходит растворение!!!). НЕНАСЫЩЕННЫЙ РАСТВОР- растворено вещества меньше растворимости ПЕРЕСЫЩЕННЫЙ РАСТВОР – растворено вещества больше растворимости
РАСТВОРИМОСТЬ - способность растворяться! Иногда: растворимость концентрация насыщенного раствора коэффициент растворимости – масса вещества, при растворении которой в 100 г растворителя при данной температуре, образуется насыщенный раствор ( зависит от температуры, при которой происходит растворение!!!). НЕНАСЫЩЕННЫЙ РАСТВОР- растворено вещества меньше растворимости ПЕРЕСЫЩЕННЫЙ РАСТВОР – растворено вещества больше растворимости
 Кристаллы KCl в его пересыщенном водном растворе
Кристаллы KCl в его пересыщенном водном растворе
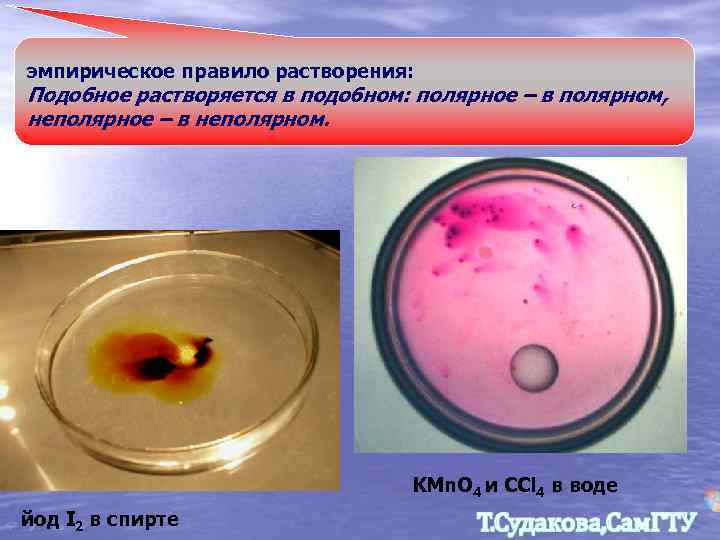 эмпирическое правило растворения: Подобное растворяется в подобном: полярное – в полярном, неполярное – в неполярном. KMn. O 4 и CCl 4 в воде йод I 2 в спирте
эмпирическое правило растворения: Подобное растворяется в подобном: полярное – в полярном, неполярное – в неполярном. KMn. O 4 и CCl 4 в воде йод I 2 в спирте
 Концентрация вещества в растворе – количество растворенного вещества в определенной массе или объеме раствора или растворителя. Способы выражения концентрации: 1. Массовая С (гл, мгл), титр (мгмл, мкгмл). 2. Массовая доля или процент (0, 5; 50%. . . ) ω = m(X)/mр-р • 100% 3. Молярная (мольл, мкмольл…) СМ = n/Vр-р = m/(M • Vр-р) 4. Молярная концентрация эквивалента (нормальная), (мольл) Сэ = nэ/Vр-р = m/(Mэ • Vр-р) 5. Моляльная (моль растворенногокг растворителя) Сm = n/mр-ль = m/(M • mр-ль) 6. Объемная доля или процент (0, 7; 70%. . . ) ω = V(X)/V • 100% ω = V(X)/V,
Концентрация вещества в растворе – количество растворенного вещества в определенной массе или объеме раствора или растворителя. Способы выражения концентрации: 1. Массовая С (гл, мгл), титр (мгмл, мкгмл). 2. Массовая доля или процент (0, 5; 50%. . . ) ω = m(X)/mр-р • 100% 3. Молярная (мольл, мкмольл…) СМ = n/Vр-р = m/(M • Vр-р) 4. Молярная концентрация эквивалента (нормальная), (мольл) Сэ = nэ/Vр-р = m/(Mэ • Vр-р) 5. Моляльная (моль растворенногокг растворителя) Сm = n/mр-ль = m/(M • mр-ль) 6. Объемная доля или процент (0, 7; 70%. . . ) ω = V(X)/V • 100% ω = V(X)/V,
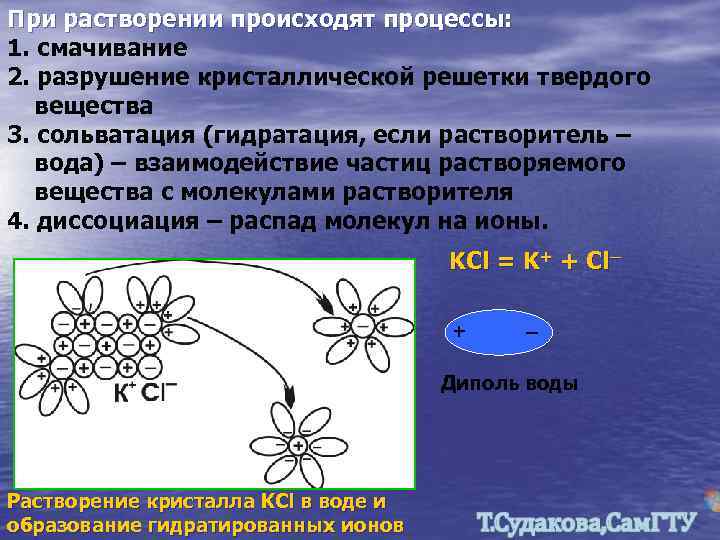 При растворении происходят процессы: 1. смачивание 2. разрушение кристаллической решетки твердого вещества 3. сольватация (гидратация, если растворитель – вода) – взаимодействие частиц растворяемого вещества с молекулами растворителя 4. диссоциация – распад молекул на ионы. KCl = K+ + Cl─ + _ Диполь воды Растворение кристалла KCl в воде и образование гидратированных ионов
При растворении происходят процессы: 1. смачивание 2. разрушение кристаллической решетки твердого вещества 3. сольватация (гидратация, если растворитель – вода) – взаимодействие частиц растворяемого вещества с молекулами растворителя 4. диссоциация – распад молекул на ионы. KCl = K+ + Cl─ + _ Диполь воды Растворение кристалла KCl в воде и образование гидратированных ионов
 В водных растворах гидратация - 1 стадия диссоциации и главная ее причина!!! 2 стадия – поляризация связи: под действием диполей воды происходит сильное смещение связывающих электронов и связь становится ионной. 3 стадия - собственно диссоциация – разрушение поляризованной молекулы и образование гидратированных ионов. HCl + 2 H 2 O (Н+)→(ОН)─(H+)→(Cl─)(Н+)→(ОН─) (Н 2 О)H+ + (Н 2 О)Cl─ степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул, введенных в раствор : α = Nи/N, (доли или проценты) Nи – число молекул, распавшихся на ионы; N – число молекул, введенных в раствор.
В водных растворах гидратация - 1 стадия диссоциации и главная ее причина!!! 2 стадия – поляризация связи: под действием диполей воды происходит сильное смещение связывающих электронов и связь становится ионной. 3 стадия - собственно диссоциация – разрушение поляризованной молекулы и образование гидратированных ионов. HCl + 2 H 2 O (Н+)→(ОН)─(H+)→(Cl─)(Н+)→(ОН─) (Н 2 О)H+ + (Н 2 О)Cl─ степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул, введенных в раствор : α = Nи/N, (доли или проценты) Nи – число молекул, распавшихся на ионы; N – число молекул, введенных в раствор.
 СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ: хорошо диссоциируют на ионы, α>30% ЭЛЕКТРОЛИТЫ почти все соли; кислоты (H 2 SO 4, HCl, HBr, HI, HNO 3), основания (Na. OH, KOH, Ca(OH)2, Li. OH, Ba(OH)2). СЛАБЫЕ ЭЛЕКТРОЛИТЫ: плохо диссоциируют на ионы, α<30% ЭЛЕКТРОЛИТЫ большинство органических кислот, некоторые неорганические (H 2 S, HCN, H 2 CO 3, H 2 SO 3, HСl. O, H 3 BO 3, Hg 2 Cl 2, Fe(SCN)3 ) Ktm. Ann ↔ m. Ktn+ + n. Anm─ - равновесие константа диссоциации (ионизации): Kд =( [Ktn+]m • [Anm─]n)/[Ktm. Ann] = const при данной температуре!!!. [Ktn+] и [Anm ─] – молярные равновесные концентрации ионов электролита; [Ktm. Ann] – молярная равновесная концентрация недиссоциированных молекул электролита. Пример: Н 2 SO 3 ↔ SO 32─ + 2 Н+ Кд = ([SO 32─] • [Н+]2)/ [H 2 SO 3] = 8, 68 • 10─10.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ: хорошо диссоциируют на ионы, α>30% ЭЛЕКТРОЛИТЫ почти все соли; кислоты (H 2 SO 4, HCl, HBr, HI, HNO 3), основания (Na. OH, KOH, Ca(OH)2, Li. OH, Ba(OH)2). СЛАБЫЕ ЭЛЕКТРОЛИТЫ: плохо диссоциируют на ионы, α<30% ЭЛЕКТРОЛИТЫ большинство органических кислот, некоторые неорганические (H 2 S, HCN, H 2 CO 3, H 2 SO 3, HСl. O, H 3 BO 3, Hg 2 Cl 2, Fe(SCN)3 ) Ktm. Ann ↔ m. Ktn+ + n. Anm─ - равновесие константа диссоциации (ионизации): Kд =( [Ktn+]m • [Anm─]n)/[Ktm. Ann] = const при данной температуре!!!. [Ktn+] и [Anm ─] – молярные равновесные концентрации ионов электролита; [Ktm. Ann] – молярная равновесная концентрация недиссоциированных молекул электролита. Пример: Н 2 SO 3 ↔ SO 32─ + 2 Н+ Кд = ([SO 32─] • [Н+]2)/ [H 2 SO 3] = 8, 68 • 10─10.
 Н 2 О ↔ Н++ОН─ или 2 Н 2 О ↔ Н 3 О++ОН─ + 56, 6 к. Дж/моль α ≈ 2 • 10─9, амфотерные свойства Кд =([Н+] • [ОН─])/[Н 2 О] = const при Т= const Кд • [Н 2 О] = [Н+] • [ОН─] 1, 8 • 10─16 • 55, 5 = [Н+] • [ОН─] = 10─14– ионное произведение воды, = const при 298 К [Н+] = [ОН─] = √ 10─14 = 10─7. -lg ([Н+] • [ОН─]) = -lg 10─14 -lg[Н+] + (-lg[ОН─]) = -lg 10─14 р. Н + р. ОН = 14 = const р. Н – водородный показатель – показатель концентрации ионов водорода; р. ОН – гидроксильный показатель - показатель концентрации гидроксид-анионов [Н+] = [ОН─] = 10─7 и р. Н=р. ОН = 7 нейтральная среда Для кислых растворов: [Н+] > 10─7> [ОН─] р. Н < 7 < р. ОН Для щелочных растворов: [Н+] < 10─7 < [ОН─] р. Н > 7 > р. ОН.
Н 2 О ↔ Н++ОН─ или 2 Н 2 О ↔ Н 3 О++ОН─ + 56, 6 к. Дж/моль α ≈ 2 • 10─9, амфотерные свойства Кд =([Н+] • [ОН─])/[Н 2 О] = const при Т= const Кд • [Н 2 О] = [Н+] • [ОН─] 1, 8 • 10─16 • 55, 5 = [Н+] • [ОН─] = 10─14– ионное произведение воды, = const при 298 К [Н+] = [ОН─] = √ 10─14 = 10─7. -lg ([Н+] • [ОН─]) = -lg 10─14 -lg[Н+] + (-lg[ОН─]) = -lg 10─14 р. Н + р. ОН = 14 = const р. Н – водородный показатель – показатель концентрации ионов водорода; р. ОН – гидроксильный показатель - показатель концентрации гидроксид-анионов [Н+] = [ОН─] = 10─7 и р. Н=р. ОН = 7 нейтральная среда Для кислых растворов: [Н+] > 10─7> [ОН─] р. Н < 7 < р. ОН Для щелочных растворов: [Н+] < 10─7 < [ОН─] р. Н > 7 > р. ОН.
 В общем случае гидролиз - обменная реакция между веществом и водой (от греч. hýdor – вода и lysis – разложение). Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию слабо диссоциирующих соединений. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой: Al 3+ OH─----H+ Al 3+ + OH---H СО 32─ Н+---ОН─ СО 3 2─ + Н---ОН Al 3+ OH─ + H+ H+ + (Al. OH)2+ - слабо диссоциирует СО 32─ Н+ + ОН─ + (НСО 3)─ - слабо диссоциирует
В общем случае гидролиз - обменная реакция между веществом и водой (от греч. hýdor – вода и lysis – разложение). Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию слабо диссоциирующих соединений. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой: Al 3+ OH─----H+ Al 3+ + OH---H СО 32─ Н+---ОН─ СО 3 2─ + Н---ОН Al 3+ OH─ + H+ H+ + (Al. OH)2+ - слабо диссоциирует СО 32─ Н+ + ОН─ + (НСО 3)─ - слабо диссоциирует
 Сильным поляризующим действием обладают: катионы dэлементов (Al 3+, Zn 2+, Cr 3+, Cu 2+, Ag+, Au 3+ и др. ), анионы слабых кислот (CO 32─, PO 43─, SO 32─, Si. O 32─ и др. ), Mg 2+. ТИПЫ ГИДРОЛИЗА: 1) Гидролиз по катиону – гидролиз солей, образованных слабым основанием и сильной кислотой: NH 4 Cl + HOH ↔ NH 4 OH + HCl NH 4+ + HO---H + Cl─ ↔ NH 4 OH + Cl─ + H+ p. H < 7 2) Гидролиз по аниону – гидролиз солей, образованных слабой кислотой и сильным основанием: K 3 PO 4 + HOH ↔ K 2 HPO 4 + KOH 3 K+ + PO 43─ + H---OH ↔ 3 K+ + HPO 42─ + OH─ p. H >7 3) Полный гидролиз – гидролиз солей, образованных слабой кислотой и слабым основанием: NH 4 CN + HOH ↔ NH 4 OH + HCN NH 4+ + HO---H + CN─ ↔ NH 4 OH + HCN
Сильным поляризующим действием обладают: катионы dэлементов (Al 3+, Zn 2+, Cr 3+, Cu 2+, Ag+, Au 3+ и др. ), анионы слабых кислот (CO 32─, PO 43─, SO 32─, Si. O 32─ и др. ), Mg 2+. ТИПЫ ГИДРОЛИЗА: 1) Гидролиз по катиону – гидролиз солей, образованных слабым основанием и сильной кислотой: NH 4 Cl + HOH ↔ NH 4 OH + HCl NH 4+ + HO---H + Cl─ ↔ NH 4 OH + Cl─ + H+ p. H < 7 2) Гидролиз по аниону – гидролиз солей, образованных слабой кислотой и сильным основанием: K 3 PO 4 + HOH ↔ K 2 HPO 4 + KOH 3 K+ + PO 43─ + H---OH ↔ 3 K+ + HPO 42─ + OH─ p. H >7 3) Полный гидролиз – гидролиз солей, образованных слабой кислотой и слабым основанием: NH 4 CN + HOH ↔ NH 4 OH + HCN NH 4+ + HO---H + CN─ ↔ NH 4 OH + HCN
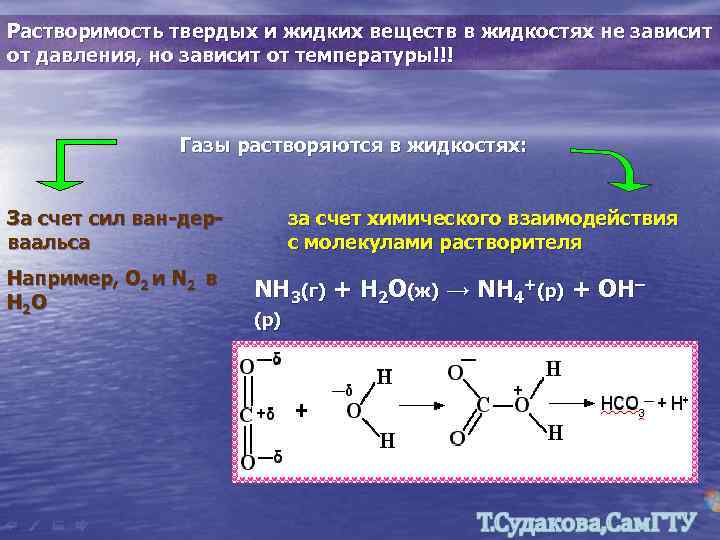 Растворимость твердых и жидких веществ в жидкостях не зависит от давления, но зависит от температуры!!! Газы растворяются в жидкостях: За счет сил ван-дерваальса Например, О 2 и N 2 в Н 2 О за счет химического взаимодействия с молекулами растворителя NH 3(г) + H 2 O(ж) → NH 4+(р) + OH– (р)
Растворимость твердых и жидких веществ в жидкостях не зависит от давления, но зависит от температуры!!! Газы растворяются в жидкостях: За счет сил ван-дерваальса Например, О 2 и N 2 в Н 2 О за счет химического взаимодействия с молекулами растворителя NH 3(г) + H 2 O(ж) → NH 4+(р) + OH– (р)
 Растворимость газов в жидкостях зависит от давления!!! закон Генри: С (Х) = Кг (Х) • р (Х) С(Х) – молярная концентрация газа в насыщенном растворе, моль/л; р(Х) – парциальное давление газа над раствором, Па; Кг(Х) – постоянная Генри для газа Х, моль·л-1·Па-1. Она зависит от природы газа, растворителя и температуры. растворимость газов в жидкостях уменьшается при растворении в них электролитов, т. к. электролиты при диссоциации связывают молекулы воды
Растворимость газов в жидкостях зависит от давления!!! закон Генри: С (Х) = Кг (Х) • р (Х) С(Х) – молярная концентрация газа в насыщенном растворе, моль/л; р(Х) – парциальное давление газа над раствором, Па; Кг(Х) – постоянная Генри для газа Х, моль·л-1·Па-1. Она зависит от природы газа, растворителя и температуры. растворимость газов в жидкостях уменьшается при растворении в них электролитов, т. к. электролиты при диссоциации связывают молекулы воды
 СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ Зависящие от природы растворенного вещества (цвет, плотность и др. ) независящие от природы растворенного вещества, а только от количества растворенных частиц – коллигативные свойства. Основная причина – уменьшение количества свободных молекул растворителя.
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ Зависящие от природы растворенного вещества (цвет, плотность и др. ) независящие от природы растворенного вещества, а только от количества растворенных частиц – коллигативные свойства. Основная причина – уменьшение количества свободных молекул растворителя.
 Осмотическое давление – мера стремления растворителя к переходу через полупроницаемую перегородку в данный раствор. Оно численно равно тому давлению, которое надо приложить к раствору, чтобы осмос прекратился. Рассчитывается по формуле p = См. RT, См – молярная концентрация раствора, моль/л, R – универсальная газовая постоянная, T – абсолютная температура, К. Чем больше число молекул или ионов в растворе, тем больше осмотическое давление раствора!!! растворитель ПОЛУПРОНИЦАЕМАЯ ПЕРЕГОРОДКА
Осмотическое давление – мера стремления растворителя к переходу через полупроницаемую перегородку в данный раствор. Оно численно равно тому давлению, которое надо приложить к раствору, чтобы осмос прекратился. Рассчитывается по формуле p = См. RT, См – молярная концентрация раствора, моль/л, R – универсальная газовая постоянная, T – абсолютная температура, К. Чем больше число молекул или ионов в растворе, тем больше осмотическое давление раствора!!! растворитель ПОЛУПРОНИЦАЕМАЯ ПЕРЕГОРОДКА
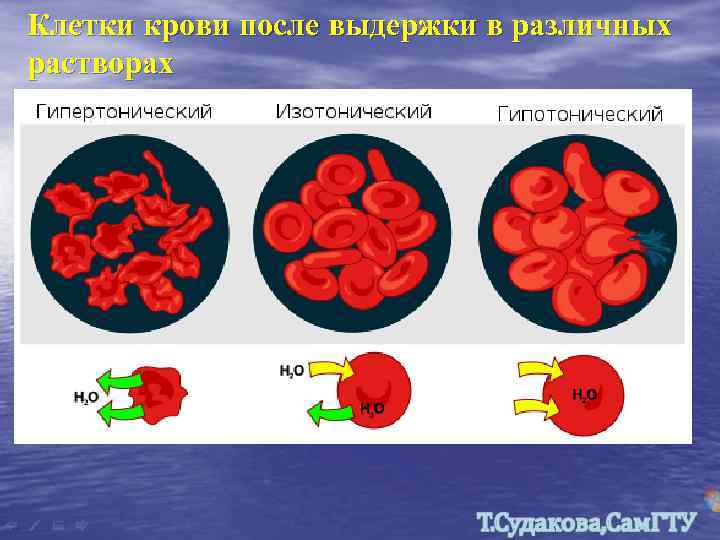 Клетки крови после выдержки в различных растворах
Клетки крови после выдержки в различных растворах
 Куриные яйца после эксперимента по осмосу
Куриные яйца после эксперимента по осмосу
 Понижение давления пара растворителя над раствором - закон Рауля: Δp/p 0 = nв/(nв + n 0) Δp – понижение давления насыщенного пара растворителя над раствором; p 0 - давление насыщенного пара чистого растворителя; nв – количество молей растворенного вещества; n 0 – количество молей растворителя; nв/(nв + n 0) – мольная доля растворенного вещества. Чем больше мольная доля растворенного вещества, тем сильнее уменьшается над раствором давление насыщенного пара растворителя.
Понижение давления пара растворителя над раствором - закон Рауля: Δp/p 0 = nв/(nв + n 0) Δp – понижение давления насыщенного пара растворителя над раствором; p 0 - давление насыщенного пара чистого растворителя; nв – количество молей растворенного вещества; n 0 – количество молей растворителя; nв/(nв + n 0) – мольная доля растворенного вещества. Чем больше мольная доля растворенного вещества, тем сильнее уменьшается над раствором давление насыщенного пара растворителя.
 Температура замерзания растворов ниже, чем температура замерзания чистого растворителя; понижение температуры ΔТз = Ккр • Сm, Сm – моляльная концентрация раствора, моль/кг р-ля, Ккр – криоскопическая константа растворителя; для воды Ккр = 1, 86(о. С • кг)моль. Например, хлоридом кальция можно понизить температуру замерзания воды до -55 о. С. Температура кипения растворов выше, чем температура кипения чистого растворителя; повышение температуры кипения ΔТк = Кэ • Сm, Кэ – эбулиоскопическая константа растворителя, для воды Кэ = 0, 512(о. С • кг)моль,
Температура замерзания растворов ниже, чем температура замерзания чистого растворителя; понижение температуры ΔТз = Ккр • Сm, Сm – моляльная концентрация раствора, моль/кг р-ля, Ккр – криоскопическая константа растворителя; для воды Ккр = 1, 86(о. С • кг)моль. Например, хлоридом кальция можно понизить температуру замерзания воды до -55 о. С. Температура кипения растворов выше, чем температура кипения чистого растворителя; повышение температуры кипения ΔТк = Кэ • Сm, Кэ – эбулиоскопическая константа растворителя, для воды Кэ = 0, 512(о. С • кг)моль,


