первичный активный транспорт.ppt
- Количество слайдов: 51

Первичный активный транспорт

Общие положения, термины Классификация транспортных систем (в соответствии с рекомендациями IUBMB): 1. Каналы и поры 2. Переносчики (carriers, porters) 3. Транспортеры первичного активного транспорта (primary active transporters): системы, использующие гидролиз фосфодиэфирных связей, декарбоксилирование, перенос метильных групп; окислительновосстановительные реакции; энергию света 4. Трансферазы (group translocators) 5. Переносчики электронов

Общие положения, термины Мембранный транспорт (транспорт веществ через липидный бислой): пассивный и активный. Пассивный мембранный транспорт – по (электро)химическому градиенту, не требует энергетических затрат: диффузия или облегченная диффузия. Активный мембранный транспорт – против (электро)химического градиента, т. е. необходимы энергетические затраты (сопряжение с энергетически выгодным процессом): первичный и вторичный. Источники энергии для активного мембранного транспорта: гидролиз АТФ, свет, окислительно-восстановительные реакции, (электро)химический градиент. Энергия для первичного активного транспорта поступает из источника, отличного от уже имеющегося (электро)химического градиента. Источником энергии для вторичного активного транспорта служит предсуществующий (электро)химический градиент.
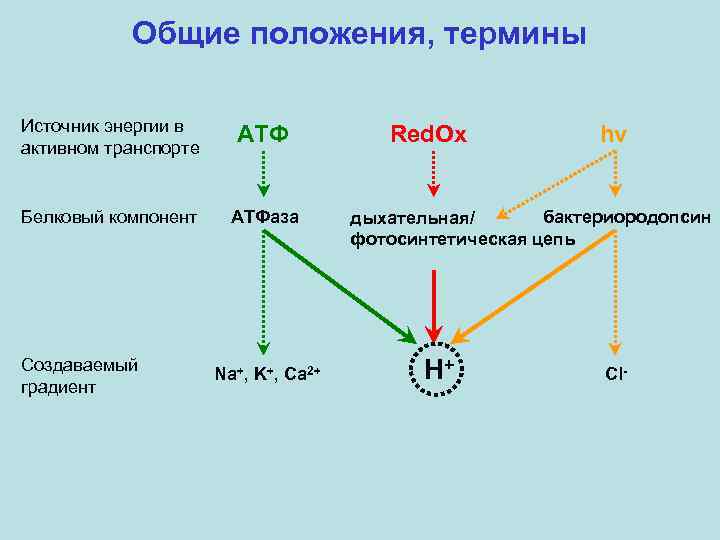
Общие положения, термины Источник энергии в активном транспорте АТФ Белковый компонент АТФаза Создаваемый градиент Na+, K+, Ca 2+ Red. Ox hν бактериородопсин дыхательная/ фотосинтетическая цепь H+ Cl-
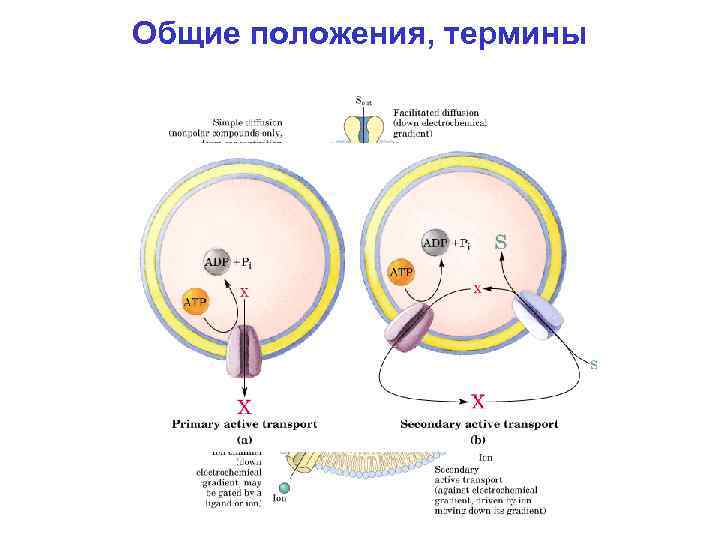
Общие положения, термины

Первичный активный транспорт Часть I. Бактериородопсин – интегральный мембранный белок (хромопротеин) галобактерий (археи), являющийся фотоиндуцируемой светозависимой протонной помпой. В настоящее время известны пространственные структуры: бактериородопсина из пурпурной мембраны Halobacterium salinarum (первый мембранный белок, для которого исследована пространственная структура), а также галородопсина из той же бактерии, сенсорного родопсина II из Natronomonas pharaonis (энтеробактерия) и сенсорного родопсина из Anabaena sp. (цианобактерия), химеры каналродопсинов Ch. R 1 и Ch. R 2 из Chlamydomonas reinhardtii (зеленая водоросль). Белок (Mr~27 к. Да) содержит семь трансмембранных α-спиральных сегментов. Хромофор – остаток ретиналя – связан ковалентно альдиминной связью (основание Шиффа) с остатком Lys 216.
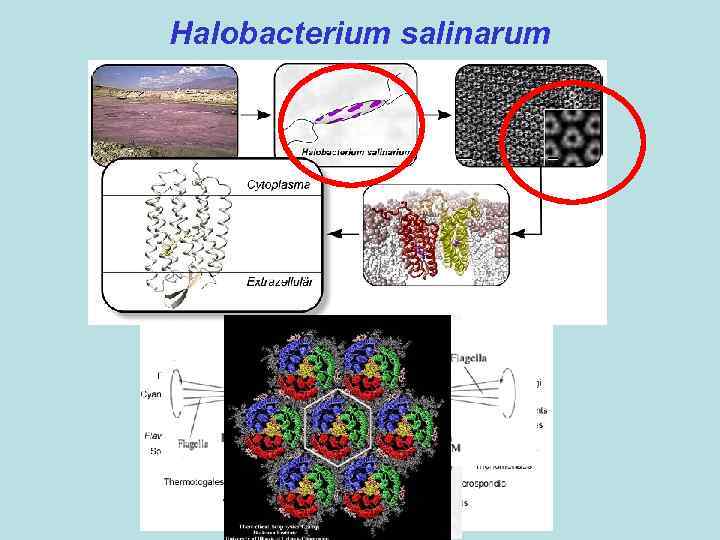
Halobacterium salinarum
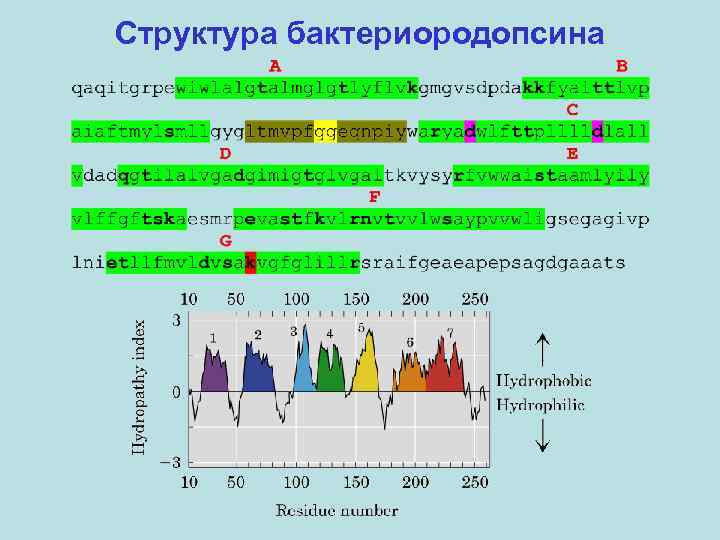
Структура бактериородопсина
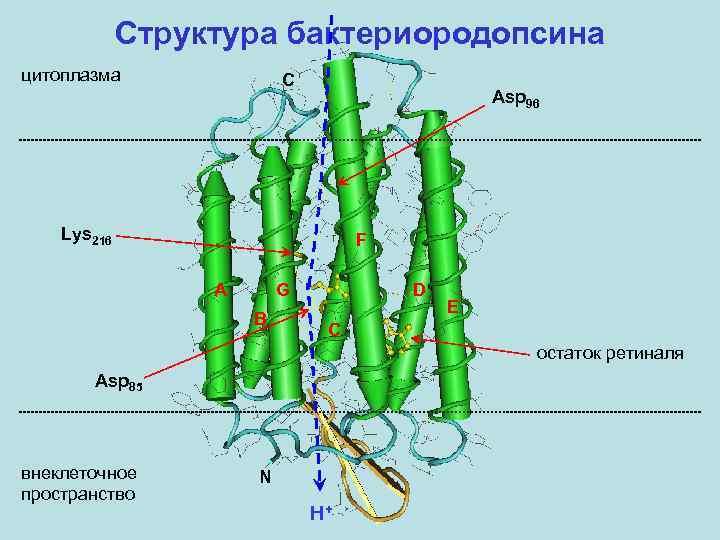
Структура бактериородопсина цитоплазма C Asp 96 Lys 216 F A G B D E C остаток ретиналя Asp 85 внеклеточное пространство N H+
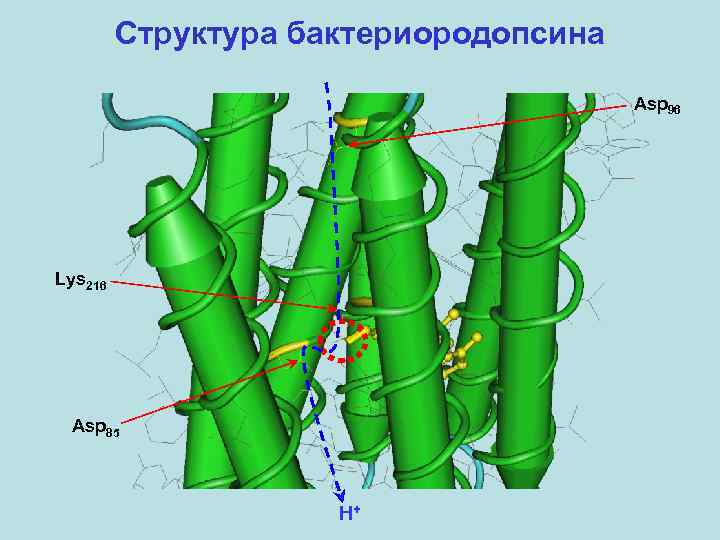
Структура бактериородопсина Asp 96 Lys 216 Asp 85 H+
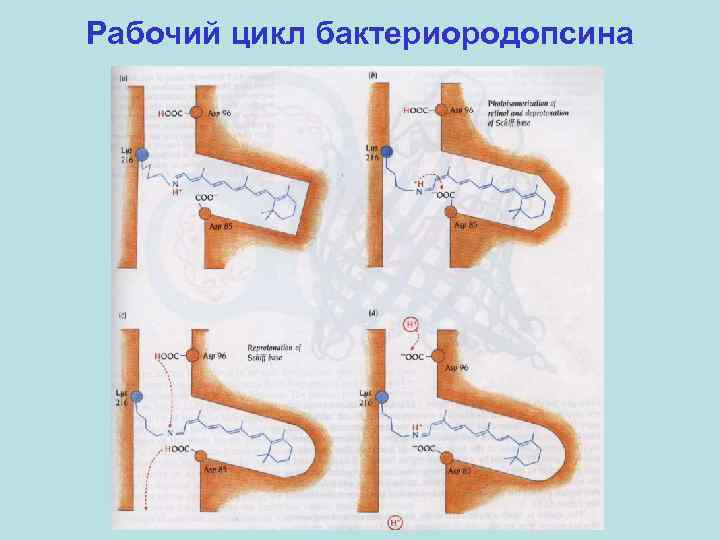
Рабочий цикл бактериородопсина
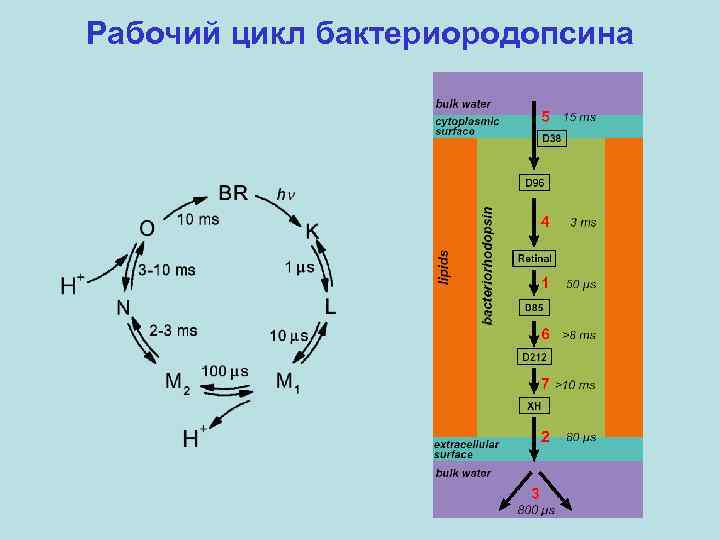
Рабочий цикл бактериородопсина
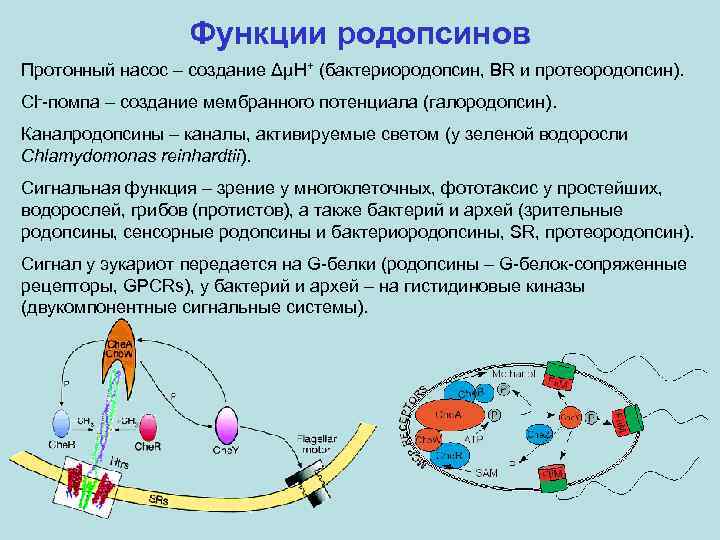
Функции родопсинов Протонный насос – создание ΔμH+ (бактериородопсин, BR и протеородопсин). Cl--помпа – создание мембранного потенциала (галородопсин). Каналродопсины – каналы, активируемые светом (у зеленой водоросли Chlamydomonas reinhardtii). Сигнальная функция – зрение у многоклеточных, фототаксис у простейших, водорослей, грибов (протистов), а также бактерий и архей (зрительные родопсины, сенсорные родопсины и бактериородопсины, SR, протеородопсин). Сигнал у эукариот передается на G-белки (родопсины – G-белок-сопряженные рецепторы, GPCRs), у бактерий и архей – на гистидиновые киназы (двукомпонентные сигнальные системы).
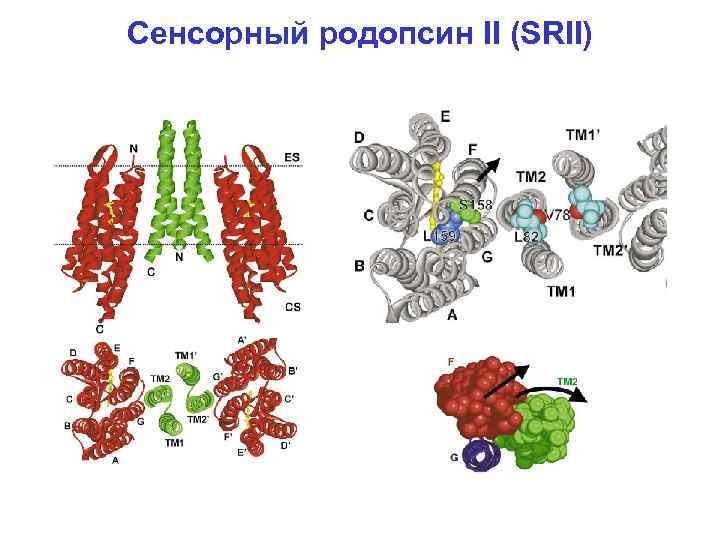
Сенсорный родопсин II (SRII)
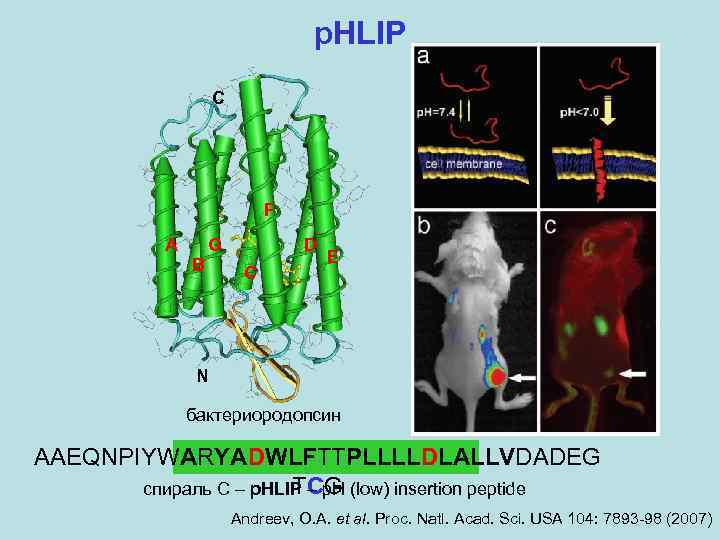
p. HLIP C F A B G D C E N бактериородопсин AAEQNPIYWARYADWLFTTPLLLLDLALLVDADEG TCG спираль C – p. HLIP – p. H (low) insertion peptide Andreev, O. A. et al. Proc. Natl. Acad. Sci. USA 104: 7893 -98 (2007)
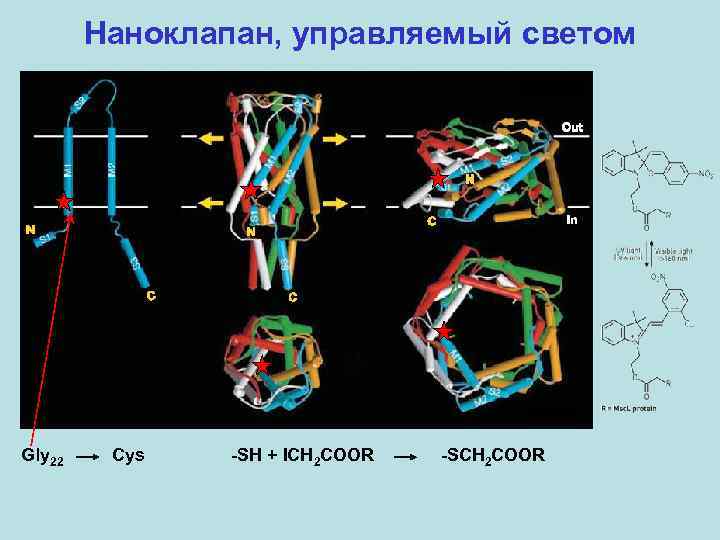
Наноклапан, управляемый светом Gly 22 Cys -SH + ICH 2 COOR -SCH 2 COOR
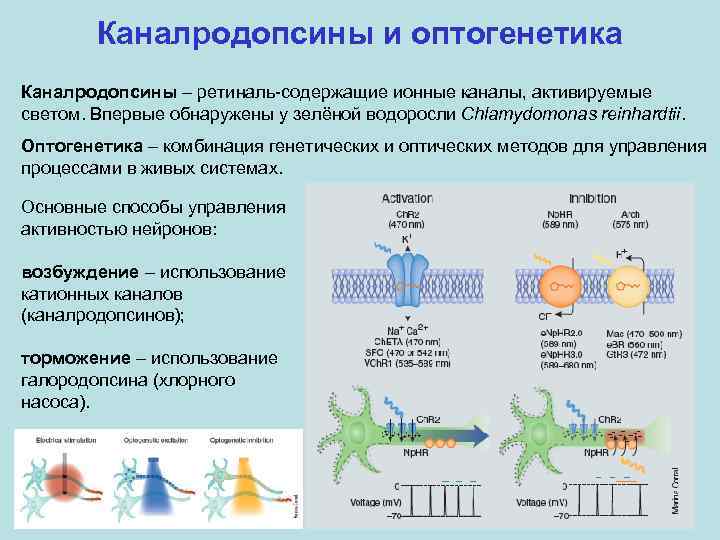
Каналродопсины и оптогенетика Каналродопсины – ретиналь-содержащие ионные каналы, активируемые светом. Впервые обнаружены у зелёной водоросли Chlamydomonas reinhardtii. Оптогенетика – комбинация генетических и оптических методов для управления процессами в живых системах. Основные способы управления активностью нейронов: возбуждение – использование катионных каналов (каналродопсинов); торможение – использование галородопсина (хлорного насоса).

G-белок-сопряженные рецепторы (GPCRs) Составляют одно из самых больших и разнообразных (супер)семейств белков эукариот. Являются гомологами родопсина (белка-прототипа семейства). Содержат семь трансмембранных α-спиралей (N-конец на внеклеточной стороне). Известны пространственные структуры: родопсина, β 2 адренергического рецептора (также в комплексе с агонистами и антагонистом), A 2 A аденозинового рецептора (с антагонистом), β 1 адренергического рецептора, D 3 дофаминового рецептора (с антагонистом), CXCR 4 хемокинового рецептора (с антагонистами). Основная функция – сигнальная, у человека обеспечивают 3 из 5 канонических сенсорных модальностей (зрение, вкус, обоняние). Найдены практически у всех эукариотических организмов с известным геномом, включая грибы и растения, предковая форма, по-видимому, родопсинового типа. Число различных рецепторов – от 1 -10 у растений и дрожжей до >1000 у млекопитающих и нематод (6% всех генов). Не обнаруживают гомологии с бактериородопсинами! Пример конвергентной эволюции белковых структур? Сигнал передается на тримерные G-белки (у человека по крайней мере 18 изоформ Gα, 5 – Gβ и 11 – Gγ). 10% GPCRs человека – известные мишени лекарств, до 50% всех лекарственных средств действуют на GPCRs.

Классификация GPCRs человека На основании гомологий аминокислотных последовательностей G-белоксопряженные рецепторы человека предложено объединять в 5 основных семейств (GRAFS-номенклатура): Glutamate (15): метаботропные глутаматные, ГАМК- и вкусовые рецепторы, Ca 2+чувствительный рецептор (N-концевой лиганд-связывающий домен 280 -580 а. к. ) Rhodopsin (701): рецепторы простагландинов, биогенных аминов, пептидных и непептидных гормонов, каннабиноидов, нейропептидов, нейротрансмиттеров, опиоидов, цитокинов, нуклеотидов, светочувствительные рецепторы, а также одорантные рецепторы (460) Adhesion (24): предполагаемые молекулы клеточной адгезии, рецептор латротоксина (протяженная N-концевая область 200 -2800 а. к. , содержащая домены белков клеточной адгезии) Frizzled (24): вкусовые рецепторы (отличаются от входящих в glutamateсемейство), а также рецепторы регуляторов клеточной пролиферации и дифференцировки в развитии (N-концевой лиганд-связывающий домен 200 а. к. , консервативные S-S-мосты) Secretin (15): рецепторы пептидных гормонов (N-концевой лиганд-связывающий домен 60 -80 а. к. , консервативные S-S-мосты)
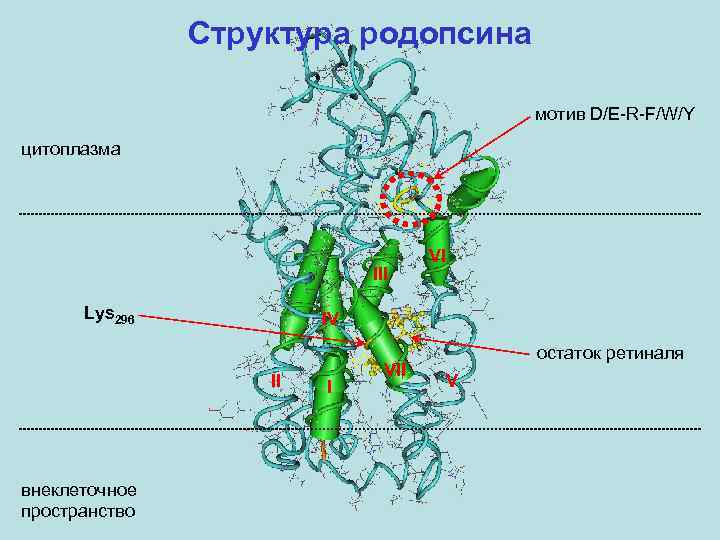
Структура родопсина мотив D/E-R-F/W/Y цитоплазма III Lys 296 IV II внеклеточное пространство VI I VII остаток ретиналя V

Механизм передачи сигнала GPCR мотив D/E-R-F/W/Y в α-спирали III сеть ионных и водородных связей аргинина и дикарбоновых аминокислот стабилизируют согнутую конформацию α-спирали VI и ее сближение с α-спиралью III активация рецептора приводит к нарушению этих взаимодействий, распрямлению α-спирали VI и ее удаление от α-спирали III

Нобелевские премии Джордж Уолд 1967, за открытия, касающиеся первичных физиологических и химических зрительных процессов Ричард Аксель Линда Б. Бак 2004, за открытие одорантных рецепторов и организации системы обоняния Роберт Дж. Лефковитц Брайан К. Кобилка 2012, за исследования G-белок-сопряженных рецепторов

Первичный активный транспорт Часть II. Мембранные АТФазы (ионные насосы / помпы) – интегральные мембранные ферменты (белки), сопрягающие реакцию гидролиза / синтеза АТФ с направленным переносом веществ через мембрану. На сегодняшний день известны пространственные структуры: Ca 2+-АТФазы саркоплазматического ретикулюма, Na+, K+-АТФазы, H+-АТФазы растений, F 1 -домена АТФ-синтазы, ротора АТФаз F- и V-типа, а также целого ряда комплексов и отдельных субъединиц, некоторых белковых доменов, входящих в состав многих мембранных АТФаз; многих ABC транспортеров бактерий.
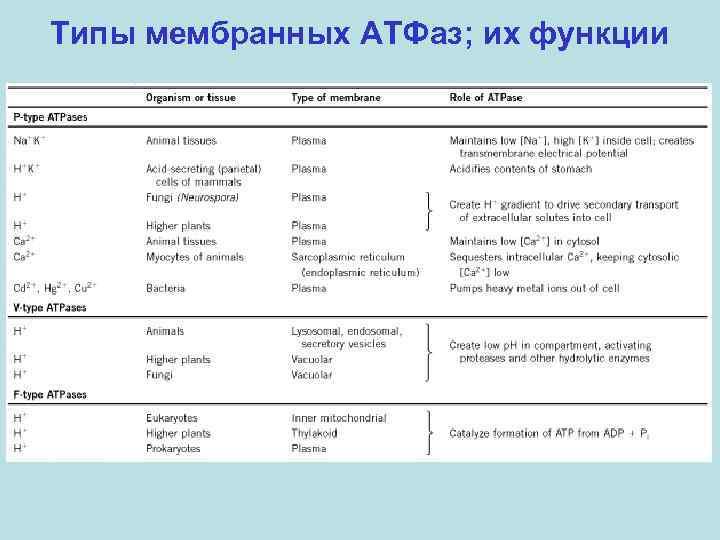
Типы мембранных АТФаз; их функции
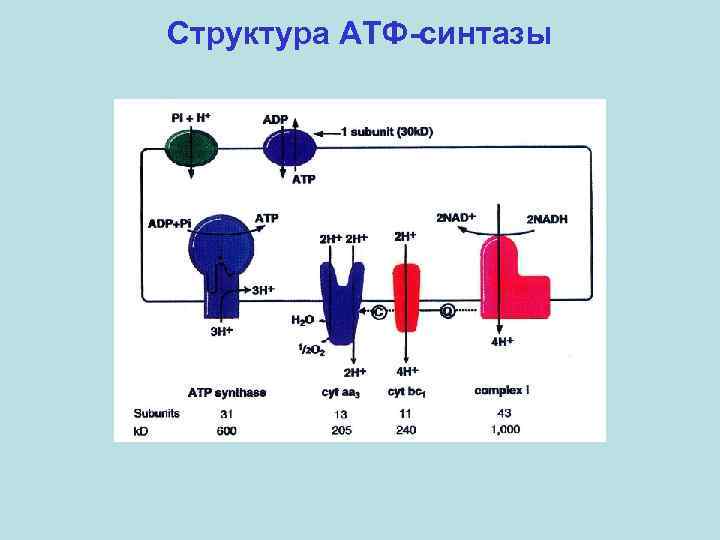
Структура АТФ-синтазы
Структура АТФ-синтазы

Структура АТФ-синтазы F 1 -домен ~370 к. Да 3α: 3β: 1γ: 1δ: 1ε Fo-домен 1 a: 2 b: 9 -14 c
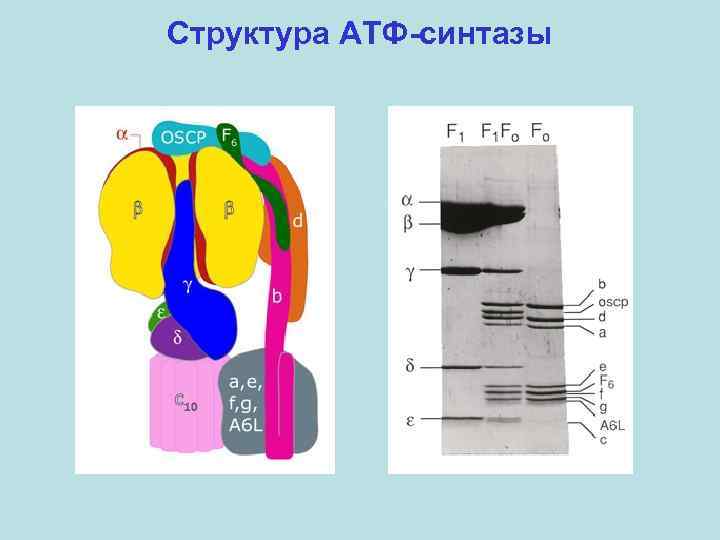
Структура АТФ-синтазы
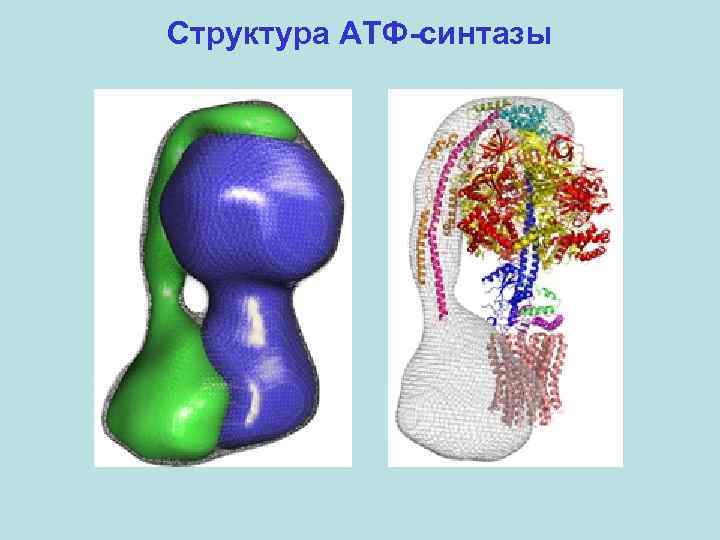
Структура АТФ-синтазы
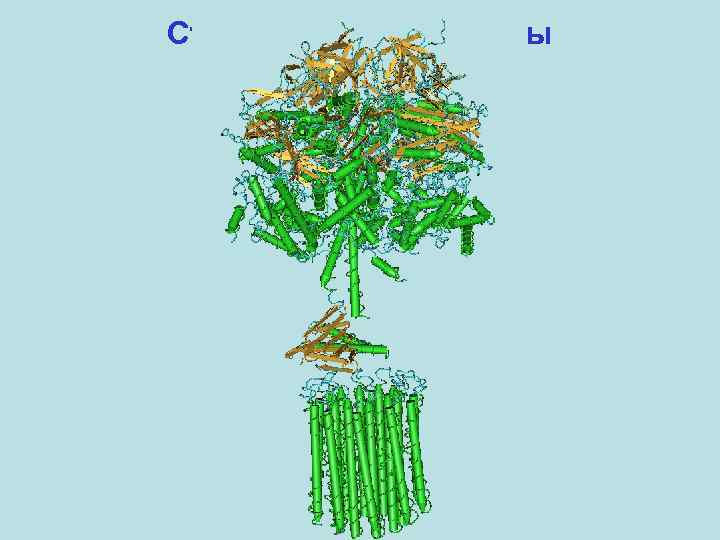
Структура АТФ-синтазы
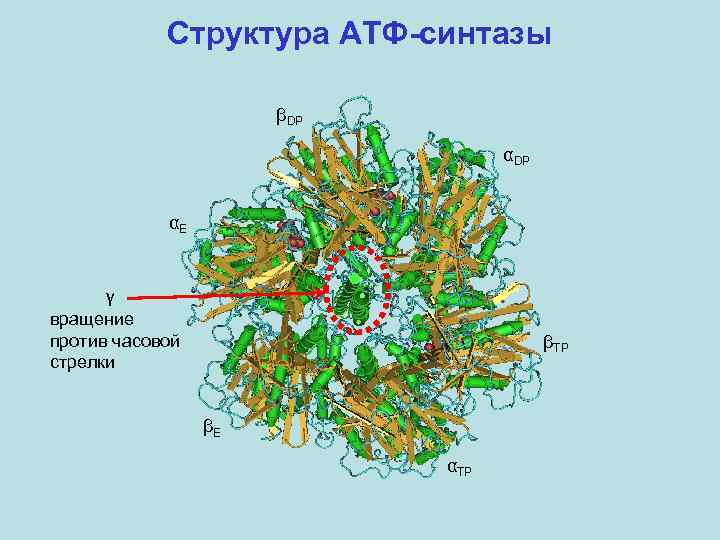
Структура АТФ-синтазы βDP αE γ вращение против часовой стрелки βTP βE αTP

Механизм Бойера и его подтверждение 1. Фермент не высвобождает продукт из одного сайта, пока другой сайт не занят субстратом. 2. Три каталитических сайта β-субъединиц одинаково эффективны. 3. Лимитирующая стадия – высвобождение продукта. Происходит обратимый ресинтез АТФ. 4. Три каталитических сайта в данный момент времени различаются аффинностью к АТФ: <1 н. М, ~1 мк. М, ~30 мк. М. Связывание субстрата имеет отрицательную кооперативность. 5. Катализ отличается положительной кооперативностью: если занято более одного сайта, скорость гидролиза АТФ возрастает в 104 -105 раз.

Механизм Бойера и его подтверждение
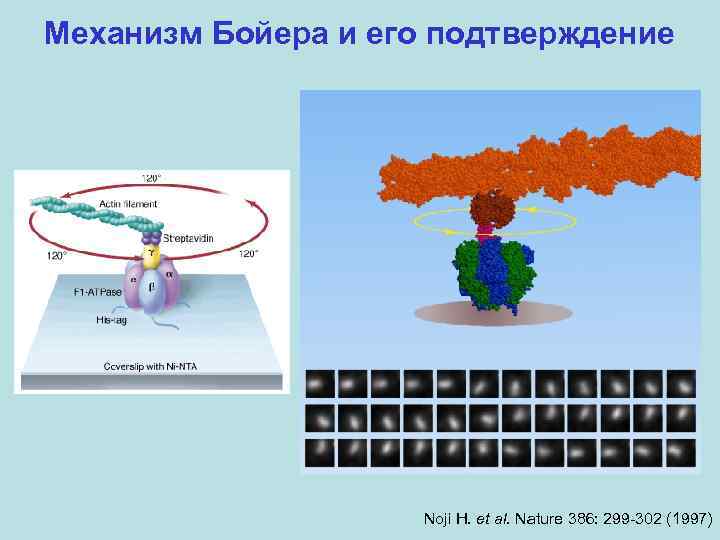
Механизм Бойера и его подтверждение Noji H. et al. Nature 386: 299 -302 (1997)
Сайт связывания нуклеотидов
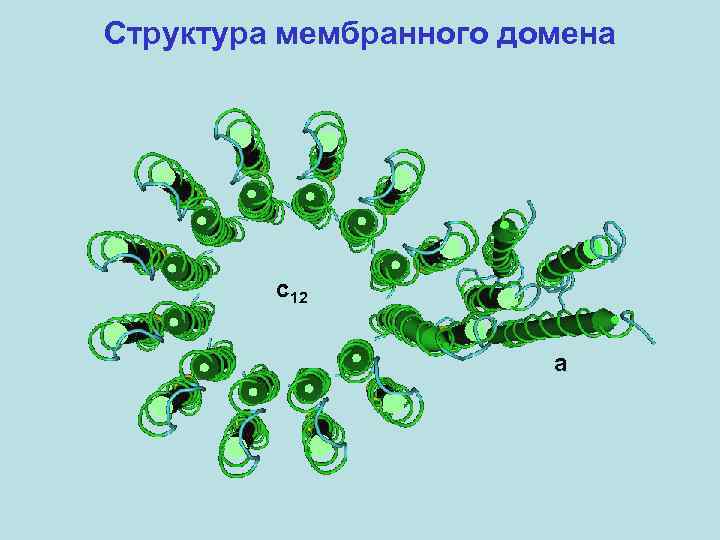
Структура мембранного домена c 12 a
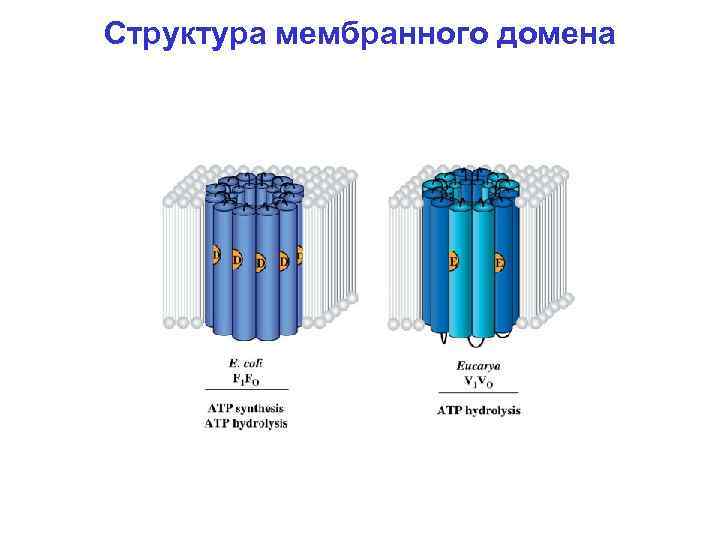
Структура мембранного домена
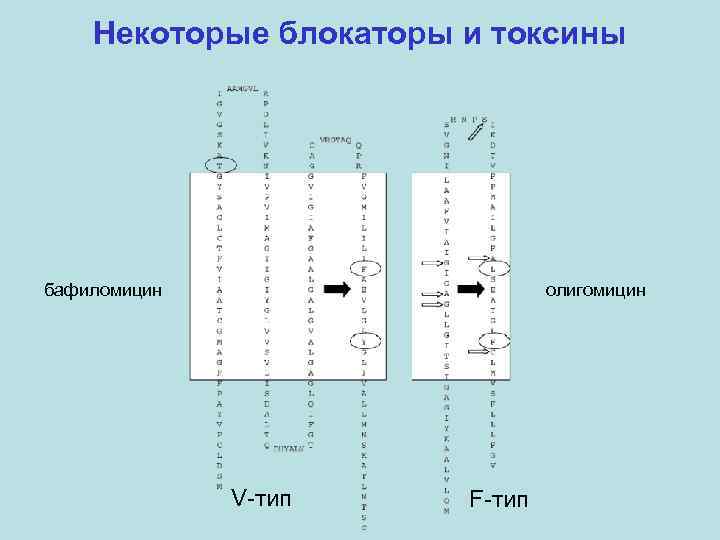
Некоторые блокаторы и токсины бафиломицин олигомицин V-тип F-тип
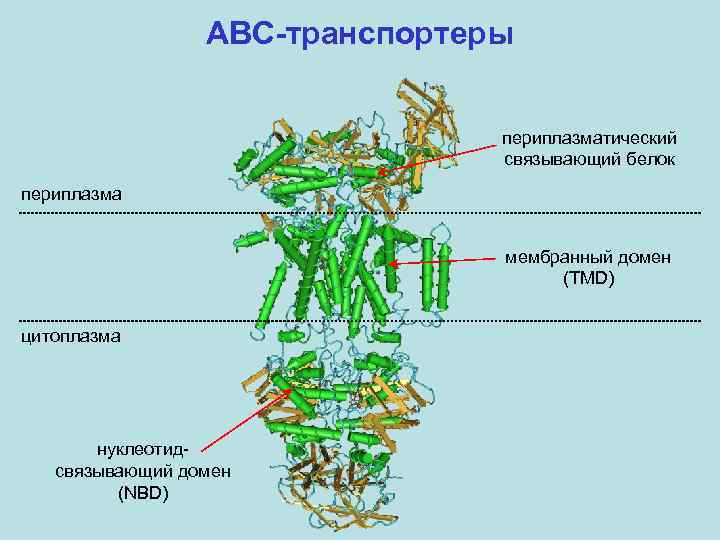
ABC-транспортеры периплазматический связывающий белок периплазма мембранный домен (TMD) цитоплазма нуклеотидсвязывающий домен (NBD)
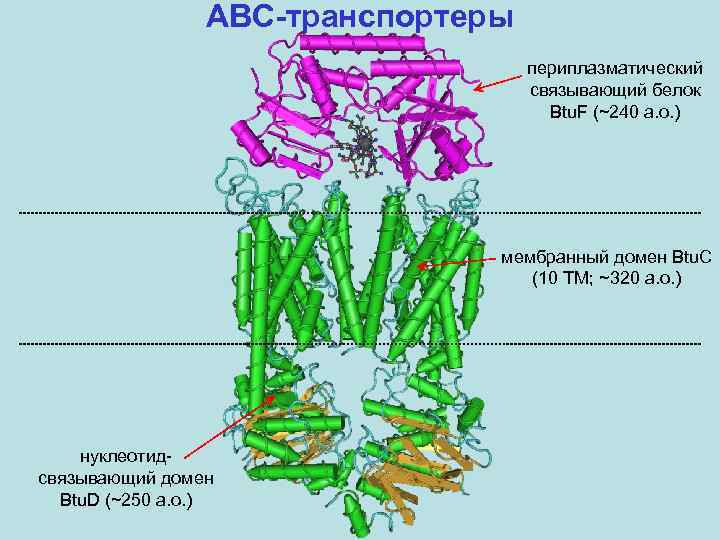
ABC-транспортеры периплазматический связывающий белок Btu. F (~240 а. о. ) мембранный домен Btu. C (10 TM; ~320 а. о. ) нуклеотидсвязывающий домен Btu. D (~250 а. о. )
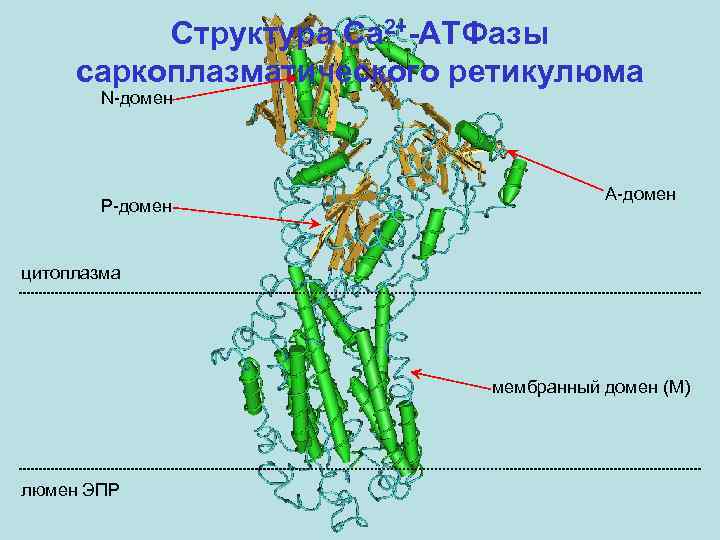
Структура Ca 2+-АТФазы саркоплазматического ретикулюма N-домен P-домен A-домен цитоплазма мембранный домен (M) люмен ЭПР
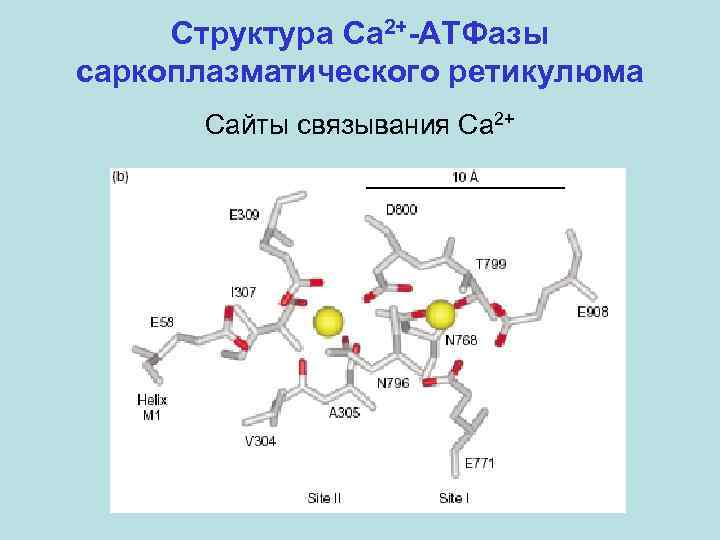
Структура Ca 2+-АТФазы саркоплазматического ретикулюма Сайты связывания Ca 2+

Структура АТФаз P-типа
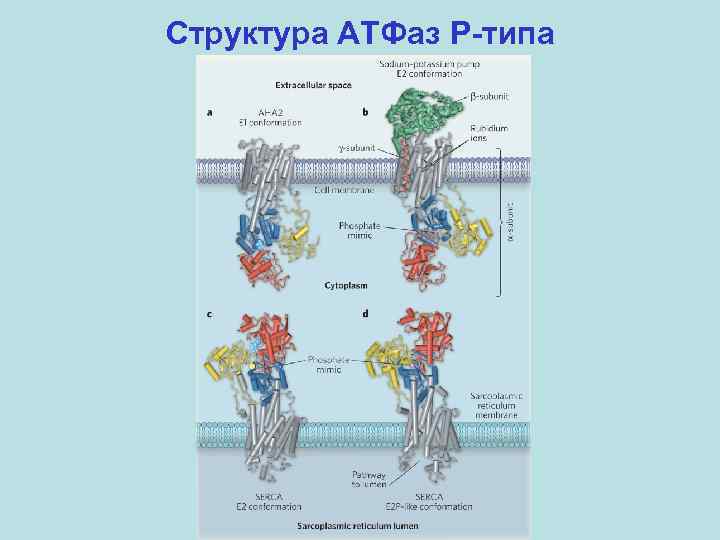
Структура АТФаз P-типа
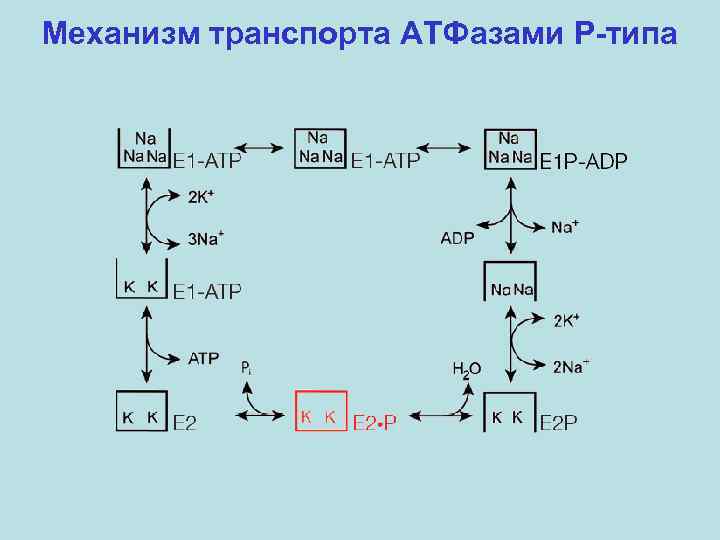
Механизм транспорта АТФазами P-типа
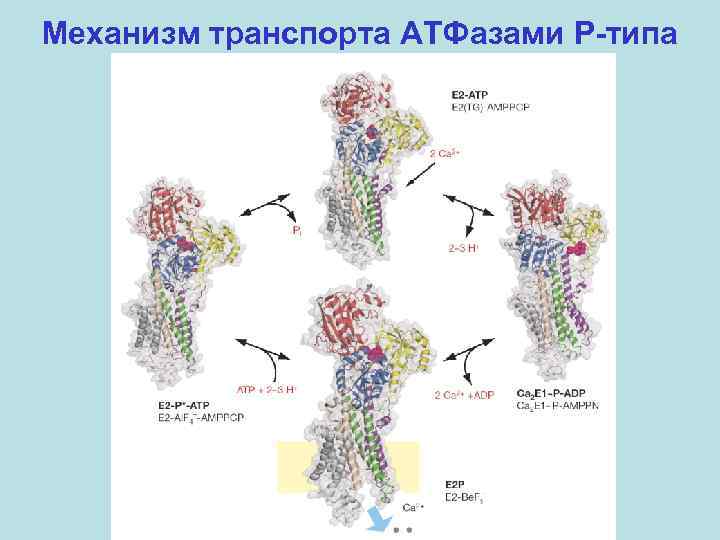
Механизм транспорта АТФазами P-типа
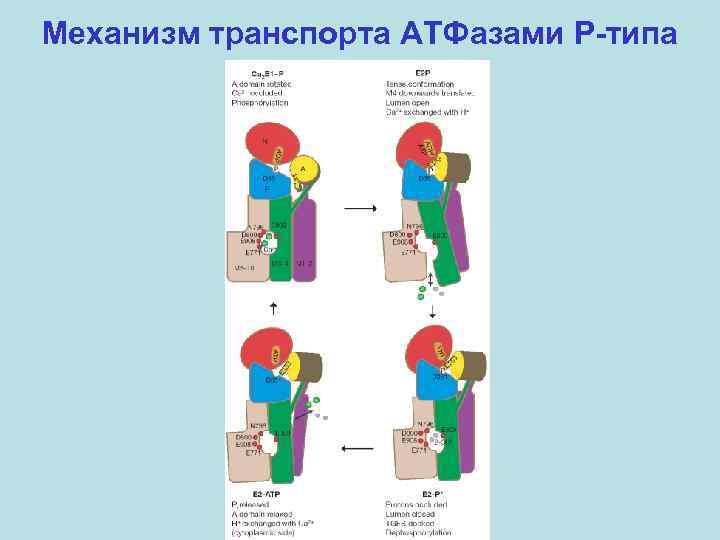
Механизм транспорта АТФазами P-типа
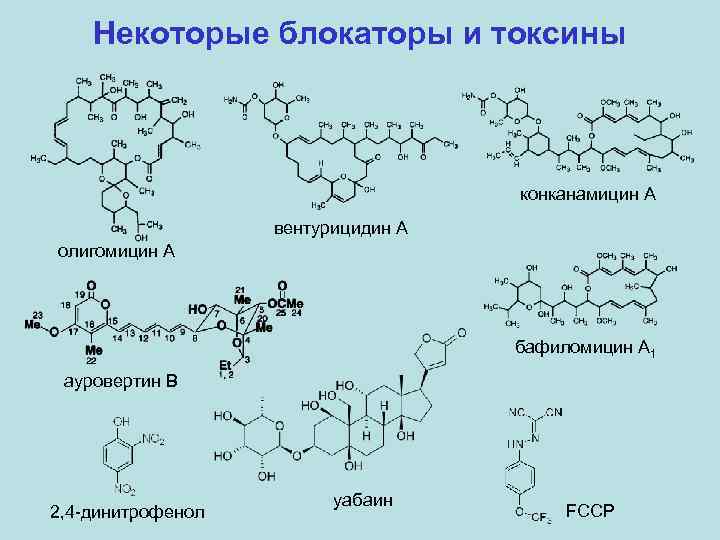
Некоторые блокаторы и токсины конканамицин A вентурицидин A олигомицин A бафиломицин A 1 ауровертин B 2, 4 -динитрофенол уабаин FCCP
Некоторые блокаторы и токсины палитоксин 2, 7 к. Да, 64 асимметрических центра 7 двойных связей

Нобелевские премии Питер Д. Митчелл 1978, за вклад в понимание процесса преобразования энергии в биологических системах, конкретно, за формулирование хемиосмотической теории Пол Д. Бойер Джон Э. Уокер 1997, за выяснение механизма ферментативного синтеза АТФ Йенс Х. Скоу 1997, за открытие первого ионтранспортирующего фермента, Na, K-АТФазы
первичный активный транспорт.ppt