26a5a688_odm_n3.ppt
- Количество слайдов: 60
 ПЕРВИЧНЫЕ И ВТОРИЧНЫЕ ИССЛЕДОВАНИЯ. УЯЗВИМЫЕ КАТЕГОРИИ НАСЕЛЕНИЯ ДЛЯ ВКЛЮЧЕНИЯ В КИ. УРОВНИ ДОКАЗАННОСТИ. КЛАССЫ РЕКОМЕНДАЦИЙ. КОНЕЧНЫЕ ТОЧКИ КИ. УЧАСТНИКИ КИ № 3 для студентов 6 курса педиатрического факультета 2012 -13 учебный год
ПЕРВИЧНЫЕ И ВТОРИЧНЫЕ ИССЛЕДОВАНИЯ. УЯЗВИМЫЕ КАТЕГОРИИ НАСЕЛЕНИЯ ДЛЯ ВКЛЮЧЕНИЯ В КИ. УРОВНИ ДОКАЗАННОСТИ. КЛАССЫ РЕКОМЕНДАЦИЙ. КОНЕЧНЫЕ ТОЧКИ КИ. УЧАСТНИКИ КИ № 3 для студентов 6 курса педиатрического факультета 2012 -13 учебный год
 ПЛАН 1. Понятия первичных и вторичных исследований 2. Уязвимые категории населения для включения в КИ 3. Уровни доказанности, классы рекомендаций 4. Конечные точки КИ 5. Участники КИ; их права и обязанности
ПЛАН 1. Понятия первичных и вторичных исследований 2. Уязвимые категории населения для включения в КИ 3. Уровни доказанности, классы рекомендаций 4. Конечные точки КИ 5. Участники КИ; их права и обязанности
 ВРЕМЕННЫЕ ТОЧКИ ИССЛЕДОВАНИЯ • Разработка протокола • Получение разрешения на проведение исследования • Отбор исследовательских центров • Стартовое совещание • Инициализация центров • Мониторирование • Закрытие центров • Обработка результатов, публикации • Регистрация препарата • Начало продаж
ВРЕМЕННЫЕ ТОЧКИ ИССЛЕДОВАНИЯ • Разработка протокола • Получение разрешения на проведение исследования • Отбор исследовательских центров • Стартовое совещание • Инициализация центров • Мониторирование • Закрытие центров • Обработка результатов, публикации • Регистрация препарата • Начало продаж
 ОЦЕНКА СОБЛЮДЕНИЯ ПРОТОКОЛА КИ ВКЛЮЧАЕТ ПРОВЕРКУ: • Критериев включения и исключения • Графика и полноты методов обследований • Процедуры рандомизации, если таковая применялась • Процедур хранения, подготовки и назначения препарата • Критериев эффективности и безопасности • Сопутствующей терапии
ОЦЕНКА СОБЛЮДЕНИЯ ПРОТОКОЛА КИ ВКЛЮЧАЕТ ПРОВЕРКУ: • Критериев включения и исключения • Графика и полноты методов обследований • Процедуры рандомизации, если таковая применялась • Процедур хранения, подготовки и назначения препарата • Критериев эффективности и безопасности • Сопутствующей терапии
 ТРЕБОВАНИЯ К ЭКСПЕРИМЕНТАЛЬНОМУ И КОНТРОЛЬНОМУ КУРСАМ ЛЕЧЕНИЯ • Одинаковые условия • Оба курса должны быть этически оправданными и учитывать интересы охраны здоровья испытуемых • Каждый курс должен быть приемлем для пациента, исследователя и этического комитета • Польза от курса должна быть выше риска
ТРЕБОВАНИЯ К ЭКСПЕРИМЕНТАЛЬНОМУ И КОНТРОЛЬНОМУ КУРСАМ ЛЕЧЕНИЯ • Одинаковые условия • Оба курса должны быть этически оправданными и учитывать интересы охраны здоровья испытуемых • Каждый курс должен быть приемлем для пациента, исследователя и этического комитета • Польза от курса должна быть выше риска
 ТИПЫ КОНТРОЛЬНЫХ ГРУПП • • • Активный препарат Плацебо Группа без лечения Различные дозы одного препарата Традиционная терапия Историческое сравнение
ТИПЫ КОНТРОЛЬНЫХ ГРУПП • • • Активный препарат Плацебо Группа без лечения Различные дозы одного препарата Традиционная терапия Историческое сравнение
 КРИТЕРИИ СТРОГОГО КОНТРОЛЯ КИ • • • Строгий протокол Рандомизация Сравнительное КИ Проспективное КИ Слепое КИ Многоцентровое КИ
КРИТЕРИИ СТРОГОГО КОНТРОЛЯ КИ • • • Строгий протокол Рандомизация Сравнительное КИ Проспективное КИ Слепое КИ Многоцентровое КИ
 ПЛАЦЕБО-ЭФФЕКТ • Психологически обусловленное уменьшение симптомов, а не истинное биологическое их уменьшение
ПЛАЦЕБО-ЭФФЕКТ • Психологически обусловленное уменьшение симптомов, а не истинное биологическое их уменьшение
 ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ПЛАЦЕБО-КОНТРОЛЯ • Заболевание не требует медикаментозной коррекции • Не существует известной эффективной терапии, которая могла бы быть использована для активного контроля • Испытуемые не переносят известную эффективную терапию
ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ПЛАЦЕБО-КОНТРОЛЯ • Заболевание не требует медикаментозной коррекции • Не существует известной эффективной терапии, которая могла бы быть использована для активного контроля • Испытуемые не переносят известную эффективную терапию
 КАТЕГОРИИ ВТОРИЧНЫХ ИССЛЕДОВАНИЙ а) Несистематические обзоры, обобщающие результаты первичных исследований б) Систематические обзоры - то же, но на основе жесткой методологии в) Мета-анализы, обобщающие количественные данные нескольких исследований (два и более) с определением средних показателей г) Клинические рекомендации, в которых сформулированы выводы из исследований, касающиеся требований к действиям врачей д) Экономический анализ, позволяющий делать выводы о целесообразности финансирования определенных вмешательств
КАТЕГОРИИ ВТОРИЧНЫХ ИССЛЕДОВАНИЙ а) Несистематические обзоры, обобщающие результаты первичных исследований б) Систематические обзоры - то же, но на основе жесткой методологии в) Мета-анализы, обобщающие количественные данные нескольких исследований (два и более) с определением средних показателей г) Клинические рекомендации, в которых сформулированы выводы из исследований, касающиеся требований к действиям врачей д) Экономический анализ, позволяющий делать выводы о целесообразности финансирования определенных вмешательств
 СИСТЕМАТИЧЕСКИЕ ОБЗОРЫ • Научные исследования, в которых синтезируются результаты оригинальных КИ
СИСТЕМАТИЧЕСКИЕ ОБЗОРЫ • Научные исследования, в которых синтезируются результаты оригинальных КИ
 ЭТАПЫ СОСТАВЛЕНИЯ СИСТЕМАТИЧЕСКОГО ОБЗОРА • Поиск всех публикаций по теме обзора • Выявление из всех имеющихся публикаций наиболее надежных в плане строгости методики • Оценка соответствия статьи заранее установленным критериям качества • Объединение результатов исследования: качественное и количественное (мета-анализ) • Оценка результатов
ЭТАПЫ СОСТАВЛЕНИЯ СИСТЕМАТИЧЕСКОГО ОБЗОРА • Поиск всех публикаций по теме обзора • Выявление из всех имеющихся публикаций наиболее надежных в плане строгости методики • Оценка соответствия статьи заранее установленным критериям качества • Объединение результатов исследования: качественное и количественное (мета-анализ) • Оценка результатов
 МЕТОДИКА ВЫПОЛНЕНИЯ СИСТЕМАТИЧЕСКОГО ОБЗОРА 1. 2. 3. 4. 5. 6. Проблема: лечение стабильной стенокардии (сравнение хирургических методов между собой и с медикаментозной терапией) Оцениваемые клинические исходы: летальность; частота ИМ; частота повторных реваскуляризаций; продолжительность антиангинального эффекта Анализируемые исследования: РКИ, регистры, систематические обзоры, МА Источники информации: Medline, Medscape, Кокрановская библиотека, журналы, материалы конференций, библиографические ссылки Ключевые слова, используемые при поиске Метод формирования информационного массива: название – реферат – полный текст - библиография
МЕТОДИКА ВЫПОЛНЕНИЯ СИСТЕМАТИЧЕСКОГО ОБЗОРА 1. 2. 3. 4. 5. 6. Проблема: лечение стабильной стенокардии (сравнение хирургических методов между собой и с медикаментозной терапией) Оцениваемые клинические исходы: летальность; частота ИМ; частота повторных реваскуляризаций; продолжительность антиангинального эффекта Анализируемые исследования: РКИ, регистры, систематические обзоры, МА Источники информации: Medline, Medscape, Кокрановская библиотека, журналы, материалы конференций, библиографические ссылки Ключевые слова, используемые при поиске Метод формирования информационного массива: название – реферат – полный текст - библиография
 ГЛАВНЫЕ ВОПРОСЫ, НА КОТОРЫЕ ДОЛЖЕН ДАТЬ ОТВЕТ СИСТЕМАТИЧЕСКИЙ ОБЗОР 1. Действительно ли эффективно анализируемое вмешательство? 2. Насколько оно эффективнее других вмешательств, применяемых в настоящее время при данной патологии? 3. Насколько безопасно изучаемое вмешательство? 4. Оправдано ли данное вмешательство с позиций соотношения польза/риск?
ГЛАВНЫЕ ВОПРОСЫ, НА КОТОРЫЕ ДОЛЖЕН ДАТЬ ОТВЕТ СИСТЕМАТИЧЕСКИЙ ОБЗОР 1. Действительно ли эффективно анализируемое вмешательство? 2. Насколько оно эффективнее других вмешательств, применяемых в настоящее время при данной патологии? 3. Насколько безопасно изучаемое вмешательство? 4. Оправдано ли данное вмешательство с позиций соотношения польза/риск?
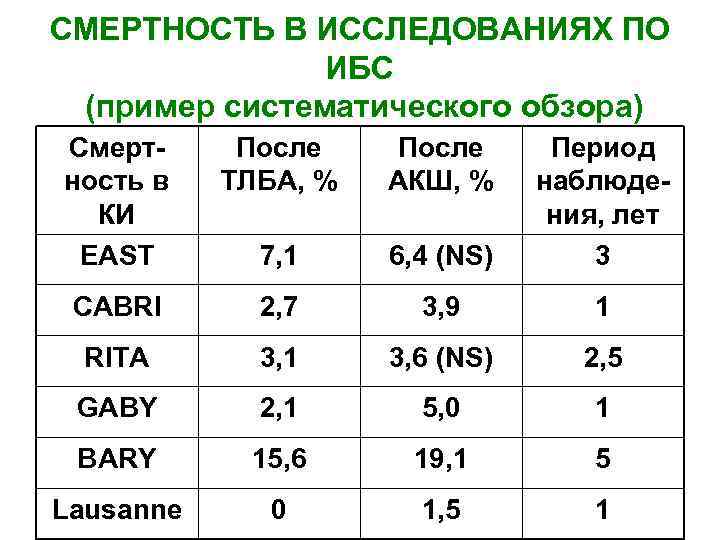 СМЕРТНОСТЬ В ИССЛЕДОВАНИЯХ ПО ИБС (пример систематического обзора) Смертность в КИ EAST После ТЛБА, % После АКШ, % 7, 1 6, 4 (NS) Период наблюдения, лет 3 CABRI 2, 7 3, 9 1 RITA 3, 1 3, 6 (NS) 2, 5 GABY 2, 1 5, 0 1 BARY 15, 6 19, 1 5 Lausanne 0 1, 5 1
СМЕРТНОСТЬ В ИССЛЕДОВАНИЯХ ПО ИБС (пример систематического обзора) Смертность в КИ EAST После ТЛБА, % После АКШ, % 7, 1 6, 4 (NS) Период наблюдения, лет 3 CABRI 2, 7 3, 9 1 RITA 3, 1 3, 6 (NS) 2, 5 GABY 2, 1 5, 0 1 BARY 15, 6 19, 1 5 Lausanne 0 1, 5 1
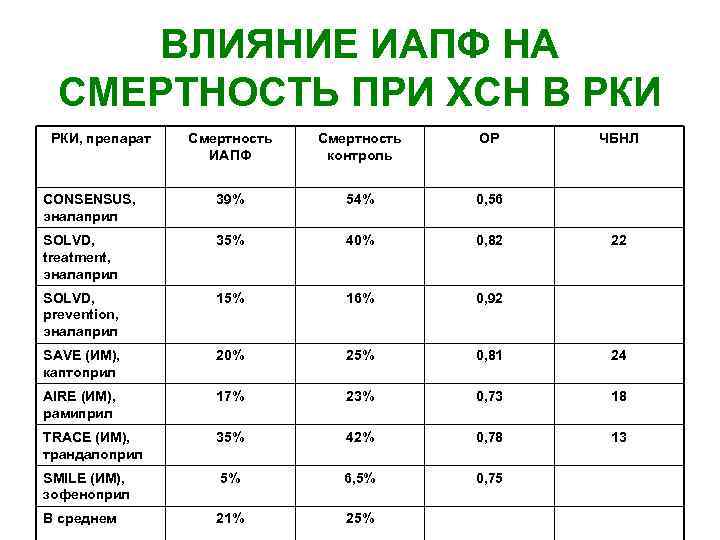 ВЛИЯНИЕ ИАПФ НА СМЕРТНОСТЬ ПРИ ХСН В РКИ, препарат Смертность ИАПФ Смертность контроль ОР ЧБНЛ CONSENSUS, эналаприл 39% 54% 0, 56 SOLVD, treatment, эналаприл 35% 40% 0, 82 SOLVD, prevention, эналаприл 15% 16% 0, 92 SAVE (ИМ), каптоприл 20% 25% 0, 81 24 AIRE (ИМ), рамиприл 17% 23% 0, 73 18 TRACE (ИМ), трандалоприл 35% 42% 0, 78 13 SMILE (ИМ), зофеноприл 5% 6, 5% 0, 75 В среднем 21% 25% 22
ВЛИЯНИЕ ИАПФ НА СМЕРТНОСТЬ ПРИ ХСН В РКИ, препарат Смертность ИАПФ Смертность контроль ОР ЧБНЛ CONSENSUS, эналаприл 39% 54% 0, 56 SOLVD, treatment, эналаприл 35% 40% 0, 82 SOLVD, prevention, эналаприл 15% 16% 0, 92 SAVE (ИМ), каптоприл 20% 25% 0, 81 24 AIRE (ИМ), рамиприл 17% 23% 0, 73 18 TRACE (ИМ), трандалоприл 35% 42% 0, 78 13 SMILE (ИМ), зофеноприл 5% 6, 5% 0, 75 В среднем 21% 25% 22
 Систематические обзоры исследований, касающихся медицинских вмешательств, дают возможность: • Определить полезные и эффективные вмешательства • Извлекать и обобщать различные уровни доказательств • Уменьшать ошибки и отклонения при интерпретации данных • Делать предполагаемое ясным
Систематические обзоры исследований, касающихся медицинских вмешательств, дают возможность: • Определить полезные и эффективные вмешательства • Извлекать и обобщать различные уровни доказательств • Уменьшать ошибки и отклонения при интерпретации данных • Делать предполагаемое ясным
 МЕТА-АНАЛИЗ (МА) Это объединение результатов нескольких КИ, проведенных в одинаковых условиях и расчет общих (средних) показателей с целью преодоления «слабости» малых исследований ВОПРОСЫ, ПРИМЕНИМЫЕ К МЕТААНАЛИЗУ: • Все ли исследования по изучаемому вопросу выявлены? • Включает ли МА только строгие научно обоснованные КИ? • Однородны ли включенные КИ?
МЕТА-АНАЛИЗ (МА) Это объединение результатов нескольких КИ, проведенных в одинаковых условиях и расчет общих (средних) показателей с целью преодоления «слабости» малых исследований ВОПРОСЫ, ПРИМЕНИМЫЕ К МЕТААНАЛИЗУ: • Все ли исследования по изучаемому вопросу выявлены? • Включает ли МА только строгие научно обоснованные КИ? • Однородны ли включенные КИ?
 ИССЛЕДОВАНИЯ И ПУБЛИКАЦИИ, КОТОРЫЕ НЕ МОГУТ БЫТЬ ВКЛЮЧЕНЫ В МЕТА- • • • АНАЛИЗ Не отвечающие критериям включения Если отсутствуют данные об изучаемых исходах у всех больных Если оцениваемое вмешательство не было определено заранее Если приведены несопоставимые виды вмешательств Исследования и публикации с нечетко сформулированными определениями терминов
ИССЛЕДОВАНИЯ И ПУБЛИКАЦИИ, КОТОРЫЕ НЕ МОГУТ БЫТЬ ВКЛЮЧЕНЫ В МЕТА- • • • АНАЛИЗ Не отвечающие критериям включения Если отсутствуют данные об изучаемых исходах у всех больных Если оцениваемое вмешательство не было определено заранее Если приведены несопоставимые виды вмешательств Исследования и публикации с нечетко сформулированными определениями терминов
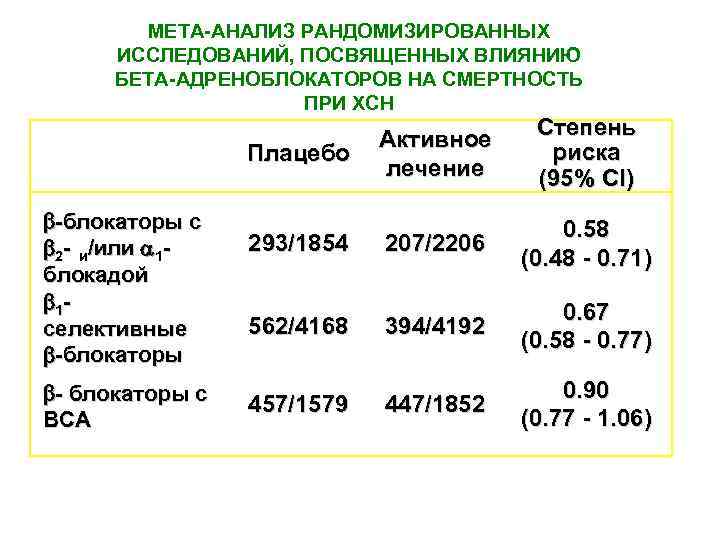 МЕТА-АНАЛИЗ РАНДОМИЗИРОВАННЫХ ИССЛЕДОВАНИЙ, ПОСВЯЩЕННЫХ ВЛИЯНИЮ БЕТА-АДРЕНОБЛОКАТОРОВ НА СМЕРТНОСТЬ ПРИ ХСН Плацебо -блокаторы с 2 - и/или 1 - блокадой 1 селективные -блокаторы - блокаторы с ВСА Активное лечение Степень риска (95% CI) 293/1854 207/2206 0. 58 (0. 48 - 0. 71) 394/4192 0. 67 (0. 58 - 0. 77) 447/1852 0. 90 (0. 77 - 1. 06) 562/4168 457/1579
МЕТА-АНАЛИЗ РАНДОМИЗИРОВАННЫХ ИССЛЕДОВАНИЙ, ПОСВЯЩЕННЫХ ВЛИЯНИЮ БЕТА-АДРЕНОБЛОКАТОРОВ НА СМЕРТНОСТЬ ПРИ ХСН Плацебо -блокаторы с 2 - и/или 1 - блокадой 1 селективные -блокаторы - блокаторы с ВСА Активное лечение Степень риска (95% CI) 293/1854 207/2206 0. 58 (0. 48 - 0. 71) 394/4192 0. 67 (0. 58 - 0. 77) 447/1852 0. 90 (0. 77 - 1. 06) 562/4168 457/1579
 КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ КР – систематически разработанные утверждения, помогающие врачу принимать правильные решения в определенных клинических ситуациях ЦЕЛИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Сделать доказательные стандарты ясными и доступными • Упростить и сделать объективнее процессы принятия клинических решений • Быть критерием оценки профессиональной деятельности • Обеспечить разделение обязанностей (лечащий врач/консультант) • Обучить пациентов и врачей лучшим способам медицинской помощи • Повысить экономическую эффективность медицинских услуг • Служить инструментом внешнего контроля ВОЗМОЖНЫЕ НЕДОСТАТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Могут основываться на «мнении экспертов» , отражающем не обоснованную доказательную практику • Иногда препятствуют инновациям, могут не учитывать местные особенности • Могут вызвать нежелательный дисбаланс сил между различными профессиональными группами (врачи – ученые)
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ КР – систематически разработанные утверждения, помогающие врачу принимать правильные решения в определенных клинических ситуациях ЦЕЛИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Сделать доказательные стандарты ясными и доступными • Упростить и сделать объективнее процессы принятия клинических решений • Быть критерием оценки профессиональной деятельности • Обеспечить разделение обязанностей (лечащий врач/консультант) • Обучить пациентов и врачей лучшим способам медицинской помощи • Повысить экономическую эффективность медицинских услуг • Служить инструментом внешнего контроля ВОЗМОЖНЫЕ НЕДОСТАТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Могут основываться на «мнении экспертов» , отражающем не обоснованную доказательную практику • Иногда препятствуют инновациям, могут не учитывать местные особенности • Могут вызвать нежелательный дисбаланс сил между различными профессиональными группами (врачи – ученые)
 КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ (продолжение) УРОВНИ НАДЕЖНОСТИ СВЕДЕНИЙ, ПРЕДОСТАВЛЯЕМЫХ В КР • Мета-анализ многих хорошо организованных КИ • По крайней мере одно хорошо организованное экспериментальное КИ • Хорошо организованные нерандомизированные контролируемые испытания, когортные исследования, исследования серий случаев • Описание клинических случаев
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ (продолжение) УРОВНИ НАДЕЖНОСТИ СВЕДЕНИЙ, ПРЕДОСТАВЛЯЕМЫХ В КР • Мета-анализ многих хорошо организованных КИ • По крайней мере одно хорошо организованное экспериментальное КИ • Хорошо организованные нерандомизированные контролируемые испытания, когортные исследования, исследования серий случаев • Описание клинических случаев
 НАИБОЛЕЕ ЧАСТЫЕ ПРИЧИНЫ НИЗКОГО КАЧЕСТВА КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Отсутствие связи между КР и научными доказательствами • Отражение мнения заинтересованных экспертов в ущерб научным фактам • Отсутствие информации о процессе разработки, заказчиках, способах внедрения в практику • Отсутствие реальной практической помощи
НАИБОЛЕЕ ЧАСТЫЕ ПРИЧИНЫ НИЗКОГО КАЧЕСТВА КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Отсутствие связи между КР и научными доказательствами • Отражение мнения заинтересованных экспертов в ущерб научным фактам • Отсутствие информации о процессе разработки, заказчиках, способах внедрения в практику • Отсутствие реальной практической помощи
 ПРИНЦИПЫ ОЦЕНКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Четко ли сформулированы критерии отбора исследований, на основании которых разработаны КР и где результаты этих исследований опубликованы? • Являются ли используемые данные современными? • Какой уровень доказанности имеют использованные исследования? • Являются ли разработчики КР ведущими специалистами и экспертами в соответствующей области?
ПРИНЦИПЫ ОЦЕНКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ • Четко ли сформулированы критерии отбора исследований, на основании которых разработаны КР и где результаты этих исследований опубликованы? • Являются ли используемые данные современными? • Какой уровень доказанности имеют использованные исследования? • Являются ли разработчики КР ведущими специалистами и экспертами в соответствующей области?
 ПРИНЦИПЫ ОЦЕНКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ (продолжение) • Четко ли определены результаты внедрения? • Существуют ли другие КР по данной проблеме, чем они отличаются и как трактуются противоречия? • Соответствуют ли КР принятым стратегиям и техническим возможностям оказания медицинской помощи? • Соответствуют ли КР международным стандартам?
ПРИНЦИПЫ ОЦЕНКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ (продолжение) • Четко ли определены результаты внедрения? • Существуют ли другие КР по данной проблеме, чем они отличаются и как трактуются противоречия? • Соответствуют ли КР принятым стратегиям и техническим возможностям оказания медицинской помощи? • Соответствуют ли КР международным стандартам?
 ОТ ЧЕГО ЗАВИСЯТ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ? • От его плана • От выбранной цели • От критериев отбора больных и числа пациентов • От методов диагностики • От характера конечных точек • От длительности проведения • От схемы лечения • От наличия статистически значимого эффекта
ОТ ЧЕГО ЗАВИСЯТ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ? • От его плана • От выбранной цели • От критериев отбора больных и числа пациентов • От методов диагностики • От характера конечных точек • От длительности проведения • От схемы лечения • От наличия статистически значимого эффекта
 СИСТЕМАТИЧЕСКИЕ ОШИБКИ Систематическая ошибка (смещение результатов) – систематическое (неслучайное) отклонение результатов от истинных значений Виды систематических ошибок: 1. 2. 3. 4. 5. СО, обусловленная отбором – сравниваемые группы пациентов различаются по факторам, влияющим на исход СО, обусловленная использованием в сравниваемых группах разных методов измерения СО, обусловленная вмешивающимся фактором СО, обусловленная неправильно проведенным статистическим анализом СО, обусловленная эффектом плацебо
СИСТЕМАТИЧЕСКИЕ ОШИБКИ Систематическая ошибка (смещение результатов) – систематическое (неслучайное) отклонение результатов от истинных значений Виды систематических ошибок: 1. 2. 3. 4. 5. СО, обусловленная отбором – сравниваемые группы пациентов различаются по факторам, влияющим на исход СО, обусловленная использованием в сравниваемых группах разных методов измерения СО, обусловленная вмешивающимся фактором СО, обусловленная неправильно проведенным статистическим анализом СО, обусловленная эффектом плацебо
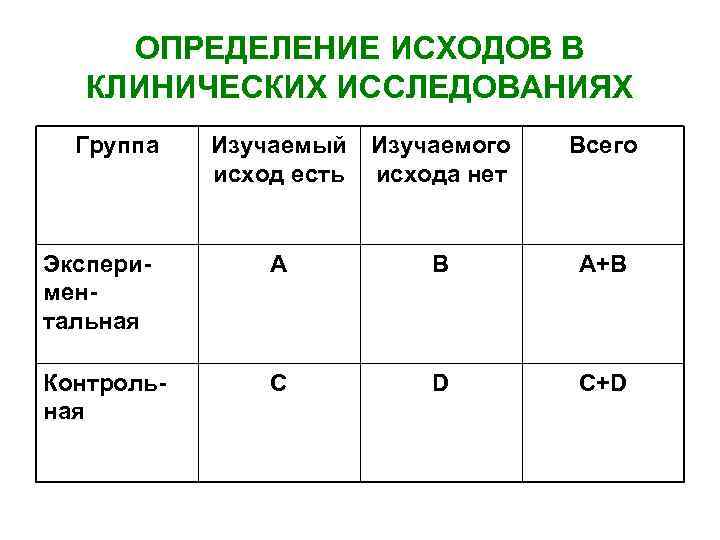 ОПРЕДЕЛЕНИЕ ИСХОДОВ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ Группа Изучаемый Изучаемого исход есть исхода нет Всего Экспериментальная А В А+В Контрольная C D C+D
ОПРЕДЕЛЕНИЕ ИСХОДОВ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ Группа Изучаемый Изучаемого исход есть исхода нет Всего Экспериментальная А В А+В Контрольная C D C+D
 • • • ОПРЕДЕЛЕНИЕ ИСХОДОВ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ (продолжение) ЧИЛ – частота исходов в экспериментальной группе: А/(A+B) ЧИК – частота исходов в контрольной группе: C/(C+D) ОР (относительный риск) = ЧИЛ/ЧИК Шанс = A/B C/D ОШ (отношение шансов)= (A/B)/(C/D)
• • • ОПРЕДЕЛЕНИЕ ИСХОДОВ В КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ (продолжение) ЧИЛ – частота исходов в экспериментальной группе: А/(A+B) ЧИК – частота исходов в контрольной группе: C/(C+D) ОР (относительный риск) = ЧИЛ/ЧИК Шанс = A/B C/D ОШ (отношение шансов)= (A/B)/(C/D)
 ТИПИЧНЫЕ ОШИБКИ В МЕДИЦИНСКИХ ИССЛЕДОВАНИЯХ 1. Отсутствие контрольной группы или некорректное ее формирование 2. Формирование гипотезы для КИ после получения данных или изменение организации КИ в ходе обработки данных 3. Смешение понятий «частота новых случаев» ( «Incidence» ) — отношение числа лиц, у которых в течение определенного времени развилось интересующее состояние ко всем обследованным в группе, где исходно этого состояния никто не имел (определяется когортным исследованием), и «распространенность» ( «Prevalence» ) — доля лиц с изучаемым заболеванием в определенной популяции в данный момент времени (определяется одномоментным исследованием) 4. Смешение понятий «статистическая значимость» и «клиническая значимость» 5. Систематические ошибки
ТИПИЧНЫЕ ОШИБКИ В МЕДИЦИНСКИХ ИССЛЕДОВАНИЯХ 1. Отсутствие контрольной группы или некорректное ее формирование 2. Формирование гипотезы для КИ после получения данных или изменение организации КИ в ходе обработки данных 3. Смешение понятий «частота новых случаев» ( «Incidence» ) — отношение числа лиц, у которых в течение определенного времени развилось интересующее состояние ко всем обследованным в группе, где исходно этого состояния никто не имел (определяется когортным исследованием), и «распространенность» ( «Prevalence» ) — доля лиц с изучаемым заболеванием в определенной популяции в данный момент времени (определяется одномоментным исследованием) 4. Смешение понятий «статистическая значимость» и «клиническая значимость» 5. Систематические ошибки
 ПРИЧИНЫ ВЫПАДЕНИЯ БОЛЬНЫХ ИЗ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В ПРОЦЕССЕ ИХ ПРОВЕДЕНИЯ • Неправильное включение пациентов в испытание • Подозрение на побочные эффекты • Снижение мотивации у пациента • Исключение по клиническим показаниям (беременность, сопутствующие заболевания и т. д. ) • Невозможность последующего наблюдения • Смерть
ПРИЧИНЫ ВЫПАДЕНИЯ БОЛЬНЫХ ИЗ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В ПРОЦЕССЕ ИХ ПРОВЕДЕНИЯ • Неправильное включение пациентов в испытание • Подозрение на побочные эффекты • Снижение мотивации у пациента • Исключение по клиническим показаниям (беременность, сопутствующие заболевания и т. д. ) • Невозможность последующего наблюдения • Смерть
 ОСНОВНЫЕ КРИТЕРИИ, ОГРАНИЧИВАЮЩИЕ ВКЛЮЧЕНИЕ ПАЦИЕНТОВ В КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ • • Нетипичный характер заболевания Наличие других болезней Необычно плохой прогноз Высокая вероятность несоблюдения предписанного лечения • Противопоказания к одному из видов предполагаемого лечения • Отказ пациента
ОСНОВНЫЕ КРИТЕРИИ, ОГРАНИЧИВАЮЩИЕ ВКЛЮЧЕНИЕ ПАЦИЕНТОВ В КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ • • Нетипичный характер заболевания Наличие других болезней Необычно плохой прогноз Высокая вероятность несоблюдения предписанного лечения • Противопоказания к одному из видов предполагаемого лечения • Отказ пациента
 УЯЗВИМЫЕ КАТЕГОРИИ НАСЕЛЕНИЯ ДЛЯ ВКЛЮЧЕНИЯ В КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ • • Дети Беременные Люди с психическими отклонениями Экономически или образовательно несостоятельные личности • Заключенные • Военнослужащие • Медицинские работники и члены их семей
УЯЗВИМЫЕ КАТЕГОРИИ НАСЕЛЕНИЯ ДЛЯ ВКЛЮЧЕНИЯ В КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ • • Дети Беременные Люди с психическими отклонениями Экономически или образовательно несостоятельные личности • Заключенные • Военнослужащие • Медицинские работники и члены их семей
 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ С УЧАСТИЕМ НЕДЕЕСПОСОБНЫХ ВЗРОСЛЫХ, НЕ СПОСОБНЫХ ДАТЬ ЮРИДИЧЕСКИ ЗНАЧИМОЕ ИНФОРМИРОВАННОЕ СОГЛАСИЕ Включение в КИ недееспособных взрослых разрешается только, если: а) получено информированное согласие законного представителя; согласие должно представлять предполагаемую волю испытуемого и может быть отозвано в любое время б) не используется никаких поощрений или финансовых стимулов, кроме компенсации в) клинические исследования были спланированы так, чтобы минимизировать боль, дискомфорт, страх и другой предвидимый риск в зависимости от заболевания и этапа разработки г) комитет по этике, компетентный в соответствующем заболевании и популяции, одобрил протокол д) имеются основания ожидать, что применение исследуемого медицинского препарата принесет пользу, превышающую риск, или не представляет собой никакого риска вообще
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ С УЧАСТИЕМ НЕДЕЕСПОСОБНЫХ ВЗРОСЛЫХ, НЕ СПОСОБНЫХ ДАТЬ ЮРИДИЧЕСКИ ЗНАЧИМОЕ ИНФОРМИРОВАННОЕ СОГЛАСИЕ Включение в КИ недееспособных взрослых разрешается только, если: а) получено информированное согласие законного представителя; согласие должно представлять предполагаемую волю испытуемого и может быть отозвано в любое время б) не используется никаких поощрений или финансовых стимулов, кроме компенсации в) клинические исследования были спланированы так, чтобы минимизировать боль, дискомфорт, страх и другой предвидимый риск в зависимости от заболевания и этапа разработки г) комитет по этике, компетентный в соответствующем заболевании и популяции, одобрил протокол д) имеются основания ожидать, что применение исследуемого медицинского препарата принесет пользу, превышающую риск, или не представляет собой никакого риска вообще
 ПОЖИЛЫЕ ЛЮДИ С КОГНИТИВНЫМИ НАРУШЕНИЯМИ МОГУТ ПРИВЛЕКАТЬСЯ К ИССЛЕДОВАНИЯМ В СЛЕДУЮЩИХ СЛУЧАЯХ: • Когда другие группы людей не подходят для исследования • Если исследование имеет отношение к проблеме, характерной только для больных с подобными нарушениями • Если исследование влечет за собой лишь минимальный риск
ПОЖИЛЫЕ ЛЮДИ С КОГНИТИВНЫМИ НАРУШЕНИЯМИ МОГУТ ПРИВЛЕКАТЬСЯ К ИССЛЕДОВАНИЯМ В СЛЕДУЮЩИХ СЛУЧАЯХ: • Когда другие группы людей не подходят для исследования • Если исследование имеет отношение к проблеме, характерной только для больных с подобными нарушениями • Если исследование влечет за собой лишь минимальный риск
 ВОПРОСЫ, НА КОТРЫЕ ДОЛЖНЫ ОТВЕТИТЬ ИССЛЕДОВАТЕЛИ И ЭК ПЕРЕД ПРОВЕДЕНИЕМ ИССЛЕДОВАНИЙ НА ДЕТЯХ • Обосновано ли клиническое исследование, важны ли предполагаемые результаты и будут ли получены ответы на поставленные вопросы? • Не являются ли достаточными результаты, полученные на взрослых пациентах? • Допустимы ли риск и нагрузки, которым будут подвергнуты участники КИ? • Не нарушаются ли права субъектов исследования при получении согласия?
ВОПРОСЫ, НА КОТРЫЕ ДОЛЖНЫ ОТВЕТИТЬ ИССЛЕДОВАТЕЛИ И ЭК ПЕРЕД ПРОВЕДЕНИЕМ ИССЛЕДОВАНИЙ НА ДЕТЯХ • Обосновано ли клиническое исследование, важны ли предполагаемые результаты и будут ли получены ответы на поставленные вопросы? • Не являются ли достаточными результаты, полученные на взрослых пациентах? • Допустимы ли риск и нагрузки, которым будут подвергнуты участники КИ? • Не нарушаются ли права субъектов исследования при получении согласия?
 КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ С УЧАСТИЕМ ДЕТЕЙ Клинические исследование на несовершеннолетних могут быть проведены только в том случае, если: а) получено добровольное информированное согласие родителей или законных представителей, которое должно содержать предполагаемую волю несовершеннолетнего и может быть отозвано без ущерба для несовершеннолетнего б) исследование базируется на результатах исследований на лабораторных животных и взрослых пациентов таким образом, что ожидаемые результаты лишь подтвердят его обоснованность в) несовершеннолетний получил информацию, соответствующую его способности понять ее, об эксперименте, рисках и пользе от персонала, имеющего опыт общения с несовершеннолетними г) явное желание несовершеннолетнего, способного формировать свое мнение, отказаться от участия или выйти из клинического исследование в любое время учитывается исследователем д) не используются никакие стимулы или финансовые побуждения, кроме компенсации з) клинические исследования были запланированы с учетом минимизации боли, дискомфорта, страха или другого предсказуемого риска, связанного с болезнью и) комитет по этике, компетентный в области педиатрии, одобрил данный протокол
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ С УЧАСТИЕМ ДЕТЕЙ Клинические исследование на несовершеннолетних могут быть проведены только в том случае, если: а) получено добровольное информированное согласие родителей или законных представителей, которое должно содержать предполагаемую волю несовершеннолетнего и может быть отозвано без ущерба для несовершеннолетнего б) исследование базируется на результатах исследований на лабораторных животных и взрослых пациентов таким образом, что ожидаемые результаты лишь подтвердят его обоснованность в) несовершеннолетний получил информацию, соответствующую его способности понять ее, об эксперименте, рисках и пользе от персонала, имеющего опыт общения с несовершеннолетними г) явное желание несовершеннолетнего, способного формировать свое мнение, отказаться от участия или выйти из клинического исследование в любое время учитывается исследователем д) не используются никакие стимулы или финансовые побуждения, кроме компенсации з) клинические исследования были запланированы с учетом минимизации боли, дискомфорта, страха или другого предсказуемого риска, связанного с болезнью и) комитет по этике, компетентный в области педиатрии, одобрил данный протокол
 Исследования у детей, имеющих показания к данному препарату, являются приемлемыми, если они отвечают следующим условиям • • • Необходимые данные не могут быть получены в результате исследования на взрослых пациентах Исследования должны проводиться на пациентах, а не на добровольцах Необходимо стремиться к назначению одной дозы препарата в процессе исследования Сведены к минимуму дискомфорт для пациентов и число инвазивных процедур Исследование направлено на получение результатов по совершенствованию диагностики и лечения, или способствующих обобщению и систематизации данных о детских заболеваниях Ожидаемая польза от КИ превышает риск, который, в свою очередь, является минимальным Исследователи имеют достаточную квалификацию и опыт проведения научных исследований на детях Исследователь обладает достаточной информацией о предсказуемости любых возможных неблагоприятных последствий КИ Испытуемые и их законные представители располагают всей необходимой информацией для получения их осознанного добровольного согласия В полном объеме обеспечивается юридическая и страховая защита испытуемых
Исследования у детей, имеющих показания к данному препарату, являются приемлемыми, если они отвечают следующим условиям • • • Необходимые данные не могут быть получены в результате исследования на взрослых пациентах Исследования должны проводиться на пациентах, а не на добровольцах Необходимо стремиться к назначению одной дозы препарата в процессе исследования Сведены к минимуму дискомфорт для пациентов и число инвазивных процедур Исследование направлено на получение результатов по совершенствованию диагностики и лечения, или способствующих обобщению и систематизации данных о детских заболеваниях Ожидаемая польза от КИ превышает риск, который, в свою очередь, является минимальным Исследователи имеют достаточную квалификацию и опыт проведения научных исследований на детях Исследователь обладает достаточной информацией о предсказуемости любых возможных неблагоприятных последствий КИ Испытуемые и их законные представители располагают всей необходимой информацией для получения их осознанного добровольного согласия В полном объеме обеспечивается юридическая и страховая защита испытуемых
 МЕТОДОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ИССЛЕДОВАНИЙ, СПЕЦИФИЧЕСКИЕ ДЛЯ ДЕТСКОГО ВОЗРАСТА • Меньший размер популяции • Большая гетерогенность популяции • Трудности в определении жестких конечных точек • Отсутствие аналогов ряда детских болезней у взрослых • Иная, чем у взрослых, фармакокинетика ряда ЛС • Иное, чем у взрослых, субъективное восприятие медикаментозных и немедикаментозных воздействий
МЕТОДОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ИССЛЕДОВАНИЙ, СПЕЦИФИЧЕСКИЕ ДЛЯ ДЕТСКОГО ВОЗРАСТА • Меньший размер популяции • Большая гетерогенность популяции • Трудности в определении жестких конечных точек • Отсутствие аналогов ряда детских болезней у взрослых • Иная, чем у взрослых, фармакокинетика ряда ЛС • Иное, чем у взрослых, субъективное восприятие медикаментозных и немедикаментозных воздействий
 ИССЛЕДОВАНИЯ У БЕРЕМЕННЫХ Если исследование соответствует стандартам минимального риска, ЭК выносит решение относительно его одобрения Требуется согласие матери и отца на проведение исследования за исключением случаев, когда: • Цель исследования – помощь здоровью матери • Личность отца не установлена • Беременность является результатом изнасилования
ИССЛЕДОВАНИЯ У БЕРЕМЕННЫХ Если исследование соответствует стандартам минимального риска, ЭК выносит решение относительно его одобрения Требуется согласие матери и отца на проведение исследования за исключением случаев, когда: • Цель исследования – помощь здоровью матери • Личность отца не установлена • Беременность является результатом изнасилования
 КОМПЕНСАЦИЯ ИСПЫТУЕМЫМ И ИССЛЕДОВАТЕЛЯМ • Спонсор должен обеспечить страхование исследователя/учреждения от исков, связанных с исследованием, за исключением исков, связанных с недобросовестным врачеванием, или халатностью • Спонсор должен брать на себя расходы, связанные с лечением испытуемых, в случае, если в результате участия в исследовании нанесен ущерб их здоровью
КОМПЕНСАЦИЯ ИСПЫТУЕМЫМ И ИССЛЕДОВАТЕЛЯМ • Спонсор должен обеспечить страхование исследователя/учреждения от исков, связанных с исследованием, за исключением исков, связанных с недобросовестным врачеванием, или халатностью • Спонсор должен брать на себя расходы, связанные с лечением испытуемых, в случае, если в результате участия в исследовании нанесен ущерб их здоровью
 УРОВНИ ДОКАЗАТЕЛЬНОСТИ ДАННЫХ, НА ОСНОВАНИИ КОТОРЫХ ОПРЕДЕЛЯЕТСЯ КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ЛЕЧЕБНЫХ ВМЕШАТЕЛЬСТВ Уровень доказательности Источники доказательств A Несколько РКИ с большим количеством участников, или метаанализ РКИ B Ограниченное количество РКИ с небольшим количеством участников, нерандомизированные исследования, данные наблюдательных регистров C Мнение экспертов, ретроспективные исследования, небольшие нерандомизированные исследования
УРОВНИ ДОКАЗАТЕЛЬНОСТИ ДАННЫХ, НА ОСНОВАНИИ КОТОРЫХ ОПРЕДЕЛЯЕТСЯ КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ЛЕЧЕБНЫХ ВМЕШАТЕЛЬСТВ Уровень доказательности Источники доказательств A Несколько РКИ с большим количеством участников, или метаанализ РКИ B Ограниченное количество РКИ с небольшим количеством участников, нерандомизированные исследования, данные наблюдательных регистров C Мнение экспертов, ретроспективные исследования, небольшие нерандомизированные исследования
 ОПРЕДЕЛЕНИЕ КЛАССА РЕКОМЕНДАЦИЙ Класс I. Состояния, для которых доказано, что данный метод диагностики и лечения полезен и эффективен Класс II. Состояния, при которых доказательства эффективности и полезности данного метода диагностики и лечения противоречивы Класс III. Состояния, при которых доказано и/или имеется общее согласие необязательности или даже опасных последствий проведения данного метода диагностики и лечения
ОПРЕДЕЛЕНИЕ КЛАССА РЕКОМЕНДАЦИЙ Класс I. Состояния, для которых доказано, что данный метод диагностики и лечения полезен и эффективен Класс II. Состояния, при которых доказательства эффективности и полезности данного метода диагностики и лечения противоречивы Класс III. Состояния, при которых доказано и/или имеется общее согласие необязательности или даже опасных последствий проведения данного метода диагностики и лечения
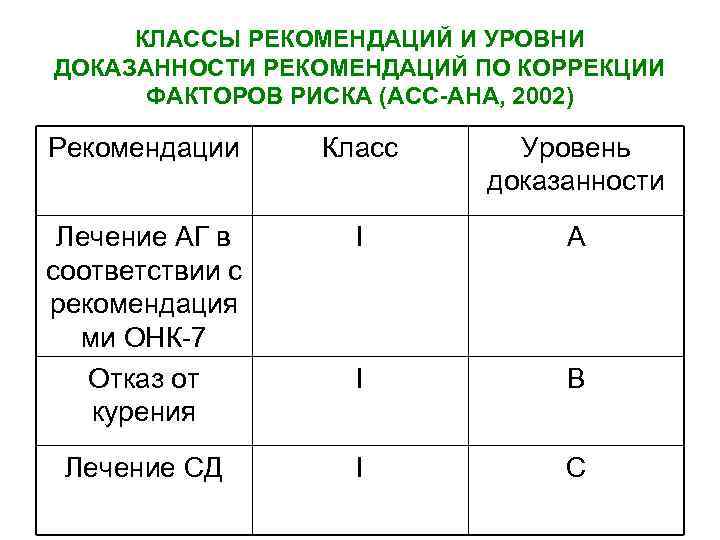 КЛАССЫ РЕКОМЕНДАЦИЙ И УРОВНИ ДОКАЗАННОСТИ РЕКОМЕНДАЦИЙ ПО КОРРЕКЦИИ ФАКТОРОВ РИСКА (АСС-АНА, 2002) Рекомендации Класс Уровень доказанности Лечение АГ в соответствии с рекомендация ми ОНК-7 Отказ от курения I A I B Лечение СД I C
КЛАССЫ РЕКОМЕНДАЦИЙ И УРОВНИ ДОКАЗАННОСТИ РЕКОМЕНДАЦИЙ ПО КОРРЕКЦИИ ФАКТОРОВ РИСКА (АСС-АНА, 2002) Рекомендации Класс Уровень доказанности Лечение АГ в соответствии с рекомендация ми ОНК-7 Отказ от курения I A I B Лечение СД I C
 Иерархия клинических доказательств Систематические обзоры - A Meтаанализы - A Двойные слепые контролируемые испытания - A Когортные исследования - B Исследования «случай-контроль» -C Описания случаев и серий случаев - C Физиологические исследования Интуиция или убеждение
Иерархия клинических доказательств Систематические обзоры - A Meтаанализы - A Двойные слепые контролируемые испытания - A Когортные исследования - B Исследования «случай-контроль» -C Описания случаев и серий случаев - C Физиологические исследования Интуиция или убеждение
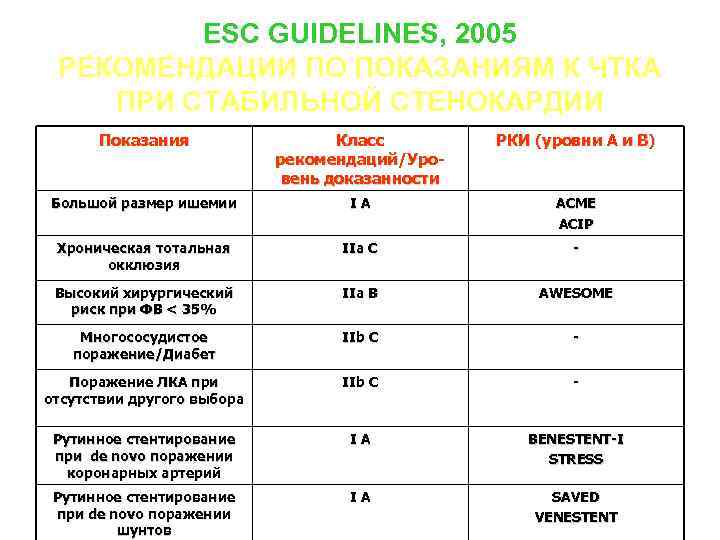 ESC GUIDELINES, 2005 РЕКОМЕНДАЦИИ ПО ПОКАЗАНИЯМ К ЧТКА ПРИ СТАБИЛЬНОЙ СТЕНОКАРДИИ Показания Класс рекомендаций/Уровень доказанности РКИ (уровни А и В) Большой размер ишемии IA ACME ACIP Хроническая тотальная окклюзия IIa C - Высокий хирургический риск при ФВ < 35% IIa B AWESOME Многососудистое поражение/Диабет IIb C - Поражение ЛКА при отсутствии другого выбора IIb C - Рутинное стентирование при de novo поражении коронарных артерий IA BENESTENT-I STRESS Рутинное стентирование при de novo поражении шунтов IA SAVED VENESTENT
ESC GUIDELINES, 2005 РЕКОМЕНДАЦИИ ПО ПОКАЗАНИЯМ К ЧТКА ПРИ СТАБИЛЬНОЙ СТЕНОКАРДИИ Показания Класс рекомендаций/Уровень доказанности РКИ (уровни А и В) Большой размер ишемии IA ACME ACIP Хроническая тотальная окклюзия IIa C - Высокий хирургический риск при ФВ < 35% IIa B AWESOME Многососудистое поражение/Диабет IIb C - Поражение ЛКА при отсутствии другого выбора IIb C - Рутинное стентирование при de novo поражении коронарных артерий IA BENESTENT-I STRESS Рутинное стентирование при de novo поражении шунтов IA SAVED VENESTENT
 Сколько в медицине доказанного? Matzen P. Ugeskr laeger 2003; 165: 1431 -5 • Медицина общей практики - 50% • Психиатрия- 65% • Другие разделы (хирургия, дерматология и т. д. ) - меньше Lai Br. J Ophthal. 2003; 4: 385 -90: • 42. 9% вмешательств основано на доказательствах РКИ, мета-анализов, систематических обзоров; 23% не основано на доказательствах вообще
Сколько в медицине доказанного? Matzen P. Ugeskr laeger 2003; 165: 1431 -5 • Медицина общей практики - 50% • Психиатрия- 65% • Другие разделы (хирургия, дерматология и т. д. ) - меньше Lai Br. J Ophthal. 2003; 4: 385 -90: • 42. 9% вмешательств основано на доказательствах РКИ, мета-анализов, систематических обзоров; 23% не основано на доказательствах вообще
 ЗНАЧЕНИЕ ЭПИДЕМИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ • Выявление распространенности факторов риска, заболеваний, особенностей их клинического течения и осложнений • Оценка прогноза (стратификация риска) • Мониторирование факторов риска и оценка эффективности профилактических мероприятий
ЗНАЧЕНИЕ ЭПИДЕМИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ • Выявление распространенности факторов риска, заболеваний, особенностей их клинического течения и осложнений • Оценка прогноза (стратификация риска) • Мониторирование факторов риска и оценка эффективности профилактических мероприятий
 ОПРЕДЕЛЕНИЕ МЕТОДОЛОГИЧЕСКОЙ ЦЕННОСТИ ИССЛЕДОВАНИЯ 1. Является ли исследование оригинальным? Крупнее, продолжительнее и более значимо ли оно, чем предыдущие? 2. Являются ли методы этого исследования более точными? 3. Отличается ли изучаемая популяция (этнос, пол, возраст) от предыдущих? 4. Достаточно ли важен поставленный вопрос с клинической точки зрения? 5. Как осуществлялся набор участников исследования? 6. Каких пациентов включали и исключали? 7. Какие вмешательства оценивались и с чем их сравнивали? 8. Какие измерялись исходы и каким образом? 9. Было ли исследование адекватно контролируемым?
ОПРЕДЕЛЕНИЕ МЕТОДОЛОГИЧЕСКОЙ ЦЕННОСТИ ИССЛЕДОВАНИЯ 1. Является ли исследование оригинальным? Крупнее, продолжительнее и более значимо ли оно, чем предыдущие? 2. Являются ли методы этого исследования более точными? 3. Отличается ли изучаемая популяция (этнос, пол, возраст) от предыдущих? 4. Достаточно ли важен поставленный вопрос с клинической точки зрения? 5. Как осуществлялся набор участников исследования? 6. Каких пациентов включали и исключали? 7. Какие вмешательства оценивались и с чем их сравнивали? 8. Какие измерялись исходы и каким образом? 9. Было ли исследование адекватно контролируемым?
 КОНЕЧНЫЕ ТОЧКИ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ КОНЕЧНАЯ ТОЧКА – основной конечный показатель, по которому оценивается эффективность ЛС А. ОСНОВНЫЕ (ПЕРВИЧНЫЕ; ЖЕСТКИЕ) КОНЕЧНЫЕ ТОЧКИ: • Клинические исходы заболевания (смертность, серьезные осложнения) • Некоторые показатели экономического характера • Б. СУРРОГАТНЫЕ (ПРОМЕЖУТОЧНЫЕ, МЯГКИЕ, ВТОРИЧНЫЕ) КОНЕЧНЫЕ ТОЧКИ - любые данные, использующиеся в качестве основы для клинического выражения конечной точки и определяющиеся через самочувствие больного, функциональную активность и выживаемость. Это легко измеряемый параметр, предсказывающий отдаленный исход воздействия, но не являющийся сам по себе прямым показателем клинической пользы или вреда
КОНЕЧНЫЕ ТОЧКИ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ КОНЕЧНАЯ ТОЧКА – основной конечный показатель, по которому оценивается эффективность ЛС А. ОСНОВНЫЕ (ПЕРВИЧНЫЕ; ЖЕСТКИЕ) КОНЕЧНЫЕ ТОЧКИ: • Клинические исходы заболевания (смертность, серьезные осложнения) • Некоторые показатели экономического характера • Б. СУРРОГАТНЫЕ (ПРОМЕЖУТОЧНЫЕ, МЯГКИЕ, ВТОРИЧНЫЕ) КОНЕЧНЫЕ ТОЧКИ - любые данные, использующиеся в качестве основы для клинического выражения конечной точки и определяющиеся через самочувствие больного, функциональную активность и выживаемость. Это легко измеряемый параметр, предсказывающий отдаленный исход воздействия, но не являющийся сам по себе прямым показателем клинической пользы или вреда
 Некоторые конечные точки в течение болезни • Выздоровление • Смерть • Ответ на лечение (процент больных, продемонстрировавших доказанное улучшение в процессе лечения) • Ремиссия (процент больных, достигших состояния, в при котором болезнь длительно не проявляется) • Рецидив (процент больных, у которых заболевание возобновилось после «светлого» промежутка)
Некоторые конечные точки в течение болезни • Выздоровление • Смерть • Ответ на лечение (процент больных, продемонстрировавших доказанное улучшение в процессе лечения) • Ремиссия (процент больных, достигших состояния, в при котором болезнь длительно не проявляется) • Рецидив (процент больных, у которых заболевание возобновилось после «светлого» промежутка)
 ИДЕАЛЬНЫЕ ХАРАКТЕРИСТИКИ СУРРОГАТНОЙ КОНЕЧНОЙ ТОЧКИ • Надежность, воспроизводимость, доступность, легкое количественное измерение • Прямое отношение к патофизиологии заболевания • Положительный результат (чувствительность) суррогатной точки должен выявлять большинство пациентов с повышенным риском возникновения определенного исхода • Отрицательный результат (специфичность) суррогатной точки должен исключать большинство пациентов без повышенного риска возникновения данного исхода • Изменения суррогатной точки должны быстро и точно отражать эффективность лечения и иметь параллелизм с первичной конечной точкой
ИДЕАЛЬНЫЕ ХАРАКТЕРИСТИКИ СУРРОГАТНОЙ КОНЕЧНОЙ ТОЧКИ • Надежность, воспроизводимость, доступность, легкое количественное измерение • Прямое отношение к патофизиологии заболевания • Положительный результат (чувствительность) суррогатной точки должен выявлять большинство пациентов с повышенным риском возникновения определенного исхода • Отрицательный результат (специфичность) суррогатной точки должен исключать большинство пациентов без повышенного риска возникновения данного исхода • Изменения суррогатной точки должны быстро и точно отражать эффективность лечения и иметь параллелизм с первичной конечной точкой
 КОНЕЧНЫЕ ТОЧКИ В ИССЛЕДОВАНИЯХ ПО АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ 1. «Жесткие» события: ИМ, инсульт, сердечно-сосудистая смерть, общая смертность 2. «Мягкие» события: ХСН, стенокардия, ТИА, когнитивные нарушения, конечная стадия заболевания почек 3. Субклинические поражения органов: ГЛЖ, ИМТ, креатинин, протеинурия, МАУ 4. Ухудшение метаболических показателей, возникновение СД
КОНЕЧНЫЕ ТОЧКИ В ИССЛЕДОВАНИЯХ ПО АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ 1. «Жесткие» события: ИМ, инсульт, сердечно-сосудистая смерть, общая смертность 2. «Мягкие» события: ХСН, стенокардия, ТИА, когнитивные нарушения, конечная стадия заболевания почек 3. Субклинические поражения органов: ГЛЖ, ИМТ, креатинин, протеинурия, МАУ 4. Ухудшение метаболических показателей, возникновение СД
 ОСНОВНЫЕ УЧАСТНИКИ КИ Испытуемые Заказчик Врач-исследователь Монитор ОБЯЗАННОСТИ ЗАКАЗЧИКА КИ: • Предоставить план КИ в форме протокола и финансировать затраты на выполнение его требований • Иметь разрешение государственного органа на проведение КИ • Получить разрешение этического комитета • Выбрать компетентных специалистов • Назначить и обеспечить работу монитора • Информировать о нежелательных явлениях у исследуемых • Обеспечить исследователя всей необходимой информацией о препарате • Предоставить препарат для КИ
ОСНОВНЫЕ УЧАСТНИКИ КИ Испытуемые Заказчик Врач-исследователь Монитор ОБЯЗАННОСТИ ЗАКАЗЧИКА КИ: • Предоставить план КИ в форме протокола и финансировать затраты на выполнение его требований • Иметь разрешение государственного органа на проведение КИ • Получить разрешение этического комитета • Выбрать компетентных специалистов • Назначить и обеспечить работу монитора • Информировать о нежелательных явлениях у исследуемых • Обеспечить исследователя всей необходимой информацией о препарате • Предоставить препарат для КИ
 ОБЯЗАННОСТИ ВРАЧАИССЛЕДОВАТЕЛЯ • Получение письменного информированного согласия больного • Точное выполнение предусмотренных протоколом процедур; сбор и хранение необходимых данных • Информирование медицинского персонала о требованиях протокола • Информирование заказчика и локального этического комитета о неблагоприятных явлениях • Предоставление монитору документации согласно требованиям протокола • Хранение и учет исследуемых препаратов
ОБЯЗАННОСТИ ВРАЧАИССЛЕДОВАТЕЛЯ • Получение письменного информированного согласия больного • Точное выполнение предусмотренных протоколом процедур; сбор и хранение необходимых данных • Информирование медицинского персонала о требованиях протокола • Информирование заказчика и локального этического комитета о неблагоприятных явлениях • Предоставление монитору документации согласно требованиям протокола • Хранение и учет исследуемых препаратов
 ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ИССЛЕДОВАТЕЛЯ • Образование, тренинг, подготовка, врачебная квалификация • GCP-тренинг • Опыт работы в исследованиях (желательно не менее двух лет) • Знакомство с исследуемым продуктом • Хранение материалов
ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ИССЛЕДОВАТЕЛЯ • Образование, тренинг, подготовка, врачебная квалификация • GCP-тренинг • Опыт работы в исследованиях (желательно не менее двух лет) • Знакомство с исследуемым продуктом • Хранение материалов
 ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (1) • • • Читать протокол Соглашаться с ним Подписать его Следовать ему Аккуратное и полное ведение первичной документации • Своевременность ввода данных • Сертификация оборудования • Доступность оборудования для проверки
ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (1) • • • Читать протокол Соглашаться с ним Подписать его Следовать ему Аккуратное и полное ведение первичной документации • Своевременность ввода данных • Сертификация оборудования • Доступность оборудования для проверки
 ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (2) • • Информирование пациентов Подписание согласия Контакты с ЛЭК Принятие решения об исключении пациента
ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (2) • • Информирование пациентов Подписание согласия Контакты с ЛЭК Принятие решения об исключении пациента
 ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (3) Обращение с исследуемым препаратом: • • • Получение Хранение Приготовление и выдача Учет Сбор неиспользованного Уничтожение СЕРЬЕЗНЫЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ • Выявление, сообщение • Документирование • Медицинские аспекты
ЗОЛОТЫЕ ПРАВИЛА ИССЛЕДОВАТЕЛЯ (3) Обращение с исследуемым препаратом: • • • Получение Хранение Приготовление и выдача Учет Сбор неиспользованного Уничтожение СЕРЬЕЗНЫЕ НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ • Выявление, сообщение • Документирование • Медицинские аспекты
 CASE REPORT FORM (CRF) ИНДИВИДУАЛЬНАЯ РЕГИСТРАЦИОННАЯ КАРТА (ИРК) • Бумажный или электронный документ для записи требуемой протоколом информации о каждом субъекте исследования • За точное, полное, достоверное и своевременное представление данных в CRF несет ответственность исследователь
CASE REPORT FORM (CRF) ИНДИВИДУАЛЬНАЯ РЕГИСТРАЦИОННАЯ КАРТА (ИРК) • Бумажный или электронный документ для записи требуемой протоколом информации о каждом субъекте исследования • За точное, полное, достоверное и своевременное представление данных в CRF несет ответственность исследователь


