3 Периодические свойства элементов. Степень окисления. Валентность.pptx
- Количество слайдов: 18
 Периодические свойства элементов. Степень окисления. Валентность
Периодические свойства элементов. Степень окисления. Валентность
 Энергетические подуровни Обозначение Максимальное подуровня количество электронов, (орбитали) 2*н, где н-нечетное число Содержание в уровнях Историческое наименование s 2 В каждом уровне sharp p 6 Со 2 -ого уровня principal 10 С 3 -его уровня (заполняется с 4 периода) номер периода - 1 diffuse 14 С 4 -ого уровня (заполняется с 6 периода) номер периода - 2 fundamental 18 С 5 -ого уровня (заполняется с 8 периода) номер периода - 3 (Алфавитный порядок) d f g
Энергетические подуровни Обозначение Максимальное подуровня количество электронов, (орбитали) 2*н, где н-нечетное число Содержание в уровнях Историческое наименование s 2 В каждом уровне sharp p 6 Со 2 -ого уровня principal 10 С 3 -его уровня (заполняется с 4 периода) номер периода - 1 diffuse 14 С 4 -ого уровня (заполняется с 6 периода) номер периода - 2 fundamental 18 С 5 -ого уровня (заполняется с 8 периода) номер периода - 3 (Алфавитный порядок) d f g
 Наиболее выгодные энергетические состояния атомов Полностью заполненная орбиталь p s Полностью пустая орбиталь p s Наполовину заполненная орбиталь p s
Наиболее выгодные энергетические состояния атомов Полностью заполненная орбиталь p s Полностью пустая орбиталь p s Наполовину заполненная орбиталь p s
 Правило октета Атомы стремятся отдавать/принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов. Атомы отдают электроны с внешнего уровня. s s Атомы принимают электроны на внешний уровень. p p s s Правило 18 электронов – применяется, когда в образовании химических связей принимают участие d-орбитали.
Правило октета Атомы стремятся отдавать/принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов. Атомы отдают электроны с внешнего уровня. s s Атомы принимают электроны на внешний уровень. p p s s Правило 18 электронов – применяется, когда в образовании химических связей принимают участие d-орбитали.
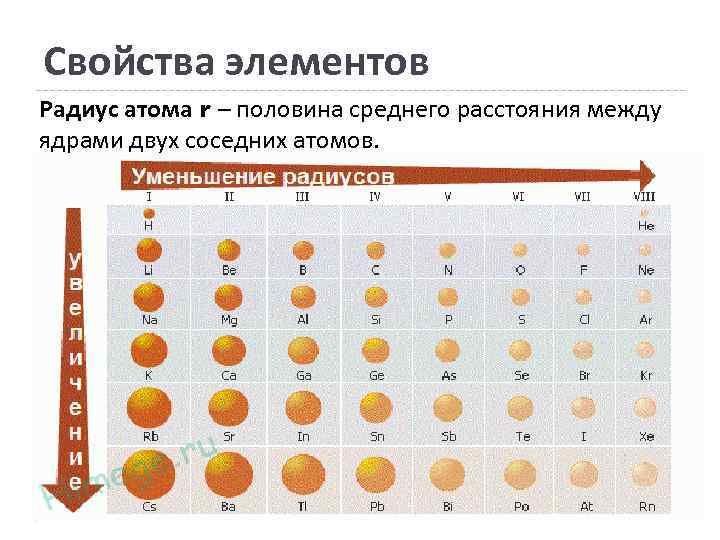 Свойства элементов Радиус атома r – половина среднего расстояния между ядрами двух соседних атомов.
Свойства элементов Радиус атома r – половина среднего расстояния между ядрами двух соседних атомов.
 Свойства элементов Металлические и восстановительные свойства характеризуются способностью атома к отдаче электронов с внешнего уровня. Неметаллические и окислительные свойства характеризуются способностью атома к принятию недостающих электронов до завершения внешнего уровня.
Свойства элементов Металлические и восстановительные свойства характеризуются способностью атома к отдаче электронов с внешнего уровня. Неметаллические и окислительные свойства характеризуются способностью атома к принятию недостающих электронов до завершения внешнего уровня.
 Металлы. Неметаллы
Металлы. Неметаллы
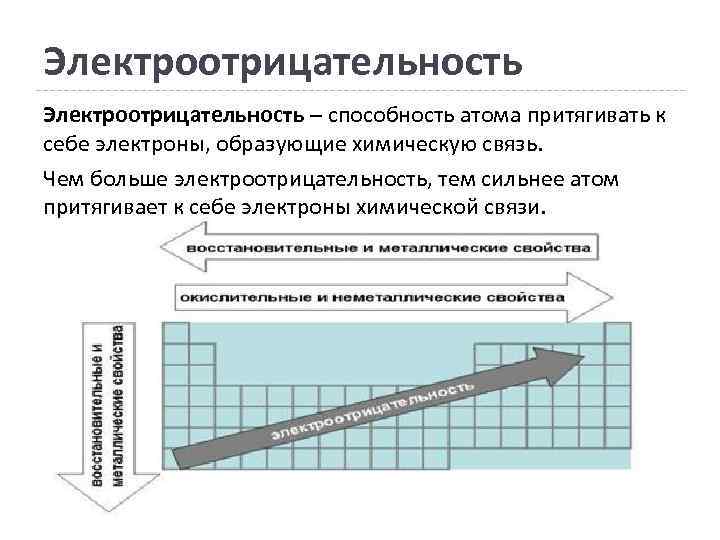 Электроотрицательность – способность атома притягивать к себе электроны, образующие химическую связь. Чем больше электроотрицательность, тем сильнее атом притягивает к себе электроны химической связи.
Электроотрицательность – способность атома притягивать к себе электроны, образующие химическую связь. Чем больше электроотрицательность, тем сильнее атом притягивает к себе электроны химической связи.
 Свойства элементов Потенциал ионизации I – показывает какую энергию нужно затратить, чтобы оторвать 1 электрон от нейтрального атома. Сродство к электрону – энергия, которая выделится, если к нейтральному атому присоединить 1 электрон. Увеличивается потенциал ионизации и сродство к электрону
Свойства элементов Потенциал ионизации I – показывает какую энергию нужно затратить, чтобы оторвать 1 электрон от нейтрального атома. Сродство к электрону – энергия, которая выделится, если к нейтральному атому присоединить 1 электрон. Увеличивается потенциал ионизации и сродство к электрону
 Свойства По периоду В группе увеличивается постоянно уменьшается увеличивается Потенциал ионизации, I увеличивается уменьшается Сродство к электрону увеличивается уменьшается Электроотрицательность увеличивается уменьшается Заряд ядра Число заполняемых энергетических уровней Число электронов на внешнем энергетическом уровне Радиус атома, r Металлические/восстановительные свойства Неметаллические/окислительные свойства
Свойства По периоду В группе увеличивается постоянно уменьшается увеличивается Потенциал ионизации, I увеличивается уменьшается Сродство к электрону увеличивается уменьшается Электроотрицательность увеличивается уменьшается Заряд ядра Число заполняемых энергетических уровней Число электронов на внешнем энергетическом уровне Радиус атома, r Металлические/восстановительные свойства Неметаллические/окислительные свойства
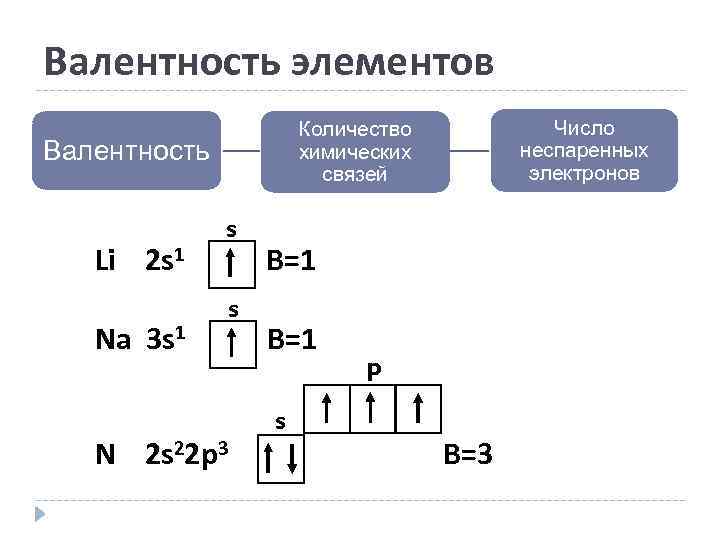 Валентность элементов Валентность Li 2 s 1 Na 3 s 1 Число неспаренных электронов Количество химических связей s s N 2 s 22 p 3 B=1 s p B=3
Валентность элементов Валентность Li 2 s 1 Na 3 s 1 Число неспаренных электронов Количество химических связей s s N 2 s 22 p 3 B=1 s p B=3
 Валентность элементов Для большинства атомов можно увеличить валентность: Стационарный атом +Е 1) Распаривание электронов внешнего уровня 2) Переход электронов на вакантные (свободные) орбитали Возбужденный атом Для распаривания электронных пар необходимо: 1) наличие свободных ячеек в соответствующем электронном слое; 2) наличие электронных пар среди возможных валентных. Некоторые элементы имеют по несколько валентностей.
Валентность элементов Для большинства атомов можно увеличить валентность: Стационарный атом +Е 1) Распаривание электронов внешнего уровня 2) Переход электронов на вакантные (свободные) орбитали Возбужденный атом Для распаривания электронных пар необходимо: 1) наличие свободных ячеек в соответствующем электронном слое; 2) наличие электронных пар среди возможных валентных. Некоторые элементы имеют по несколько валентностей.
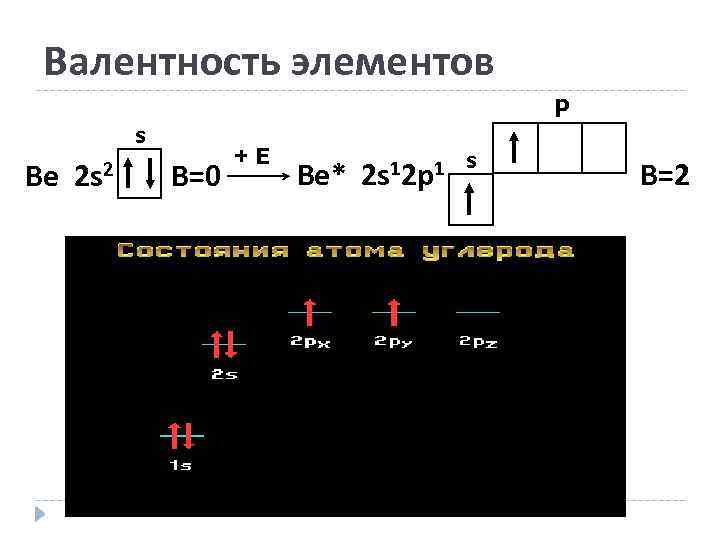 Валентность элементов p s Be 2 s 2 B=0 +E Be* 2 s 12 p 1 s B=2
Валентность элементов p s Be 2 s 2 B=0 +E Be* 2 s 12 p 1 s B=2

 Валентность элементов Для d- и f-элементов, в атомах которых во внешнем слое находятся спаренные электроны, в нормальном состоянии валентность неопределима, так как неспаренные d (или f) электроны как бы блокированы внешними d электронами. p Mn 3 d 54 s 2 B = неопределима s d p Mn* 3 d 54 s 14 p 1 B=7 s d
Валентность элементов Для d- и f-элементов, в атомах которых во внешнем слое находятся спаренные электроны, в нормальном состоянии валентность неопределима, так как неспаренные d (или f) электроны как бы блокированы внешними d электронами. p Mn 3 d 54 s 2 B = неопределима s d p Mn* 3 d 54 s 14 p 1 B=7 s d
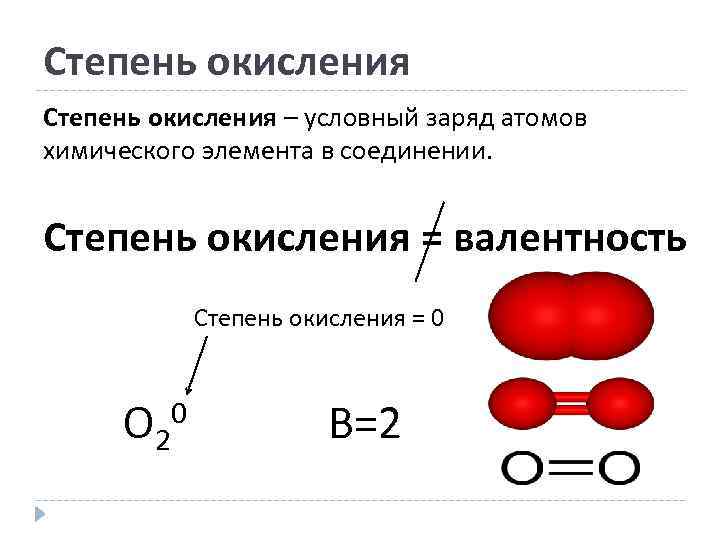 Степень окисления – условный заряд атомов химического элемента в соединении. Степень окисления = валентность Степень окисления = 0 O 2 0 B=2
Степень окисления – условный заряд атомов химического элемента в соединении. Степень окисления = валентность Степень окисления = 0 O 2 0 B=2
 Правило определения степени окисления 1) В простых веществах = 0 (H 20, C 0, O 20, Fe 0) 2) У фтора F = -1 (H+F-, Ca+2 F-2) 3) У водорода H = +1 (H+2 O-2, K+O-2 H+), исключение – в соединениях с металлами (гидриды) = -1 (Na+H-, Ca+2 H-2) 4) У кислорода O = -2 (C+2 O -2, Na+2 C+4 O -23), исключения – во фториде водорода OF 2 = +2 и перекисных соединениях = -1 (H+2 O-2, Na+2 O-2) 5) Максимальная степень окисления = номер группы, кроме элементов побочных подгрупп І и VІІІ групп (Au+3, Cu+2, Fe+6) 6) Минимальная степень окисления неметаллов = номер группы – 8 (H+2 S-2, H+Cl-) 7) Алгебраическая сумма степеней окисления всех атомов в молекуле = 0 (H+3 P+5 O-24, Ca+2 Cl-2) 8) Алгебраическая сумма степеней окисления всех атомов в ионе = заряд иона
Правило определения степени окисления 1) В простых веществах = 0 (H 20, C 0, O 20, Fe 0) 2) У фтора F = -1 (H+F-, Ca+2 F-2) 3) У водорода H = +1 (H+2 O-2, K+O-2 H+), исключение – в соединениях с металлами (гидриды) = -1 (Na+H-, Ca+2 H-2) 4) У кислорода O = -2 (C+2 O -2, Na+2 C+4 O -23), исключения – во фториде водорода OF 2 = +2 и перекисных соединениях = -1 (H+2 O-2, Na+2 O-2) 5) Максимальная степень окисления = номер группы, кроме элементов побочных подгрупп І и VІІІ групп (Au+3, Cu+2, Fe+6) 6) Минимальная степень окисления неметаллов = номер группы – 8 (H+2 S-2, H+Cl-) 7) Алгебраическая сумма степеней окисления всех атомов в молекуле = 0 (H+3 P+5 O-24, Ca+2 Cl-2) 8) Алгебраическая сумма степеней окисления всех атомов в ионе = заряд иона
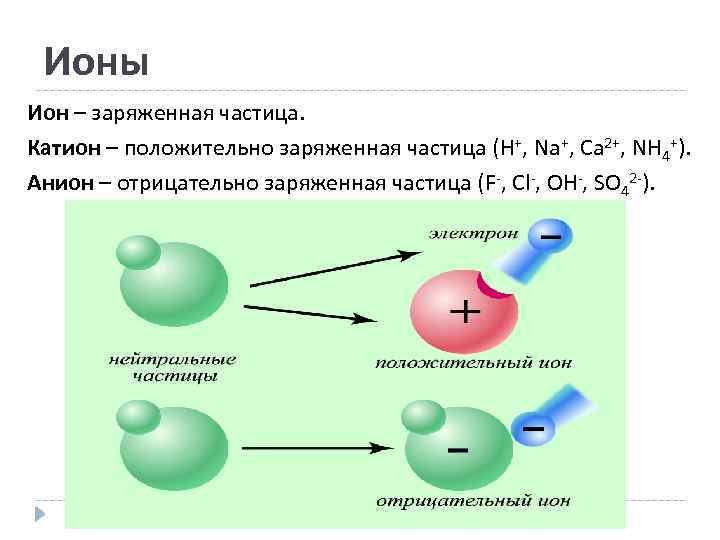 Ионы Ион – заряженная частица. Катион – положительно заряженная частица (H+, Na+, Ca 2+, NH 4+). Анион – отрицательно заряженная частица (F-, Cl-, OH-, SO 42 -).
Ионы Ион – заряженная частица. Катион – положительно заряженная частица (H+, Na+, Ca 2+, NH 4+). Анион – отрицательно заряженная частица (F-, Cl-, OH-, SO 42 -).


