2 - Переработка природного растворимого сырья.pptx
- Количество слайдов: 26

Переработка природного растворимого сырья

Процессы растворения Растворение твердых веществ в жидкости можно ориентировочно разграничить на физическое и химическое. Физическое растворение, при котором происходит лишь разрушение кристаллической решетки, обратимо, т. е. возможна обратная кристаллизация растворённого вещества. Этот тип растворения встречается в технологии минеральных удобрений и солей. На различной растворимости солей часто основано их разделение, этот прием применяется в производстве хлористого калия из сильвинита и карналлита, медного купороса. Химическое необратимое растворение сопровождается такого рода взаимодействиями растворенного вещества с растворителями или с химически активными веществами, присутствующими в растворе, при котором меняется природа растворённого вещества, и его кристаллизация в первоначальном виде невозможна. Характерным примером химического растворения является растворение металлов в кислотах при травлении поверхности металлов, при получении медного купороса из медных отходов. Наибольшее применение в технике имеет избирательное растворение твердых веществ – экстрагирование или выщелачивание.

Процессы растворения Растворение твёрдых тел в жидкостях всегда сопровождается тепловым эффектом: чаще всего поглощением тепла, реже – его выделением. Количество тепла, поглощаемого или выделяемого при растворении единицы массы вещества, называется теплотой растворения. Её величина и знак зависят от природы растворителя и растворяемой соли, температуры, при которой производится растворение, а также от начальной и конечной концентрации раствора, то есть от того, производится ли растворение в чистом растворителе или же в растворе определённой концентрации.

Процессы растворения При некоторой концентрации, называемой концентрацией насыщения, между твёрдым телом и жидкостью устанавливается равновесие. При нём химический потенциал вещества в растворе становится равным химическому потенциалу того же вещества в твёрдом состоянии. Концентрация насыщения не зависит от давления, однако в значительной степени определяется температурой, с увеличением которой растворимость возрастает, что оказывает сильное влияние на кинетику растворения. С увеличением растворимости возрастает разность концентраций – движущая сила процесса – и растворение ускоряется.

Процессы растворения Физическое растворение может протекать по диффузионному, кинетическому и смешанному механизмам. Наиболее распространённым является диффузионный механизм. При растворении на поверхности растворяющегося тела возникает диффузионный пограничный слой, в пределах которого концентрация изменяется от концентрации насыщения на поверхности тела до концентрации в основной массе раствора. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей её и тела в слое и вне его (естественная конвекция).

Процессы растворения •

Процессы растворения •

Процессы растворения Основу современной теории растворов создал Д. И. Менделеев. Он установил, что при растворении протекают одновременно два процесса: физический – равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический – взаимодействие растворителя с растворяемым веществом. Последний процесс называют сольватацией, а образующиеся соединения – сольватами. Применительно к водным растворам говорят о гидратации и гидратах. Процесс сольватации зависит от природы растворенного вещества. При растворении веществ с ионной структурой образование сольватов происходит за счет ион-дипольных взаимодействий или донорно-акцепторных (молекулы растворенного вещества акцепторы, а молекулы растворителя – доноры электронов). Последнее характерно для таких растворителей как вода, аммиак, образуемые сольваты – частный случай комплексных соединений. При растворении веществ с молекулярной структурой сольваты образуются в результате диполь-дипольного взаимодействий.

Процессы растворения При растворении хлорида натрия между ионами Na+ и Cl– и полярными молекулами воды возникает ионно-дипольная связь. Она оказывается прочнее, чем межионные связи в молекулах поваренной соли. В результате этого процесса связь между ионами, расположенными на поверхности кристаллов Na. Cl, ослабляется, ионы натрия и хлора отрываются от кристалла, а молекулы воды образуют вокруг них так называемые гидратные оболочки. Отделившиеся гидратированные ионы под влиянием теплового движения равномерно распределяются между молекулами растворителя. Взаимодействие между растворенным веществом и растворителем меняется в зависимости от количественных соотношений между ними. При повышении количества растворенного вещества усиливается интенсивность взаимодействий и усложняется структура раствора. При уменьшении доли растворенного вещества взаимодействие ослабевает, и структура раствора упрощается.

Процессы растворения Общими приемами интенсификации процессов растворения, выщелачивания, экстрагирования являются: Ø увеличение поверхности соприкосновения фаз измельчением твёрдого вещества; Ø увеличение пористости твёрдого вещества и более полное омывание поверхности кристаллов жидкостью; Ø увеличение относительной скорости перемещения твердой и жидкой фаз (перемешивание); Ø повышение температуры может служить одним из наиболее эффективных приемов ускорения процессов растворения и выщелачивания, как в кинетической, так и в диффузионной области. Для процессов растворения, идущих в диффузионной области, преимущественным приемом интенсификации может быть интенсивное перемешивание, которое ускоряет диффузию, выравнивает концентрацию

Процессы кристаллизации Для осуществления процесса кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два основных метода кристаллизации: Ø охлаждение горячих насыщенных растворов (изогидрическая или политермическая кристаллизация); Ø удаление части растворителя путем выпаривания (изотермическая кристаллизация).
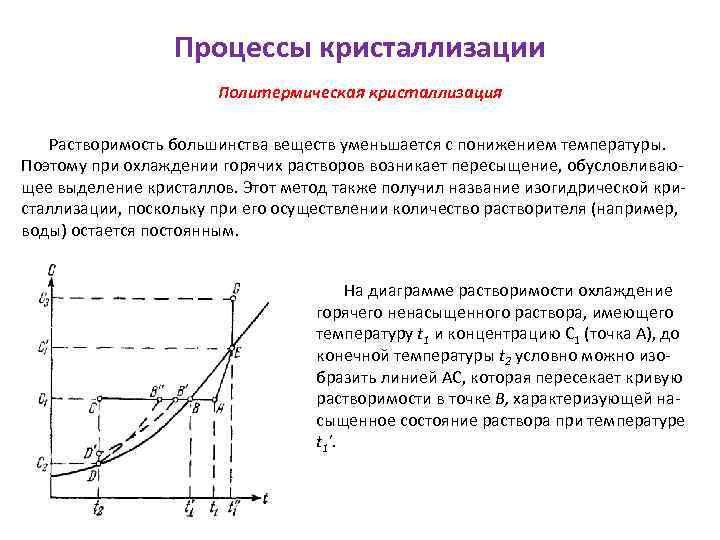
Процессы кристаллизации Политермическая кристаллизация Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Этот метод также получил название изогидрической кристаллизации, поскольку при его осуществлении количество растворителя (например, воды) остается постоянным. На диаграмме растворимости охлаждение горячего ненасыщенного раствора, имеющего температуру t 1 и концентрацию C 1 (точка А), до конечной температуры t 2 условно можно изобразить линией АС, которая пересекает кривую растворимости в точке В, характеризующей насыщенное состояние раствора при температуре t 1'.
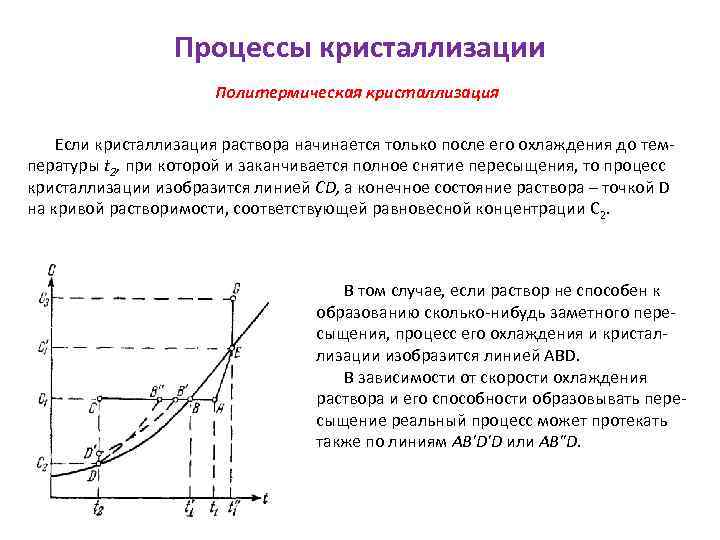
Процессы кристаллизации Политермическая кристаллизация Если кристаллизация раствора начинается только после его охлаждения до температуры t 2, при которой и заканчивается полное снятие пересыщения, то процесс кристаллизации изобразится линией CD, а конечное состояние раствора – точкой D на кривой растворимости, соответствующей равновесной концентрации C 2. В том случае, если раствор не способен к образованию сколько-нибудь заметного пересыщения, процесс его охлаждения и кристаллизации изобразится линией АВD. В зависимости от скорости охлаждения раствора и его способности образовывать пересыщение реальный процесс может протекать также по линиям AB'D'D или AB"D.

Процессы кристаллизации Изотермическая кристаллизация Перевод исходного раствора, характеризуемого точкой А, в пересыщенное состояние можно осуществить и за счет частичного удаления растворителя при выпаривании раствора. Такой метод получил название изотермической кристаллизации, так как выпаривание насыщенного раствора происходит при постоянной температуре его кипения. Изменение концентрации исходного ненасыщенного раствора при выпаривании изобразится линией AEG, которая показывает, что с повышением концентрации раствора соответственно возрастает и его температура кипения. Только после перехода раствора в насыщенное состояние при концентрации С 1' (точка Е) температура уже больше не меняется и остается равной t 1''.
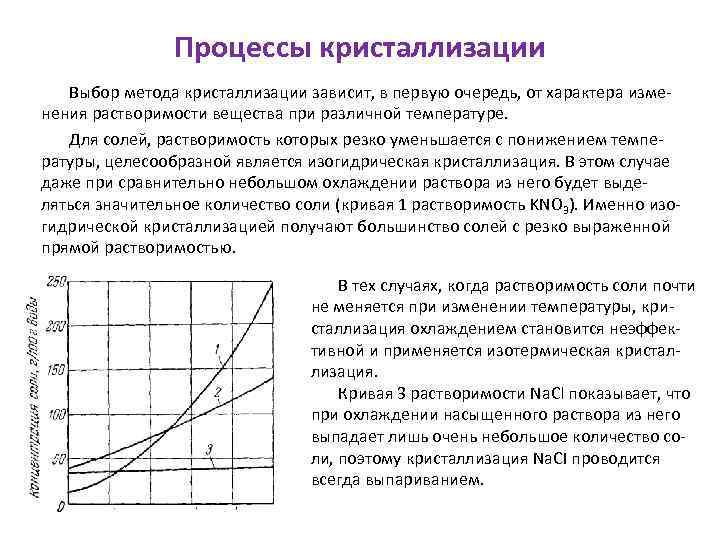
Процессы кристаллизации Выбор метода кристаллизации зависит, в первую очередь, от характера изменения растворимости вещества при различной температуре. Для солей, растворимость которых резко уменьшается с понижением температуры, целесообразной является изогидрическая кристаллизация. В этом случае даже при сравнительно небольшом охлаждении раствора из него будет выделяться значительное количество соли (кривая 1 растворимость KNO 3). Именно изогидрической кристаллизацией получают большинство солей с резко выраженной прямой растворимостью. В тех случаях, когда растворимость соли почти не меняется при изменении температуры, кристаллизация охлаждением становится неэффективной и применяется изотермическая кристаллизация. Кривая 3 растворимости Na. Cl показывает, что при охлаждении насыщенного раствора из него выпадает лишь очень небольшое количество соли, поэтому кристаллизация Na. CI проводится всегда выпариванием.

Процессы кристаллизации Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na 2 SO 4, растворимость которого, начиная с 32, 4 0 С, уменьшается с повышением температуры. Для кристаллизации солей с резко выраженной обратной растворимостью иногда используют просто нагревание раствора до высоких температур. Так, например, получают безводный кристаллический сульфит натрия Na 2 SO 3 и сульфат марганца Mn. SO 4. На практике в ряде случаев комбинируют методы создания пересыщения. Так, при вакуум-кристаллизации раствор охлаждается за счет адиабатического испарения части растворителя. Этот метод кристаллизации особенно эффективен для солей, растворимость которых сравнительно плавно уменьшается с понижением температуры.

Процессы кристаллизации Кристаллизация высаливанием При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и кристаллизацию. Подобный метод кристаллизации получил название высаливания. Вещества, добавляемые в раствор, обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами процессов высаливания являются: Ø кристаллизация железного купороса из травильных растворов при добавлении в них концентрированной серной кислоты; Ø высаливание Na. Cl из рассолов за счет введения в них хлористого магния или хлористого кальция; Ø получение безводного сульфата натрия добавлением к его растворам Na. Cl; Ø высаливание поваренной солью хлористого бария из гидросульфидных щелоков.

Процессы кристаллизации Кристаллизация высаливанием Высаливающее вещество лучше вводить в раствор в виде насыщенного раствора, так как при добавлении твердого высаливателя на нем может осаждаться кристаллизующаяся соль, что вызовет замедление или даже прекращение растворения осадителя. В некоторых случаях для выделения соли к раствору добавляют вещества, понижающие растворимость кристаллизуемой соли. Так, для высаливания сульфата натрия из водного раствора можно использовать аммиак, метиловый или этиловый спирты. Аналогично кристаллизуют железный купорос из травильных растворов при добавлении ацетона. Введение органических растворителей в водные растворы неорганических солей увеличивает эффективность процесса кристаллизации, обеспечивая высокую сте-пень извлечения соли из раствора и возможность получения продукта в чистом виде. Недостатком этого способа является сравнительно высокая стоимость органических растворителей, регенерация которых требует проведения дополнительных операций и связана с некоторой потерей реагента.

Процессы кристаллизации Кристаллизация в результате химических реакций Пересыщение можно создать за счет проведения химических реакций. Образующееся в результате вещество выделяется в виде кристаллической фазы из раствора. Такой химический метод кристаллизации используется в аналитической практике, а также в ряде технологических схем. Так, например, при очистке природных и сточных вод чаще всего проводят кристаллизацию карбонатов, сульфатов и гидроокисей металлов, обладающих незначительной растворимостью. Использование при очистке кристаллизации труднорастворимых соединений обусловлено главным образом одной причиной - полнотой осаждения. Следует, однако, отметить, что в определенных условиях остаточные пересыщения при кристаллизации труднорастворимых соединений могут быть значительными. Наблюдаемая картина связана с особой способностью таких веществ образовывать устойчивые пересыщенные растворы.

Процессы кристаллизации Кристаллизация в результате химических реакций За счет проведения химической реакции в коксохимическом производстве получают кристаллический сульфат аммония при нейтрализации растворов серной кислоты аммиаком, содержащимся в коксовом газе. В сатураторах, используемых для этой цели, протекает следующая реакция: 2 NH 3 + H 2 SО 4 (NH 4)2 SO 4 В производстве кальцинированной соды промежуточный продукт (бикарбонат натрия Na. HCO 3) также получают вследствие химической реакции, протекающей при абсорбции аммиачно-соляным раствором двуокиси углерода. Эта реакция может быть выражена суммарным уравнением: Na. Cl + NH 3 + CO 2 + H 2 O Na. HCO 3 + NH 4 Cl В образующемся растворе наименее растворимой солью является бикарбонат натрия, который выпадает в виде кристаллического осадка и служит для получения кальцинированной соды.

Процессы кристаллизации Процесс кристаллизации из растворов включает две стадии: образование кристаллических зародышей и их дальнейший рост. Первой теорией, количественно описывающей образование кристаллических зародышей, явилась теория М. Фольмера. Однако, М. Фольмер в своих работах не рассматривает механизм образования зародышей. Эта часть его теории была разработана И. Н. Странским и Р. Каишевым, предложившим молекулярно-кинетическую теорию образования кристаллических зародышей. В её основу положено представление Гиббса о скачкообразном росте кристаллов в отличие от роста изотропных капель. По мнению авторов, процесс образования центра кристаллизации проходит три ступени. Вначале будущему зародышу энергетически «выгоднее» расти как «одномерному» - в виде цепочки, затем он растёт как «двухмерный» - в виде пластины, после чего, достигнув определённой величины, становится «трёхмерным» , то есть объёмным.

Процессы кристаллизации На размеры кристаллов оказывают влияние следующие факторы: 1. пересыщение раствора – при очень малых пересыщениях кристалл растёт, главным образом, в результате присоединения отдельных ионов или молекул к местам нарушений кристаллической решётки. Однако при этом, несмотря на малое пересыщение раствора, возможен рост кристалла и через двухмерные зародыши. Пересыщение оказывает влияние и на форму образующихся кристаллов. С уменьшением степени пересыщения раствора происходит нивелировка скоростей роста отдельных граней кристалла, и он оказывается огранённым большим числом плоскостей, более равномерно развитых.

Процессы кристаллизации На размеры кристаллов оказывают влияние следующие факторы: С увеличением степени пересыщения увеличивается разница в скоростях роста отдельных граней, а также общая скорость роста кристалла за счёт увеличения толщины нарастающих слоёв и повышения частоты их появления на грани. При ещё большем пересыщении наряду с послойным и молекулярно-диффузионным ростом становится возможным так называемый «блоковый» рост кристалла в результате присоединения к нему целых групп определённым образом ориентированных ионов или молекул, размеры которых могут колебаться в широком интервале – от трёхмерных зародышей до микроскопических размеров.

Процессы кристаллизации На размеры кристаллов оказывают влияние следующие факторы: 2. перемешивание раствора – при перемешивании раствора обеспечивается равномерный приток кристаллизующегося вещества к различным граням, тем самым устраняется влияние концентрационных потоков, что способствует образованию кристаллов правильной формы. При массовой кристаллизации перемешивание раствора препятствует осаждению кристаллов на дне и стенках сосуда и предупреждает тем самым возможность друзового роста. Кроме того, с повышением интенсивности перемешивания кристаллизуемого раствора уменьшается агрегированный рост кристаллов, которые постепенно приобретают всё более правильную форму. 3. влияние температуры – повышение температуры кристаллизации резко увеличивает скорость роста кристаллов, что непосредственно вытекает из общих положений теории кристаллизации.

Процессы кристаллизации На размеры кристаллов оказывают влияние следующие факторы: 4. влияние растворимых примесей – присутствие в растворе даже ничтожно малого количества примесей может оказать существенное влияние на скорость роста отдельных граней кристалла, его форму, окраску, однородность. Некоторые примеси могут полностью приостановить рост кристалла даже при значительном пересыщении раствора. Другие, наоборот, могут вызвать укрупнение кристаллов в процессе массовой кристаллизации. Существенное влияние на форму кристаллов, выделяющихся из водных растворов, оказывают органические соединения, являющиеся поверхностно-активными веществами.

Процессы кристаллизации Конечный размер кристаллов при массовой кристаллизации зависит от соотношения скоростей образования зародышей и их последующего роста. Если скорость возникновения зародышей значительно превышает скорость их роста, то в процессе кристаллизации образуются мелкокристаллические осадки. Если же основная масса кристаллизующегося вещества отлагается на поверхности первоначально возникших зародышей, а в последующем новые центры кристаллизации не образуются или образуются в очень малом количестве, то в результате будет образовываться крупнокристаллический продукт. В производственных условиях обычно стремятся получать крупнокристаллический, по возможности однородный продукт и лишь в редких случаях – мелкие кристаллы.
2 - Переработка природного растворимого сырья.pptx