24_пептидыбелкиНК.pptx
- Количество слайдов: 63

Пептиды Белки “Натура тем паче всего удивительна, что в простоте своей многохитростна и от малого числа причин производит неисчислимые образы свойств, перемен и явлений М. В. Ломоносов 1

Биологическая роль пептидов Гормоны (окситоцин, вазопрессин) Нейропептиды (эндорфины, энкефалины) Регуляторные пептиды (рилизинг-факторы, карнозин, ансерин) Токсины (фаллоидин - яд бледной поганки, меллитин-яд пчел) Антибиотики (грамицидин, актиномицин)

Биологическая роль белков Ферменты Гормоны (инсулин, гормон роста и др. ) Структурные белки (коллаген, кератин и др. ) Защитные (цит. Р-450, иммуноглобулины) Двигательные (актин, миозин) Рецепторные (холинорецептор, родопсин) Регуляторные (гистоны, репрессоры и др. ) Транспортные (гемоглобин, альбумин и др. ) Токсины (ботулинический, дифтерийный)

Пептиды и белки – продукты поликонденации a-аминокислот Чем отличаются пептиды от белков? 1. Молекулярная масса: граница 10000 дальтон 2. Диализуемость. Дальтон-единица измерения массы атомов, молекул, а также вирусов, клеток и их структур (хромосом, рибосом, митохондрий и др. ), равная 1/12 массы атома углерода (12 С), или 1, 661 10– 24 г. Название дано в честь англ. физика и химика Дж. Дальтона (1766– 1844).
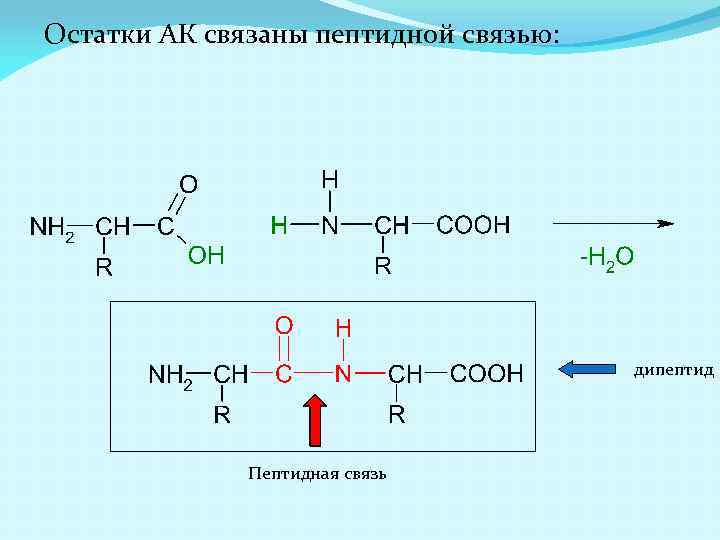
Остатки АК связаны пептидной связью: дипептид Пептидная связь
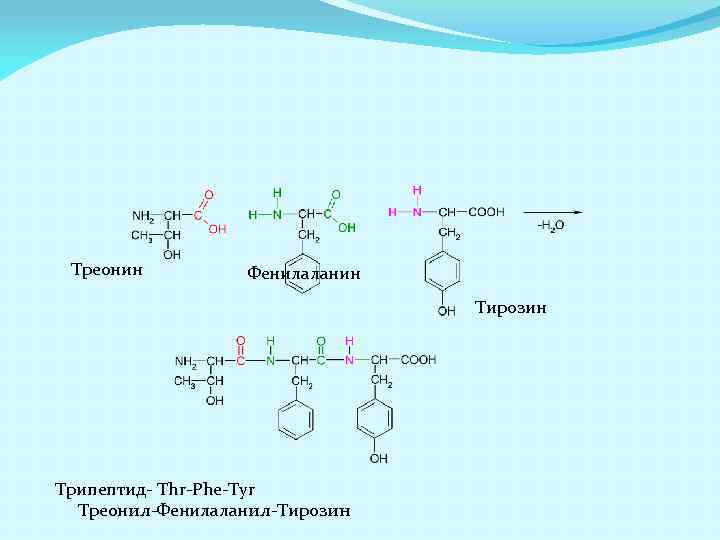
Треонин Фенилаланин Тирозин Трипептид- Thr-Phe-Tyr Треонил-Фенилаланил-Тирозин
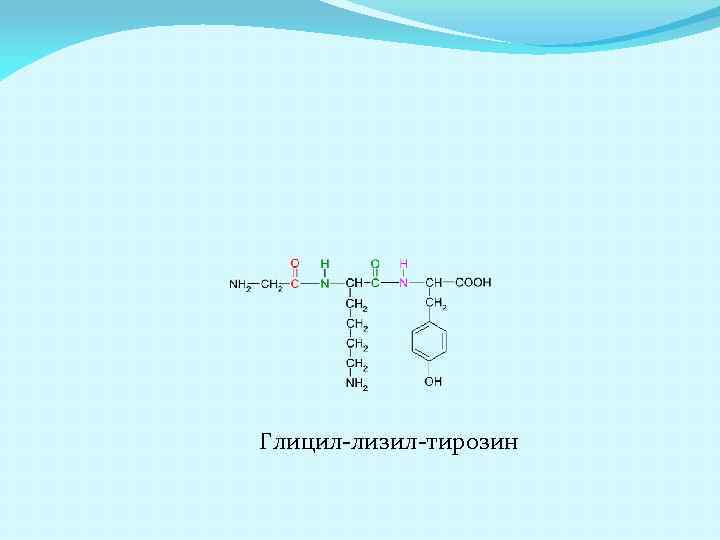
Глицил-лизил-тирозин
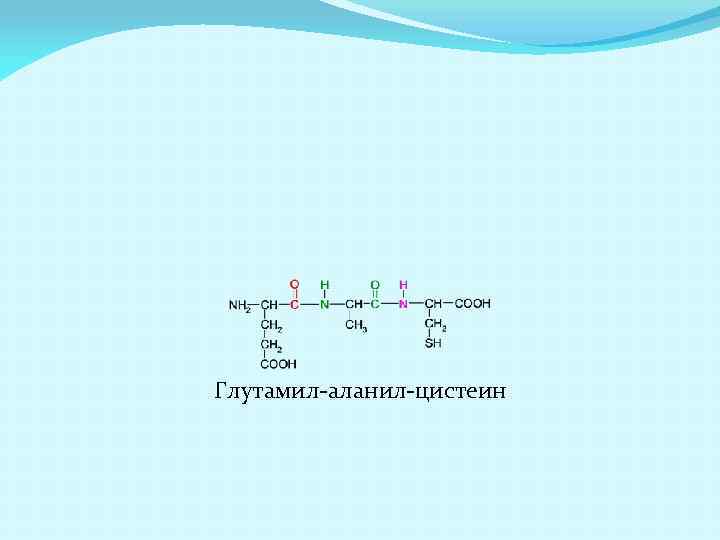
Глутамил-аланил-цистеин
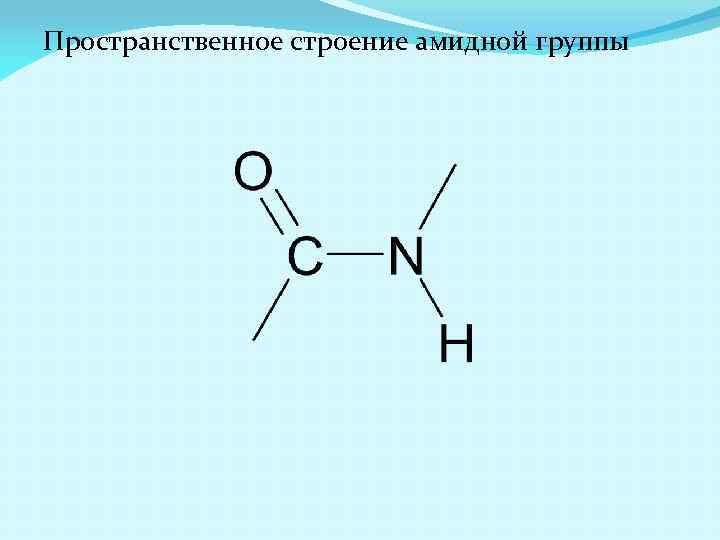
Пространственное строение амидной группы
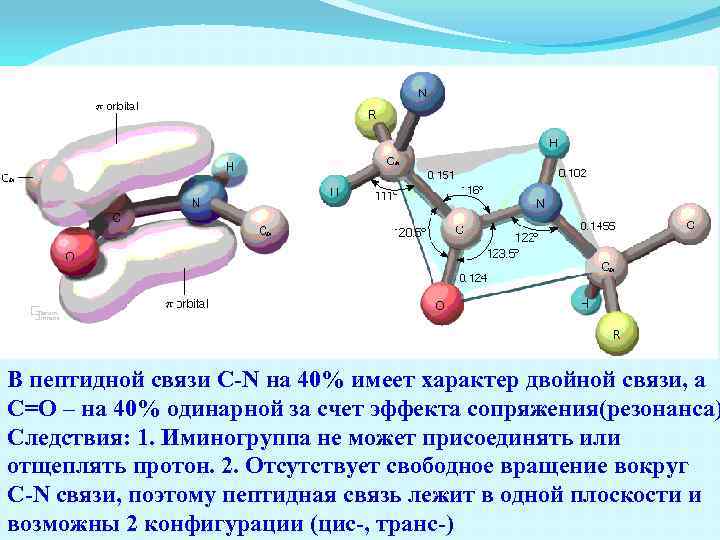
В пептидной связи C-N на 40% имеет характер двойной связи, а С=О – на 40% одинарной за счет эффекта сопряжения(резонанса) Следствия: 1. Иминогруппа не может присоединять или отщеплять протон. 2. Отсутствует свободное вращение вокруг C-N связи, поэтому пептидная связь лежит в одной плоскости и возможны 2 конфигурации (цис-, транс-)

Как и аминокислоты, пептиды и белки являются амфотерными соединениями, содержащими и кислотные группы (COOH) и оснóвные группы (NH 2). ИЭТ зависит от их количества- если больше COOH чем NH 2, то ИЭТ меньше 5 -6, если наоборот, то больше. Пептид: Тре-Фен-Тир. Содержит одну COOH и одну NH 2 ИЭТ будет равна 5 -6. Пептид: Гли-Лиз-Тир. Содержит одну COOH и две NH 2 ИЭТ будет равна 8 -11. Пептид: Глу-Ала-Цис. Содержит две COOH и одну NH 2 ИЭТ будет равна 3.

Анализ первичной структуры пептидов Метод Эдмана Используя фенилизотиоцианат (Ph-NCS) последовательно отщепляют АК с N-конца и определяют образующиеся фенилтиогидантоиновые производные. Прибор для автоматического определения первичной структуры - секвенатор
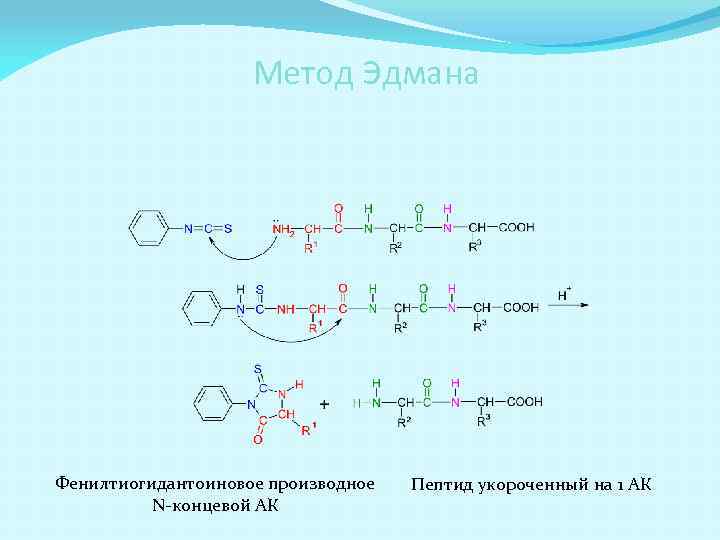
Метод Эдмана Фенилтиогидантоиновое производное N-концевой АК Пептид укороченный на 1 АК

Уровни структурной организации белка первичная структура – аминокислотная последовательность вторичная структура – локальные высокоупорядоченные конформации белковой цепи (a -спираль, b-структура) третичная структура – форма белковой молекулы; трёхмерная структура белка. четвертичная структура – агрегат из нескольких молекул белка
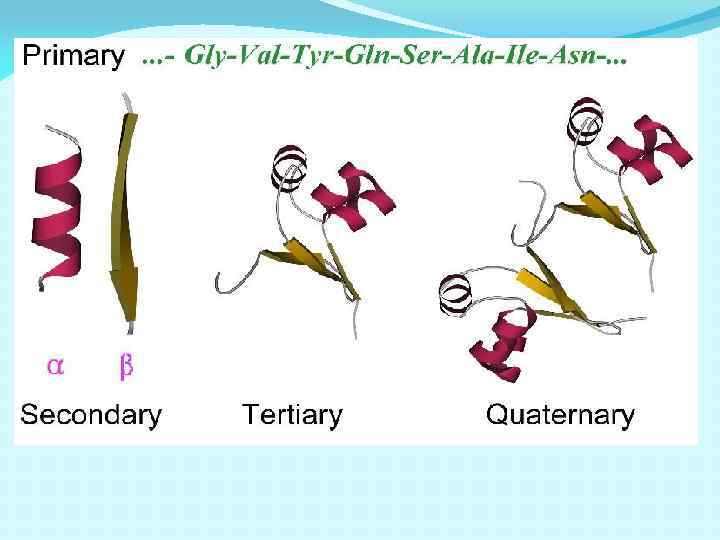
Уровни структурной организации белка

первичная структура –последовательность аминокислотных остатков в молекуле белка или пептида. NH 2 -Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH Первичная структура определяет все остальные уровни структурной организации белка Замена Глу в шестом положении b-цепи гемоглобина на Вал приводит к серповидноклеточной анемии (sickle cell anemia).
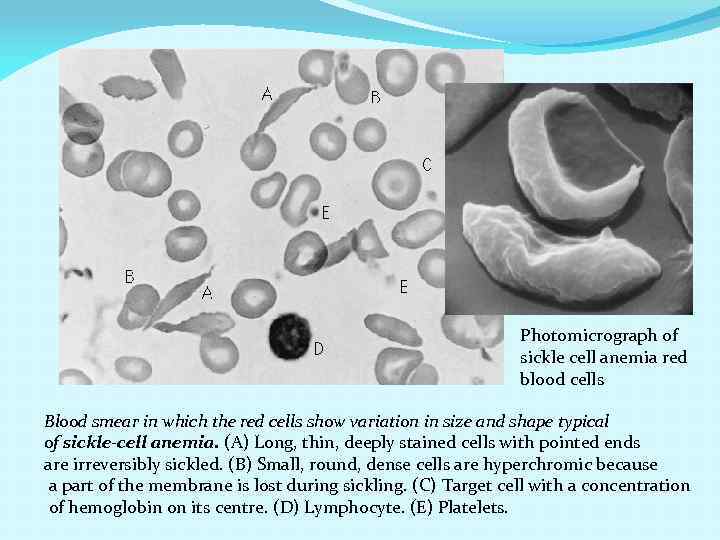
Photomicrograph of sickle cell anemia red blood cells Blood smear in which the red cells show variation in size and shape typical of sickle-cell anemia. (A) Long, thin, deeply stained cells with pointed ends are irreversibly sickled. (B) Small, round, dense cells are hyperchromic because a part of the membrane is lost during sickling. (C) Target cell with a concentration of hemoglobin on its centre. (D) Lymphocyte. (E) Platelets.

20 аминокислот могут дать примерно 1000000000000000000000000000000000000000000 0000000000000000 белков, состоящих из 150 остатков аминокислот. Это астрономическое число – число гугол умноженное на число гугол (число гугол – это 10100) 12. 02. 2018 Нижник Я. П. http: //norgchem. professorjournal. ru 18

Вторичная структура Вторичная структура- локальные высокоупорядоченные конформации белковой цепи – спирали и складчатые слои.

a-спираль a-спирали Правые в полипептидной цепи стабилизируются водородными связями, где С=О группы связаны с лежащими от них в направлении С-конца цепи H-N группами
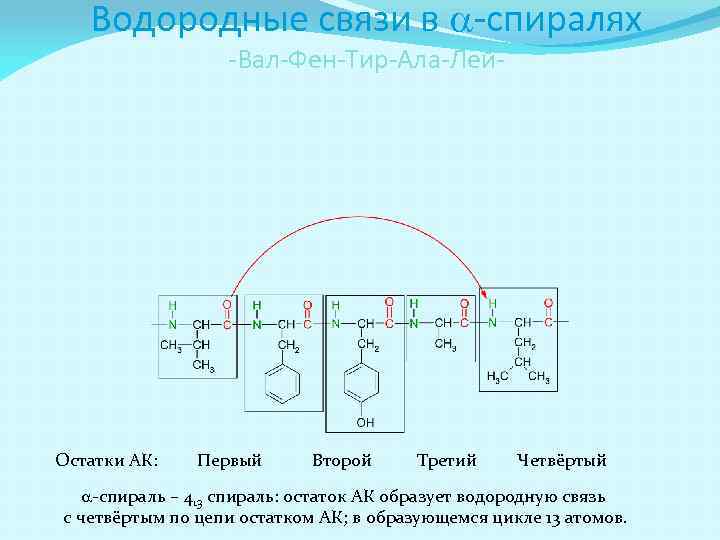
Водородные связи в a-спиралях -Вал-Фен-Тир-Ала-Лей- Остатки АК: Первый Второй Третий Четвёртый a-спираль – 413 спираль: остаток АК образует водородную связь с четвёртым по цепи остатком АК; в образующемся цикле 13 атомов.

Структура b-складчатых слоев b-структура образуется из нескольких ПП цепей связанных водородными связями.
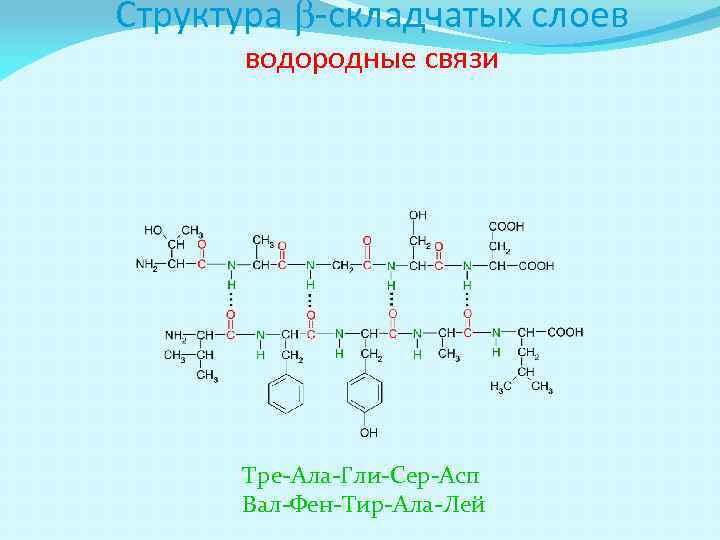
Структура b-складчатых слоев водородные связи Тре-Ала-Гли-Сер-Асп Вал-Фен-Тир-Ала-Лей

Обозначение вторичной структуры Укладка a-спиралей и b-структуры с образованием глобулы

Третичная структура третичная структура – форма белковой молекулы; трёхмерная структура белка. Укладка нерегулярных областей и a и bструктур в глобулу определяет третичную структуру белка

Взаимодействия остатков АК в третичной структуре АК в белковой глобуле взаимодействуют за счёт: Ковалентных связей (дисульфидные –S–S– связи в цистине) Ионных связей (Глу-COO- H 3 N+-Лиз) Водородных связей (Глу-COO-…HO-Тир) Гидрофобных взаимодействий (Вал, Лей, Иле, Фен)
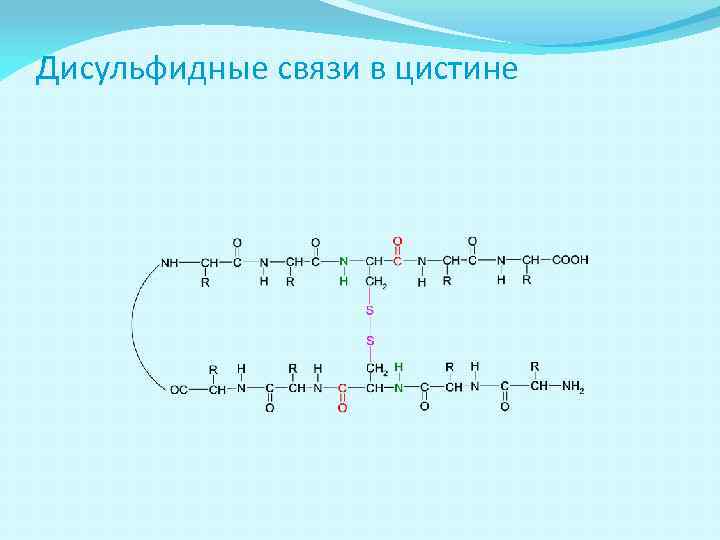
Дисульфидные связи в цистине
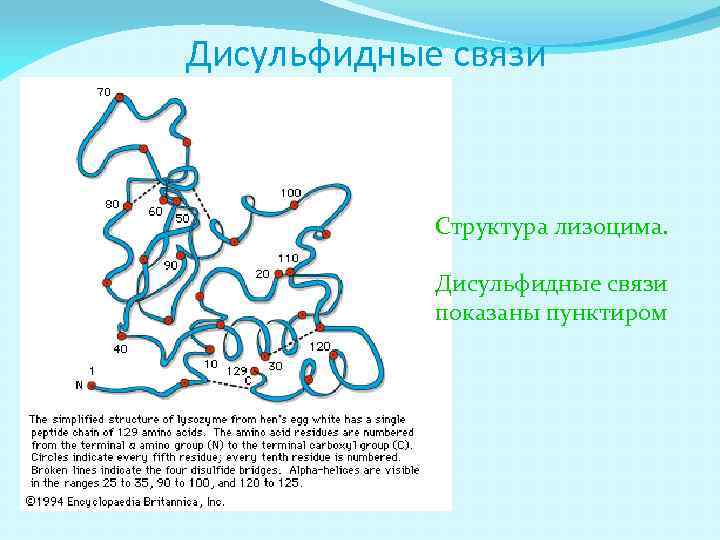
Дисульфидные связи Структура лизоцима. Дисульфидные связи показаны пунктиром
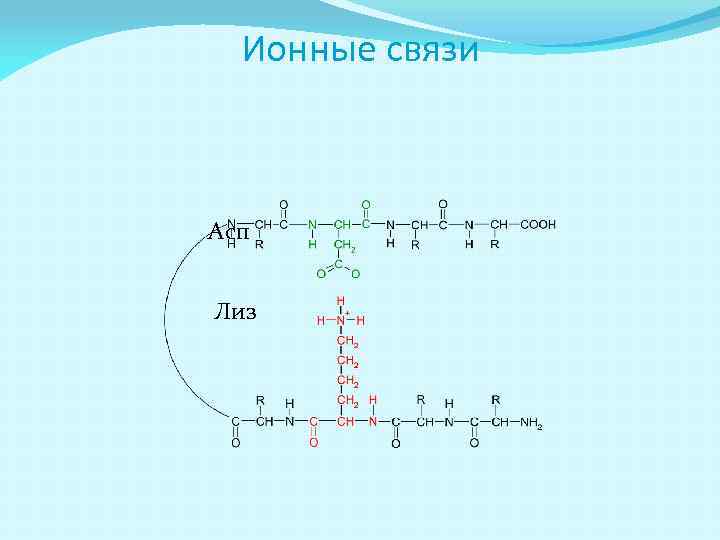
Ионные связи Асп Лиз
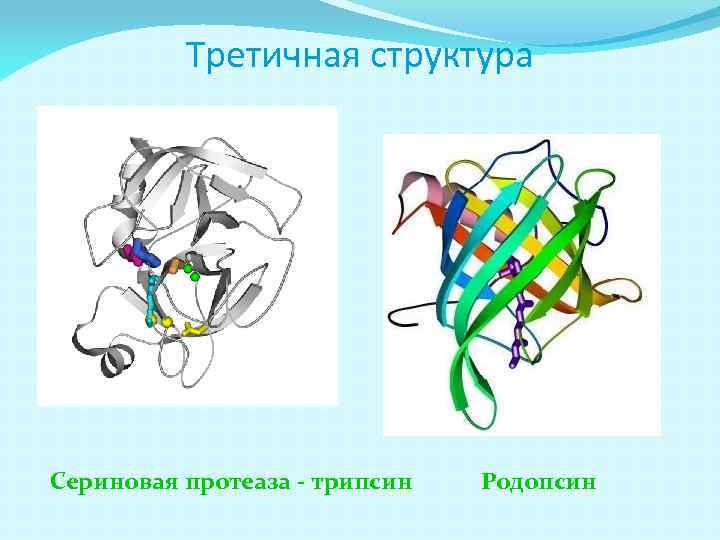
Третичная структура Сериновая протеаза - трипсин Родопсин

Третичная структура ацилтрансфераза пиктатлиаза С
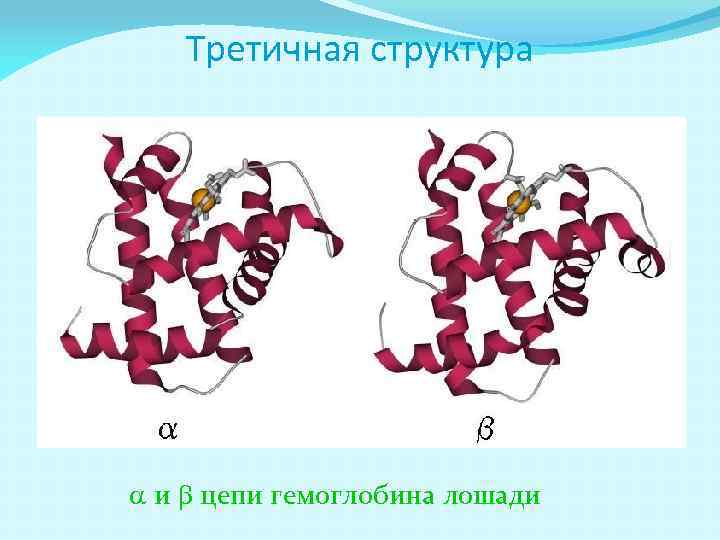
Третичная структура a и b цепи гемоглобина лошади

Третичная структура Порин
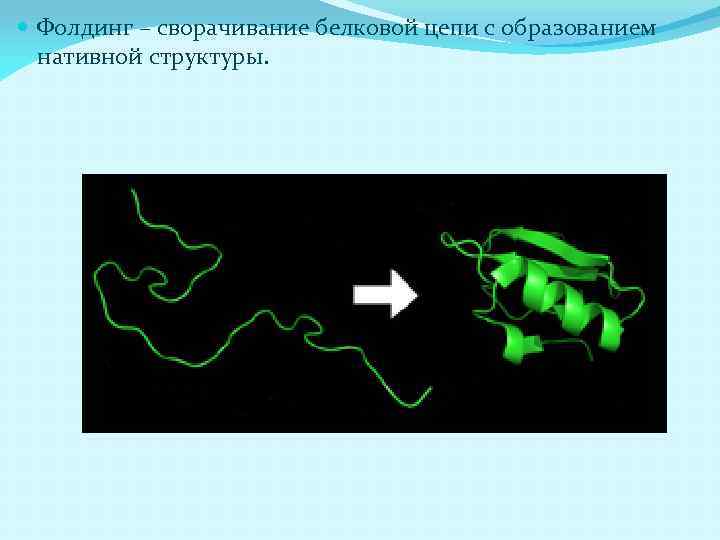
Фолдинг – сворачивание белковой цепи с образованием нативной структуры.
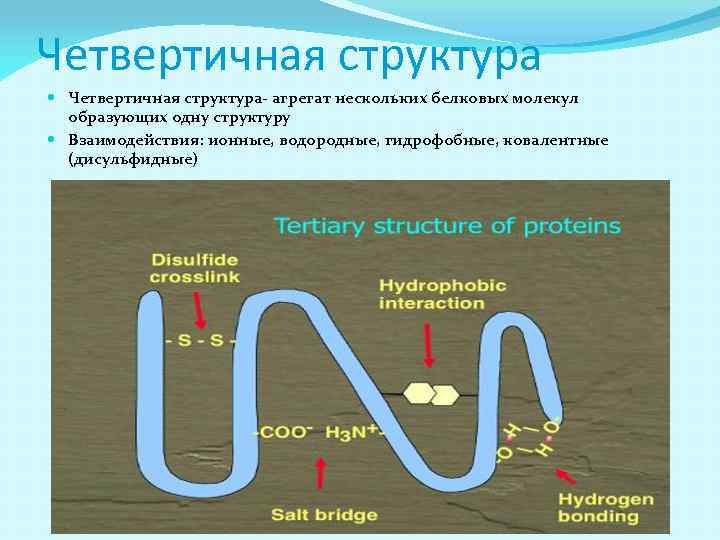
Четвертичная структура Четвертичная структура- агрегат нескольких белковых молекул образующих одну структуру Взаимодействия: ионные, водородные, гидрофобные, ковалентные (дисульфидные)

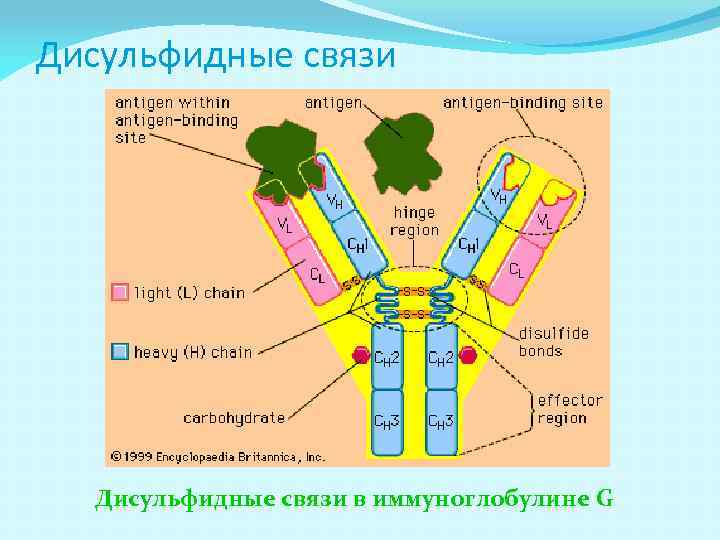
Дисульфидные связи в иммуноглобулине G
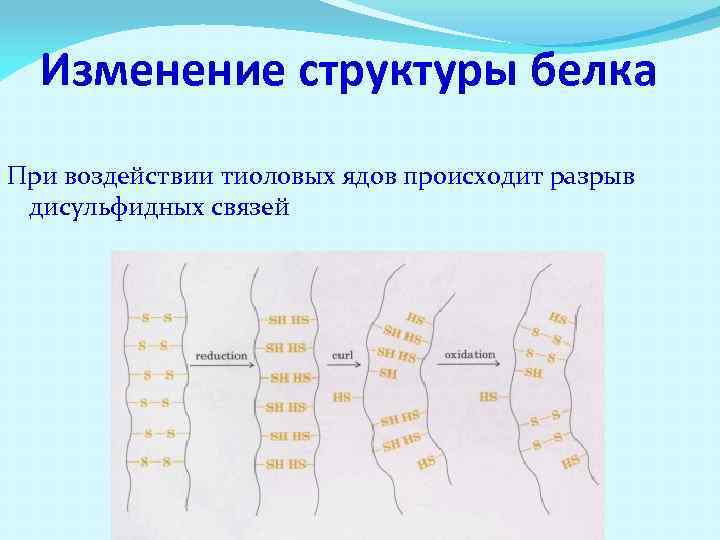
Изменение структуры белка При воздействии тиоловых ядов происходит разрыв дисульфидных связей
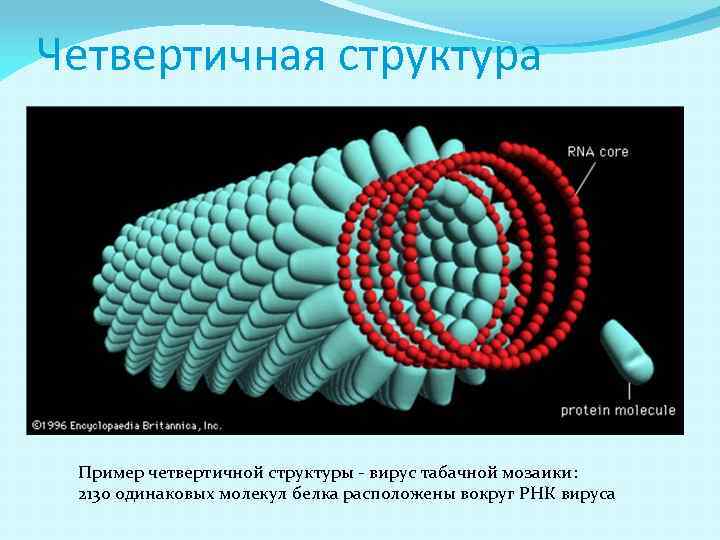
Четвертичная структура Пример четвертичной структуры - вирус табачной мозаики: 2130 одинаковых молекул белка расположены вокруг РНК вируса

Нуклеиновые кислоты НК-это биополимеры, мономерами которых являются нуклеотиды n Нуклеотиды состоят из: - азотистого основания (пиримидинового или пуринового) - моносахарида (рибоза или 2 -дезоксирибоза) - остатка фосфорной кислоты n
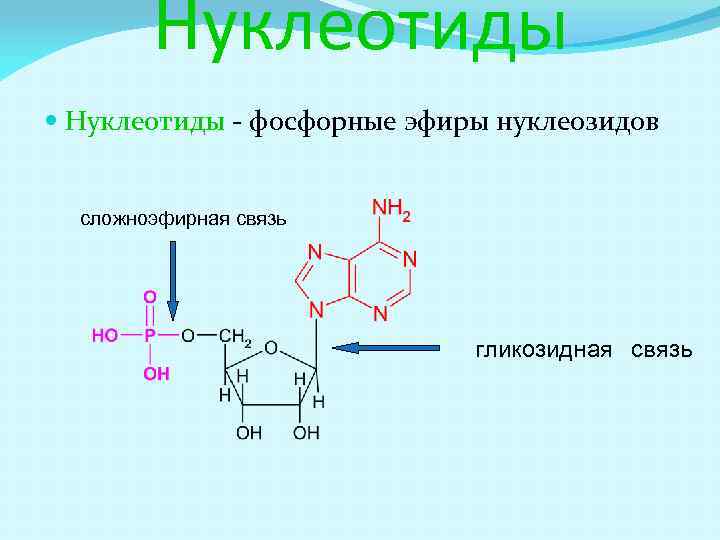
Нуклеотиды - фосфорные эфиры нуклеозидов сложноэфирная связь гликозидная связь
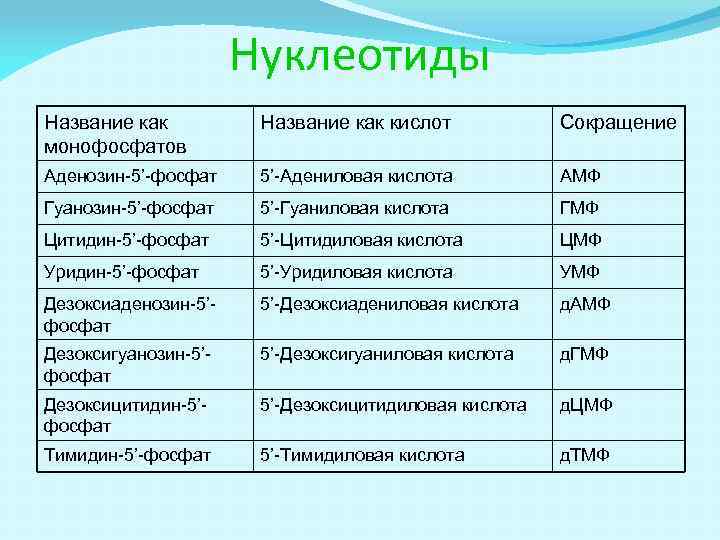
Нуклеотиды Название как монофосфатов Название как кислот Сокращение Аденозин-5’-фосфат 5’-Адениловая кислота АМФ Гуанозин-5’-фосфат 5’-Гуаниловая кислота ГМФ Цитидин-5’-фосфат 5’-Цитидиловая кислота ЦМФ Уридин-5’-фосфат 5’-Уридиловая кислота УМФ Дезоксиаденозин-5’фосфат 5’-Дезоксиадениловая кислота д. АМФ Дезоксигуанозин-5’фосфат 5’-Дезоксигуаниловая кислота д. ГМФ Дезоксицитидин-5’фосфат 5’-Дезоксицитидиловая кислота д. ЦМФ Тимидин-5’-фосфат 5’-Тимидиловая кислота д. ТМФ
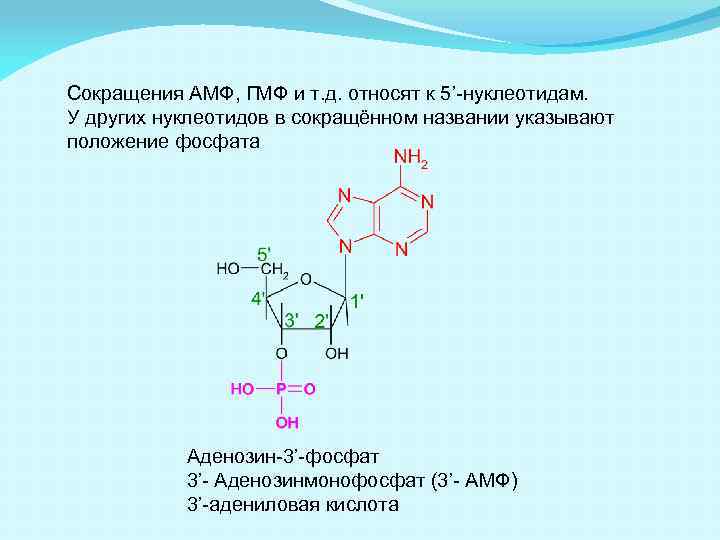
Сокращения АМФ, ГМФ и т. д. относят к 5’-нуклеотидам. У других нуклеотидов в сокращённом названии указывают положение фосфата Аденозин-3’-фосфат 3’- Аденозинмонофосфат (3’- АМФ) 3’-адениловая кислота
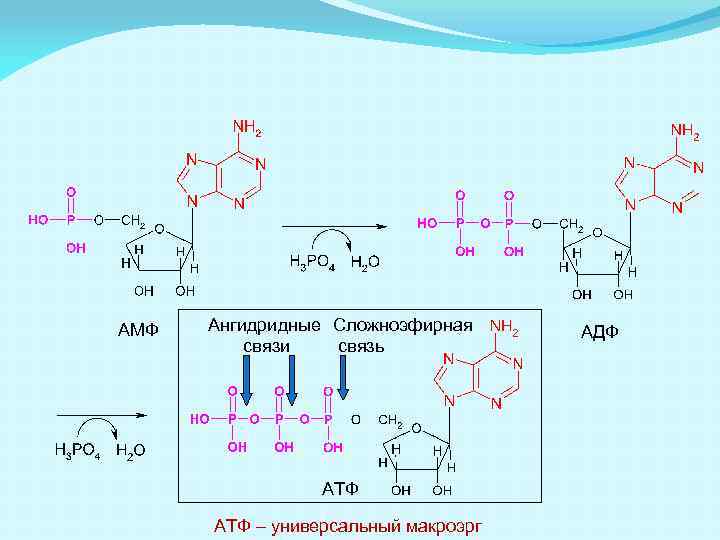
АМФ Ангидридные Сложноэфирная связи связь АТФ – универсальный макроэрг АДФ
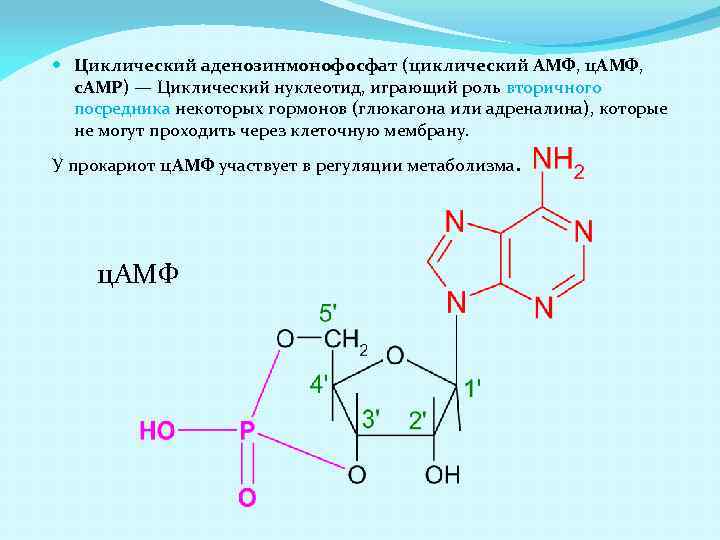
Циклический аденозинмонофосфат (циклический AMФ, ц. AMФ, c. AMP) — Циклический нуклеотид, играющий роль вторичного посредника некоторых гормонов (глюкагона или адреналина), которые не могут проходить через клеточную мембрану. У прокариот ц. AMФ участвует в регуляции метаболизма. ц. AMФ

Первичная структура НК - последовательность нуклеотидов 5’- конец ТГАЦТААГТАЦЦ 3’-конец (ф-конец) (OH-конец)
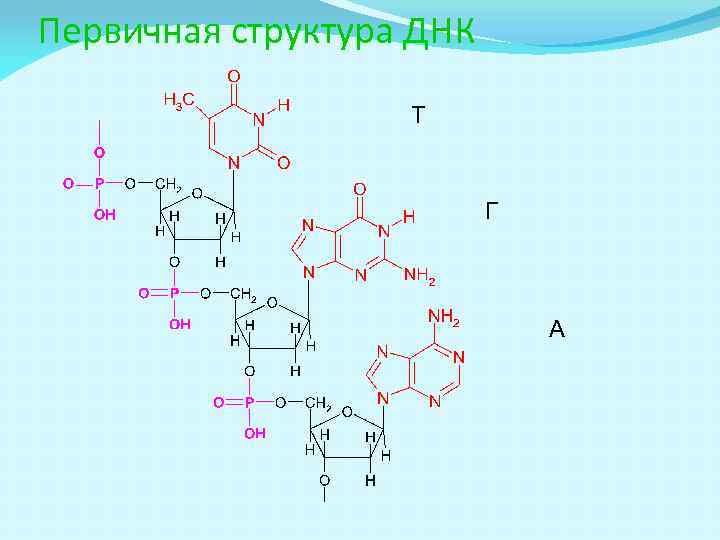
Первичная структура ДНК Т Г А
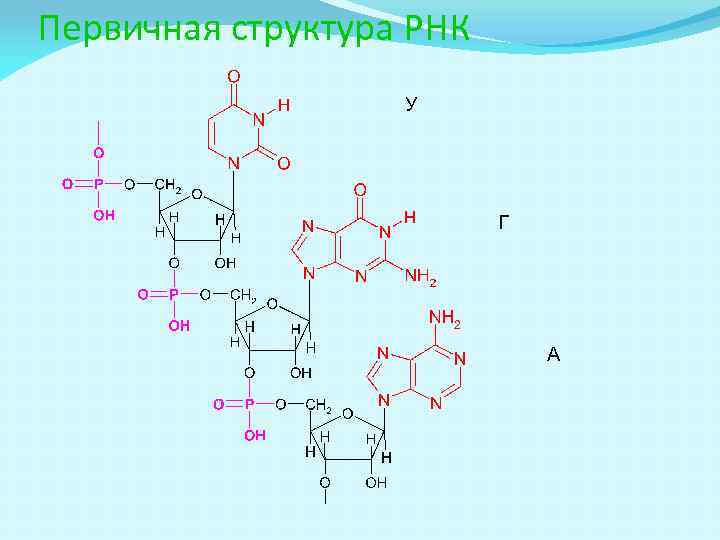
Первичная структура РНК У Г А

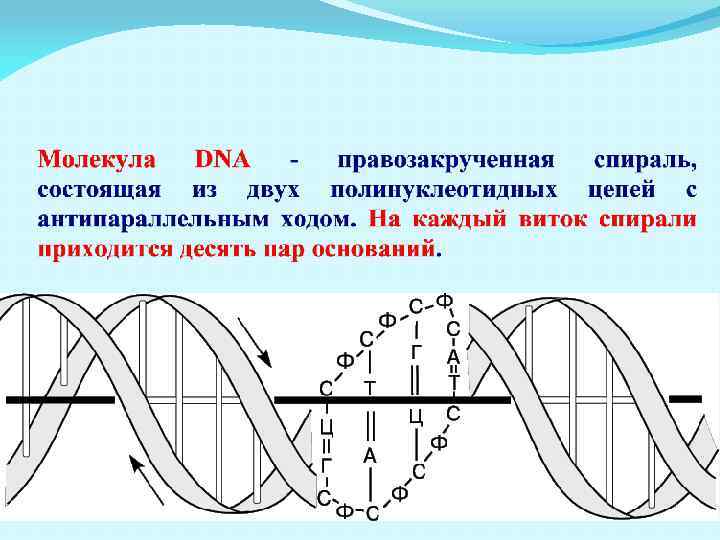
Вторичная структура ДНК – двойная правая спираль (Уотсон, Крик, 1953) Две цепи антипараллельны другу. Цепи связаны водородными связями по принципу комплементарности. 5’ 3’ А Г Г Т Ц Т А Т Г А Ц Т Т Г Ц Т А Ц Т Ц Ц А Г А Т А Ц Т Г А А Ц Г А Т Г 3’ 5’
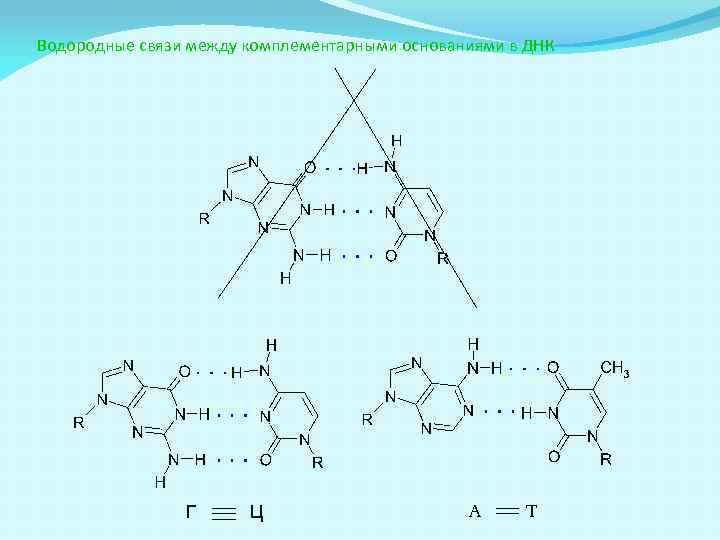
Водородные связи между комплементарными основаниями в ДНК Г Ц А Т



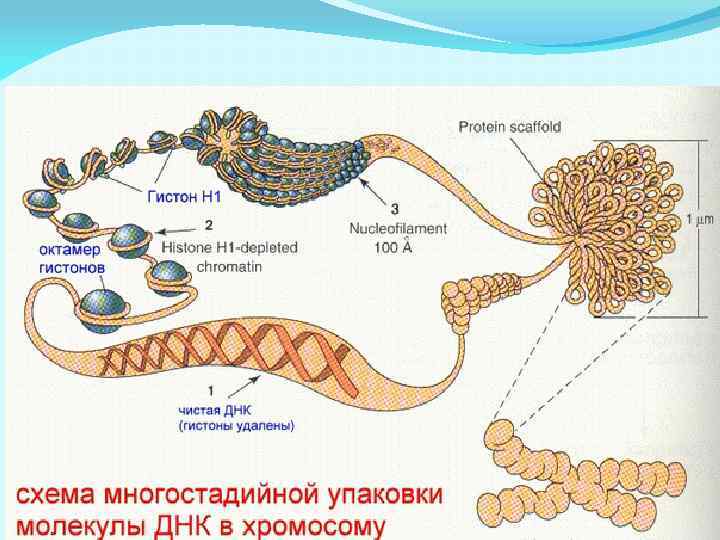
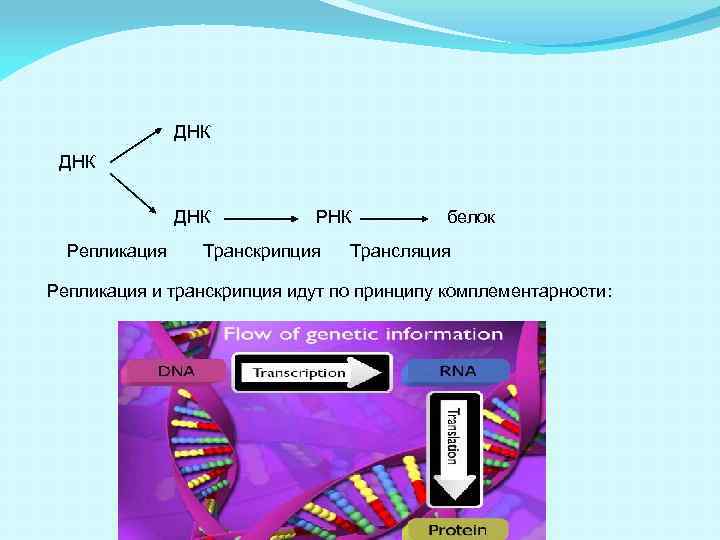
ДНК ДНК Репликация РНК Транскрипция белок Трансляция Репликация и транскрипция идут по принципу комплементарности:
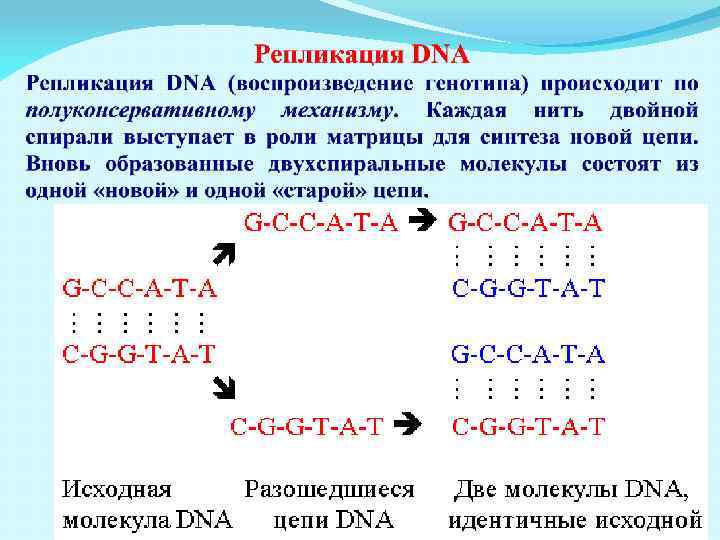
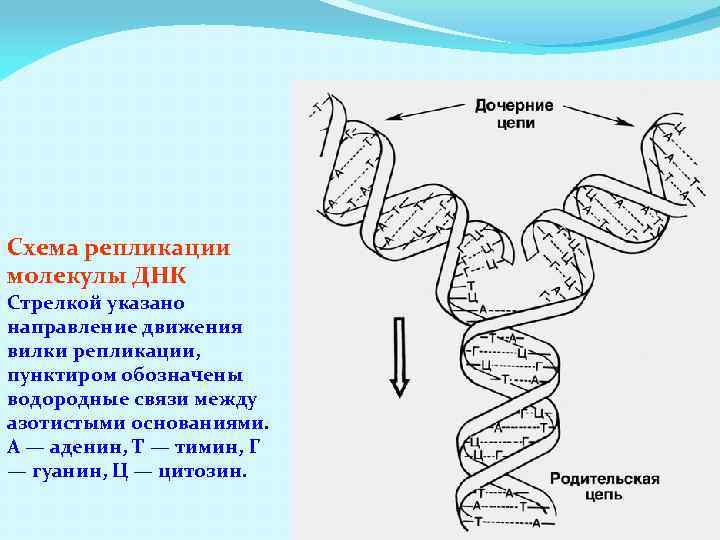
Схема репликации молекулы ДНК Стрелкой указано направление движения вилки репликации, пунктиром обозначены водородные связи между азотистыми основаниями. А — аденин, Т — тимин, Г — гуанин, Ц — цитозин.

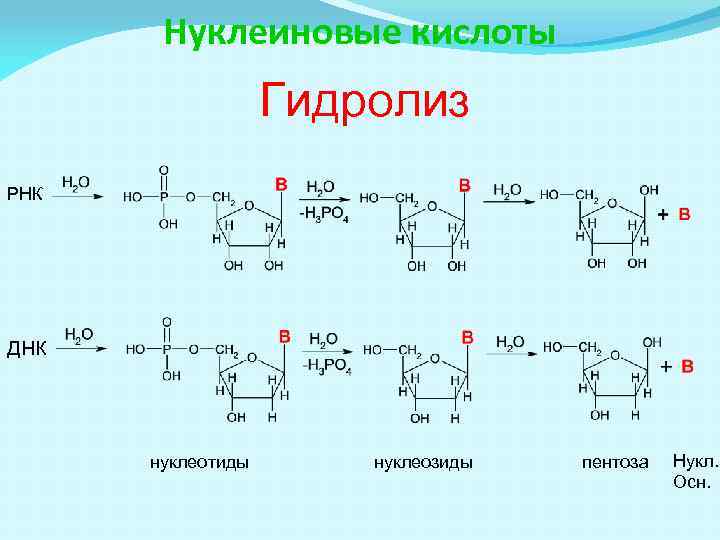
Нуклеиновые кислоты Гидролиз РНК ДНК нуклеотиды нуклеозиды пентоза Нукл. Осн.

Ваше внимание!
24_пептидыбелкиНК.pptx