ОИМ-2010.ppt
- Количество слайдов: 85


 Патогенез острого коронарного синдрома Разрыв ранимой атеросклеротической бляшки • внутрикоронарный тромбоз • изменение геометрии бляшки • дистальная эмболизация • локальный спазм Спазм коронарной артерии • в месте стеноза • без видимого стеноза потребности миокарда в кислороде при значимых стенозах ¯ доставки кислорода к миокарду при значимых стенозах Появление/усугубление ишемии миокарда Симптомы обострения КБС (острый коронарный синдром)
Патогенез острого коронарного синдрома Разрыв ранимой атеросклеротической бляшки • внутрикоронарный тромбоз • изменение геометрии бляшки • дистальная эмболизация • локальный спазм Спазм коронарной артерии • в месте стеноза • без видимого стеноза потребности миокарда в кислороде при значимых стенозах ¯ доставки кислорода к миокарду при значимых стенозах Появление/усугубление ишемии миокарда Симптомы обострения КБС (острый коронарный синдром)
 Классификация нестабильной стенокардии в зависимости от остроты её возникновения Класс I. Недавнее начало тяжелой или прогрессирующей стенокардии напряжения. Анамнез обострения ИБС менее 1 месяца. Класс II. Стенокардия покоя подострая. Больные с ангинозными приступами в покое в течение предшествующего месяца, но не в течение последних 48 ч. Класс III. Стенокардия покоя острая. Больные с одним или несколькими ангинозными приступами в покое на протяжении последних 48 ч.
Классификация нестабильной стенокардии в зависимости от остроты её возникновения Класс I. Недавнее начало тяжелой или прогрессирующей стенокардии напряжения. Анамнез обострения ИБС менее 1 месяца. Класс II. Стенокардия покоя подострая. Больные с ангинозными приступами в покое в течение предшествующего месяца, но не в течение последних 48 ч. Класс III. Стенокардия покоя острая. Больные с одним или несколькими ангинозными приступами в покое на протяжении последних 48 ч.
 Классификация нестабильной стенокардии в зависимости от условий возникновения Класс А. Вторичная нестабильная стенокардия. Больные, у которых НС развивается при наличии факторов, усугубляющих ишемию (анемия, лихорадка, инфекция, гипотензия, неконтролируемая гипертензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность). Класс В. Первичная нестабильная стенокардия. Больные, у которых НС развивается при отсутствии факторов, усугубляющих ишемию. Класс С. Ранняя постинфарктная нестабильная стенокардия. Больные, у которых НС развилась в течение первых 2 недель после ОИМ.
Классификация нестабильной стенокардии в зависимости от условий возникновения Класс А. Вторичная нестабильная стенокардия. Больные, у которых НС развивается при наличии факторов, усугубляющих ишемию (анемия, лихорадка, инфекция, гипотензия, неконтролируемая гипертензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность). Класс В. Первичная нестабильная стенокардия. Больные, у которых НС развивается при отсутствии факторов, усугубляющих ишемию. Класс С. Ранняя постинфарктная нестабильная стенокардия. Больные, у которых НС развилась в течение первых 2 недель после ОИМ.
 ИНФАРКТ МИОКАРДА -коронарогенный некроз сердечной мышцы, который развивается в результате острого несоответствия между потребностью миокарда в кислороде и его доставкой по коронарным сосудам
ИНФАРКТ МИОКАРДА -коронарогенный некроз сердечной мышцы, который развивается в результате острого несоответствия между потребностью миокарда в кислороде и его доставкой по коронарным сосудам
 АТЕРОТРОМБОЗ ПРИ ИНФАРКТЕ МИОКАРДА
АТЕРОТРОМБОЗ ПРИ ИНФАРКТЕ МИОКАРДА
 Хронология событий от начала формирования атеросклеротической бляшки до острого инфаркта миокарда с подъемом сегмента ST ПАТОГЕНЕЗ ИНФАРКТ МИОКАРДА С ЭЛЕВАЦИЕЙ СЕГМЕНТА ST F F связан с образованием тромбоцитарного тромба на поверхности лопнувшей или эрозированной атеросклеротической бляшки выраженность ишемии миокарда зависит от степени сужения или окклюзии коронарной артерии, а также ее длительности Окклюзия коронарной артерии: слева – неполная, справа – полная
Хронология событий от начала формирования атеросклеротической бляшки до острого инфаркта миокарда с подъемом сегмента ST ПАТОГЕНЕЗ ИНФАРКТ МИОКАРДА С ЭЛЕВАЦИЕЙ СЕГМЕНТА ST F F связан с образованием тромбоцитарного тромба на поверхности лопнувшей или эрозированной атеросклеротической бляшки выраженность ишемии миокарда зависит от степени сужения или окклюзии коронарной артерии, а также ее длительности Окклюзия коронарной артерии: слева – неполная, справа – полная

 В основе ОИМ лежит редукция кровотока в инфаркт зависимой коронарной артерии
В основе ОИМ лежит редукция кровотока в инфаркт зависимой коронарной артерии
 Морфологические изменения при ОИМ • В течение первых 2 часов изменения клеточных структур становятся необратимыми. • К 8 -10 дню миокард в зоне инфаркта истончается (резорбция макрофагами некротизированных масс), по окружности появляется и продвигается в глубь некроза молодая соединительная ткань, замещающая в течение 3 -4 недель погибший миокард. • В течение 2 -3 месяцев увеличивается количество коллагена, формируется плотный рубец, в толще которого сохраняются уцелевшие мышечные островки.
Морфологические изменения при ОИМ • В течение первых 2 часов изменения клеточных структур становятся необратимыми. • К 8 -10 дню миокард в зоне инфаркта истончается (резорбция макрофагами некротизированных масс), по окружности появляется и продвигается в глубь некроза молодая соединительная ткань, замещающая в течение 3 -4 недель погибший миокард. • В течение 2 -3 месяцев увеличивается количество коллагена, формируется плотный рубец, в толще которого сохраняются уцелевшие мышечные островки.
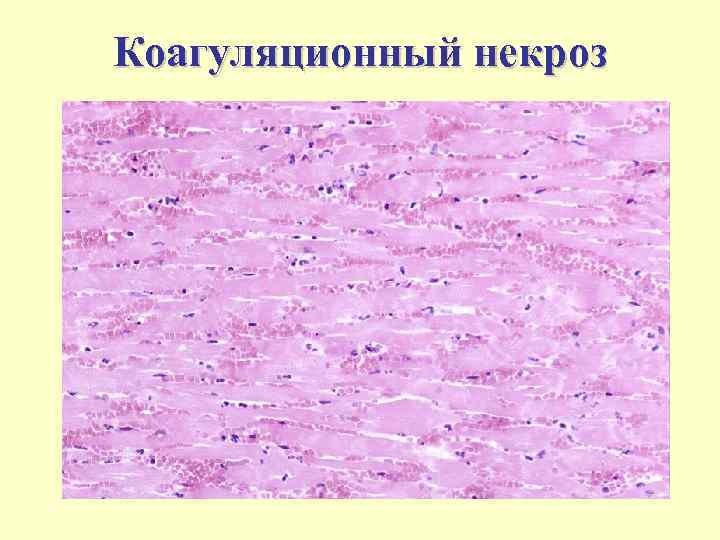 Коагуляционный некроз
Коагуляционный некроз





 Первое сообщение об инфаркте миокарда на основании данных аутопсии принадлежит Крювельеру (1827). Первый клинический диагноз инфаркта миокарда, подтвержденный патологоанатомическим исследованием, был поставлен Гаммером (Hammer, 1873) - эмболия левой венечной артерии в ходе затяжного эндокардита. В России в 1878 г. врач К. Кнорф впервые описал клиническую картину инфаркта миокарда, осложненного кардиогенным шоком и разрывом сердца. Термин "инфаркт миокарда" впервые упомянут в работе французского терапевта R. Marie (1897) Клинические варианты инфаркта миокарда были впервые описаны и выделены российскими терапевтами В. Образцовым и Н. Стражеско. В 1909 г. на I съезде терапевтов они доложили о таких формах заболевания, как status anginosus, gastralgicus, astmaticus. Было описано три случая наблюдения больных, которым инфаркт миокарда был диагностирован прижизненно, а затем подтвержден на секции.
Первое сообщение об инфаркте миокарда на основании данных аутопсии принадлежит Крювельеру (1827). Первый клинический диагноз инфаркта миокарда, подтвержденный патологоанатомическим исследованием, был поставлен Гаммером (Hammer, 1873) - эмболия левой венечной артерии в ходе затяжного эндокардита. В России в 1878 г. врач К. Кнорф впервые описал клиническую картину инфаркта миокарда, осложненного кардиогенным шоком и разрывом сердца. Термин "инфаркт миокарда" впервые упомянут в работе французского терапевта R. Marie (1897) Клинические варианты инфаркта миокарда были впервые описаны и выделены российскими терапевтами В. Образцовым и Н. Стражеско. В 1909 г. на I съезде терапевтов они доложили о таких формах заболевания, как status anginosus, gastralgicus, astmaticus. Было описано три случая наблюдения больных, которым инфаркт миокарда был диагностирован прижизненно, а затем подтвержден на секции.





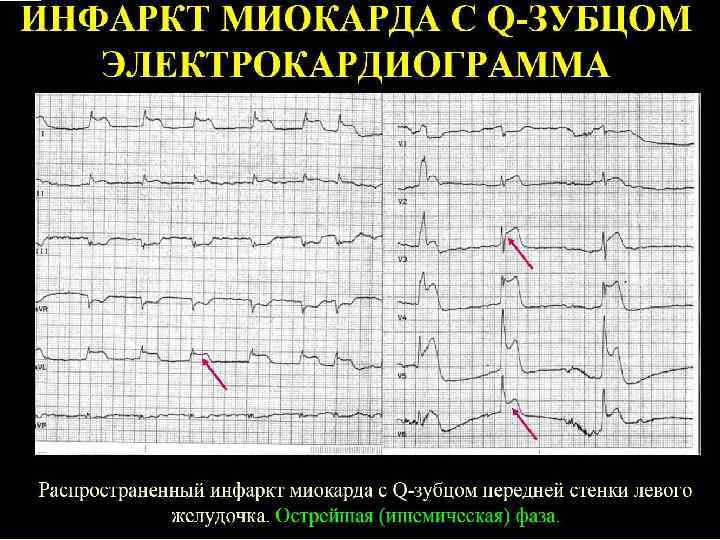
 Классификация инфаркта миокарда По глубине поражения (на основе данных ЭКГ): а) трансмуральный и крупноочаговый ИМ (с подъемом сегмента ST в первые часы заболевания и формированием зубца Q в последующем); б) мелкоочаговый ИМ "не Q-инфаркт" (не сопровождающийся формированием зубца Q, а проявляющийся отрицательными зубцами Т). По клиническому течению: а) неосложненный ИМ; б) осложненный ИМ. По локализации: По локализации а) инфаркт левого желудочка: - передний, - задний (нижний), - перегородочный; б) инфаркт правого желудочка.
Классификация инфаркта миокарда По глубине поражения (на основе данных ЭКГ): а) трансмуральный и крупноочаговый ИМ (с подъемом сегмента ST в первые часы заболевания и формированием зубца Q в последующем); б) мелкоочаговый ИМ "не Q-инфаркт" (не сопровождающийся формированием зубца Q, а проявляющийся отрицательными зубцами Т). По клиническому течению: а) неосложненный ИМ; б) осложненный ИМ. По локализации: По локализации а) инфаркт левого желудочка: - передний, - задний (нижний), - перегородочный; б) инфаркт правого желудочка.

 Клинические проявления острой ишемии миокарда • Сильная боль за грудиной сжимающая, давящая • Испарина, липкий холодный пот • Тошнота, рвота • Одышка • Слабость, коллапс
Клинические проявления острой ишемии миокарда • Сильная боль за грудиной сжимающая, давящая • Испарина, липкий холодный пот • Тошнота, рвота • Одышка • Слабость, коллапс


 Честь первого описания клиники инфаркта миокарда принадлежит русским ученым Василию Пармёновичу Образцову и Николаю Дмитриевичу Стражеско. Николай Дмитриевич Стражеско (1876 -1952)
Честь первого описания клиники инфаркта миокарда принадлежит русским ученым Василию Пармёновичу Образцову и Николаю Дмитриевичу Стражеско. Николай Дмитриевич Стражеско (1876 -1952)
 КЛИНИЧЕСКИЕ ВАРИАНТЫ ИНФАРКТА МИОКАРДА • • • БОЛЕВОЙ (STATUS ANGINOSUS) – до 70 -94%. АСТМАТИЧЕСКИЙ (STATUS ASTHMATICUS) – до 20% (приступ одышки, удушья, нехватки воздуха). АБДОМИНАЛЬНЫЙ (ГАСТРАЛГИЧЕСКИЙ) (STATUS ABDOMINALIS) – 1% (боли в верхних отделах живота с диспепсией – тошнота, рвота, отрыжка и др. ). АРИТМИЧЕСКИЙ – <1% (пароксизм желудочковой или наджелудочковой тахикардии, неполная a-v блокада высокой степени с выраженной желудочковой брадисистолией). ЦЕРЕБРОВАСКУЛЯРНЫЙ - 0. 8 -1. 3% - симптомы нарушения (обычно динамического) мозгового кровообращения: обморок, головокружение, а также и очаговая симптоматика. МАЛОСИМПТОМНЫЙ (БЕССИМПТОМНЫЙ) – 0. 9%.
КЛИНИЧЕСКИЕ ВАРИАНТЫ ИНФАРКТА МИОКАРДА • • • БОЛЕВОЙ (STATUS ANGINOSUS) – до 70 -94%. АСТМАТИЧЕСКИЙ (STATUS ASTHMATICUS) – до 20% (приступ одышки, удушья, нехватки воздуха). АБДОМИНАЛЬНЫЙ (ГАСТРАЛГИЧЕСКИЙ) (STATUS ABDOMINALIS) – 1% (боли в верхних отделах живота с диспепсией – тошнота, рвота, отрыжка и др. ). АРИТМИЧЕСКИЙ – <1% (пароксизм желудочковой или наджелудочковой тахикардии, неполная a-v блокада высокой степени с выраженной желудочковой брадисистолией). ЦЕРЕБРОВАСКУЛЯРНЫЙ - 0. 8 -1. 3% - симптомы нарушения (обычно динамического) мозгового кровообращения: обморок, головокружение, а также и очаговая симптоматика. МАЛОСИМПТОМНЫЙ (БЕССИМПТОМНЫЙ) – 0. 9%.


 Биохимические маркеры ОИМ 1. Активность MB-фракции КФК при инфаркте миокарда начинает возрастать через 3— 12 ч после появления боли, достигает пика через 24 ч и возвращается к норме через 48— 72 ч. Повышение активности MB-фракции КФК в первые 24— 36 ч — это признак инфаркта миокарда, имеющий чувствительность и специфичность, равные 95%. 2. Сердечные тропонины. Уровень сердечных тропонинов I и T — еще более ценный показатель, чем активность MBфракции КФК. Уровень сердечных тропонинов I и T в плазме возрастает через 3— 12 ч после появления боли, достигает пика через 24— 48 ч и возвращается к норме через 5— 14 сут. 3. При инфаркте миокарда активность ЛДГ возрастает через 12 ч после появления боли, достигает пика через 24 — 48 ч и остается повышенной на протяжении 10— 14 сут. Повышение активности ЛДГ 1 характерно для инфаркта миокарда. Повышение уровня миоглобина происходит уже в первые 4— 6 ч инфаркта миокарда, но специфичность данного анализа низка.
Биохимические маркеры ОИМ 1. Активность MB-фракции КФК при инфаркте миокарда начинает возрастать через 3— 12 ч после появления боли, достигает пика через 24 ч и возвращается к норме через 48— 72 ч. Повышение активности MB-фракции КФК в первые 24— 36 ч — это признак инфаркта миокарда, имеющий чувствительность и специфичность, равные 95%. 2. Сердечные тропонины. Уровень сердечных тропонинов I и T — еще более ценный показатель, чем активность MBфракции КФК. Уровень сердечных тропонинов I и T в плазме возрастает через 3— 12 ч после появления боли, достигает пика через 24— 48 ч и возвращается к норме через 5— 14 сут. 3. При инфаркте миокарда активность ЛДГ возрастает через 12 ч после появления боли, достигает пика через 24 — 48 ч и остается повышенной на протяжении 10— 14 сут. Повышение активности ЛДГ 1 характерно для инфаркта миокарда. Повышение уровня миоглобина происходит уже в первые 4— 6 ч инфаркта миокарда, но специфичность данного анализа низка.
 Динамика маркеров ОИМ
Динамика маркеров ОИМ









 ОСНОВНЫЕ НАПРАВЛЕНИЯ ТЕРАПИИ ОИМ 1. Купирование болевого синдрома. 2. Восстановление коронарного кровотока. 3. Уменьшение работы сердца и потребности миокарда в кислороде. 4. Ограничение размеров ИМ. 5. Лечение и профилактика осложнений ИМ.
ОСНОВНЫЕ НАПРАВЛЕНИЯ ТЕРАПИИ ОИМ 1. Купирование болевого синдрома. 2. Восстановление коронарного кровотока. 3. Уменьшение работы сердца и потребности миокарда в кислороде. 4. Ограничение размеров ИМ. 5. Лечение и профилактика осложнений ИМ.

 Терапия острейшей стадии неосложненного ИМ Лекарствен- Направления терапии ное средство Морфин Адекватное внутривенно дробно обезболивание, снижение пред- и постнагрузки, психомоторного возбуждения, потребности миокарда в кислороде Рекомендуемая доза 2 -5 мг внутривенно каждые 5 -15 мин до полного устранения болевого синдрома либо до появления побочных эффектов
Терапия острейшей стадии неосложненного ИМ Лекарствен- Направления терапии ное средство Морфин Адекватное внутривенно дробно обезболивание, снижение пред- и постнагрузки, психомоторного возбуждения, потребности миокарда в кислороде Рекомендуемая доза 2 -5 мг внутривенно каждые 5 -15 мин до полного устранения болевого синдрома либо до появления побочных эффектов


 Обязательное условие для начала тромболитической терапии – наличие элеваций сегмента ST на ЭКГ или признаков блокады ножек пучка Гиса. Тромболитическая терапия не показана, если элевации сегмента ST отсутствуют, независимо от того, как выглядит конечная фаза QRS на ЭКГ – депрессии, отрицательные Т или отсутствие каких-либо изменений. Раннее начало терапии тромболитиками позволяет спасти до 30 больных из 1000 леченых. Тромболизис в течение 1 -го часа от начала симптомов ИМ не только способствует уменьшению смертности, но у 40% больных обрывает процесс развития ИМ, а также препятствует развитию необратимого повреждения миокарда, его дисфункции и внезапной смерти, более половины случаев которой приходится на первые часы ИМ.
Обязательное условие для начала тромболитической терапии – наличие элеваций сегмента ST на ЭКГ или признаков блокады ножек пучка Гиса. Тромболитическая терапия не показана, если элевации сегмента ST отсутствуют, независимо от того, как выглядит конечная фаза QRS на ЭКГ – депрессии, отрицательные Т или отсутствие каких-либо изменений. Раннее начало терапии тромболитиками позволяет спасти до 30 больных из 1000 леченых. Тромболизис в течение 1 -го часа от начала симптомов ИМ не только способствует уменьшению смертности, но у 40% больных обрывает процесс развития ИМ, а также препятствует развитию необратимого повреждения миокарда, его дисфункции и внезапной смерти, более половины случаев которой приходится на первые часы ИМ.

 Тромболитики первого поколения стрептокиназа (1 500 000 ЕД в течение 1 ч) – урокиназа (3 000 ЕД в течение 1 ч), второго поколения – тканевой активатор плазминогена (100 мг болюсом плюс инфузия), проурокиназа (80 мг болюсос плюс инфузия 1 ч). Тканевой активатор плазминогена восстанавливал проходимость инфарктсвязанной артерии к 90 -й минуте у 81% больных, стрептокиназа - у 60%. К 180 -й минуте эти показатели выравнивались, составляя 76 и 74 %.
Тромболитики первого поколения стрептокиназа (1 500 000 ЕД в течение 1 ч) – урокиназа (3 000 ЕД в течение 1 ч), второго поколения – тканевой активатор плазминогена (100 мг болюсом плюс инфузия), проурокиназа (80 мг болюсос плюс инфузия 1 ч). Тканевой активатор плазминогена восстанавливал проходимость инфарктсвязанной артерии к 90 -й минуте у 81% больных, стрептокиназа - у 60%. К 180 -й минуте эти показатели выравнивались, составляя 76 и 74 %.
 Абсолютные противопоказания: тяжелая травма, хирургическое вмешательство или травма головы в предшествующие 3 мес, желудочно-кишечное кровотечение в предшествующий месяц, инсульт, склонность к кровотечениям и расслаивающая аневризма аорты.
Абсолютные противопоказания: тяжелая травма, хирургическое вмешательство или травма головы в предшествующие 3 мес, желудочно-кишечное кровотечение в предшествующий месяц, инсульт, склонность к кровотечениям и расслаивающая аневризма аорты.
 • Относительные противопоказания: преходящее нарушение мозгового кровообращения в предшествующие 6 мес, лечение непрямыми антикоагулянтами, беременность, пункция сосудов, не поддающихся прижатию, травматичная реанимация, рефрактерная гипертензия (систолическое АД более 180 мм рт. ст. ) и недавнее лечение сетчатки лазером.
• Относительные противопоказания: преходящее нарушение мозгового кровообращения в предшествующие 6 мес, лечение непрямыми антикоагулянтами, беременность, пункция сосудов, не поддающихся прижатию, травматичная реанимация, рефрактерная гипертензия (систолическое АД более 180 мм рт. ст. ) и недавнее лечение сетчатки лазером.
 Абсолютными противопоказаниями к тромболитической терапии считаются подозрение на расслоение аорты, активное кровотечение и предшествующий геморрагический инсульт.
Абсолютными противопоказаниями к тромболитической терапии считаются подозрение на расслоение аорты, активное кровотечение и предшествующий геморрагический инсульт.




 Внутривенное введение нитратов при ИМ в первые 12 ч заболевания уменьшает размер очага некроза, влияет на основные осложнения ИМ, включая летальные исходы и частоту развития кардиогенного шока. Применение их снижает летальность до 30% в первые 7 дней болезни (при инфарктах передней стенки). АД должно быть выше 100 мм рт. ст. Терапию нитратами проводят в течение 24 ч, если не появляется необходимости продолжения этой терапии, в частности при сохраняющихся болях, связанных с ишемией миокарда, или признаках сердечной недостаточности.
Внутривенное введение нитратов при ИМ в первые 12 ч заболевания уменьшает размер очага некроза, влияет на основные осложнения ИМ, включая летальные исходы и частоту развития кардиогенного шока. Применение их снижает летальность до 30% в первые 7 дней болезни (при инфарктах передней стенки). АД должно быть выше 100 мм рт. ст. Терапию нитратами проводят в течение 24 ч, если не появляется необходимости продолжения этой терапии, в частности при сохраняющихся болях, связанных с ишемией миокарда, или признаках сердечной недостаточности.

 Механизм влияния b-блокаторов на летальность – это уменьшение случаев фибрилляции желудочков и разрывов сердца. Лечение b-блокаторами начинают с внутривенного введения (метопролол, атенолол, пропранолол) –до оптимального снижения частоты сердечных сокращений. Затем переходят на прием препаратов внутрь: метопролол 50 мг каждые 6 -12 ч в первые 2 сут, атенолол по 50 мг каждые 12 ч в течение суток, а затем подбирают дозу индивидуально для каждого больного. Основные показания к применению b-блокаторов – признаки симпатической гиперактивности, такие как тахикардия при отсутствии признаков сердечной недостаточности, гипертония, болевой синдром, наличие ишемии миокарда.
Механизм влияния b-блокаторов на летальность – это уменьшение случаев фибрилляции желудочков и разрывов сердца. Лечение b-блокаторами начинают с внутривенного введения (метопролол, атенолол, пропранолол) –до оптимального снижения частоты сердечных сокращений. Затем переходят на прием препаратов внутрь: метопролол 50 мг каждые 6 -12 ч в первые 2 сут, атенолол по 50 мг каждые 12 ч в течение суток, а затем подбирают дозу индивидуально для каждого больного. Основные показания к применению b-блокаторов – признаки симпатической гиперактивности, такие как тахикардия при отсутствии признаков сердечной недостаточности, гипертония, болевой синдром, наличие ишемии миокарда.



 Ингибиторы ангиотензинпревращающего фермента • и. АПФ способны приостанавливать расширение, дилатацию левого желудочка, истончение миокарда, т. е. воздействовать на процессы, приводящие к ремоделированию миокарда левого желудочка и сопровождающиеся серьезным ухудшением сократительной функции миокарда и прогноза. • Лечение и. АПФ начинают через 24– 48 ч от момента развития ИМ, чтобы снизить вероятность артериальной гипотонии.
Ингибиторы ангиотензинпревращающего фермента • и. АПФ способны приостанавливать расширение, дилатацию левого желудочка, истончение миокарда, т. е. воздействовать на процессы, приводящие к ремоделированию миокарда левого желудочка и сопровождающиеся серьезным ухудшением сократительной функции миокарда и прогноза. • Лечение и. АПФ начинают через 24– 48 ч от момента развития ИМ, чтобы снизить вероятность артериальной гипотонии.
 Терапия острейшей стадии неосложненного ИМ Лекарственное средство Направления терапии Рекомендуемая доза Нитроглицерин или Купирование болевого синдрома, изосорбида динит- уменьшение размеров ИМ и рат внутривенно летальности капельно 10 мкг/мин с увеличением скорости на 20 мкг/мин каждые 5 мин под контролем ЧСС и АД Бетаадреноблокаторы пропранолол 1 мг/мин каждые 3 -5 мин до общей дозы 10 мг Снижение потребности миокарда в кислороде, купирование болевого синдрома, уменьшение размеров некроза, профилактика фибрилляции желудочков и разрыва левого желудочка, повторных ИМ, снижение летальности Ацетилсалициловая Купирование и профилактика кислота процессов, связанных с агрегацией тромбоцитов; при раннем(!) назначении снижает летальность 160 -325 мг разжевать
Терапия острейшей стадии неосложненного ИМ Лекарственное средство Направления терапии Рекомендуемая доза Нитроглицерин или Купирование болевого синдрома, изосорбида динит- уменьшение размеров ИМ и рат внутривенно летальности капельно 10 мкг/мин с увеличением скорости на 20 мкг/мин каждые 5 мин под контролем ЧСС и АД Бетаадреноблокаторы пропранолол 1 мг/мин каждые 3 -5 мин до общей дозы 10 мг Снижение потребности миокарда в кислороде, купирование болевого синдрома, уменьшение размеров некроза, профилактика фибрилляции желудочков и разрыва левого желудочка, повторных ИМ, снижение летальности Ацетилсалициловая Купирование и профилактика кислота процессов, связанных с агрегацией тромбоцитов; при раннем(!) назначении снижает летальность 160 -325 мг разжевать

 Острейшая стадия (стадия повреждения) • 1 -3 часа, 1 -3 дня монофазная кривая кошкина спина • Зона повреждения
Острейшая стадия (стадия повреждения) • 1 -3 часа, 1 -3 дня монофазная кривая кошкина спина • Зона повреждения
 Острая стадия 1 -3 недели • Зона некроза • Зона повреждения • Зона ишемии
Острая стадия 1 -3 недели • Зона некроза • Зона повреждения • Зона ишемии
 Подострая стадия 3 -8 недель • Зона некроза (стабилизация) • Зона ишемии
Подострая стадия 3 -8 недель • Зона некроза (стабилизация) • Зона ишемии
 Рубцовая стадия Всю жизнь • Рубцовая ткань
Рубцовая стадия Всю жизнь • Рубцовая ткань










 Патогенез нестабильной стенокардии Основным механизмом развития нестабильной стенокардии являются морфологические изменения бляшки (разрывы), тромбоз на поверхности бляшки, а также развитие спазма коронарной артерии в результате нарушения функции эндотелия. Причиной разрыва и/или трещины бляшки в большинстве случаев являются резкие изменения гемодинамики, обусловленные симпатической гиперактивностью. После деструкции бляшки обнажается тромбоактивная поверхность, на которой протекает процесс адгезии и агрегации тромбоцитов с формированием преимущественно тромбоцитарного тромба. Выделяющиеся в процессе агрегации медиаторы (в частности, тромбоксан А 2) могут вызвать спазм коронарной артерии в месте атеросклеротического стеноза (сокращение интактного сегмента при эксцентрическом расположении бляшки).
Патогенез нестабильной стенокардии Основным механизмом развития нестабильной стенокардии являются морфологические изменения бляшки (разрывы), тромбоз на поверхности бляшки, а также развитие спазма коронарной артерии в результате нарушения функции эндотелия. Причиной разрыва и/или трещины бляшки в большинстве случаев являются резкие изменения гемодинамики, обусловленные симпатической гиперактивностью. После деструкции бляшки обнажается тромбоактивная поверхность, на которой протекает процесс адгезии и агрегации тромбоцитов с формированием преимущественно тромбоцитарного тромба. Выделяющиеся в процессе агрегации медиаторы (в частности, тромбоксан А 2) могут вызвать спазм коронарной артерии в месте атеросклеротического стеноза (сокращение интактного сегмента при эксцентрическом расположении бляшки).
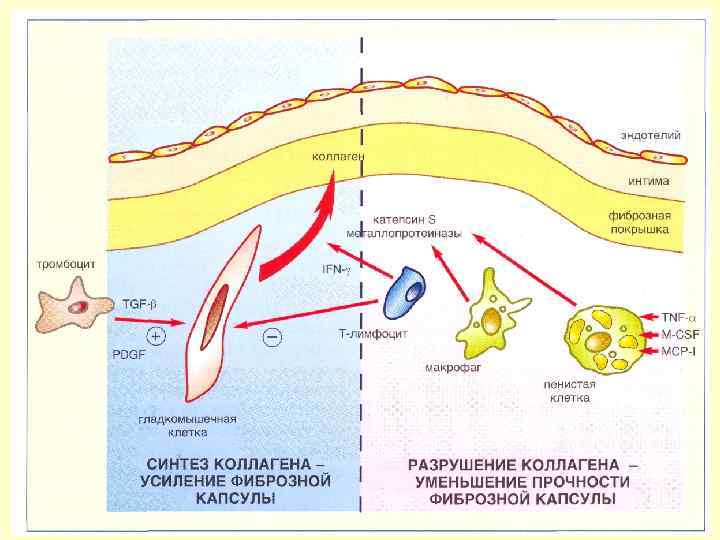
 Патогенез нестабильной стенокардии Риск разрыва в большей степени обусловлен не размером бляшки, а её составом. Чаще разрываются бляшки с рыхлым ядром, содержащим большое количество липидов, и тонким поверхностным слоем. В них обычно меньше коллагена и гладкомышечных клеток и больше макрофагов. Наличие большого количества макрофагов способствует разрыву бляшки, так как они продуцируют коллагеназу, желатиназу, стромализин, которые разрушают покрывающий бляшку слой соединительной ткани. Бляшка с крутым подъемом и резко суживающая просвет подвергается более значительному гемодинамическому стрессу, чем бляшка с постепенным нарастанием ее величины.
Патогенез нестабильной стенокардии Риск разрыва в большей степени обусловлен не размером бляшки, а её составом. Чаще разрываются бляшки с рыхлым ядром, содержащим большое количество липидов, и тонким поверхностным слоем. В них обычно меньше коллагена и гладкомышечных клеток и больше макрофагов. Наличие большого количества макрофагов способствует разрыву бляшки, так как они продуцируют коллагеназу, желатиназу, стромализин, которые разрушают покрывающий бляшку слой соединительной ткани. Бляшка с крутым подъемом и резко суживающая просвет подвергается более значительному гемодинамическому стрессу, чем бляшка с постепенным нарастанием ее величины.


