Патофизиология коры надпочечников.pptx
- Количество слайдов: 29
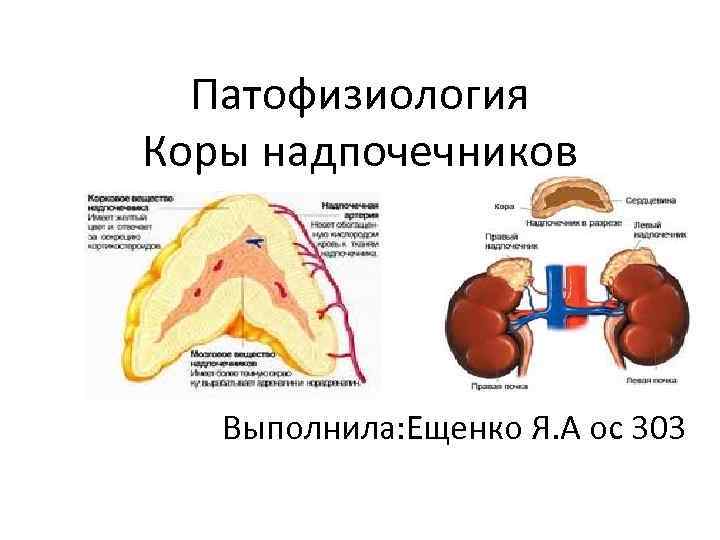 Патофизиология Коры надпочечников Выполнила: Ещенко Я. А ос 303
Патофизиология Коры надпочечников Выполнила: Ещенко Я. А ос 303
 • Надпочечники - парный орган. Располагаются забрюшинно у верхнего полюса почки. Состоят из коркового (90% надпочечника) и мозгового веществ. В коре выделяют три области: • клубочковая (наружный слой, продуцирует альдостерон) • пучковая (промежуточная положение, продуцирует глюкокортикоиды) • сетчатая (примыкает к мозговому веществу, продуцирует андрогены).
• Надпочечники - парный орган. Располагаются забрюшинно у верхнего полюса почки. Состоят из коркового (90% надпочечника) и мозгового веществ. В коре выделяют три области: • клубочковая (наружный слой, продуцирует альдостерон) • пучковая (промежуточная положение, продуцирует глюкокортикоиды) • сетчатая (примыкает к мозговому веществу, продуцирует андрогены).
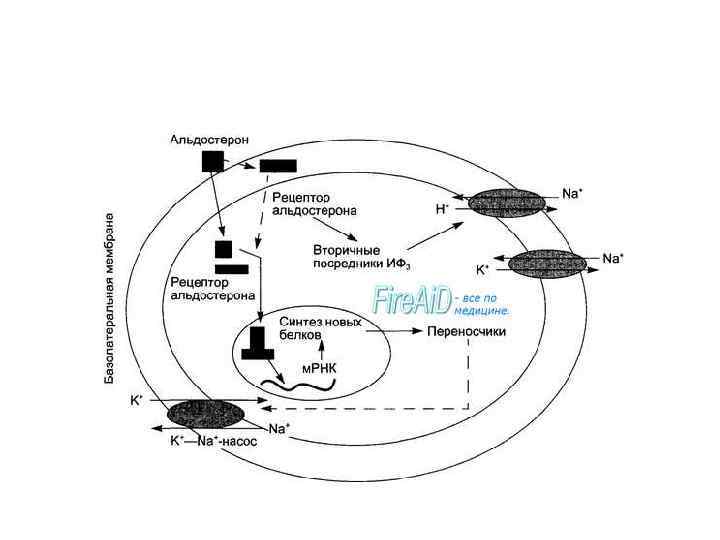
 Механизм действия альдостерона, как и всех стероидных гормонов, состоит в прямом влиянии на генетический аппарат ядра клеток со стимуляцией синтеза соответствующих РНК, активации синтеза транспортирующих катионы белков и ферментов, а также повышении проницаемости мембран для аминокислот.
Механизм действия альдостерона, как и всех стероидных гормонов, состоит в прямом влиянии на генетический аппарат ядра клеток со стимуляцией синтеза соответствующих РНК, активации синтеза транспортирующих катионы белков и ферментов, а также повышении проницаемости мембран для аминокислот.
 Негеномные эффекты гормона реализуются через системы вторичных посредников. Они обусловлены стимуляцией мембранного антипорта Na+/H+ в клетках разных типов (гладкие мышцы матки, эпителий дистальных канальцев почек, гладкие мышцы артерий и артериол, клетки крипт кишечника). Эти эффекты обусловлены образованием вторичного посредника диацилглицерола и активацией протеинкиназы С. Повышение уровня внутриклеточного кальция в эндотелиальных и гладкомышечных клетках сосудов под влиянием альдостерона обусловлено активацией вторичного посредника ИФЗ. Альдостерон вызывает в клетках и двукратное повышение уровня ц. АМФ, модулируя геномные эффекты стероидных гормонов. Быстрые негеномные эффекты альдостерона проявляются и со стороны сердечно-сосудистой системы в виде: повышения сосудистого сопротивления и артериального давления при снижении сердечного выброса, противодействия повышению в гладких мышцах сосудов уровня ц. АМФ и увеличения чувствительности к прессорным эффектам катехоламинов и ангиотензина II, что дало основание считать альдостерон циркуляторным гормоном стресса.
Негеномные эффекты гормона реализуются через системы вторичных посредников. Они обусловлены стимуляцией мембранного антипорта Na+/H+ в клетках разных типов (гладкие мышцы матки, эпителий дистальных канальцев почек, гладкие мышцы артерий и артериол, клетки крипт кишечника). Эти эффекты обусловлены образованием вторичного посредника диацилглицерола и активацией протеинкиназы С. Повышение уровня внутриклеточного кальция в эндотелиальных и гладкомышечных клетках сосудов под влиянием альдостерона обусловлено активацией вторичного посредника ИФЗ. Альдостерон вызывает в клетках и двукратное повышение уровня ц. АМФ, модулируя геномные эффекты стероидных гормонов. Быстрые негеномные эффекты альдостерона проявляются и со стороны сердечно-сосудистой системы в виде: повышения сосудистого сопротивления и артериального давления при снижении сердечного выброса, противодействия повышению в гладких мышцах сосудов уровня ц. АМФ и увеличения чувствительности к прессорным эффектам катехоламинов и ангиотензина II, что дало основание считать альдостерон циркуляторным гормоном стресса.
 • Альдостерон поддерживает оптимальный водно-солевой обмен между внешней и внутренней средой организма. Одним из главных органов-мишеней гормона являются почки, где альдостерон вызывает усиленную реабсорбцию натрия в дистальных канальцах с его задержкой в организме и повышение экскреции калия с мочой. • Под влиянием альдостерона происходит: • задержка в организме хлоридов и воды • усиленное выведение Н-ионов и аммония • увеличивается объем циркулирующей крови • формируется сдвиг кислотно-основного состояния в сторону алкалоза. • Действуя на клетки сосудов и тканей, гормон способствует транспорту натрия и воды во внутриклеточное пространство • усиливает воспаление и реакции иммунной системы
• Альдостерон поддерживает оптимальный водно-солевой обмен между внешней и внутренней средой организма. Одним из главных органов-мишеней гормона являются почки, где альдостерон вызывает усиленную реабсорбцию натрия в дистальных канальцах с его задержкой в организме и повышение экскреции калия с мочой. • Под влиянием альдостерона происходит: • задержка в организме хлоридов и воды • усиленное выведение Н-ионов и аммония • увеличивается объем циркулирующей крови • формируется сдвиг кислотно-основного состояния в сторону алкалоза. • Действуя на клетки сосудов и тканей, гормон способствует транспорту натрия и воды во внутриклеточное пространство • усиливает воспаление и реакции иммунной системы
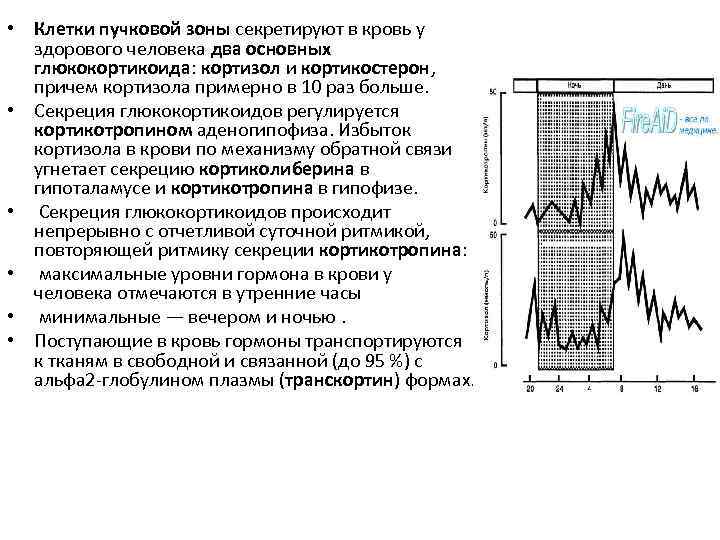 • Клетки пучковой зоны секретируют в кровь у здорового человека два основных глюкокортикоида: кортизол и кортикостерон, причем кортизола примерно в 10 раз больше. • Секреция глюкокортикоидов регулируется кортикотропином аденогипофиза. Избыток кортизола в крови по механизму обратной связи угнетает секрецию кортиколиберина в гипоталамусе и кортикотропина в гипофизе. • Секреция глюкокортикоидов происходит непрерывно с отчетливой суточной ритмикой, повторяющей ритмику секреции кортикотропина: • максимальные уровни гормона в крови у человека отмечаются в утренние часы • минимальные — вечером и ночью. • Поступающие в кровь гормоны транспортируются к тканям в свободной и связанной (до 95 %) с альфа 2 -глобулином плазмы (транскортин) формах.
• Клетки пучковой зоны секретируют в кровь у здорового человека два основных глюкокортикоида: кортизол и кортикостерон, причем кортизола примерно в 10 раз больше. • Секреция глюкокортикоидов регулируется кортикотропином аденогипофиза. Избыток кортизола в крови по механизму обратной связи угнетает секрецию кортиколиберина в гипоталамусе и кортикотропина в гипофизе. • Секреция глюкокортикоидов происходит непрерывно с отчетливой суточной ритмикой, повторяющей ритмику секреции кортикотропина: • максимальные уровни гормона в крови у человека отмечаются в утренние часы • минимальные — вечером и ночью. • Поступающие в кровь гормоны транспортируются к тканям в свободной и связанной (до 95 %) с альфа 2 -глобулином плазмы (транскортин) формах.
 • Среди синтезированных под влиянием кортизола белков в клетке-мишени важнейшую роль для реализации опосредованных эффектов гормона играет семейство липокортинов. • Последние, выходя из клетки, связываются со специфическими липокортиновыми рецепторами клеточной мембраны (аутокринный путь влияния), что вызывает подавление активности фосфолипазы-А. • Липокортины способны ингибировать фосфолипазу. А и непосредственно, следствием чего является подавление синтеза в клетках простагландинов и лейкотриенов, ослабление их метаболических и регуляторных эффектов. Уменьшение проницаемости клеточных мембран и противовоспалительный эффект кортизола обусловлены ингибированием синтеза лейкотриенов.
• Среди синтезированных под влиянием кортизола белков в клетке-мишени важнейшую роль для реализации опосредованных эффектов гормона играет семейство липокортинов. • Последние, выходя из клетки, связываются со специфическими липокортиновыми рецепторами клеточной мембраны (аутокринный путь влияния), что вызывает подавление активности фосфолипазы-А. • Липокортины способны ингибировать фосфолипазу. А и непосредственно, следствием чего является подавление синтеза в клетках простагландинов и лейкотриенов, ослабление их метаболических и регуляторных эффектов. Уменьшение проницаемости клеточных мембран и противовоспалительный эффект кортизола обусловлены ингибированием синтеза лейкотриенов.
 Глюкокортикоиды прямо или опосредованно регулируют практически все виды обмена веществ и физиологические функции. Обобщенно эти сдвиги можно свести к распаду белков и липидов в тканях, после чего метаболиты поступают в печень, где из них синтезируется глюкоза, использующаяся как источник энергии. Эффекты на углеводный обмен в целом противоположны инсулину, поэтому глюкокортикоиды называют контринсулярными гормонами. Гипергликемия под влиянием гормонов возникает за счет усиленного образования глюкозы в печени из аминокислот — глюконеогенеза и подавления утилизации ее тканями. Гипергликемия является причиной активации секреции инсулина. Чувствительность тканей к инсулину глюкокортикоиды снижают, а контринсулярные метаболические эффекты могут вести к развитию стероидного сахарного диабета.
Глюкокортикоиды прямо или опосредованно регулируют практически все виды обмена веществ и физиологические функции. Обобщенно эти сдвиги можно свести к распаду белков и липидов в тканях, после чего метаболиты поступают в печень, где из них синтезируется глюкоза, использующаяся как источник энергии. Эффекты на углеводный обмен в целом противоположны инсулину, поэтому глюкокортикоиды называют контринсулярными гормонами. Гипергликемия под влиянием гормонов возникает за счет усиленного образования глюкозы в печени из аминокислот — глюконеогенеза и подавления утилизации ее тканями. Гипергликемия является причиной активации секреции инсулина. Чувствительность тканей к инсулину глюкокортикоиды снижают, а контринсулярные метаболические эффекты могут вести к развитию стероидного сахарного диабета.
 На белковый обмен гормоны оказывают катаболический и антианаболический эффекты приводя к отрицательному азотистому балансу Распад белка происходит в мышечной, соединительной и костной тканях, снижается уровень альбумина в крови, уменьшается проницаемость клеточных мембран для аминокислот синтез некоторых белков в печени, например альфа 2 -глобулинов повышается. Со стороны жирового обмена : липо-литический эффект в тканях гиперлипидемия и гиперхолестеринемия, активация кетогенеза в печени угнетение липогенеза в печени, стимуляция липогенеза и перераспределения жира в жировой ткани центральной оси туловища и лица, стимуляция аппетита и потребления жира Влияние глюкокортикоидов на реактивность тканей проявляется не только в виде подавления чувствительности к инсулину, но и в повышении чувствительности адренорецепторов к катехоламинам.
На белковый обмен гормоны оказывают катаболический и антианаболический эффекты приводя к отрицательному азотистому балансу Распад белка происходит в мышечной, соединительной и костной тканях, снижается уровень альбумина в крови, уменьшается проницаемость клеточных мембран для аминокислот синтез некоторых белков в печени, например альфа 2 -глобулинов повышается. Со стороны жирового обмена : липо-литический эффект в тканях гиперлипидемия и гиперхолестеринемия, активация кетогенеза в печени угнетение липогенеза в печени, стимуляция липогенеза и перераспределения жира в жировой ткани центральной оси туловища и лица, стимуляция аппетита и потребления жира Влияние глюкокортикоидов на реактивность тканей проявляется не только в виде подавления чувствительности к инсулину, но и в повышении чувствительности адренорецепторов к катехоламинам.
 Глюкокортикоиды вызывают снижение в крови количества лимфоцитов, эозинофилов и базофилов, повышение чувствительности сенсорных структур и возбудимости нервной системы, обеспечение оптимальной симпатической регуляции сердечно-сосудистой системы. Почечные эффекты глюкокортикоидов состоят в стимуляции диуреза путем снижения реабсорбции воды и повышении клубочковой фильтрации; подобно минералокортикоидам, они могут вызывать задержку натрия при потере калия. в печени повышают синтез ангиотензиногена и тем самым способствуют большему образованию в крови ангиотензина II и секреции альдостерона, в мозговом веществе надпочечников увеличивают синтез катехоламинов в Гормоны повышают устойчивость организма к действию чрезмерных раздражителей, подавляют сосудистую проницаемость и воспаление (поэтому их называют адаптивными и противовоспалительными) антиаллергические эффекты из-за катаболизма белка в лимфоидной ткани и угнетения иммунных реакций. Физиологическое влияние кортизола на им-мунокомпетентные клетки носит защитный, регуляторный характер
Глюкокортикоиды вызывают снижение в крови количества лимфоцитов, эозинофилов и базофилов, повышение чувствительности сенсорных структур и возбудимости нервной системы, обеспечение оптимальной симпатической регуляции сердечно-сосудистой системы. Почечные эффекты глюкокортикоидов состоят в стимуляции диуреза путем снижения реабсорбции воды и повышении клубочковой фильтрации; подобно минералокортикоидам, они могут вызывать задержку натрия при потере калия. в печени повышают синтез ангиотензиногена и тем самым способствуют большему образованию в крови ангиотензина II и секреции альдостерона, в мозговом веществе надпочечников увеличивают синтез катехоламинов в Гормоны повышают устойчивость организма к действию чрезмерных раздражителей, подавляют сосудистую проницаемость и воспаление (поэтому их называют адаптивными и противовоспалительными) антиаллергические эффекты из-за катаболизма белка в лимфоидной ткани и угнетения иммунных реакций. Физиологическое влияние кортизола на им-мунокомпетентные клетки носит защитный, регуляторный характер
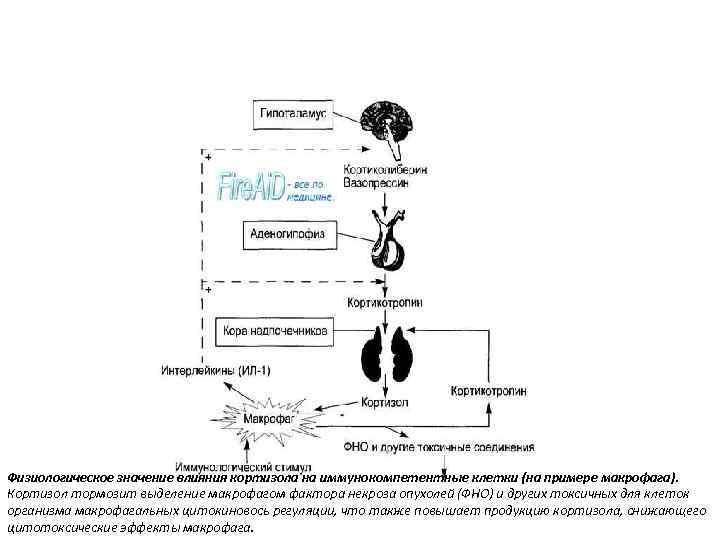 Физиологическое значение влияния кортизола на иммунокомпетентные клетки (на примере макрофага). Кортизол тормозит выделение макрофагом фактора некроза опухолей (ФНО) и других токсичных для клеток организма макрофагальных цитокиновось регуляции, что также повышает продукцию кортизола, снижающего цитотоксические эффекты макрофага.
Физиологическое значение влияния кортизола на иммунокомпетентные клетки (на примере макрофага). Кортизол тормозит выделение макрофагом фактора некроза опухолей (ФНО) и других токсичных для клеток организма макрофагальных цитокиновось регуляции, что также повышает продукцию кортизола, снижающего цитотоксические эффекты макрофага.
 Андрогены надпочечника стимулируют окостенение эпифизарных хрящей, повышают синтез белка (анаболический эффект) в коже, мышечной и костной ткани являются предшественниками основного андрогена семенников — тестостерона и могут превращаться в него при метаболизме в тканях-мишенях способствуют развитию оволосения по мужскому типу, а их избыток у женщин — к вирилизации, т. е. появлению мужских черт.
Андрогены надпочечника стимулируют окостенение эпифизарных хрящей, повышают синтез белка (анаболический эффект) в коже, мышечной и костной ткани являются предшественниками основного андрогена семенников — тестостерона и могут превращаться в него при метаболизме в тканях-мишенях способствуют развитию оволосения по мужскому типу, а их избыток у женщин — к вирилизации, т. е. появлению мужских черт.
 Кортикостероидная недостаточность Кортикостероидная недостаточность может быть тотальной, когда выпадает действие всех гормонов, и частичной — при выпадении активности одного из гормонов коры надпочечников. Тотальная кортикостероидная недостаточность в эксперименте вызывается адреналэктомией. После адреналэктомии животное неминуемо погибает при явлениях выраженной адинамии и гипотонии. Продолжительность жизни составляет от нескольких часов до нескольких суток. Если животное выживает, это свидетельствует о наличии дополнительной корковой ткани надпочечника. У людей острая тотальная недостаточность надпочечников может возникать при некоторых инфекционных болезнях. В связи с быстрым выпадением функции надпочечников развивается коллапс и больные могут умереть в течение первых же суток. Хроническая надпочечниковая недостаточность характерна для болезни Аддисона (аддисоновой или бронзовой болезни). В основе патофизиологических изменений, возникающих в результате прогрессирующей гибели ткани коры надпочечника, лежит комбинация недостаточности всех гормонов его коры. При этом наблюдаются: нарушения водного, минерального и углеводного обмена; расстройство функции сердечно-сосудистой системы; развитие адинамии (мышечная слабость); пигментация кожных покровов и слизистых оболочек, в связи с чем это заболевание называют еще бронзовой болезнью.
Кортикостероидная недостаточность Кортикостероидная недостаточность может быть тотальной, когда выпадает действие всех гормонов, и частичной — при выпадении активности одного из гормонов коры надпочечников. Тотальная кортикостероидная недостаточность в эксперименте вызывается адреналэктомией. После адреналэктомии животное неминуемо погибает при явлениях выраженной адинамии и гипотонии. Продолжительность жизни составляет от нескольких часов до нескольких суток. Если животное выживает, это свидетельствует о наличии дополнительной корковой ткани надпочечника. У людей острая тотальная недостаточность надпочечников может возникать при некоторых инфекционных болезнях. В связи с быстрым выпадением функции надпочечников развивается коллапс и больные могут умереть в течение первых же суток. Хроническая надпочечниковая недостаточность характерна для болезни Аддисона (аддисоновой или бронзовой болезни). В основе патофизиологических изменений, возникающих в результате прогрессирующей гибели ткани коры надпочечника, лежит комбинация недостаточности всех гормонов его коры. При этом наблюдаются: нарушения водного, минерального и углеводного обмена; расстройство функции сердечно-сосудистой системы; развитие адинамии (мышечная слабость); пигментация кожных покровов и слизистых оболочек, в связи с чем это заболевание называют еще бронзовой болезнью.
 Бронзовая болезнь - Синдром Аддисона - Хроническая недостаточность надпочечников Заболевание, связанное с двусторонним поражением коры надпочечников и характеризующееся адинамией, артериальной гипотонией и пигментацией. Встречается в любом возрасте, одинаково часто среди мужчин и женщин, у детей - реже. Причинами болезни могут быть кровоизлияния в надпочечники, тромбоз сосудов, сифилис, опухоли или метастазы рака в надпочечники, амилоидоз, гнойное воспаление, аутоиммунное поражение надпочечников, длительное применение кортикостероидов. Водный и минеральный обмен. В основе нарушения этого обмена лежит недостаток минералокортикоида альдостерона и в меньшей степени глюкокортикоидов — кортизола и кортикостерона. Нарушение минерального обмена сводится к перераспределению ионов натрия и калия между клетками тканей и внеклеточным депо. Натрий начинает переходить из внеклеточного депо внутрь клеток, а калий — наоборот. Вслед за натрием в клетки устремляется вода, что ведет к развитию водной интоксикации. Уменьшение количества воды в экстрацеллюлярном депо приводит к дегидратации организма и уменьшению объема крови. В канальцах почек снижается реабсорбция натрия и он теряется с мочой. Ионы калия, наоборот, реабсорбируются более интенсивно и К+ начинает накапливаться в организме. В связи со снижением кровяного давления падает фильтрационное давление в клубочках почек и в результате уменьшается образование первичной мочи. Одновременно увеличивается реабсорбция воды в канальцах. Это связано с нарастанием концентрации ионов калия, что повышает чувствительность канальцевого эпителия к АДГ. Таким образом, уменьшение фильтрации и усиление реаб-сорбции воды ведут к понижению суточного диуреза. Потеря натрия обусловливает уменьшение активности симпатических окончаний, что является одним из механизмов развития адинамии и гипотонии. Задержка калия приводит к снижению сократительной способности скелетной п сердечном мускулатуры и, следовательно, к брадикардии и аритмии. Углеводный обмен. Недостаток глюкокортикоидов вызывает гипогликемию в результате: а) снижения глюконеогенеза из белка за счет уменьшения активности некоторыз трансаминаз и активности "ключевого" фермента глюконеогенеза - фосфоэнолпируваткарбоксилазы; б) увеличечения активности инсулина, по отношению к которому глюкокортикоиды являются антагонистами; поэтому больные с недостаточностью надпочечников очень чувствительны к инсулину и введение обычных доз его всегда дает более выраженный эффект; в) уменьшения активации глюкозо-6 -фосфатазы, что ведет к менее интенсивному поступлению в кровь глюкозы из клеток печени; г) снижения всасывания глюкозы в кишечнике в связи с нарушением соотношения между ионами натрия и калия.
Бронзовая болезнь - Синдром Аддисона - Хроническая недостаточность надпочечников Заболевание, связанное с двусторонним поражением коры надпочечников и характеризующееся адинамией, артериальной гипотонией и пигментацией. Встречается в любом возрасте, одинаково часто среди мужчин и женщин, у детей - реже. Причинами болезни могут быть кровоизлияния в надпочечники, тромбоз сосудов, сифилис, опухоли или метастазы рака в надпочечники, амилоидоз, гнойное воспаление, аутоиммунное поражение надпочечников, длительное применение кортикостероидов. Водный и минеральный обмен. В основе нарушения этого обмена лежит недостаток минералокортикоида альдостерона и в меньшей степени глюкокортикоидов — кортизола и кортикостерона. Нарушение минерального обмена сводится к перераспределению ионов натрия и калия между клетками тканей и внеклеточным депо. Натрий начинает переходить из внеклеточного депо внутрь клеток, а калий — наоборот. Вслед за натрием в клетки устремляется вода, что ведет к развитию водной интоксикации. Уменьшение количества воды в экстрацеллюлярном депо приводит к дегидратации организма и уменьшению объема крови. В канальцах почек снижается реабсорбция натрия и он теряется с мочой. Ионы калия, наоборот, реабсорбируются более интенсивно и К+ начинает накапливаться в организме. В связи со снижением кровяного давления падает фильтрационное давление в клубочках почек и в результате уменьшается образование первичной мочи. Одновременно увеличивается реабсорбция воды в канальцах. Это связано с нарастанием концентрации ионов калия, что повышает чувствительность канальцевого эпителия к АДГ. Таким образом, уменьшение фильтрации и усиление реаб-сорбции воды ведут к понижению суточного диуреза. Потеря натрия обусловливает уменьшение активности симпатических окончаний, что является одним из механизмов развития адинамии и гипотонии. Задержка калия приводит к снижению сократительной способности скелетной п сердечном мускулатуры и, следовательно, к брадикардии и аритмии. Углеводный обмен. Недостаток глюкокортикоидов вызывает гипогликемию в результате: а) снижения глюконеогенеза из белка за счет уменьшения активности некоторыз трансаминаз и активности "ключевого" фермента глюконеогенеза - фосфоэнолпируваткарбоксилазы; б) увеличечения активности инсулина, по отношению к которому глюкокортикоиды являются антагонистами; поэтому больные с недостаточностью надпочечников очень чувствительны к инсулину и введение обычных доз его всегда дает более выраженный эффект; в) уменьшения активации глюкозо-6 -фосфатазы, что ведет к менее интенсивному поступлению в кровь глюкозы из клеток печени; г) снижения всасывания глюкозы в кишечнике в связи с нарушением соотношения между ионами натрия и калия.
 Сердечно-сосудистая система. Кортикостероидная недостаточность сопровождается снижением артериального давления. Это объясняется: а) уменьшением объема циркулирующей крови; б) брадикардией, являющейся одной из причин снижения минутного объема крови; в) снижением сосудистого тонуса, в основе которого лежит падение чувствительности сосудистой стенки к адреналину и норадреналину и снижение тонуса сосудодвигательного центра в связи с общим уменьшением катаболизма белка, в частности в центральной нервной системе, что приводит к менее интенсивному образованию аммиака, необходимого для поддержания нормального уровня возбудимости сосудодвигательного и дыхательного центров. Адинамия. В основе мышечной слабости, кроме указанного выше нарушения сократительных свойств мускулатуры, лежит и дефицит андростендиона (гормон, секретируемый сетчатой зоной коры надпочечников) в связи с выпадением его анаболического действия в отношении мышечных белков. Пигментация. При аддисоновой болезни возникает вследствие увеличения отложения меланина в коже и слизистых оболочках. В связи с уменьшением образования кортизола растормаживается секреция меланофорного гормона, что и приводит к усилению синтеза меланина. При недостатке кортизола по механизму обратной связи усиливается и секреция АКТГ, который имеет в своей молекуле участок с такой же последовательностью аминокислот, какая имеется в молекуле меланофорного гормона. Поэтому большие количества АКТГ также оказывают некоторое меланофорное влияние.
Сердечно-сосудистая система. Кортикостероидная недостаточность сопровождается снижением артериального давления. Это объясняется: а) уменьшением объема циркулирующей крови; б) брадикардией, являющейся одной из причин снижения минутного объема крови; в) снижением сосудистого тонуса, в основе которого лежит падение чувствительности сосудистой стенки к адреналину и норадреналину и снижение тонуса сосудодвигательного центра в связи с общим уменьшением катаболизма белка, в частности в центральной нервной системе, что приводит к менее интенсивному образованию аммиака, необходимого для поддержания нормального уровня возбудимости сосудодвигательного и дыхательного центров. Адинамия. В основе мышечной слабости, кроме указанного выше нарушения сократительных свойств мускулатуры, лежит и дефицит андростендиона (гормон, секретируемый сетчатой зоной коры надпочечников) в связи с выпадением его анаболического действия в отношении мышечных белков. Пигментация. При аддисоновой болезни возникает вследствие увеличения отложения меланина в коже и слизистых оболочках. В связи с уменьшением образования кортизола растормаживается секреция меланофорного гормона, что и приводит к усилению синтеза меланина. При недостатке кортизола по механизму обратной связи усиливается и секреция АКТГ, который имеет в своей молекуле участок с такой же последовательностью аминокислот, какая имеется в молекуле меланофорного гормона. Поэтому большие количества АКТГ также оказывают некоторое меланофорное влияние.
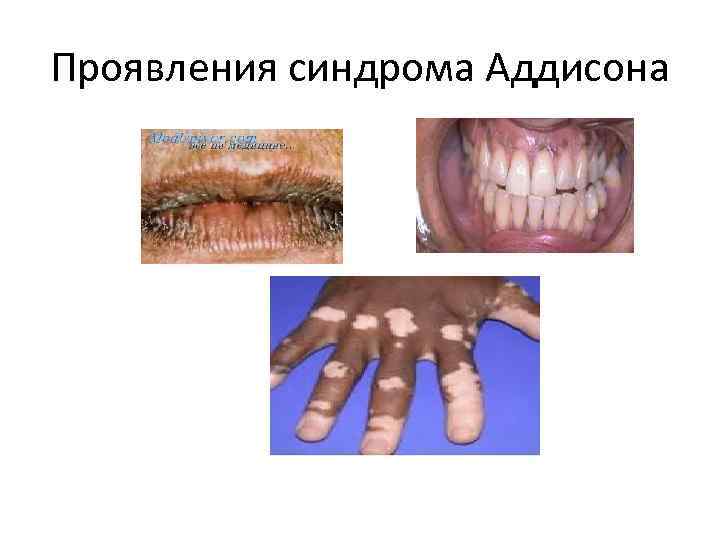 Проявления синдрома Аддисона
Проявления синдрома Аддисона
 Гипоальдостерони зм- это состояние, при котором кора надпочечников секретирует меньше альдостерона, чем требуется в норме. Может быть первичным и вторичным. Дефицит альдостерона, связанный с гипофункцией надпочечников, наблюдается при аддисоновой болезни, синдроме Уотерхауза-Фридериксена и врожденной недостаточности ферментов, участвующих в биосинтезе стероидов. Вторичный гипоальдостеронизм может быть следствием угнетения системы ренин-ангиотензин, дефицита АКТГ, злоупотребления минералокортикоидными препаратами или лакрицей. При недостатке альдостерона организм непрерывно теряет натрий, в связи с чем уменьшается объём внеклеточной жидкости, а это приводит к утомляемости, головным болям, гипотонии и тахикардии. Одновременная задержка K+ и H+ вызывает гиперкалиемию и ацидоз, проявляющиеся в виде соответственно сердечной аритмии и мышечных спазмов, гипервентиляции и помутнения сознания
Гипоальдостерони зм- это состояние, при котором кора надпочечников секретирует меньше альдостерона, чем требуется в норме. Может быть первичным и вторичным. Дефицит альдостерона, связанный с гипофункцией надпочечников, наблюдается при аддисоновой болезни, синдроме Уотерхауза-Фридериксена и врожденной недостаточности ферментов, участвующих в биосинтезе стероидов. Вторичный гипоальдостеронизм может быть следствием угнетения системы ренин-ангиотензин, дефицита АКТГ, злоупотребления минералокортикоидными препаратами или лакрицей. При недостатке альдостерона организм непрерывно теряет натрий, в связи с чем уменьшается объём внеклеточной жидкости, а это приводит к утомляемости, головным болям, гипотонии и тахикардии. Одновременная задержка K+ и H+ вызывает гиперкалиемию и ацидоз, проявляющиеся в виде соответственно сердечной аритмии и мышечных спазмов, гипервентиляции и помутнения сознания
 Синдром Уотерхауса — Фридериксена (острая Недостаточность коры надпочечников) наблюдается при «молниеносных» формах менингококкемии, когда очень быстрое развитие клинической картины менингококкового менингита сочетается с коллапсом. Клинически проявляется резким снижением артериального давления (особенно диастолического), «нитевидным» пульсом, тахикардией, угнетением дыхания, цианозом. Имеет место олигурия или анурия. Могут возникать геморрагические высыпания на коже. Сознание изменено, наблюдается оглушение или возбуждение. Однако даже при катастрофически низких цифрах артериального давления редко наблюдается кома. Относительно причин развития синдрома Уотерхауса — Фридериксена является непосредственным следствием быстро развивающихся кровоизлияний в кору надпочечников, но, очевидно, более обоснованно считать его причиной токсическое воздействие менингококков на свертывающую систему крови в целом. Для купирования синдрома Уотерхауса — Фридериксена требуется экстренная комплексная терапия, в которой кортикостероиды занимают ведущее место. Ввиду угнетения основных функций надпочечников в наиболее тяжелых случаях показано сочетание глюкокортикоидов и минералокортикоидов.
Синдром Уотерхауса — Фридериксена (острая Недостаточность коры надпочечников) наблюдается при «молниеносных» формах менингококкемии, когда очень быстрое развитие клинической картины менингококкового менингита сочетается с коллапсом. Клинически проявляется резким снижением артериального давления (особенно диастолического), «нитевидным» пульсом, тахикардией, угнетением дыхания, цианозом. Имеет место олигурия или анурия. Могут возникать геморрагические высыпания на коже. Сознание изменено, наблюдается оглушение или возбуждение. Однако даже при катастрофически низких цифрах артериального давления редко наблюдается кома. Относительно причин развития синдрома Уотерхауса — Фридериксена является непосредственным следствием быстро развивающихся кровоизлияний в кору надпочечников, но, очевидно, более обоснованно считать его причиной токсическое воздействие менингококков на свертывающую систему крови в целом. Для купирования синдрома Уотерхауса — Фридериксена требуется экстренная комплексная терапия, в которой кортикостероиды занимают ведущее место. Ввиду угнетения основных функций надпочечников в наиболее тяжелых случаях показано сочетание глюкокортикоидов и минералокортикоидов.
 Гиперкортикостероидизм Гиперкортикостероидизмом называются такие изменения в организме, которые соответствуют усилению функции коры надпочечников. Гиперкортикостероидизм может развиваться за счет избыточного образования (или повышения активности) одного или сразу нескольких гормонов. Наиболее часто встречаются следующие виды гиперкортикостероидизма: гиперкортизолизм, альдостеронизм и адреногенитальный синдромы.
Гиперкортикостероидизм Гиперкортикостероидизмом называются такие изменения в организме, которые соответствуют усилению функции коры надпочечников. Гиперкортикостероидизм может развиваться за счет избыточного образования (или повышения активности) одного или сразу нескольких гормонов. Наиболее часто встречаются следующие виды гиперкортикостероидизма: гиперкортизолизм, альдостеронизм и адреногенитальный синдромы.
 Альдостеронизм. Различают первичный и вторичный альдостеронизм. Первичный альдостеронизм чаще всего сопровождается гормонально-активной аденомой клубочковой зоны, секретирующей избыточное количество альдостерона. Это приводит к усилению реабсорбции натрия в канальцах почек. Натрий задерживается в организме. Его концентрация в экстрацеллюлярных депо в большинстве случаев увеличивается. Одновременно в почках в связи с усилением реабсорбции натрия конкурентно тормозится реабсорбция калия, что ведет к значительной потере калия из клеток организма. Эта потеря компенсируется вхождением в клетки ионов натрия и водорода.
Альдостеронизм. Различают первичный и вторичный альдостеронизм. Первичный альдостеронизм чаще всего сопровождается гормонально-активной аденомой клубочковой зоны, секретирующей избыточное количество альдостерона. Это приводит к усилению реабсорбции натрия в канальцах почек. Натрий задерживается в организме. Его концентрация в экстрацеллюлярных депо в большинстве случаев увеличивается. Одновременно в почках в связи с усилением реабсорбции натрия конкурентно тормозится реабсорбция калия, что ведет к значительной потере калия из клеток организма. Эта потеря компенсируется вхождением в клетки ионов натрия и водорода.
 СИНДРОМ КОННА - первичный альдостеронизм. Этиология. Чаще аденома надпочечников (60%), которая выявляется у 2% больных с артериальной гипертензией. Двусторонняя макро- и микроузелковая гиперплазия наблюдается реже (30 - 40%). Рак надпочечника - у 0, 7 - 1, 2% Этиопатогенез. Альдостерон увеличивает реабсорбцию натрия и экскрецию калия и ионов водорода в дистальных почечных канальцах. Он наиболее мощный из надпочечниковых минералкортикоидов. Баланс натрия восстанавливается после накопления 1 -2 литров жидкости, ведет к артериальной гипертензии. Потеря калия ввызывает мышечную слабость, парэстезии и тетании. Гипокалиемическая нефропатия может вызвать полиурию. Клиника. Внешне больные не изменены. Результатом дефицита калия или вторичных почечных нарушений являются полиурия, никтурия и полидипсия, а также неврологические симптомы (периодические эпизоды мышечной слабости или параличи, спонтанные судороги). Склонность к инсультам. Диагностика. Ключ - гипокалиемия. На диагноз нацеливает щелочная моча при артериальной гипертензии. Гипокалиемия, гиперальдостеронемия, гипоренинемия более выражены при односторонней аденоме, чем при гиперплазии. Помогает сравнение содержания альдостерона в крови из обоих вен надпочечников. Обязательно УЗИ, КТ, МРТ. При этом важно оценивать состояние (атрофия или гиперплазия) второго надпочечника. Дифференциальный диагноз от вторичного альдостеронизма - повышения продукции альдостерона, вызванной стимулами, исходящими не из надпочечника. В таких случаях гиперальдостеронизм возникает в результате увеличения секреции ренина и повышения активности плазменного ренина. Причины: - уменьшение массы циркулирующей крови в результате обезвоживания и кровопотери; - внесосудистая потеря карбонатов и воды при сердечной патологии и отеках, циррозе печени и асците, нефротическом синдроме, сольтеряющем нефрите; - сдавление почечных сосудов при злокачественной гипертензии, фибромускулярной гиперплазии, атеросклерозе сосудов; - ятрогенная патология, связанная с диуретиками, оральными контрацептивами и др. ; - гиперплазия юкстагломерулярного аппарата (синдром Бартера) или ренин-секретирующне опухоли почек. Ключ дифференцирования - активность ренина плазмы, высокая активность которого сопровождает высокий уровень альдостерона при вторичном процессе. При первичном альдостеронизме активность ренина снижена.
СИНДРОМ КОННА - первичный альдостеронизм. Этиология. Чаще аденома надпочечников (60%), которая выявляется у 2% больных с артериальной гипертензией. Двусторонняя макро- и микроузелковая гиперплазия наблюдается реже (30 - 40%). Рак надпочечника - у 0, 7 - 1, 2% Этиопатогенез. Альдостерон увеличивает реабсорбцию натрия и экскрецию калия и ионов водорода в дистальных почечных канальцах. Он наиболее мощный из надпочечниковых минералкортикоидов. Баланс натрия восстанавливается после накопления 1 -2 литров жидкости, ведет к артериальной гипертензии. Потеря калия ввызывает мышечную слабость, парэстезии и тетании. Гипокалиемическая нефропатия может вызвать полиурию. Клиника. Внешне больные не изменены. Результатом дефицита калия или вторичных почечных нарушений являются полиурия, никтурия и полидипсия, а также неврологические симптомы (периодические эпизоды мышечной слабости или параличи, спонтанные судороги). Склонность к инсультам. Диагностика. Ключ - гипокалиемия. На диагноз нацеливает щелочная моча при артериальной гипертензии. Гипокалиемия, гиперальдостеронемия, гипоренинемия более выражены при односторонней аденоме, чем при гиперплазии. Помогает сравнение содержания альдостерона в крови из обоих вен надпочечников. Обязательно УЗИ, КТ, МРТ. При этом важно оценивать состояние (атрофия или гиперплазия) второго надпочечника. Дифференциальный диагноз от вторичного альдостеронизма - повышения продукции альдостерона, вызванной стимулами, исходящими не из надпочечника. В таких случаях гиперальдостеронизм возникает в результате увеличения секреции ренина и повышения активности плазменного ренина. Причины: - уменьшение массы циркулирующей крови в результате обезвоживания и кровопотери; - внесосудистая потеря карбонатов и воды при сердечной патологии и отеках, циррозе печени и асците, нефротическом синдроме, сольтеряющем нефрите; - сдавление почечных сосудов при злокачественной гипертензии, фибромускулярной гиперплазии, атеросклерозе сосудов; - ятрогенная патология, связанная с диуретиками, оральными контрацептивами и др. ; - гиперплазия юкстагломерулярного аппарата (синдром Бартера) или ренин-секретирующне опухоли почек. Ключ дифференцирования - активность ренина плазмы, высокая активность которого сопровождает высокий уровень альдостерона при вторичном процессе. При первичном альдостеронизме активность ренина снижена.
 Проявления альдостеронизма заключаются в следующем: 1) повышение артериального давления в связи с повышением тонуса артериол; это вызвано увеличением концентрации ионов натрия в клетках, что усиливает реакцию клеток на симпатические импульсы и потенцирует действие норадреналина; 2) развитие мышечной слабости и временных параличей в связи с потерей калия; снижается сократимость мышц и возникают парезы и параличи, которые могут длиться на протяжении многих суток; 3) полиурия в связи со снижением концентрации калия в клетках, что уменьшает реакцию канальцевого эпителия почек на АДГ. Возможно, полиурия является одной из причин того, что при первичном альдостеронизме, несмотря на задержку натрия, не бывает отеков в отличие от вторичного альдостеронизма. Определенную роль играет и отсутствие застоя в венозной системе; 4) гипокалиемический алкалоз; потеря ионов хлора (вместе с ионами калия) ведет к снижению их уровня в крови и компенсаторному увеличению в экстрацеллюлярном депо бикарбонатов (связывание избытка натрия); алкалоз может стать некомпенсированным и привести к развитию тетании; 5) уменьшение в плазме крови концентрации ренина и ангиотензина II; это связано с гиперволемией, которая тормозит секрецию ренина. Вторичный альдостеронизм развивается на фоне первичных процессов, протекающих вне надпочечников. К этим процессам относятся недостаточность правого сердца, циррозы печени, злокачественная гипертония
Проявления альдостеронизма заключаются в следующем: 1) повышение артериального давления в связи с повышением тонуса артериол; это вызвано увеличением концентрации ионов натрия в клетках, что усиливает реакцию клеток на симпатические импульсы и потенцирует действие норадреналина; 2) развитие мышечной слабости и временных параличей в связи с потерей калия; снижается сократимость мышц и возникают парезы и параличи, которые могут длиться на протяжении многих суток; 3) полиурия в связи со снижением концентрации калия в клетках, что уменьшает реакцию канальцевого эпителия почек на АДГ. Возможно, полиурия является одной из причин того, что при первичном альдостеронизме, несмотря на задержку натрия, не бывает отеков в отличие от вторичного альдостеронизма. Определенную роль играет и отсутствие застоя в венозной системе; 4) гипокалиемический алкалоз; потеря ионов хлора (вместе с ионами калия) ведет к снижению их уровня в крови и компенсаторному увеличению в экстрацеллюлярном депо бикарбонатов (связывание избытка натрия); алкалоз может стать некомпенсированным и привести к развитию тетании; 5) уменьшение в плазме крови концентрации ренина и ангиотензина II; это связано с гиперволемией, которая тормозит секрецию ренина. Вторичный альдостеронизм развивается на фоне первичных процессов, протекающих вне надпочечников. К этим процессам относятся недостаточность правого сердца, циррозы печени, злокачественная гипертония
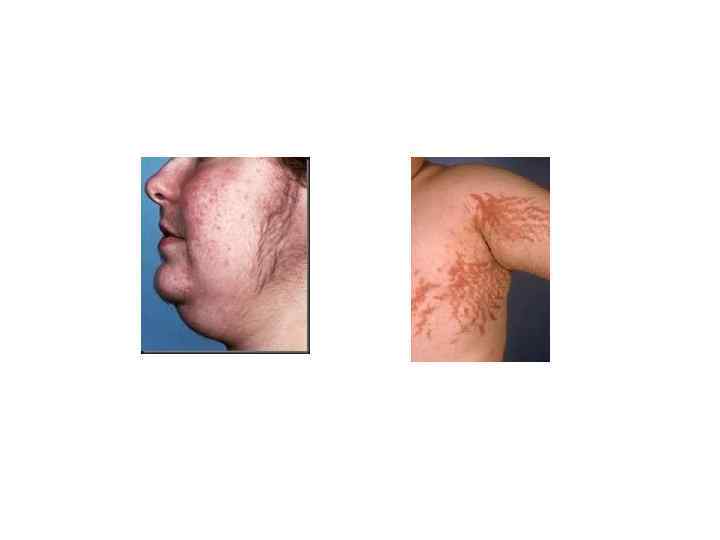
 Гиперкортизолизм — это комплекс таких изменений в организме, которые вызываются либо избыточным образованием кортизола в пучковой зоне коры надпочечников, либо повышением активности кортизола за счет уменьшения связывания его транскортином. Как указывалось выше, избыточное образование возможно при опухоли пучковой зоны одного из надпочечников. Возможно также снижение чувствительности гипоталамуса к кортизолу. В этом случае усиливаются образование кортикотропиносвобождающего фактора и, следовательно, секреция АКТГ. Возникающие при этом изменения составляют картину синдрома Иценко — Кушинга. Он характеризуется нарушениями углеводного, белкового, жирового, водносолевого обмена и функции сердечно-сосудистой системы. У больных на коже боковой поверхнос: бедрах, груди появляются полосы с фиолетовым оттенком, полосы растяжения беременных. Характерно отложение жира туловища и лица ( «лунообразное» лицо).
Гиперкортизолизм — это комплекс таких изменений в организме, которые вызываются либо избыточным образованием кортизола в пучковой зоне коры надпочечников, либо повышением активности кортизола за счет уменьшения связывания его транскортином. Как указывалось выше, избыточное образование возможно при опухоли пучковой зоны одного из надпочечников. Возможно также снижение чувствительности гипоталамуса к кортизолу. В этом случае усиливаются образование кортикотропиносвобождающего фактора и, следовательно, секреция АКТГ. Возникающие при этом изменения составляют картину синдрома Иценко — Кушинга. Он характеризуется нарушениями углеводного, белкового, жирового, водносолевого обмена и функции сердечно-сосудистой системы. У больных на коже боковой поверхнос: бедрах, груди появляются полосы с фиолетовым оттенком, полосы растяжения беременных. Характерно отложение жира туловища и лица ( «лунообразное» лицо).
 Углеводный обмен. Гиперкортизолизм приводит к развитию гипергликемии за счет: а) усиления глюконеогенеза из глюкогенных аминокислот; б) торможения перехода глюкозы в жир; в) торможения декарбоксилирования пирувата, что увеличивает способность пирувата ресинтезироваться в глюкозу; г) повышения активности глюкозо-6 -фосфафатазы в печени, что способствует переходу глюкозы в кровь. Одновременно в связи с усиленным образованием глюкозы увеличивает образование в печени гликогена. В свою очередь гипергликемия усиливает образование инсулина островковым аппаратом поджелудочной железы в случаях функциональной неполноценности инсулярного аппарота его гиперфункция сменяется истощением и развитием сахарного диабета (так называемый стероидный диабет). Белковый обмен. Усиливается катаболизм белков и тормозится их синтез преимущественно в мышцах и мезенхимальных элементах что выражается в повышении выделения азота с мочой. Результатом этого является также торможение синтеза антител и понижение резистентности к инфекциям. В костной ткани в связи с нарушением образования белкового каркаса тормозится отложение солей кальция, что является одной из причин развития остеопороза. Жировой обмен. Избыточное отложение жира вызвано: а) гипергликемией, которая активирует синтез триглицеридов и уменьшает катаболизм в жировой ткани; б) уменьшением окисления жирных кислот в печени в связи с увеличением в ней гликогена, что тормозит действие СТГ, активирующее окисление жира. Водно-солевой обмен. В связи с некоторыми минералокортикоидными свойствами кортизола и кортнкостерона отмечаются изменнения электролитного и водного обмена. В канальцах почек усиливается реабсорбция ионов натрия, что ведет к задержке этих ионов в организме и некоторому увеличению их концентрации в экстрацеллюлярной жидкости. Одновременно уменьшается реабсорбция ионов калия в почках, вызывающая некоторую потерю калия из организма. В связи с этими изменениями повышается содержание воды в экстрацеллюлярном депо и увеличивается объем крови. Нарушается и обмен кальция. Тормозится его всасывание в кишечнике и усиливается экскреция с мочой. Это ведет ко вторичному гиперпаратиреоидизму. Усиление секреции паратгормона активирует в кости переход стволовых костных клеток в остеокласты и тормозит превращение последних в остеобласты. Последний эффект паратгормона синергичен с действием кортизола. Он также тормозит превращение остеокластов в остеобласты. В результате увеличивается количество остеокластов и как следствие — резорбция костной ткани и развитие остеопороза. Сердечно-сосудистая система. Гиперкортизолизм приводит к повышению кровяного давления в результате: а) увеличение объема крови; б) повышения чувствительности сосудистой стенки к адреналину и норадреналину за счет как увеличения содержания натрия, так и пермиссивной (т. е. облегчающей действие других гормонов) активности глюкокортикоидов; в) усиления процесса возбуждения в центральной нервной системе, по-видимому, вследствие повышения концентрации аммиака в головном мозге. Это ведет к усилению тонуса сосудодвигательного центра. Таким образом, кровяное давление повышается в связи с действием различных механизмов. Однако однократное внутивенное введение глюкокортикоидов в эксперименте всегда вызывает снижение кровяного давления; очевидно, только неоднократное их введение включает механизмы, приводящие к его повышению. В связи с повышением кровяного давления увеличивается фильтрация в клубочках почек и одновременно тормозится реабсорбция воды за счет блокады действия АДГ, что ведет к повышению диуреза. Кортизол активирует развитие эритроцитов и нейтрофилов, но тормозит развитие лимфоцитов и эозинофилов и усиливает их распад.
Углеводный обмен. Гиперкортизолизм приводит к развитию гипергликемии за счет: а) усиления глюконеогенеза из глюкогенных аминокислот; б) торможения перехода глюкозы в жир; в) торможения декарбоксилирования пирувата, что увеличивает способность пирувата ресинтезироваться в глюкозу; г) повышения активности глюкозо-6 -фосфафатазы в печени, что способствует переходу глюкозы в кровь. Одновременно в связи с усиленным образованием глюкозы увеличивает образование в печени гликогена. В свою очередь гипергликемия усиливает образование инсулина островковым аппаратом поджелудочной железы в случаях функциональной неполноценности инсулярного аппарота его гиперфункция сменяется истощением и развитием сахарного диабета (так называемый стероидный диабет). Белковый обмен. Усиливается катаболизм белков и тормозится их синтез преимущественно в мышцах и мезенхимальных элементах что выражается в повышении выделения азота с мочой. Результатом этого является также торможение синтеза антител и понижение резистентности к инфекциям. В костной ткани в связи с нарушением образования белкового каркаса тормозится отложение солей кальция, что является одной из причин развития остеопороза. Жировой обмен. Избыточное отложение жира вызвано: а) гипергликемией, которая активирует синтез триглицеридов и уменьшает катаболизм в жировой ткани; б) уменьшением окисления жирных кислот в печени в связи с увеличением в ней гликогена, что тормозит действие СТГ, активирующее окисление жира. Водно-солевой обмен. В связи с некоторыми минералокортикоидными свойствами кортизола и кортнкостерона отмечаются изменнения электролитного и водного обмена. В канальцах почек усиливается реабсорбция ионов натрия, что ведет к задержке этих ионов в организме и некоторому увеличению их концентрации в экстрацеллюлярной жидкости. Одновременно уменьшается реабсорбция ионов калия в почках, вызывающая некоторую потерю калия из организма. В связи с этими изменениями повышается содержание воды в экстрацеллюлярном депо и увеличивается объем крови. Нарушается и обмен кальция. Тормозится его всасывание в кишечнике и усиливается экскреция с мочой. Это ведет ко вторичному гиперпаратиреоидизму. Усиление секреции паратгормона активирует в кости переход стволовых костных клеток в остеокласты и тормозит превращение последних в остеобласты. Последний эффект паратгормона синергичен с действием кортизола. Он также тормозит превращение остеокластов в остеобласты. В результате увеличивается количество остеокластов и как следствие — резорбция костной ткани и развитие остеопороза. Сердечно-сосудистая система. Гиперкортизолизм приводит к повышению кровяного давления в результате: а) увеличение объема крови; б) повышения чувствительности сосудистой стенки к адреналину и норадреналину за счет как увеличения содержания натрия, так и пермиссивной (т. е. облегчающей действие других гормонов) активности глюкокортикоидов; в) усиления процесса возбуждения в центральной нервной системе, по-видимому, вследствие повышения концентрации аммиака в головном мозге. Это ведет к усилению тонуса сосудодвигательного центра. Таким образом, кровяное давление повышается в связи с действием различных механизмов. Однако однократное внутивенное введение глюкокортикоидов в эксперименте всегда вызывает снижение кровяного давления; очевидно, только неоднократное их введение включает механизмы, приводящие к его повышению. В связи с повышением кровяного давления увеличивается фильтрация в клубочках почек и одновременно тормозится реабсорбция воды за счет блокады действия АДГ, что ведет к повышению диуреза. Кортизол активирует развитие эритроцитов и нейтрофилов, но тормозит развитие лимфоцитов и эозинофилов и усиливает их распад.
 СИНДРОМ КУШИНГА Клиника. Туловищное (центральное) ожирение: избирательное ожирение на лице (лунообразное), шее в области 7 -го шейного позвонка (бизоний горб), молочных желез и туловища (надключичные жировые подушки) при тонких конечностях. Артериальная гипертензия (возникает в результате сосудистых эффектов кортизола). Вторичный сахарный диабет у 20% (повышенный глюконеогенез в печени и снижение утилизации глюкозы). Олигоменорея, гирсутизм, акне за счет гиперпродукции андрогенов надпочечниками. Стрии (полосы различной длины и окраски) живота, подмышечные областей, плечевого пояса, бедер, ягодиц. Основные симптомы: гипертензия, ожирение по мужскому типу, лунообразное лицо, нарушение метаболизма глюкозы, атрофия и мышечная слабость, аменорея, гирсутизм, остеопороз, психические (чаще депрессивные) нарушения. При развёрнутой клинической картине присутствуют головная боль, мышечная слабость, диспластический тип ожирения, гипотрофия с истончением конечностей, фурункулёз, резистентная к лечению артериальная гипертензия, недостаточность кровообращения, патологические переломы из-за остеопороза. У женщин - гирсутизм, дис-, аменорея. У мужчин - снижение потенции. Частые синяки за счет повышенной ломкости капилляров. Клиника может быть обусловлена одной из следующих ситуаций, требующей диагностической интерпретации (УЗИ, КТ, ЯМР). Синдром И-К, обусловленный аденомой надпочечника. Синдром И-К, обусловленный злокачественной кортикостеромой. Синдром И-К, обусловленный микро- и макроузелковой гиперплазией коры различного генеза (кортикотропин-независимый синдром Кушинга).
СИНДРОМ КУШИНГА Клиника. Туловищное (центральное) ожирение: избирательное ожирение на лице (лунообразное), шее в области 7 -го шейного позвонка (бизоний горб), молочных желез и туловища (надключичные жировые подушки) при тонких конечностях. Артериальная гипертензия (возникает в результате сосудистых эффектов кортизола). Вторичный сахарный диабет у 20% (повышенный глюконеогенез в печени и снижение утилизации глюкозы). Олигоменорея, гирсутизм, акне за счет гиперпродукции андрогенов надпочечниками. Стрии (полосы различной длины и окраски) живота, подмышечные областей, плечевого пояса, бедер, ягодиц. Основные симптомы: гипертензия, ожирение по мужскому типу, лунообразное лицо, нарушение метаболизма глюкозы, атрофия и мышечная слабость, аменорея, гирсутизм, остеопороз, психические (чаще депрессивные) нарушения. При развёрнутой клинической картине присутствуют головная боль, мышечная слабость, диспластический тип ожирения, гипотрофия с истончением конечностей, фурункулёз, резистентная к лечению артериальная гипертензия, недостаточность кровообращения, патологические переломы из-за остеопороза. У женщин - гирсутизм, дис-, аменорея. У мужчин - снижение потенции. Частые синяки за счет повышенной ломкости капилляров. Клиника может быть обусловлена одной из следующих ситуаций, требующей диагностической интерпретации (УЗИ, КТ, ЯМР). Синдром И-К, обусловленный аденомой надпочечника. Синдром И-К, обусловленный злокачественной кортикостеромой. Синдром И-К, обусловленный микро- и макроузелковой гиперплазией коры различного генеза (кортикотропин-независимый синдром Кушинга).
 Дифференциальную диагностику синдрома Кушинга при поражении собственно коры надпочечников нужно проводить с состояниями, при которых гиперсекреция глюкокортикоидов связана с другими причинами. При этом возможны два варианта. Вторичный гиперкортицизм - избыток секреции АКТГ (гипофизарная болезнь Кушинга) обусловленный: кортикотропинпродуцирующей базофильной или хромофобной аденомой гипофиза; гиперсекрецией кортикотропин-рилизинг-гормона (CRG). Паранеопластический синдром Кушинга - эктопическая секреция АКТГ (мелкоклеточный рак легких, корциноидная опухоль бронхов, корциноидная опухоль тимуса, панкреатические эндокринные опухоли, медуллярный рак щитовидной железы, феохромоцитома.
Дифференциальную диагностику синдрома Кушинга при поражении собственно коры надпочечников нужно проводить с состояниями, при которых гиперсекреция глюкокортикоидов связана с другими причинами. При этом возможны два варианта. Вторичный гиперкортицизм - избыток секреции АКТГ (гипофизарная болезнь Кушинга) обусловленный: кортикотропинпродуцирующей базофильной или хромофобной аденомой гипофиза; гиперсекрецией кортикотропин-рилизинг-гормона (CRG). Паранеопластический синдром Кушинга - эктопическая секреция АКТГ (мелкоклеточный рак легких, корциноидная опухоль бронхов, корциноидная опухоль тимуса, панкреатические эндокринные опухоли, медуллярный рак щитовидной железы, феохромоцитома.
 Адреногенитальные синдромы — это такие изменения в организме, которые развиваются при избыточной секреции андрогенов или эстрогенов сетчатой зоной коры надпочечников. Характер изменения зависит в значительной степени от пола, возраста больного и вида секретируемых гормонов. Различают два основных адреногенитальных синдрома: 1) гетеросексуальный — избыточное образование у данного пола половых гормонов противоположного пола; 2) изосексуальный — раннее или избыточное образование половых гормонов, присущих данному полу. Избыточное образование андростендиона и адреностерона. Эти гормоны близки но своему биологическому действию к мужскому половому гормону. Их образование нарушается чаще всего и связано либо с опухолью сетчатой зоны, либо с ее гиперплазией. Образовавшиеся гормоны по механизму обратной связи тормозят образование гонадотропных гормонов, что приводит к атрофии половых желез. У женщин под влиянием этих гормонов атрофируются женские первичные и вторичные половые признаки и развиваются мужские вторичные половые признаки (маскулинизация), в частности рост волос по мужскому типу (вирилизм). В связи с анаболическим действием мужских гормонов на белковый обмен происходит усиленное развитие мускулатуры и женщина приобретает мужское телосложение. Соответствующим образом меняется и психика больных. У мужчин больше выявляется анаболический эффект, а у мальчиков — преждевременное половое и физическое развитие. Избыточное образование эстрогенов. Реже опухоль сетчатой зоны продуцирует эстрогены. У девочек это вызывает преждевременное половое и физическое развитие. У мужчин развивается феминизация, в процессе которой исчезают мужские вторичные половые признаки и появляются женские. Меняются телосложение, голос, отложение жировой ткани, усиливается оволосение по женскому типу (гисутизм).
Адреногенитальные синдромы — это такие изменения в организме, которые развиваются при избыточной секреции андрогенов или эстрогенов сетчатой зоной коры надпочечников. Характер изменения зависит в значительной степени от пола, возраста больного и вида секретируемых гормонов. Различают два основных адреногенитальных синдрома: 1) гетеросексуальный — избыточное образование у данного пола половых гормонов противоположного пола; 2) изосексуальный — раннее или избыточное образование половых гормонов, присущих данному полу. Избыточное образование андростендиона и адреностерона. Эти гормоны близки но своему биологическому действию к мужскому половому гормону. Их образование нарушается чаще всего и связано либо с опухолью сетчатой зоны, либо с ее гиперплазией. Образовавшиеся гормоны по механизму обратной связи тормозят образование гонадотропных гормонов, что приводит к атрофии половых желез. У женщин под влиянием этих гормонов атрофируются женские первичные и вторичные половые признаки и развиваются мужские вторичные половые признаки (маскулинизация), в частности рост волос по мужскому типу (вирилизм). В связи с анаболическим действием мужских гормонов на белковый обмен происходит усиленное развитие мускулатуры и женщина приобретает мужское телосложение. Соответствующим образом меняется и психика больных. У мужчин больше выявляется анаболический эффект, а у мальчиков — преждевременное половое и физическое развитие. Избыточное образование эстрогенов. Реже опухоль сетчатой зоны продуцирует эстрогены. У девочек это вызывает преждевременное половое и физическое развитие. У мужчин развивается феминизация, в процессе которой исчезают мужские вторичные половые признаки и появляются женские. Меняются телосложение, голос, отложение жировой ткани, усиливается оволосение по женскому типу (гисутизм).


