лекция 3 парафины.pptx
- Количество слайдов: 28
 Парафиновые углеводороды как сырье для органического синтеза. Низкомолекулярные и высокомолекулярные парафины, синтезы на их основе Лекция 3 Лектор: доцент каф. НХТ, к. х. н. Ольга Владимировна Давыдова
Парафиновые углеводороды как сырье для органического синтеза. Низкомолекулярные и высокомолекулярные парафины, синтезы на их основе Лекция 3 Лектор: доцент каф. НХТ, к. х. н. Ольга Владимировна Давыдова
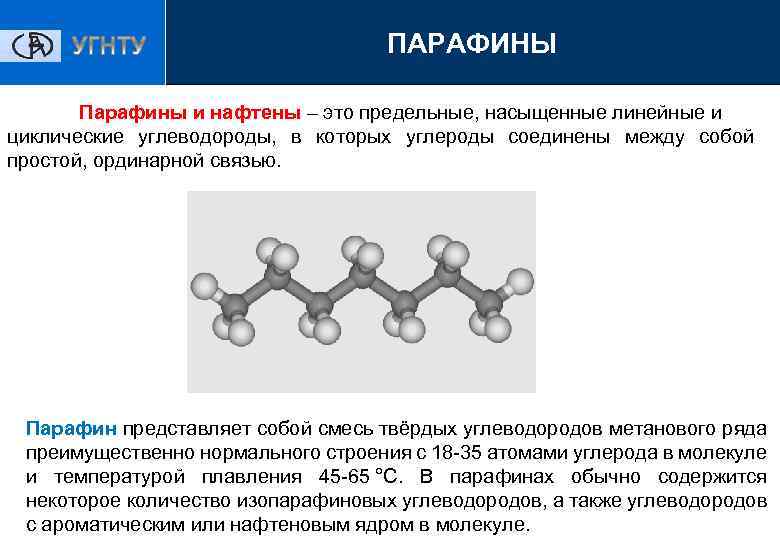 ПАРАФИНЫ Парафины и нафтены – это предельные, насыщенные линейные и циклические углеводороды, в которых углероды соединены между собой простой, ординарной связью. Парафин представляет собой смесь твёрдых углеводородов метанового ряда преимущественно нормального строения с 18 -35 атомами углерода в молекуле и температурой плавления 45 -65 °C. В парафинах обычно содержится некоторое количество изопарафиновых углеводородов, а также углеводородов с ароматическим или нафтеновым ядром в молекуле.
ПАРАФИНЫ Парафины и нафтены – это предельные, насыщенные линейные и циклические углеводороды, в которых углероды соединены между собой простой, ординарной связью. Парафин представляет собой смесь твёрдых углеводородов метанового ряда преимущественно нормального строения с 18 -35 атомами углерода в молекуле и температурой плавления 45 -65 °C. В парафинах обычно содержится некоторое количество изопарафиновых углеводородов, а также углеводородов с ароматическим или нафтеновым ядром в молекуле.
 НИЗШИЕ ПАРАФИНЫ (С 1 -С 5) От CH 4 до C 4 H 10 – газы, C 5 H 12 – низкокипящая жидкость. v Метан CH 4 – трудно сжижаемый газ, остальные газообразные парафины конденсируются уже при охлаждении водой под давлением. v Плохо растворяются в воде и полярных жидкостях (низшие спирты, эфиры, кетоны) v Поглощаются другими углеводородами и твёрдыми адсорбентами (активированный уголь). Способность сорбироваться возрастает с увеличением молекулярной массы, что используют для разделения С 3, С 4, С 1 и С 2 абсорбцией и адсорбцией. v Низшие парафины – пожаро- и взрывоопасны. Токсичность по сравнению с другими углеводородами не очень высока, но могут развиваться наркотические явления. v В качестве сырья для органического синтеза преимущественно используют метан, н- и изобутан, изопентан, реже этан и особенно пропан.
НИЗШИЕ ПАРАФИНЫ (С 1 -С 5) От CH 4 до C 4 H 10 – газы, C 5 H 12 – низкокипящая жидкость. v Метан CH 4 – трудно сжижаемый газ, остальные газообразные парафины конденсируются уже при охлаждении водой под давлением. v Плохо растворяются в воде и полярных жидкостях (низшие спирты, эфиры, кетоны) v Поглощаются другими углеводородами и твёрдыми адсорбентами (активированный уголь). Способность сорбироваться возрастает с увеличением молекулярной массы, что используют для разделения С 3, С 4, С 1 и С 2 абсорбцией и адсорбцией. v Низшие парафины – пожаро- и взрывоопасны. Токсичность по сравнению с другими углеводородами не очень высока, но могут развиваться наркотические явления. v В качестве сырья для органического синтеза преимущественно используют метан, н- и изобутан, изопентан, реже этан и особенно пропан.
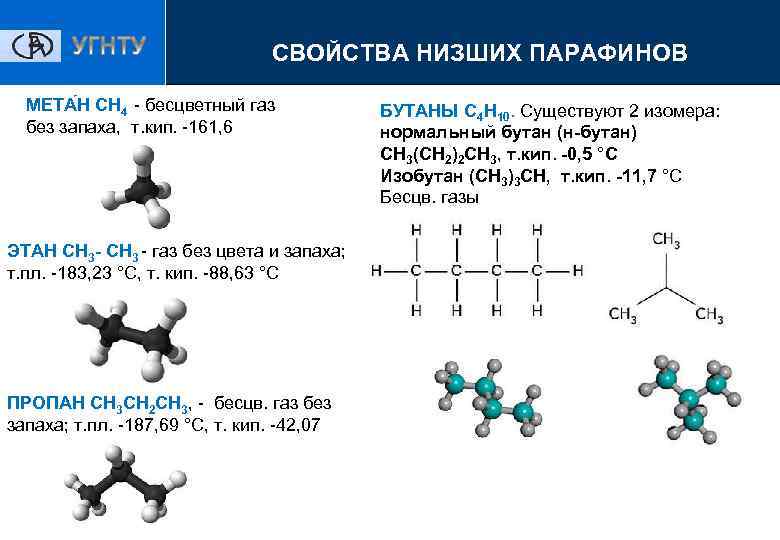 СВОЙСТВА НИЗШИХ ПАРАФИНОВ МЕТА Н CH 4 - бесцветный газ без запаха, т. кип. -161, 6 ЭТАН СН 3 - СН 3 - газ без цвета и запаха; т. пл. -183, 23 °С, т. кип. -88, 63 °С ПРОПАН СН 3 СН 2 СН 3, - бесцв. газ без запаха; т. пл. -187, 69 °С, т. кип. -42, 07 БУТАНЫ С 4 Н 10. Существуют 2 изомера: нормальный бутан (н-бутан) СН 3(СН 2)2 СН 3, т. кип. -0, 5 °С Изобутан (СН 3)3 СН, т. кип. -11, 7 °С Бесцв. газы
СВОЙСТВА НИЗШИХ ПАРАФИНОВ МЕТА Н CH 4 - бесцветный газ без запаха, т. кип. -161, 6 ЭТАН СН 3 - СН 3 - газ без цвета и запаха; т. пл. -183, 23 °С, т. кип. -88, 63 °С ПРОПАН СН 3 СН 2 СН 3, - бесцв. газ без запаха; т. пл. -187, 69 °С, т. кип. -42, 07 БУТАНЫ С 4 Н 10. Существуют 2 изомера: нормальный бутан (н-бутан) СН 3(СН 2)2 СН 3, т. кип. -0, 5 °С Изобутан (СН 3)3 СН, т. кип. -11, 7 °С Бесцв. газы
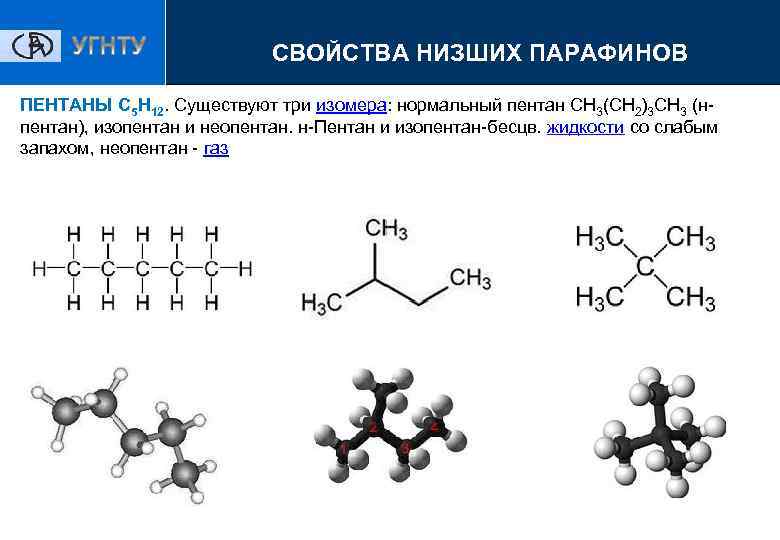 СВОЙСТВА НИЗШИХ ПАРАФИНОВ ПЕНТАНЫ C 5 H 12. Существуют три изомера: нормальный пентан CH 3(CH 2)3 СН 3 (нпентан), изопентан и неопентан. н-Пентан и изопентан-бесцв. жидкости со слабым запахом, неопентан - газ
СВОЙСТВА НИЗШИХ ПАРАФИНОВ ПЕНТАНЫ C 5 H 12. Существуют три изомера: нормальный пентан CH 3(CH 2)3 СН 3 (нпентан), изопентан и неопентан. н-Пентан и изопентан-бесцв. жидкости со слабым запахом, неопентан - газ
 Высшие парафины До С 16 – жидкости, выше С 16 – твердые вещества, температуры плавления которых увеличиваются с ростом молекулярной массы. v. Температуры плавления нормальных парафинов выше, чем изо-, и это используется при их разделении. v. При выделении из нефтепродуктов н-парафины получают в виде смесей, из которых основное значение имеют так называемые «мягкий парафин» и «твердый парафин» . v. Мягкий парафин (С 11 -С 20) Тпл< 40ºС. Ткип = 200 – 320 (350) ºС v. Твёрдый парафин (С 20 -С 35): Тпл >50 ºС, Ткип = 300 (350) – 450 (500) ºС v. Способны давать кристаллические аддукты с карбамидом. Это свойство используется для разделения н-парафинов от изо- и ароматики.
Высшие парафины До С 16 – жидкости, выше С 16 – твердые вещества, температуры плавления которых увеличиваются с ростом молекулярной массы. v. Температуры плавления нормальных парафинов выше, чем изо-, и это используется при их разделении. v. При выделении из нефтепродуктов н-парафины получают в виде смесей, из которых основное значение имеют так называемые «мягкий парафин» и «твердый парафин» . v. Мягкий парафин (С 11 -С 20) Тпл< 40ºС. Ткип = 200 – 320 (350) ºС v. Твёрдый парафин (С 20 -С 35): Тпл >50 ºС, Ткип = 300 (350) – 450 (500) ºС v. Способны давать кристаллические аддукты с карбамидом. Это свойство используется для разделения н-парафинов от изо- и ароматики.
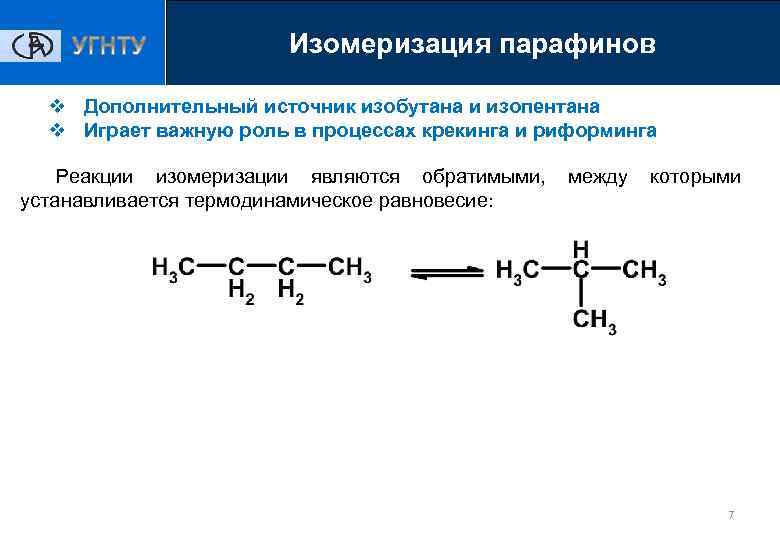 Изомеризация парафинов v Дополнительный источник изобутана и изопентана v Играет важную роль в процессах крекинга и риформинга Реакции изомеризации являются обратимыми, между которыми устанавливается термодинамическое равновесие: 7
Изомеризация парафинов v Дополнительный источник изобутана и изопентана v Играет важную роль в процессах крекинга и риформинга Реакции изомеризации являются обратимыми, между которыми устанавливается термодинамическое равновесие: 7
 Изомеризация парафинов Механизм ионный – через промежуточное образование карбокатионов. Сначала вследствие крекинга парафина или в результате его дегидрирования получаются олефины. Из них на гетерогенном контакте за счет его активных центров, играющих роль доноров протона, образуются карбокатионы Для успешного протекания изомеризации в присутствии хлорида алюминия необходим сокатализатор — хлорид водорода, так карбокатионы образуются только при совместном действии на олефин Аl. Сl 3 и НСl: 8
Изомеризация парафинов Механизм ионный – через промежуточное образование карбокатионов. Сначала вследствие крекинга парафина или в результате его дегидрирования получаются олефины. Из них на гетерогенном контакте за счет его активных центров, играющих роль доноров протона, образуются карбокатионы Для успешного протекания изомеризации в присутствии хлорида алюминия необходим сокатализатор — хлорид водорода, так карбокатионы образуются только при совместном действии на олефин Аl. Сl 3 и НСl: 8
 Изомеризация парафинов Карбокатионы способны отрывать атомы водорода (в виде гидрид-ионов) от других молекул углеводорода и изомеризоваться с перемещением атомов водорода или алкильных групп внутри молекулы. В результате идет ионно-цепной процесс изомеризации: 9
Изомеризация парафинов Карбокатионы способны отрывать атомы водорода (в виде гидрид-ионов) от других молекул углеводорода и изомеризоваться с перемещением атомов водорода или алкильных групп внутри молекулы. В результате идет ионно-цепной процесс изомеризации: 9
 Изомеризация парафинов всегда сопровождается побочными реакциями расщепления (крекинг), полимеризации и алкилирования, вследствие чего в продуктах присутствуют низкокипящие и в небольшом количестве высшие углеводороды. Для их подавления выбирают соответствующие температуры и время контакта. Первоначально изомеризацию проводили только при катализе хлоридом алюминия, который использовали в твердом виде, в виде жидкого комплекса с углеводородами (плюс НСl) или в виде раствора в трихлориде сурьмы, не растворимом в избытке парафина. Исходный углеводород предварительно насыщают хлоридом водорода и подают в реактор с мешалкой или в колонну с противоточным потоком катализатора, где под давлением при 80— 120°С протекает изомеризация. Углеводородный слой отделяют от катализатора, отгоняют НСl и нейтрализуют, после чего подвергают ректификации, возвращая непревращенное сырье на изомеризацию. 10
Изомеризация парафинов всегда сопровождается побочными реакциями расщепления (крекинг), полимеризации и алкилирования, вследствие чего в продуктах присутствуют низкокипящие и в небольшом количестве высшие углеводороды. Для их подавления выбирают соответствующие температуры и время контакта. Первоначально изомеризацию проводили только при катализе хлоридом алюминия, который использовали в твердом виде, в виде жидкого комплекса с углеводородами (плюс НСl) или в виде раствора в трихлориде сурьмы, не растворимом в избытке парафина. Исходный углеводород предварительно насыщают хлоридом водорода и подают в реактор с мешалкой или в колонну с противоточным потоком катализатора, где под давлением при 80— 120°С протекает изомеризация. Углеводородный слой отделяют от катализатора, отгоняют НСl и нейтрализуют, после чего подвергают ректификации, возвращая непревращенное сырье на изомеризацию. 10
 Изомеризация парафинов Бифункциональные катализаторы (например, 0, 5— 1, 0% Pt или Pd на Аl 2 O 3) менее активны и работают при 350— 450°С, когда равновесие не так выгодно для образования изопарафинов. Процесс проводят в адиабатическом проточном реакторе при 2— 4 МПа и избытке водорода (мольное отношение водород : углеводород от 2 : 1 до 3 : 1). При таких условиях предотвращается развитие реакций дегидрирования парафинов и полимеризации олефинов, благодаря чему катализатор не загрязняется смолистыми веществами. Пpoдукты реакции после конденсации и отделения от циркулирующего водорода подвергают ректификации; затем непрореагировавший н-пентан возвращают в цикл, а изопентан выделяют в виде товарного продукта. Степень превращения н-пентана за один проход через реактор составляет 50— 60%, а общий выход изопентана превышает 90 %. 11
Изомеризация парафинов Бифункциональные катализаторы (например, 0, 5— 1, 0% Pt или Pd на Аl 2 O 3) менее активны и работают при 350— 450°С, когда равновесие не так выгодно для образования изопарафинов. Процесс проводят в адиабатическом проточном реакторе при 2— 4 МПа и избытке водорода (мольное отношение водород : углеводород от 2 : 1 до 3 : 1). При таких условиях предотвращается развитие реакций дегидрирования парафинов и полимеризации олефинов, благодаря чему катализатор не загрязняется смолистыми веществами. Пpoдукты реакции после конденсации и отделения от циркулирующего водорода подвергают ректификации; затем непрореагировавший н-пентан возвращают в цикл, а изопентан выделяют в виде товарного продукта. Степень превращения н-пентана за один проход через реактор составляет 50— 60%, а общий выход изопентана превышает 90 %. 11
 Алкилирование парафинов Этот процесс предназначен для синтеза высокооктановых моторных топлив. Алкилирование парафинов олефинами является равновесным экзотермическим процессом. Катализаторы - вещества кислотного типа – хлорид алюминия, безводный фторид водорода, серная кислота (используют чаще всего). К каталитическому алкилированию способны только изопарафины, имеющие третичный атом углерода. Олефины могут быть различными (даже этилен), но обычно применяют нбутены, алкилирующие изобутан с образованием углеводородов C 8 H 18, по температуре кипения наиболее пригодных в качестве компонента моторного топлива. Строение продуктов, образующихся при каталитическом алкилировании изопарафинов, обычно не соответствует ожидаемому из структуры исходных веществ. Так, при взаимодействии н-бутена с изобутаном получается смесь 2, 2, 4 -, 2, 3, 4 - и 2, 3, 3 -триметилпентанов. Первый изомер, называемый просто изооктаном, является эталоном в шкале октановых чисел — для него октановое число принято равным 100. 12
Алкилирование парафинов Этот процесс предназначен для синтеза высокооктановых моторных топлив. Алкилирование парафинов олефинами является равновесным экзотермическим процессом. Катализаторы - вещества кислотного типа – хлорид алюминия, безводный фторид водорода, серная кислота (используют чаще всего). К каталитическому алкилированию способны только изопарафины, имеющие третичный атом углерода. Олефины могут быть различными (даже этилен), но обычно применяют нбутены, алкилирующие изобутан с образованием углеводородов C 8 H 18, по температуре кипения наиболее пригодных в качестве компонента моторного топлива. Строение продуктов, образующихся при каталитическом алкилировании изопарафинов, обычно не соответствует ожидаемому из структуры исходных веществ. Так, при взаимодействии н-бутена с изобутаном получается смесь 2, 2, 4 -, 2, 3, 4 - и 2, 3, 3 -триметилпентанов. Первый изомер, называемый просто изооктаном, является эталоном в шкале октановых чисел — для него октановое число принято равным 100. 12
 Алкилирование парафинов Причина несоответствия строения продуктов состоит в особенностях механизма реакции, осложненной процессами изомеризации. Вторичный карбокатион, образовавшийся из н-олефина, менее стабилен, чем третичный, вследствие чего происходит быстрый обмен гидрид-иона с изопарафином, причем образующийся трет-бутилкатион взаимодействует далее с исходным олефином. 13
Алкилирование парафинов Причина несоответствия строения продуктов состоит в особенностях механизма реакции, осложненной процессами изомеризации. Вторичный карбокатион, образовавшийся из н-олефина, менее стабилен, чем третичный, вследствие чего происходит быстрый обмен гидрид-иона с изопарафином, причем образующийся трет-бутилкатион взаимодействует далее с исходным олефином. 13
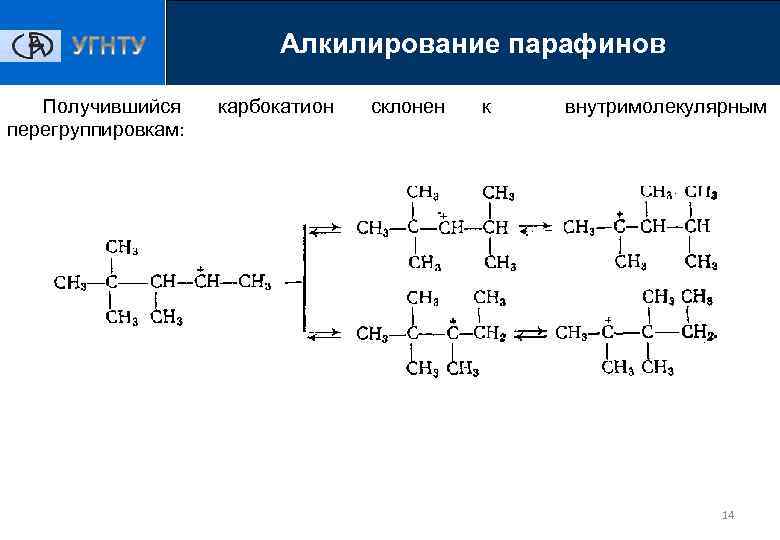 Алкилирование парафинов Получившийся перегруппировкам: карбокатион склонен к внутримолекулярным 14
Алкилирование парафинов Получившийся перегруппировкам: карбокатион склонен к внутримолекулярным 14
 Алкилирование парафинов Эти карбокатионы взаимодействуют с изобутаном, в результате чего получаются углеводород C 8 H 18 и трет-бутилкатион, обеспечивающий протекание ионно-цепного процесса : Промежуточно образующиеся изооктилкатионы также способны к реакции с олефинами: Так происходят последовательно-параллельные реакции алкилирования, причем, чтобы подавить образование высших углеводородов, необходим избыток изопарафина по отношению к олефину. 15
Алкилирование парафинов Эти карбокатионы взаимодействуют с изобутаном, в результате чего получаются углеводород C 8 H 18 и трет-бутилкатион, обеспечивающий протекание ионно-цепного процесса : Промежуточно образующиеся изооктилкатионы также способны к реакции с олефинами: Так происходят последовательно-параллельные реакции алкилирования, причем, чтобы подавить образование высших углеводородов, необходим избыток изопарафина по отношению к олефину. 15
 Галогенирование парафинов Реакция галогенирования относится к радикально-цепным. Различают термическое, фотохимическое и инициированное галогенирование. Возбужденный свободный атом галогена способен замещать атом водорода в н-алкане. Продолжение цепи осуществляется с помощью атома хлора, образовавшегося на стадии зарождения цепи. Длина реакционной цепи при хлорировании технических продуктов составляет десятки или сотни звеньев. Обрыв цепи при хлорировании в газовой фазе обычно протекает на насадке или стенке реактора. В жидкой фазе при хлорировании углеводородов, как правило, происходит квадратичный обрыв цепи на свободных радикалах. При галогенировании парафиновых углеводородов важное значение имеет направление атаки реагента, приводящее к образованию изомерных алкилгалогенидов. Состав изомеров определяется относительной подвижностью различных атомов водорода. Реакционная способность атомов водорода зависит от их положения, изменяясь в ряду: трет- > втор- > перв-. 16
Галогенирование парафинов Реакция галогенирования относится к радикально-цепным. Различают термическое, фотохимическое и инициированное галогенирование. Возбужденный свободный атом галогена способен замещать атом водорода в н-алкане. Продолжение цепи осуществляется с помощью атома хлора, образовавшегося на стадии зарождения цепи. Длина реакционной цепи при хлорировании технических продуктов составляет десятки или сотни звеньев. Обрыв цепи при хлорировании в газовой фазе обычно протекает на насадке или стенке реактора. В жидкой фазе при хлорировании углеводородов, как правило, происходит квадратичный обрыв цепи на свободных радикалах. При галогенировании парафиновых углеводородов важное значение имеет направление атаки реагента, приводящее к образованию изомерных алкилгалогенидов. Состав изомеров определяется относительной подвижностью различных атомов водорода. Реакционная способность атомов водорода зависит от их положения, изменяясь в ряду: трет- > втор- > перв-. 16
 Галогенирование парафинов Повышение температуры приводит к сближению реакционных способностей различных атомов водорода. Важное практическое значение имеют хлорпроизводные метана и парафина. Метилхлорид и метиленхлорид получают хлорированием метана при 400 — 550°С, а хлороформ и тетрахлорид углерода — фотохимическим хлорированием метиленхлорида в жидкой фазе. Этилхлорид получают хлорированием этана в газовой фазе при 450— 500 °С. При газофазном хлорировании технической смеси н- и изопентана образуется смесь семи изомеров монохлорпентана общей формулы C 5 H 11 Cl, используемая для производства смеси изомеров амиловых спиртов (пентазол).
Галогенирование парафинов Повышение температуры приводит к сближению реакционных способностей различных атомов водорода. Важное практическое значение имеют хлорпроизводные метана и парафина. Метилхлорид и метиленхлорид получают хлорированием метана при 400 — 550°С, а хлороформ и тетрахлорид углерода — фотохимическим хлорированием метиленхлорида в жидкой фазе. Этилхлорид получают хлорированием этана в газовой фазе при 450— 500 °С. При газофазном хлорировании технической смеси н- и изопентана образуется смесь семи изомеров монохлорпентана общей формулы C 5 H 11 Cl, используемая для производства смеси изомеров амиловых спиртов (пентазол).
 Галогенирование парафинов Продукт частичного замещения водорода хлором во фракции алканов С 10 С 11 используют в производстве поверхностно-активных веществ типа алкиларилсульфонатов. При хлорировании парафина, которое проводят в жидкой фазе при 70120°С, получают смесь, содержащую хлора от 40 (хлорпарафин-40) до 70 % (хлорпарафин-70). Монохлорпарафины используют для синтеза присадок к смазочным маслам. Хлорпарафин-40 используют в качестве пластификатора и для пропитки бумаги и тканей с целью повышения их огнестойкости. В технике нашли широкое применение также фторпроизводные — продукты исчерпывающего фторирования некоторых нефтяных фракций. Их используют в качестве термически и химически стойких смазочных масел и гидравлических жидкостей. 18
Галогенирование парафинов Продукт частичного замещения водорода хлором во фракции алканов С 10 С 11 используют в производстве поверхностно-активных веществ типа алкиларилсульфонатов. При хлорировании парафина, которое проводят в жидкой фазе при 70120°С, получают смесь, содержащую хлора от 40 (хлорпарафин-40) до 70 % (хлорпарафин-70). Монохлорпарафины используют для синтеза присадок к смазочным маслам. Хлорпарафин-40 используют в качестве пластификатора и для пропитки бумаги и тканей с целью повышения их огнестойкости. В технике нашли широкое применение также фторпроизводные — продукты исчерпывающего фторирования некоторых нефтяных фракций. Их используют в качестве термически и химически стойких смазочных масел и гидравлических жидкостей. 18
 Галогенирование парафинов Фторпроизводные метана и этана — хладоны — используют в качестве хладагентов и получают в промышленности замещением атомов хлора на фтор в хлороформе, тетрахлориде углерода, тетра-, пента- и гексахлорэтане. Для хладонов установлены сокращенные названия, соответствующие их составу — хладон-12, хладон-113 и т. д. Последняя цифра указывает число атомов фтора, вторая цифра справа на единицу больше числа атомов водорода, а первая слева — на единицу меньше числа атомов 1 углерода в молекуле. Наибольшее значение в технике имеют хладон-12, хладон-22 и хладон-113. Иодировать предельные углеводороды не удается. Однако можно осуществлять их прямое фторирование. 19
Галогенирование парафинов Фторпроизводные метана и этана — хладоны — используют в качестве хладагентов и получают в промышленности замещением атомов хлора на фтор в хлороформе, тетрахлориде углерода, тетра-, пента- и гексахлорэтане. Для хладонов установлены сокращенные названия, соответствующие их составу — хладон-12, хладон-113 и т. д. Последняя цифра указывает число атомов фтора, вторая цифра справа на единицу больше числа атомов водорода, а первая слева — на единицу меньше числа атомов 1 углерода в молекуле. Наибольшее значение в технике имеют хладон-12, хладон-22 и хладон-113. Иодировать предельные углеводороды не удается. Однако можно осуществлять их прямое фторирование. 19
 Сульфирование парафинов Сульфированием называют процесс введения в молекулу органического соединения сульфогруппы -SO 3 H. Сульфирующими агентами являются концентрированная серная кислота, олеум, хлорсульфоновая кислота, серный ангидрид, его комплексные соединения и некоторые другие вещества. Серная кислота и ее производные не реагируют с парафинами. К 1940 г. были открыты две важные реакции насыщенных углеводородов – сульфохлорирование и сульфоокисление. Сульфохлорирование состоит во взаимодействии SO 2 и Cl 2 с парафином при облучении: Диоксид серы и кислород при облучении или в присутствии инициаторов радикально-цепных реакций образуют с парафинами сульфокислоты (реакция сульфоокисления): 20
Сульфирование парафинов Сульфированием называют процесс введения в молекулу органического соединения сульфогруппы -SO 3 H. Сульфирующими агентами являются концентрированная серная кислота, олеум, хлорсульфоновая кислота, серный ангидрид, его комплексные соединения и некоторые другие вещества. Серная кислота и ее производные не реагируют с парафинами. К 1940 г. были открыты две важные реакции насыщенных углеводородов – сульфохлорирование и сульфоокисление. Сульфохлорирование состоит во взаимодействии SO 2 и Cl 2 с парафином при облучении: Диоксид серы и кислород при облучении или в присутствии инициаторов радикально-цепных реакций образуют с парафинами сульфокислоты (реакция сульфоокисления): 20
 Сульфирование парафинов Полученные после нейтрализации сульфонилхлорида и сульфокилоты щелочью алкилсульфонаты по своим поверхностно-активным свойствам уступают алкилсульфатам и сульфанолам, особенно при их применении в жесткой воде. Максимальной поверхностной активностью обладают сульфонаты с прямой цепью с 14÷ 16 углеродных атомов, чем определяется выбор сырья - керосиновая фракция парафинистой нефти. Вследствие клейкости и слабой кристалличности, алкилсульфонаты используются главным образом в виде водных растворов в качестве эмульгаторов, вспомогательных средств, жидких мыл и т. д. 21
Сульфирование парафинов Полученные после нейтрализации сульфонилхлорида и сульфокилоты щелочью алкилсульфонаты по своим поверхностно-активным свойствам уступают алкилсульфатам и сульфанолам, особенно при их применении в жесткой воде. Максимальной поверхностной активностью обладают сульфонаты с прямой цепью с 14÷ 16 углеродных атомов, чем определяется выбор сырья - керосиновая фракция парафинистой нефти. Вследствие клейкости и слабой кристалличности, алкилсульфонаты используются главным образом в виде водных растворов в качестве эмульгаторов, вспомогательных средств, жидких мыл и т. д. 21
 Окисление парафинов 1. Окисление по насыщенному атому углерода: 2. Деструктивное окисление, протекающее с расщеплением С–С связей Окислительный агент - молекулярный кислород в виде воздуха, технического кислорода или азотно-кислородных смесей. Концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. При окислении в газовой фазе используют и технический 22 кислород.
Окисление парафинов 1. Окисление по насыщенному атому углерода: 2. Деструктивное окисление, протекающее с расщеплением С–С связей Окислительный агент - молекулярный кислород в виде воздуха, технического кислорода или азотно-кислородных смесей. Концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. При окислении в газовой фазе используют и технический 22 кислород.
 Окисление парафинов протекает по радикально-цепному механизму и осуществляется в жидкой фазе в гомогенных условиях. Его можно подразделить на две группы: 1. термическое (автоокисление) 2. катализируемое солями металлов переменной валентности (Со, Мn и др. ). Гидропероксиды — это первые молекулярные продукты окисления углеводородов. Целевыми продуктами этих процессов в разных случаях являются гидропероксиды, спирты, альдегиды, кетоны, карбоновые кислоты и их ангидриды. 23
Окисление парафинов протекает по радикально-цепному механизму и осуществляется в жидкой фазе в гомогенных условиях. Его можно подразделить на две группы: 1. термическое (автоокисление) 2. катализируемое солями металлов переменной валентности (Со, Мn и др. ). Гидропероксиды — это первые молекулярные продукты окисления углеводородов. Целевыми продуктами этих процессов в разных случаях являются гидропероксиды, спирты, альдегиды, кетоны, карбоновые кислоты и их ангидриды. 23
 Окислительный аммонолиз - сопряженное окисление углеводородов и NH 3 мол. кислородом с образованием нитрилов или синильной кислоты: Окислительный аммонолиз парафинов изучен главным образом на примере промышленного получения синильной кислоты HCN из метана СН 4 (рция Андрусова) СН 4 + NH 3 + 1, 5 О 2 HCN + 3 H 2 O. Реакцию проводят при 1000 °С (кат. Pt - Rh или Pt - Ir, время контакта 0, 001 с); Выход HCN (в расчете на СН 4) 95 -90%; побочные продукты - N 2, CO, СО 2. Окислительный аммонолиз этана или пропана на сложных оксидных каталаизаторах (оксиды Mo, Ca, Sb и др. ) при 420 -650°С и времени контакта 35 с в присут. водяного пара приводит соотв. к образованию ацетонитрила или 24 смеси акрилонитрила и ацетонитрила. Выход нитрилов 30 -40%.
Окислительный аммонолиз - сопряженное окисление углеводородов и NH 3 мол. кислородом с образованием нитрилов или синильной кислоты: Окислительный аммонолиз парафинов изучен главным образом на примере промышленного получения синильной кислоты HCN из метана СН 4 (рция Андрусова) СН 4 + NH 3 + 1, 5 О 2 HCN + 3 H 2 O. Реакцию проводят при 1000 °С (кат. Pt - Rh или Pt - Ir, время контакта 0, 001 с); Выход HCN (в расчете на СН 4) 95 -90%; побочные продукты - N 2, CO, СО 2. Окислительный аммонолиз этана или пропана на сложных оксидных каталаизаторах (оксиды Mo, Ca, Sb и др. ) при 420 -650°С и времени контакта 35 с в присут. водяного пара приводит соотв. к образованию ацетонитрила или 24 смеси акрилонитрила и ацетонитрила. Выход нитрилов 30 -40%.
 Нитрование парафинов Нитрование – введение нитрогрупп NO 2 в молекулы органических соединений при действии различных нитрующих агентов. R-H+HNO 3 RNO 2+H 2 O Нитрование углеводородов парафинового ряда разбавленной азотной кислотой впервые осуществил русский химик М. И. Коновалов в 1888 (Коновалова реакция). Нитрование алканов окислами азота или крепкой азотной кислотой происходит преимущественно по радикальному механизму: 25
Нитрование парафинов Нитрование – введение нитрогрупп NO 2 в молекулы органических соединений при действии различных нитрующих агентов. R-H+HNO 3 RNO 2+H 2 O Нитрование углеводородов парафинового ряда разбавленной азотной кислотой впервые осуществил русский химик М. И. Коновалов в 1888 (Коновалова реакция). Нитрование алканов окислами азота или крепкой азотной кислотой происходит преимущественно по радикальному механизму: 25
 Нитрование парафинов Легче всего водород замещается у третичного атома углерода, наиболее трудно — у первичного. В промышленности нитропарафины получают жидкофазным и парофазным нитрованием смеси парафинов. Жидкофазное нитрование проводят HNO 3 при нормальном или повышенном давлении и температуре выше 180°С, или оксидами азота при давлении 2 -4, 5 МПа, 150 -22 °С, время контакта ~15 с. В этих условиях линейные углеводороды нитруются быстрее, чем их разветвленные изомеры. Парофазное нитрование (метод Хэсса) осуществляют HNO 3 при давлении 0, 7 -1, 0 МПа, 400 -500 °С, время контакта ~ 1 с. Побочные процессы - деструкция углеводородной цепи и окисление, приводящие к образованию смесей нитро- и кислородсодержащих соединений. Реакция взрывоопасна, проводят в специальных антикоррозионных нитраторах, процессы полностью автоматизированы. 26
Нитрование парафинов Легче всего водород замещается у третичного атома углерода, наиболее трудно — у первичного. В промышленности нитропарафины получают жидкофазным и парофазным нитрованием смеси парафинов. Жидкофазное нитрование проводят HNO 3 при нормальном или повышенном давлении и температуре выше 180°С, или оксидами азота при давлении 2 -4, 5 МПа, 150 -22 °С, время контакта ~15 с. В этих условиях линейные углеводороды нитруются быстрее, чем их разветвленные изомеры. Парофазное нитрование (метод Хэсса) осуществляют HNO 3 при давлении 0, 7 -1, 0 МПа, 400 -500 °С, время контакта ~ 1 с. Побочные процессы - деструкция углеводородной цепи и окисление, приводящие к образованию смесей нитро- и кислородсодержащих соединений. Реакция взрывоопасна, проводят в специальных антикоррозионных нитраторах, процессы полностью автоматизированы. 26
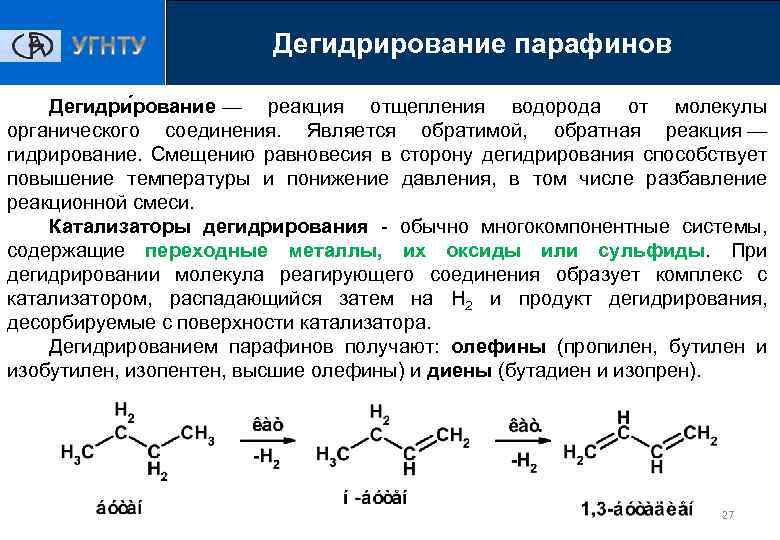 Дегидрирование парафинов Дегидри рование — реакция отщепления водорода от молекулы органического соединения. Является обратимой, обратная реакция — гидрирование. Смещению равновесия в сторону дегидрирования способствует повышение температуры и понижение давления, в том числе разбавление реакционной смеси. Катализаторы дегидрирования - обычно многокомпонентные системы, содержащие переходные металлы, их оксиды или сульфиды. При дегидрировании молекула реагирующего соединения образует комплекс с катализатором, распадающийся затем на Н 2 и продукт дегидрирования, десорбируемые с поверхности катализатора. Дегидрированием парафинов получают: олефины (пропилен, бутилен и изобутилен, изопентен, высшие олефины) и диены (бутадиен и изопрен). 27
Дегидрирование парафинов Дегидри рование — реакция отщепления водорода от молекулы органического соединения. Является обратимой, обратная реакция — гидрирование. Смещению равновесия в сторону дегидрирования способствует повышение температуры и понижение давления, в том числе разбавление реакционной смеси. Катализаторы дегидрирования - обычно многокомпонентные системы, содержащие переходные металлы, их оксиды или сульфиды. При дегидрировании молекула реагирующего соединения образует комплекс с катализатором, распадающийся затем на Н 2 и продукт дегидрирования, десорбируемые с поверхности катализатора. Дегидрированием парафинов получают: олефины (пропилен, бутилен и изобутилен, изопентен, высшие олефины) и диены (бутадиен и изопрен). 27
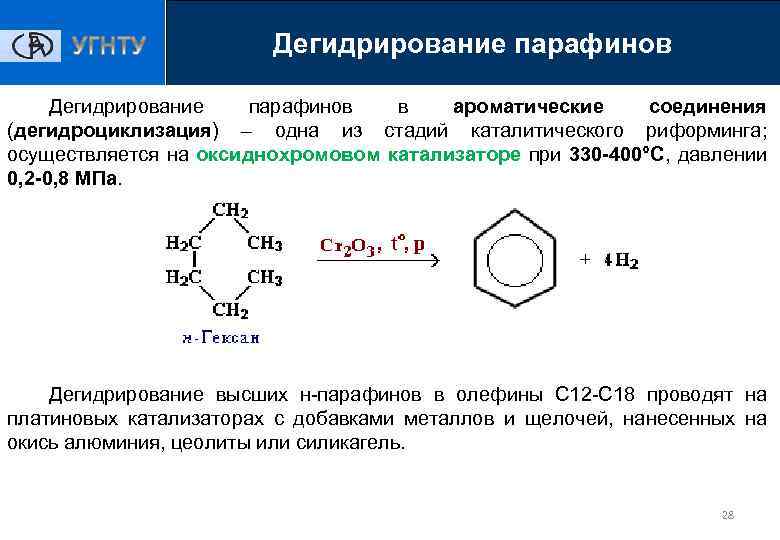 Дегидрирование парафинов в ароматические соединения (дегидроциклизация) – одна из стадий каталитического риформинга; осуществляется на оксиднохромовом катализаторе при 330 -400°С, давлении 0, 2 -0, 8 МПа. Дегидрирование высших н-парафинов в олефины С 12 -С 18 проводят на платиновых катализаторах с добавками металлов и щелочей, нанесенных на окись алюминия, цеолиты или силикагель. 28
Дегидрирование парафинов в ароматические соединения (дегидроциклизация) – одна из стадий каталитического риформинга; осуществляется на оксиднохромовом катализаторе при 330 -400°С, давлении 0, 2 -0, 8 МПа. Дегидрирование высших н-парафинов в олефины С 12 -С 18 проводят на платиновых катализаторах с добавками металлов и щелочей, нанесенных на окись алюминия, цеолиты или силикагель. 28


