 Оттек және күкірт ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттек және күкірт ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Периодтық кестедегі орны Оттек және күкірт VIA топшасындағы элементтер Бұл топтың элементтерінің жалпы аты - ХАЛЬКОГЕНдер, мағынасы «кен тудырушы» ВАСИЛИЙ КАДЕВИЧ 2008 г.
Периодтық кестедегі орны Оттек және күкірт VIA топшасындағы элементтер Бұл топтың элементтерінің жалпы аты - ХАЛЬКОГЕНдер, мағынасы «кен тудырушы» ВАСИЛИЙ КАДЕВИЧ 2008 г.
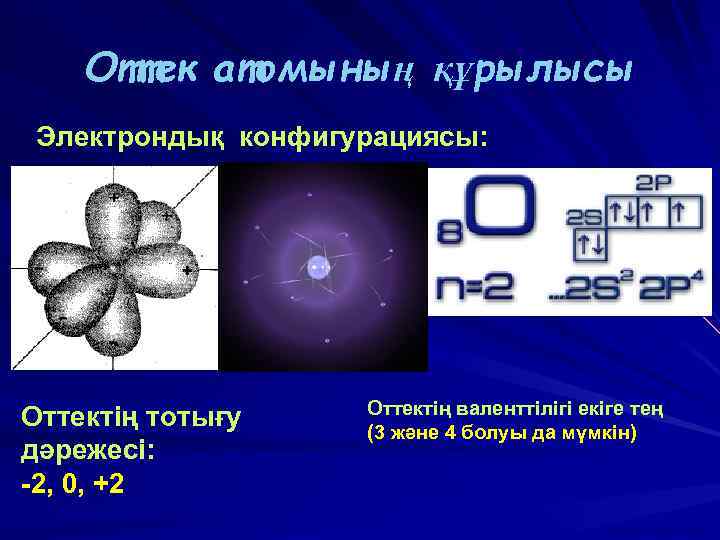 Оттек атомының құрылысы Электрондық конфигурациясы: Оттектің тотығу дәрежесі: -2, 0, +2 Оттектің валенттілігі екіге тең (3 және 4 болуы да мүмкін) ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттек атомының құрылысы Электрондық конфигурациясы: Оттектің тотығу дәрежесі: -2, 0, +2 Оттектің валенттілігі екіге тең (3 және 4 болуы да мүмкін) ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Оттектің аллотропиясы Оттек элементінің екі аллотропты түрөзгерістері бар: оттек О 2 озон О 3 ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттектің аллотропиясы Оттек элементінің екі аллотропты түрөзгерістері бар: оттек О 2 озон О 3 ВАСИЛИЙ КАДЕВИЧ 2008 г.
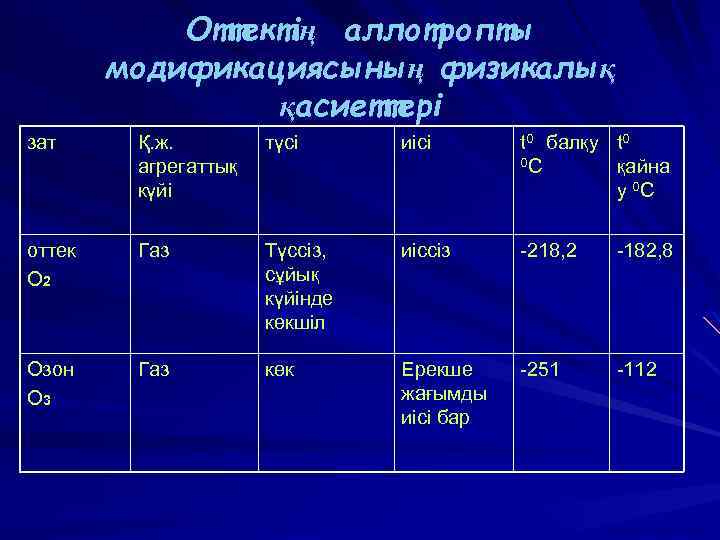 Оттектің аллотропты модификациясының физикалық қасиеттері зат Қ. ж. агрегаттық күйі түсі иісі t 0 балқу t 0 0 C қайна у 0 C оттек O 2 Газ Түссіз, сұйық күйінде көкшіл иіссіз -218, 2 -182, 8 Озон O 3 Газ көк Ерекше жағымды иісі бар -251 -112 ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттектің аллотропты модификациясының физикалық қасиеттері зат Қ. ж. агрегаттық күйі түсі иісі t 0 балқу t 0 0 C қайна у 0 C оттек O 2 Газ Түссіз, сұйық күйінде көкшіл иіссіз -218, 2 -182, 8 Озон O 3 Газ көк Ерекше жағымды иісі бар -251 -112 ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Озон оттекпен салыстырғанда химиялық белсенді: Озонның белсенділігі оның ыдырауы кезінде түзілетін атомдық оттекпен байланысты. Атомдық оттек көптеген заттармен өте белсенді реакцияға түседі. O 3=>O 2+O Мысалы, озон күміспен өте оңай реакцияға түседі, ал оттек күміспен қыздырған жағдайда да реакцияға түспейді: бірақ озон да оттек те активті металдармен реакцияға түседі. ВАСИЛИЙ КАДЕВИЧ 2008 г.
Озон оттекпен салыстырғанда химиялық белсенді: Озонның белсенділігі оның ыдырауы кезінде түзілетін атомдық оттекпен байланысты. Атомдық оттек көптеген заттармен өте белсенді реакцияға түседі. O 3=>O 2+O Мысалы, озон күміспен өте оңай реакцияға түседі, ал оттек күміспен қыздырған жағдайда да реакцияға түспейді: бірақ озон да оттек те активті металдармен реакцияға түседі. ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Озонды алу Бұл реакция жылуды сіңіру арқылы жүреді. Сондықтан озон найзағай кезінде түзіліп жатады. Ал кері реакция қалыпты жағдай кезінде орын алады, себебі озон тұрақсыз зат. Табиғаттағы озонның ыдырап кетуі атмосфераға жіберілетін түрлі газдардың әсерінен орын алады. Осындай себептерден озон қабаты бұзылып отырады. ВАСИЛИЙ КАДЕВИЧ 2008 г.
Озонды алу Бұл реакция жылуды сіңіру арқылы жүреді. Сондықтан озон найзағай кезінде түзіліп жатады. Ал кері реакция қалыпты жағдай кезінде орын алады, себебі озон тұрақсыз зат. Табиғаттағы озонның ыдырап кетуі атмосфераға жіберілетін түрлі газдардың әсерінен орын алады. Осындай себептерден озон қабаты бұзылып отырады. ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Оттекті алу Оттек (O 2) зертханада калий перманганатын ыдырату арқылы алады KMn. O 4 (марганцовка). 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттекті алу Оттек (O 2) зертханада калий перманганатын ыдырату арқылы алады KMn. O 4 (марганцовка). 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Сонымен қатар басқа да тұздарды қыздырып ыдырату арқылы 2 KNO 3=>2 KNO 2+O 2 2 KCl. O 3=>2 KCl+3 O 2 Ал өндірісте оттекті сұйық ауадан алады(ауаны to -283 Co – ға дейін суыту арқылы) немесе судың лектролизі кезінде 2 H 2 O= 2 H 2+O 2 Ал табиғатта оттек фотосинтез процесі кезінде түзіледі 6 CO 2+6 H 2 O=> C 6 H 12 O 6+6 O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008 г.
Сонымен қатар басқа да тұздарды қыздырып ыдырату арқылы 2 KNO 3=>2 KNO 2+O 2 2 KCl. O 3=>2 KCl+3 O 2 Ал өндірісте оттекті сұйық ауадан алады(ауаны to -283 Co – ға дейін суыту арқылы) немесе судың лектролизі кезінде 2 H 2 O= 2 H 2+O 2 Ал табиғатта оттек фотосинтез процесі кезінде түзіледі 6 CO 2+6 H 2 O=> C 6 H 12 O 6+6 O 2 ↑ ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Химические свойства КИСЛОРОДА Кислород непосредственно реагирует со всеми простыми веществами, кроме золота, платины и галогенов. В кислороде могут гореть даже те вещества, которые не горят на воздухе. 3 Fe+2 O 2=Fe 3 O 4 (железная окалина) ВАСИЛИЙ КАДЕВИЧ 2008 г.
Химические свойства КИСЛОРОДА Кислород непосредственно реагирует со всеми простыми веществами, кроме золота, платины и галогенов. В кислороде могут гореть даже те вещества, которые не горят на воздухе. 3 Fe+2 O 2=Fe 3 O 4 (железная окалина) ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Взаимодействие с активными металлами Горение магния 2 Mg + O 2= 2 Mg. O ВАСИЛИЙ КАДЕВИЧ 2008 г.
Взаимодействие с активными металлами Горение магния 2 Mg + O 2= 2 Mg. O ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Взаимодействие с другими неметаллами Горение серы в кислороде S + O 2= SO 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
Взаимодействие с другими неметаллами Горение серы в кислороде S + O 2= SO 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
 фосфордың оттекте жануы 4 P + 5 O 2 = 2 P 2 O 5 Көміртектің оттекте жануы С+О 2= СО 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
фосфордың оттекте жануы 4 P + 5 O 2 = 2 P 2 O 5 Көміртектің оттекте жануы С+О 2= СО 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
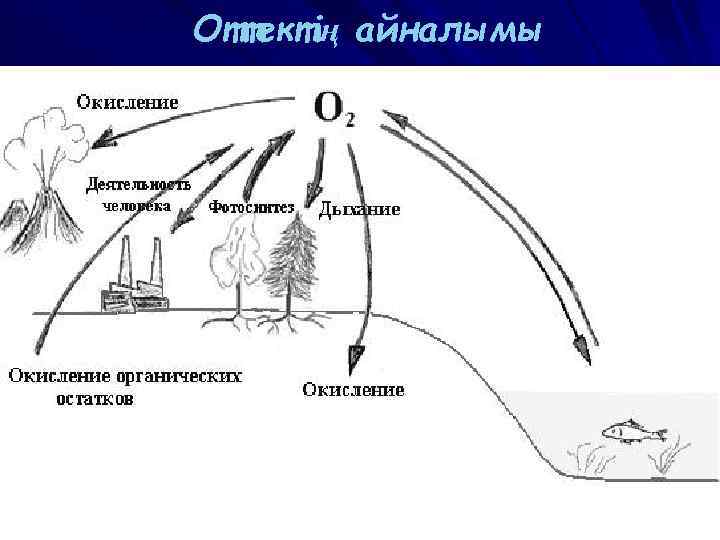 Оттектің айналымы
Оттектің айналымы
 Оттекті қолдану Химия өнеркәсіптерінде Қопарылғыш қоспалар жасауда Металл дәнекерлеу және металды кесу кезінде Ғарыш саласында(ракета отыны) Металлургия саласында Медицинада ВАСИЛИЙ КАДЕВИЧ 2008 г.
Оттекті қолдану Химия өнеркәсіптерінде Қопарылғыш қоспалар жасауда Металл дәнекерлеу және металды кесу кезінде Ғарыш саласында(ракета отыны) Металлургия саласында Медицинада ВАСИЛИЙ КАДЕВИЧ 2008 г.
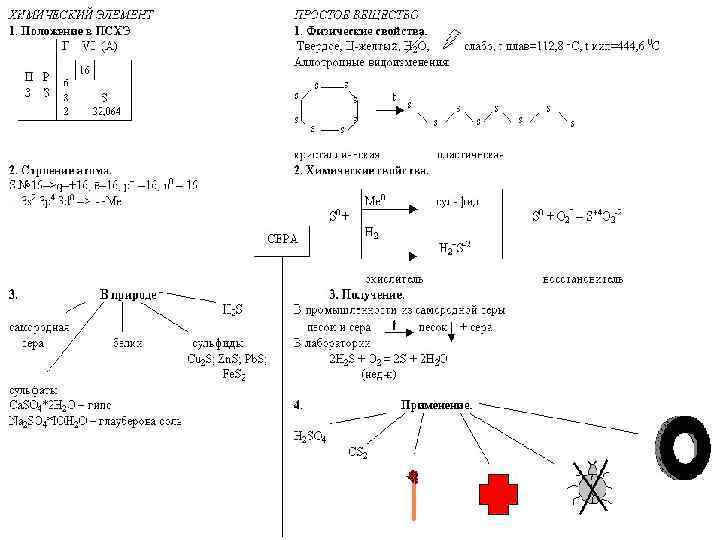
 Күкірттің атом құрылысы 1 s 22 p 63 s 23 p 4 Тотығу дәрежесі Валенттілік +2, -2 II +4 IV +6 VI ВАСИЛИЙ КАДЕВИЧ 2008 г.
Күкірттің атом құрылысы 1 s 22 p 63 s 23 p 4 Тотығу дәрежесі Валенттілік +2, -2 II +4 IV +6 VI ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Күкірттің аллотропиясы 1) ромбалық (a - күкірт) - S 8 t°балқу. = 113°C; r = 2, 07 г/см 3 Салыстырмалы түрде тұрақты түрөзгерісі 2) моноклинді (b – күкірт ) – қара-сары инелер t°балқу. = 119°C; r = 1, 96 г/см 3 Устойчивая при температуре более 96°С жоғары температурада тұрақты, ал қалыпты жағдайда ромбалық түрге ауысады. 3) пластикалық – қоңыр резеңке тәріздес масса Тұрақсыз, қату кезінде ромбалық түрге ауысады ВАСИЛИЙ КАДЕВИЧ 2008 г.
Күкірттің аллотропиясы 1) ромбалық (a - күкірт) - S 8 t°балқу. = 113°C; r = 2, 07 г/см 3 Салыстырмалы түрде тұрақты түрөзгерісі 2) моноклинді (b – күкірт ) – қара-сары инелер t°балқу. = 119°C; r = 1, 96 г/см 3 Устойчивая при температуре более 96°С жоғары температурада тұрақты, ал қалыпты жағдайда ромбалық түрге ауысады. 3) пластикалық – қоңыр резеңке тәріздес масса Тұрақсыз, қату кезінде ромбалық түрге ауысады ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Күкіртті алу 1. Өндірісте су буымен балқыту арқылы 2. күкіт сутектің толық емес тотығуы (оттек жеткіліксіз болғанда). 2 H 2 S + O 2 => 2 S + 2 H 2 O 3. Вакенродер реакциясы 2 H 2 S + SO 2 => 3 S + 2 H 2 O ВАСИЛИЙ КАДЕВИЧ 2008 г.
Күкіртті алу 1. Өндірісте су буымен балқыту арқылы 2. күкіт сутектің толық емес тотығуы (оттек жеткіліксіз болғанда). 2 H 2 S + O 2 => 2 S + 2 H 2 O 3. Вакенродер реакциясы 2 H 2 S + SO 2 => 3 S + 2 H 2 O ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Күкірттің химиялық қасиеттері (S 0 + 2ē => S-2) 1) Күкірт сілтілік металдармен қыздырмай ақ әрекеттеседі: 2 Na + S => Na 2 S қалған металдармен ( Au, Pt басқа) - t° қыздырғанда: 2 Al + 3 S =t°=> Al 2 S 3 Zn + S =t°=> Zn. S 2) кейбір бейметалдармен күкірт бинарлық қосылыстар түзеді: H 2 + S => H 2 S 2 P + 3 S => P 2 S 3 C + 2 S => CS 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
Күкірттің химиялық қасиеттері (S 0 + 2ē => S-2) 1) Күкірт сілтілік металдармен қыздырмай ақ әрекеттеседі: 2 Na + S => Na 2 S қалған металдармен ( Au, Pt басқа) - t° қыздырғанда: 2 Al + 3 S =t°=> Al 2 S 3 Zn + S =t°=> Zn. S 2) кейбір бейметалдармен күкірт бинарлық қосылыстар түзеді: H 2 + S => H 2 S 2 P + 3 S => P 2 S 3 C + 2 S => CS 2 ВАСИЛИЙ КАДЕВИЧ 2008 г.
 (S 0 - 2ē => S+2; S 0 - 4ē => S+4; S 0 - 6ē => S+6) 3) оттекпен: S + O 2 =t°=> S+4 O 2 2 S + 3 O 2 =t°pt=> 2 S+6 O 3 4) галогендермен ( йодтан басқа): S + Cl 2 => S+2 Cl 2 5) қышқылдармен: S + 2 H 2 SO 4(конц) => 3 S+4 O 2 + 2 H 2 O S + 6 HNO 3(конц) => H 2 S+6 O 4 + 6 NO 2 + 2 H 2 O ВАСИЛИЙ КАДЕВИЧ 2008 г.
(S 0 - 2ē => S+2; S 0 - 4ē => S+4; S 0 - 6ē => S+6) 3) оттекпен: S + O 2 =t°=> S+4 O 2 2 S + 3 O 2 =t°pt=> 2 S+6 O 3 4) галогендермен ( йодтан басқа): S + Cl 2 => S+2 Cl 2 5) қышқылдармен: S + 2 H 2 SO 4(конц) => 3 S+4 O 2 + 2 H 2 O S + 6 HNO 3(конц) => H 2 S+6 O 4 + 6 NO 2 + 2 H 2 O ВАСИЛИЙ КАДЕВИЧ 2008 г.
 6) 3 S 0 + 6 KOH => K 2 S+4 O 3 + 2 K 2 S-2 + 3 H 2 O 7) күкірт концентрленген натрий сульфитінде ериді: S 0 + Na 2 S+4 O 3 => Na 2 S 2 O 3 Натрийдің тиосульфаты ВАСИЛИЙ КАДЕВИЧ 2008 г.
6) 3 S 0 + 6 KOH => K 2 S+4 O 3 + 2 K 2 S-2 + 3 H 2 O 7) күкірт концентрленген натрий сульфитінде ериді: S 0 + Na 2 S+4 O 3 => Na 2 S 2 O 3 Натрийдің тиосульфаты ВАСИЛИЙ КАДЕВИЧ 2008 г.
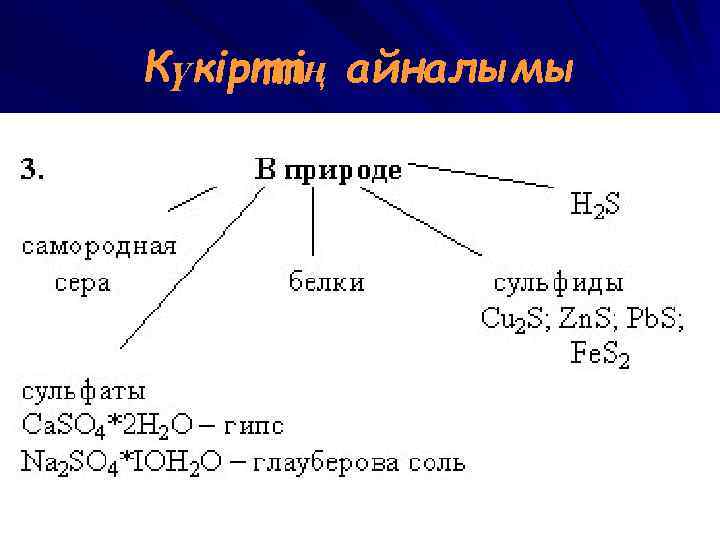 Күкірттің айналымы
Күкірттің айналымы
 Күкірттің қолданылуы Каучоктың вулканизациясы Эбонитті алу Оқдәрі және оттық жасау кезінде Ауыл шаруышылығындағы зиянкестермен күресте Медициналық мақсатта (түрлі тері аурулары кезінде қолданылатын жақпалар) Күкірт қышқылын алу үшін ВАСИЛИЙ КАДЕВИЧ 2008 г.
Күкірттің қолданылуы Каучоктың вулканизациясы Эбонитті алу Оқдәрі және оттық жасау кезінде Ауыл шаруышылығындағы зиянкестермен күресте Медициналық мақсатта (түрлі тері аурулары кезінде қолданылатын жақпалар) Күкірт қышқылын алу үшін ВАСИЛИЙ КАДЕВИЧ 2008 г.
 Назарларыңызға көп рахмет!! ВАСИЛИЙ КАДЕВИЧ 2008 г.
Назарларыңызға көп рахмет!! ВАСИЛИЙ КАДЕВИЧ 2008 г.


