Отношение халькогенов к металлам.pptx
- Количество слайдов: 11
 Отношение халькогенов кислорода и серы к простым веществам – металлам При взаимодействии с металлами кислород и сера проявляют свойства окислителей
Отношение халькогенов кислорода и серы к простым веществам – металлам При взаимодействии с металлами кислород и сера проявляют свойства окислителей
 Взаимодействие халькогенов кислорода и серы с металлами главной подгруппы I группы Металлы Li, Na, K, Rb, Cs УХР с О 2 4 Li + O 2 → 2 Li 2 O 2 Na + О 2 → Na 2 O 2 II, − 1 или Na−O−O−Na K + O 2 → KO 2 II, −½ или K−O−O−K 2 K + О 2 → K 2 O 2 УХР с S При нагревании щелочные металлы реагируют с серой, образуя сульфиды 2 Me + S → Me 2 S, где Ме – металл IА группы, например: 2 Li + S → Li 2 S
Взаимодействие халькогенов кислорода и серы с металлами главной подгруппы I группы Металлы Li, Na, K, Rb, Cs УХР с О 2 4 Li + O 2 → 2 Li 2 O 2 Na + О 2 → Na 2 O 2 II, − 1 или Na−O−O−Na K + O 2 → KO 2 II, −½ или K−O−O−K 2 K + О 2 → K 2 O 2 УХР с S При нагревании щелочные металлы реагируют с серой, образуя сульфиды 2 Me + S → Me 2 S, где Ме – металл IА группы, например: 2 Li + S → Li 2 S
 Взаимодействие халькогенов кислорода и серы с металлами главной подгруппы II группы Металлы Be, Mg, Ca, Sr, Ba УХР с О 2 При нагревании металлами главной подгруппы II группы, включая металлы щелочноземельные, реагируют с кислородом, образуя оксиды 2 Mg + O 2 → 2 Mg. O 2 Be + O 2 → 2 Be. O 2 Са +O 2 → 2 Са. O УХР с S При нагревании металлами главной подгруппы II группы, включая металлы щелочноземельные, реагируют с кислородом, образуя сульфиды Me + S → Me. S, где Ме – металл IIА группы, например: Са + S → Са. S
Взаимодействие халькогенов кислорода и серы с металлами главной подгруппы II группы Металлы Be, Mg, Ca, Sr, Ba УХР с О 2 При нагревании металлами главной подгруппы II группы, включая металлы щелочноземельные, реагируют с кислородом, образуя оксиды 2 Mg + O 2 → 2 Mg. O 2 Be + O 2 → 2 Be. O 2 Са +O 2 → 2 Са. O УХР с S При нагревании металлами главной подгруппы II группы, включая металлы щелочноземельные, реагируют с кислородом, образуя сульфиды Me + S → Me. S, где Ме – металл IIА группы, например: Са + S → Са. S
 Взаимодействие халькогенов кислорода и серы с металлами Металл Al УХР с О 2 УХР с S Алюминий, «очищенный» от оксидной плёнки (например, при амальгамировании), выступает как активный металл-восстановитель и легко реагирует с халькогенами. 4 Al + 3 O 2= 2 Al 2 O 3 + Q Реакция сопровождается выделением значительного количества энергии 2 Al + 3 S= Al 2 S 3
Взаимодействие халькогенов кислорода и серы с металлами Металл Al УХР с О 2 УХР с S Алюминий, «очищенный» от оксидной плёнки (например, при амальгамировании), выступает как активный металл-восстановитель и легко реагирует с халькогенами. 4 Al + 3 O 2= 2 Al 2 O 3 + Q Реакция сопровождается выделением значительного количества энергии 2 Al + 3 S= Al 2 S 3
 Взаимодействие халькогенов кислорода и серы с металлами Металл Fe УХР с О 2 3 Fe + 2 O 2=Fe 3 O 4 В кислороде железо сгорает, разбрасывая искры – частички железной окалины Fe 3 O 4 смешанного оксида железа (II), (III) Fe. O●Fe 2 O 3 УХР с S Fe + S = Fe. S При взаимодействии с серой при нагревании железо образует только Fe. S сульфид железа (II) − соль, черно-серого цвета с зеленым оттенком, нерастворима в воде
Взаимодействие халькогенов кислорода и серы с металлами Металл Fe УХР с О 2 3 Fe + 2 O 2=Fe 3 O 4 В кислороде железо сгорает, разбрасывая искры – частички железной окалины Fe 3 O 4 смешанного оксида железа (II), (III) Fe. O●Fe 2 O 3 УХР с S Fe + S = Fe. S При взаимодействии с серой при нагревании железо образует только Fe. S сульфид железа (II) − соль, черно-серого цвета с зеленым оттенком, нерастворима в воде
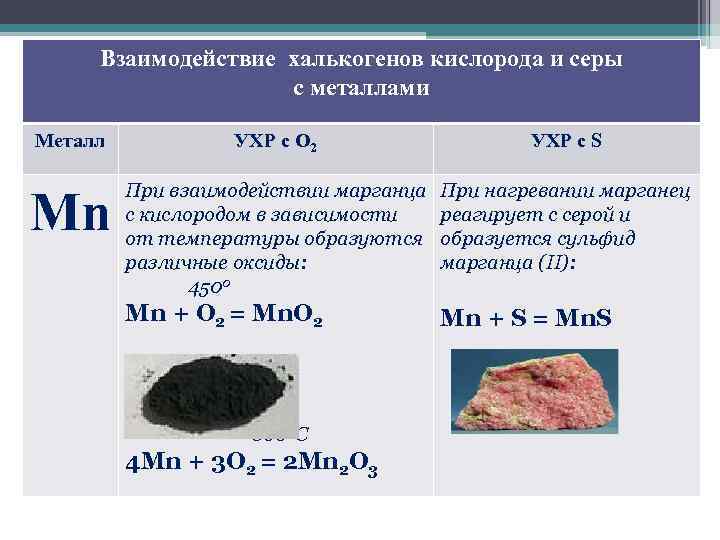 Взаимодействие халькогенов кислорода и серы с металлами Металл УХР с О 2 УХР с S Mn При взаимодействии марганца с кислородом в зависимости от температуры образуются различные оксиды: 4500 При нагревании марганец реагирует с серой и образуется сульфид марганца (II): Mn + O 2 = Mn. O 2 Mn + S = Mn. S 8000 С 4 Mn + 3 O 2 = 2 Mn 2 O 3
Взаимодействие халькогенов кислорода и серы с металлами Металл УХР с О 2 УХР с S Mn При взаимодействии марганца с кислородом в зависимости от температуры образуются различные оксиды: 4500 При нагревании марганец реагирует с серой и образуется сульфид марганца (II): Mn + O 2 = Mn. O 2 Mn + S = Mn. S 8000 С 4 Mn + 3 O 2 = 2 Mn 2 O 3
 Взаимодействие халькогенов кислорода и серы с металлами Металл Cr УХР с О 2 При взаимодействии хрома с кислородом образуется оксид хрома (III): 4 Cr+3 O 2=2 Cr 2 O 3 УХР с S При нагревании хром реагирует с серой и образуется сульфид хрома (III): 2 Cr + 3 S = Cr 2 S 3
Взаимодействие халькогенов кислорода и серы с металлами Металл Cr УХР с О 2 При взаимодействии хрома с кислородом образуется оксид хрома (III): 4 Cr+3 O 2=2 Cr 2 O 3 УХР с S При нагревании хром реагирует с серой и образуется сульфид хрома (III): 2 Cr + 3 S = Cr 2 S 3
 Взаимодействие халькогенов кислорода и серы с металлами Металл Ag УХР с О 2 УХР с S Даже при Серебро реагирует с серой нагревании серебро при нагревании: не реагирует с 2 Ag + S = Ag 2 S (t°=200°C) кислородом: Ag + О 2 ≠ Но во влажном воздухе при комнатной температуре в присутствии даже малейших следов сероводорода образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий: 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S↓ + 2 H 2 O
Взаимодействие халькогенов кислорода и серы с металлами Металл Ag УХР с О 2 УХР с S Даже при Серебро реагирует с серой нагревании серебро при нагревании: не реагирует с 2 Ag + S = Ag 2 S (t°=200°C) кислородом: Ag + О 2 ≠ Но во влажном воздухе при комнатной температуре в присутствии даже малейших следов сероводорода образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий: 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S↓ + 2 H 2 O
 Взаимодействие халькогенов кислорода и серы с металлами Металл Cu УХР с О 2 При недостатке кислорода и 200 °C образуется оксид меди (I) 4 Cu + O 2 = 2 Cu 2 O; УХР с S Медный порошок реагирует c серой в сероуглероде при комнатной температуре, образуя сульфид меди (II); Cu + S = Cu. S (CS 2) При избытке кислорода и температуре 400— 500 °C образуется оксид меди (II) 2 Cu + O 2 = 2 Cu. O черный при температуре 300— 400 °C реагирует, образуя сульфид меди (I) : 2 Cu + S = Cu 2 S черно-синий
Взаимодействие халькогенов кислорода и серы с металлами Металл Cu УХР с О 2 При недостатке кислорода и 200 °C образуется оксид меди (I) 4 Cu + O 2 = 2 Cu 2 O; УХР с S Медный порошок реагирует c серой в сероуглероде при комнатной температуре, образуя сульфид меди (II); Cu + S = Cu. S (CS 2) При избытке кислорода и температуре 400— 500 °C образуется оксид меди (II) 2 Cu + O 2 = 2 Cu. O черный при температуре 300— 400 °C реагирует, образуя сульфид меди (I) : 2 Cu + S = Cu 2 S черно-синий
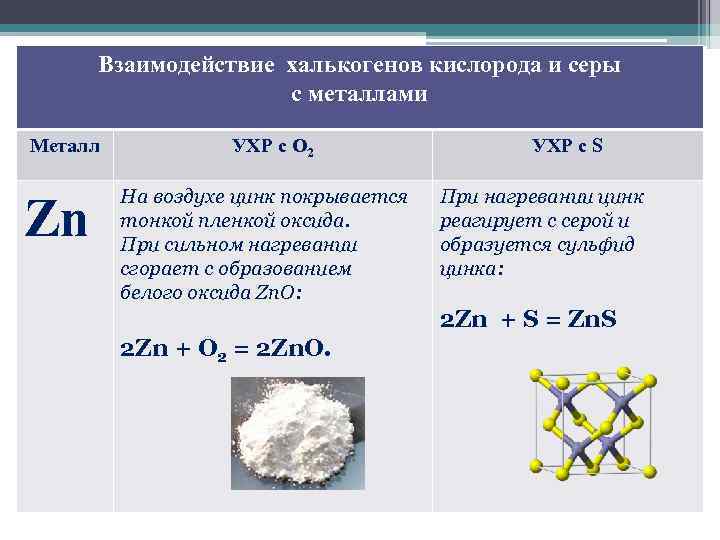 Взаимодействие халькогенов кислорода и серы с металлами Металл Zn УХР с О 2 На воздухе цинк покрывается тонкой пленкой оксида. При сильном нагревании сгорает с образованием белого оксида Zn. O: УХР с S При нагревании цинк реагирует с серой и образуется сульфид цинка: 2 Zn + S = Zn. S 2 Zn + O 2 = 2 Zn. O.
Взаимодействие халькогенов кислорода и серы с металлами Металл Zn УХР с О 2 На воздухе цинк покрывается тонкой пленкой оксида. При сильном нагревании сгорает с образованием белого оксида Zn. O: УХР с S При нагревании цинк реагирует с серой и образуется сульфид цинка: 2 Zn + S = Zn. S 2 Zn + O 2 = 2 Zn. O.
 Взаимодействие халькогенов кислорода и серы с металлами Металл Hg УХР с О 2 УХР с S При нагревании до 300 °C ртуть вступает в реакцию кислородом, образуется термически неустойчивый оксид ртути (II): При нагревании до 200 °C ртуть реагирует с серой, образуется сульфид ртути (II), называемый киноварь: 2 Hg + O 2 = 2 Hg. O Hg + S = Hg. S
Взаимодействие халькогенов кислорода и серы с металлами Металл Hg УХР с О 2 УХР с S При нагревании до 300 °C ртуть вступает в реакцию кислородом, образуется термически неустойчивый оксид ртути (II): При нагревании до 200 °C ртуть реагирует с серой, образуется сульфид ртути (II), называемый киноварь: 2 Hg + O 2 = 2 Hg. O Hg + S = Hg. S


