2013_Лек1_Тех_Ст_ГЛФ.ppt
- Количество слайдов: 98
 от греч. techne — мастерство, искусство; logos — слово, учение, наука Технология и стандартизация готовых лекарственных форм (ГЛФ) Лекция 1 14. 01. 2013 г. Лекторы: доц. Ткачевская Елена Петровна доц. Ларкина Екатерина Александровна (каф. ХТБАС, лаб. 214)
от греч. techne — мастерство, искусство; logos — слово, учение, наука Технология и стандартизация готовых лекарственных форм (ГЛФ) Лекция 1 14. 01. 2013 г. Лекторы: доц. Ткачевская Елена Петровна доц. Ларкина Екатерина Александровна (каф. ХТБАС, лаб. 214)
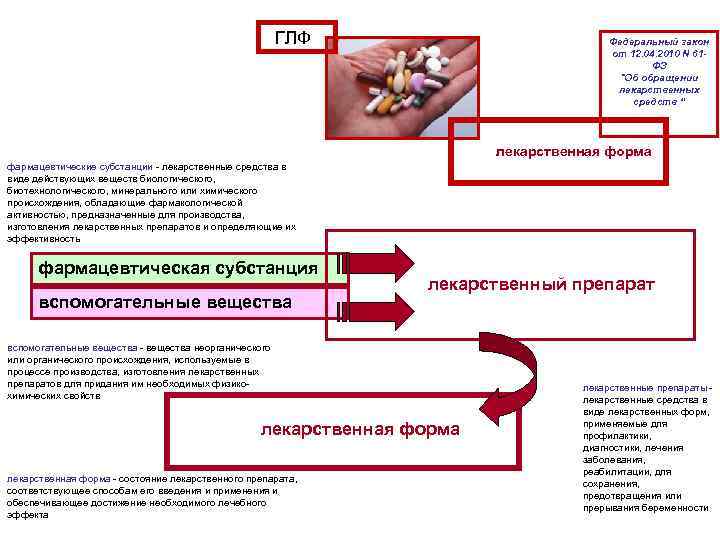 ГЛФ Федеральный закон от 12. 04. 2010 N 61 ФЗ "Об обращении лекарственных средств “ лекарственная форма фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность фармацевтическая субстанция вспомогательные вещества лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физикохимических свойств лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности
ГЛФ Федеральный закон от 12. 04. 2010 N 61 ФЗ "Об обращении лекарственных средств “ лекарственная форма фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность фармацевтическая субстанция вспомогательные вещества лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физикохимических свойств лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности
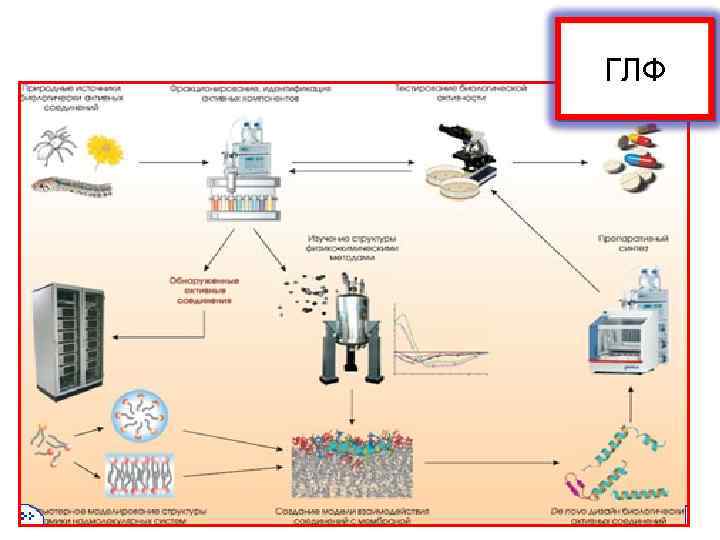 ГЛФ
ГЛФ
 http: //ru. wikipedia. org/wiki/%D 2%E 5%F 5%ED%EE%EB%EE%E 3%E 8%FF • В конце XVIII века в общем массиве знаний о технике стали различать традиционный описательный раздел и новый, нарождающийся, который получил название «технология» . Иоганн Бекман (1739— 1811) ввел в научное употребление термин «технология» , которым он назвал научную дисциплину, читавшуюся им в германском университете в Геттинге с 1772 г. • Технология — в широком смысле — объём знаний, которые можно использовать для производства товаров и услуг из экономических ресурсов. • Технология — в узком смысле — способ преобразования вещества, энергии, информации в процессе изготовления продукции, обработки и переработки материалов, сборки готовых изделий, контроля качества, управления. • Технология включает в себе методы, приемы, режим работы, последовательность операций и процедур, она тесно связана с применяемыми средствами, оборудованием, инструментами, используемыми материалами.
http: //ru. wikipedia. org/wiki/%D 2%E 5%F 5%ED%EE%EB%EE%E 3%E 8%FF • В конце XVIII века в общем массиве знаний о технике стали различать традиционный описательный раздел и новый, нарождающийся, который получил название «технология» . Иоганн Бекман (1739— 1811) ввел в научное употребление термин «технология» , которым он назвал научную дисциплину, читавшуюся им в германском университете в Геттинге с 1772 г. • Технология — в широком смысле — объём знаний, которые можно использовать для производства товаров и услуг из экономических ресурсов. • Технология — в узком смысле — способ преобразования вещества, энергии, информации в процессе изготовления продукции, обработки и переработки материалов, сборки готовых изделий, контроля качества, управления. • Технология включает в себе методы, приемы, режим работы, последовательность операций и процедур, она тесно связана с применяемыми средствами, оборудованием, инструментами, используемыми материалами.
 ТЕХНОЛОГИЯ (от греч. techne - искусство и logos - слово, учение) способ преобразования вещества, энергии, информации в процессе изготовления продукции, обработки и переработки материалов, сборки готовых изделий, контроля качества, управления. dic. academic. ru›dic. nsf/econ_dict/14610 Технология и стандартизация готовых лекарственных форм (ГЛФ) Стандартизация, процесс установления и применения стандартов. Определение стандартизации, данное Международной организацией по стандартизации (МОС; ИСО): "Стандартизация — установление и применение правил с целью упорядочения деятельности в определённой области… БСЭ
ТЕХНОЛОГИЯ (от греч. techne - искусство и logos - слово, учение) способ преобразования вещества, энергии, информации в процессе изготовления продукции, обработки и переработки материалов, сборки готовых изделий, контроля качества, управления. dic. academic. ru›dic. nsf/econ_dict/14610 Технология и стандартизация готовых лекарственных форм (ГЛФ) Стандартизация, процесс установления и применения стандартов. Определение стандартизации, данное Международной организацией по стандартизации (МОС; ИСО): "Стандартизация — установление и применение правил с целью упорядочения деятельности в определённой области… БСЭ
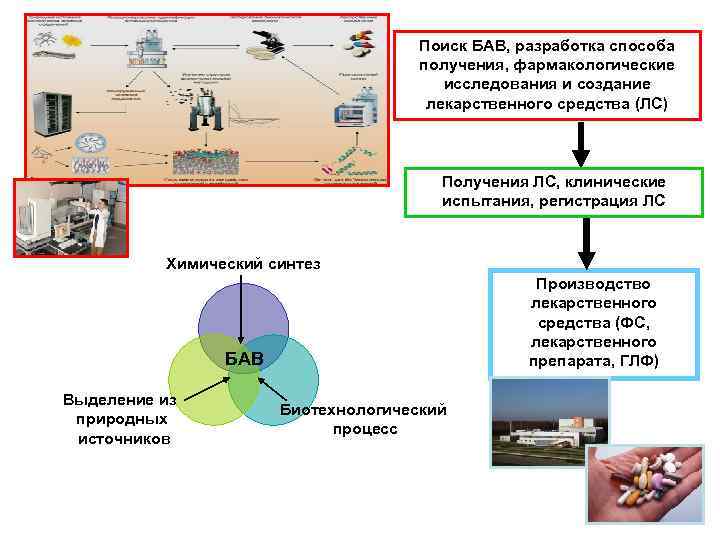 Поиск БАВ, разработка способа получения, фармакологические исследования и создание лекарственного средства (ЛС) Получения ЛС, клинические испытания, регистрация ЛС Химический синтез Производство лекарственного средства (ФС, лекарственного препарата, ГЛФ) БАВ Выделение из природных источников Биотехнологический процесс
Поиск БАВ, разработка способа получения, фармакологические исследования и создание лекарственного средства (ЛС) Получения ЛС, клинические испытания, регистрация ЛС Химический синтез Производство лекарственного средства (ФС, лекарственного препарата, ГЛФ) БАВ Выделение из природных источников Биотехнологический процесс
 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ ФЕДЕРАЦИИ СТАНДАРТ ОТРАСЛИ ПРОДУКЦИЯ МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ. ТЕХНОЛОГИЧЕСКИЕ РЕГЛАМЕНТЫ ПРОИЗВОДСТВА. СОДЕРЖАНИЕ, ПОРЯДОК РАЗРАБОТКИ, СОГЛАСОВАНИЯ И УТВЕРЖДЕНИЯ. ОСТ 42 -505 -96 2. СОДЕРЖАНИЕ РЕГЛАМЕНТА 2. 1. Промышленный регламент должен состоять из следующих разделов: - характеристика конечной продукции производства, - химическая схема производства, - технологическая схема производства, - аппаратурная схема производства и спецификации оборудования, - характеристика сырья, материалов и полупродуктов, - изложение технологического процесса, - материальный баланс, - переработка и обезвреживание отходов производства, - контроль производства и управление технологическим процессом, - техника безопасности, пожарная безопасность и производственная санитария, - охрана окружающей среды, - перечень производственных инструкций, - технико - экономические нормативы <*>, - информационные материалы <*>.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ ФЕДЕРАЦИИ СТАНДАРТ ОТРАСЛИ ПРОДУКЦИЯ МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ. ТЕХНОЛОГИЧЕСКИЕ РЕГЛАМЕНТЫ ПРОИЗВОДСТВА. СОДЕРЖАНИЕ, ПОРЯДОК РАЗРАБОТКИ, СОГЛАСОВАНИЯ И УТВЕРЖДЕНИЯ. ОСТ 42 -505 -96 2. СОДЕРЖАНИЕ РЕГЛАМЕНТА 2. 1. Промышленный регламент должен состоять из следующих разделов: - характеристика конечной продукции производства, - химическая схема производства, - технологическая схема производства, - аппаратурная схема производства и спецификации оборудования, - характеристика сырья, материалов и полупродуктов, - изложение технологического процесса, - материальный баланс, - переработка и обезвреживание отходов производства, - контроль производства и управление технологическим процессом, - техника безопасности, пожарная безопасность и производственная санитария, - охрана окружающей среды, - перечень производственных инструкций, - технико - экономические нормативы <*>, - информационные материалы <*>.
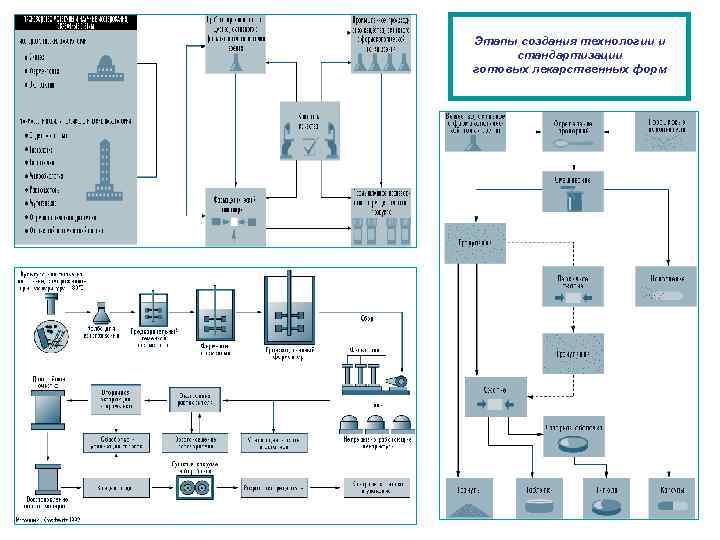 Этапы создания технологии и стандартизации готовых лекарственных форм
Этапы создания технологии и стандартизации готовых лекарственных форм
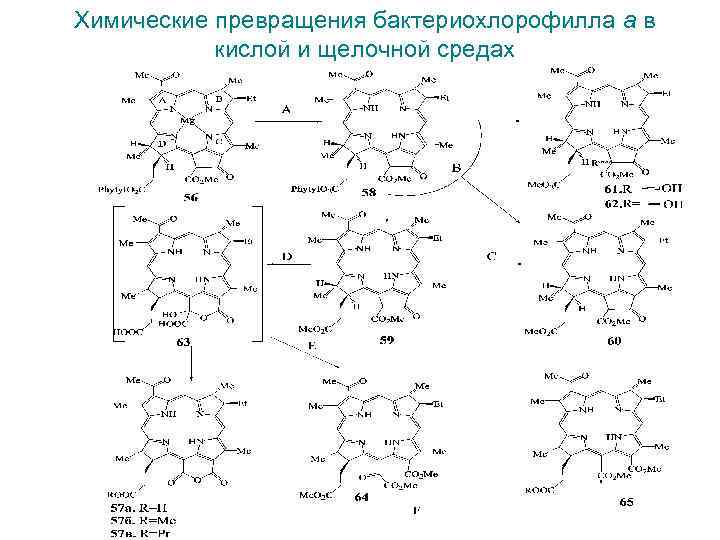 Химические превращения бактериохлорофилла а в кислой и щелочной средах
Химические превращения бактериохлорофилла а в кислой и щелочной средах
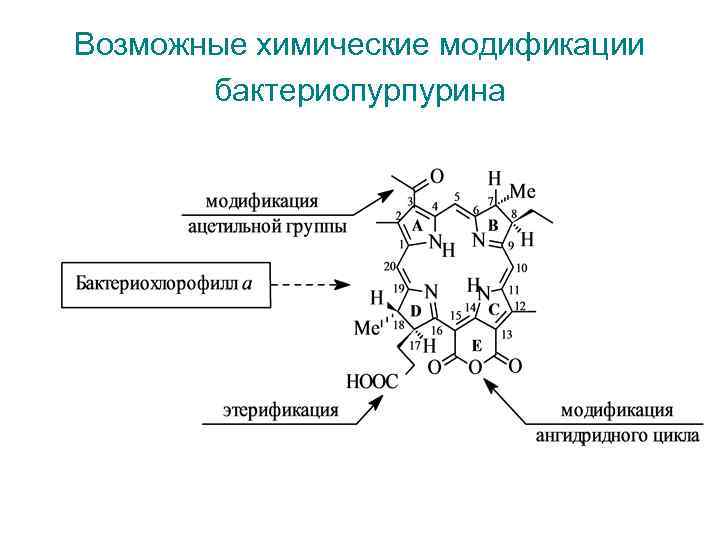 Возможные химические модификации бактериопурпурина
Возможные химические модификации бактериопурпурина
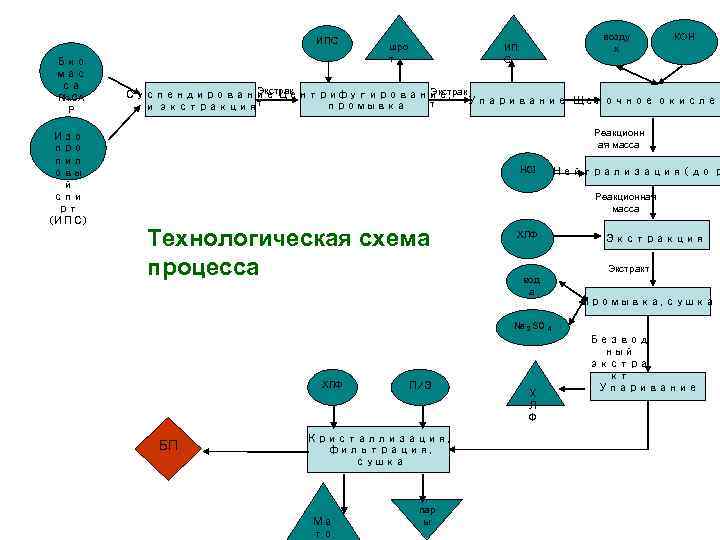 ИПС Био мас са Rh. CA P Изо про пил овы й спи рт (ИПС) шро т возду х ИП С КОН Экстрак Суспендирование Центрифугирование, Упаривание Щелочное окислен т т промывка и экстракция Реакционн ая масса HCI Нейтрализация ( до р Реакционная масса Технологическая схема процесса ХЛФ Экстракция Экстракт вод а Промывка, сушка Na 2 SO ХЛФ БП П/Э Кристаллизация, фильтрация, сушка Ма то пар ы Х Л Ф 4 Безвод ный экстра кт Упаривание
ИПС Био мас са Rh. CA P Изо про пил овы й спи рт (ИПС) шро т возду х ИП С КОН Экстрак Суспендирование Центрифугирование, Упаривание Щелочное окислен т т промывка и экстракция Реакционн ая масса HCI Нейтрализация ( до р Реакционная масса Технологическая схема процесса ХЛФ Экстракция Экстракт вод а Промывка, сушка Na 2 SO ХЛФ БП П/Э Кристаллизация, фильтрация, сушка Ма то пар ы Х Л Ф 4 Безвод ный экстра кт Упаривание
 Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств « • разработка, • доклинические исследования, • экспертиза, • государственная регистрация, • стандартизация и контроль качества, • производство, • изготовление, • хранение, • перевозка, • ввоз на территорию РФ, • вывоз с территории РФ, • реклама, • отпуск, • реализация, • передача, • применение, • уничтожение лекарственных средств
Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств « • разработка, • доклинические исследования, • экспертиза, • государственная регистрация, • стандартизация и контроль качества, • производство, • изготовление, • хранение, • перевозка, • ввоз на территорию РФ, • вывоз с территории РФ, • реклама, • отпуск, • реализация, • передача, • применение, • уничтожение лекарственных средств
 Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств" ГОСТ Р 52249 -2009 Правила производства и контроля качества лекарственных средств ОСТ 91500. 05. 001 -00“Стандарты качества лекарственных средств. Основные положения”, ОСТ 42 -505 -96 «Продукция медицинской промышленности. технологические регламенты производства. содержание, порядок разработки, согласования и утверждения» . http: //www. unico 94. ru/official/docs/show/? id=184 Государственная фармакопея (ГФ) - сборник государственных стандартов качества лекарственных средств, имеющий обязательный характер В 1999 г. был создан ФГУ “Научный центр экспертизы и государственного контроля лекарственных средств” (НЦ ЭГКЛС) с целью объединения всех существующих образований контрольно-разрешительной системы для обеспечения повышения качества экспертизы и контроля лекарственных средств, произведенных в России и за рубежом. Информация об итогах проведения экспертизы может быть получена на сайте: www. roszdravnadzor. ru
Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств" ГОСТ Р 52249 -2009 Правила производства и контроля качества лекарственных средств ОСТ 91500. 05. 001 -00“Стандарты качества лекарственных средств. Основные положения”, ОСТ 42 -505 -96 «Продукция медицинской промышленности. технологические регламенты производства. содержание, порядок разработки, согласования и утверждения» . http: //www. unico 94. ru/official/docs/show/? id=184 Государственная фармакопея (ГФ) - сборник государственных стандартов качества лекарственных средств, имеющий обязательный характер В 1999 г. был создан ФГУ “Научный центр экспертизы и государственного контроля лекарственных средств” (НЦ ЭГКЛС) с целью объединения всех существующих образований контрольно-разрешительной системы для обеспечения повышения качества экспертизы и контроля лекарственных средств, произведенных в России и за рубежом. Информация об итогах проведения экспертизы может быть получена на сайте: www. roszdravnadzor. ru
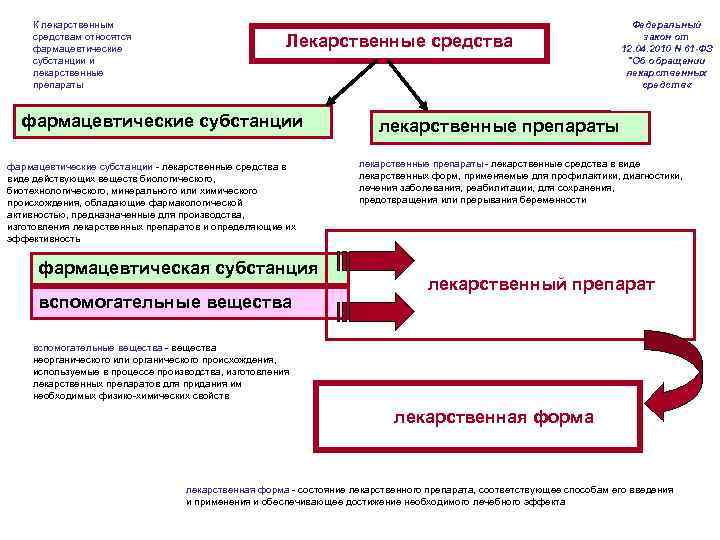 К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты Лекарственные средства фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности фармацевтическая субстанция лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств « лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта
К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты Лекарственные средства фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности фармацевтическая субстанция лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств « лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта
 Классификация лекарственных форм • I. Классификация лекарственных форм по агрегатному состоянию. • II. Классификация лекарственных форм в зависимости от способа применения или метода дозирования. • III. Классификация лекарственных форм в зависимости от способа введения в организм.
Классификация лекарственных форм • I. Классификация лекарственных форм по агрегатному состоянию. • II. Классификация лекарственных форм в зависимости от способа применения или метода дозирования. • III. Классификация лекарственных форм в зависимости от способа введения в организм.
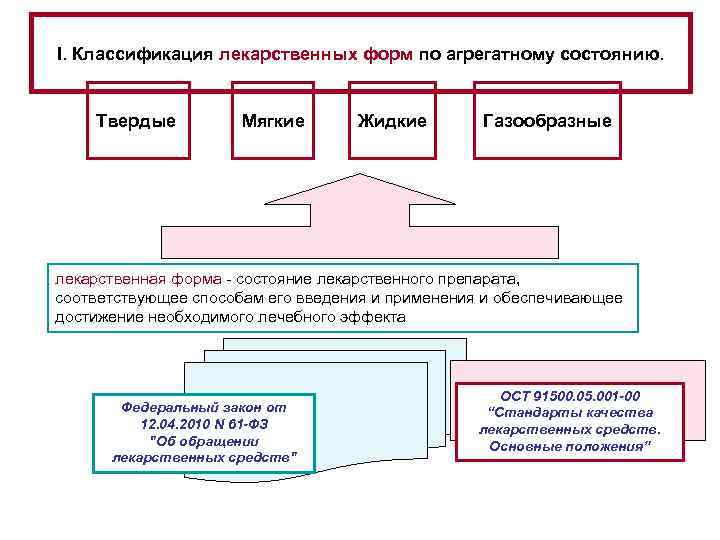 I. Классификация лекарственных форм по агрегатному состоянию. Твердые Мягкие Жидкие Газообразные лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств" ОСТ 91500. 05. 001 -00 “Стандарты качества лекарственных средств. Основные положения”
I. Классификация лекарственных форм по агрегатному состоянию. Твердые Мягкие Жидкие Газообразные лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта Федеральный закон от 12. 04. 2010 N 61 -ФЗ "Об обращении лекарственных средств" ОСТ 91500. 05. 001 -00 “Стандарты качества лекарственных средств. Основные положения”
 Твердые лекарственные формы таблетки – дозированная лекарственная форма, получаемая путем прессования или формирования лекарственного средства, лекарственных смесей и вспомогательных веществ; драже – дозированная лекарственная форма округлой формы, получаемая путем многократного наслаивания лекарственных средств и вспомогательных веществ в гранулы; гранулы – однородные частицы (крупинки, зернышки) лекарственных средств округлой, цилиндрической или неправильной формы размером 0, 2 – 0, 3 мм. ; порошки – лекарственные формы, обладающие сыпучестью; различают порошки простые (однокомпонентные) и сложные (из двух и более компонентов), разделенные на отдельные дозы и неразделенные; сборы – смесь нескольких видов изрезанного, истолченного в крупный порошок или цельного лекарственного сырья растений - иногда с добавлением других лекарственных средств; капсулы – дозированные порошкообразные, гранулированные, иногда жидкие лекарственные средства, заключенные в оболочку из желатина, крахмала, иного биополимера; спансулы – капсулы, в которых содержимым является определенное количество гранул или микрокапсул; карандаши лекарственные (медицинские) – цилиндрические палочки толщиной 4 -8 мм и длиной до 10 см с заостренным или закругленным концом; пленки лекарственные – лекарственная форма в виде полимерной пленки.
Твердые лекарственные формы таблетки – дозированная лекарственная форма, получаемая путем прессования или формирования лекарственного средства, лекарственных смесей и вспомогательных веществ; драже – дозированная лекарственная форма округлой формы, получаемая путем многократного наслаивания лекарственных средств и вспомогательных веществ в гранулы; гранулы – однородные частицы (крупинки, зернышки) лекарственных средств округлой, цилиндрической или неправильной формы размером 0, 2 – 0, 3 мм. ; порошки – лекарственные формы, обладающие сыпучестью; различают порошки простые (однокомпонентные) и сложные (из двух и более компонентов), разделенные на отдельные дозы и неразделенные; сборы – смесь нескольких видов изрезанного, истолченного в крупный порошок или цельного лекарственного сырья растений - иногда с добавлением других лекарственных средств; капсулы – дозированные порошкообразные, гранулированные, иногда жидкие лекарственные средства, заключенные в оболочку из желатина, крахмала, иного биополимера; спансулы – капсулы, в которых содержимым является определенное количество гранул или микрокапсул; карандаши лекарственные (медицинские) – цилиндрические палочки толщиной 4 -8 мм и длиной до 10 см с заостренным или закругленным концом; пленки лекарственные – лекарственная форма в виде полимерной пленки.
 Мягкие лекарственные формы мази – лекарственные формы мягкой консистенции для наружного применения; при содержании в мази порошкообразного вещества свыше 25% мази называют пастами; пластыри – лекарственная форма для наружного применения в виде пластичной массы, обладающей способностью после размягчения при температуре тела прилипать к коже; пластыри наносятся на плоскую поверхность тела; суппозитории (свечи) – твердые при комнатной температуре и расплавляющиеся при температуре тела дозированные лекарственные формы, предназначенные для введения в полости тела (ректальные, вагинальные свечи); суппозитории могут иметь форму шарика, конуса, цилиндра, сигары и т. д. пилюли – дозированная лекарственная форма в виде шарика весом от 0, 1 до 0, 5 г, приготовленная из однородной пластической массы, содержащей лекарственные средства и вспомогательные вещества; пилюля весом более 0, 5 г называется болюсом.
Мягкие лекарственные формы мази – лекарственные формы мягкой консистенции для наружного применения; при содержании в мази порошкообразного вещества свыше 25% мази называют пастами; пластыри – лекарственная форма для наружного применения в виде пластичной массы, обладающей способностью после размягчения при температуре тела прилипать к коже; пластыри наносятся на плоскую поверхность тела; суппозитории (свечи) – твердые при комнатной температуре и расплавляющиеся при температуре тела дозированные лекарственные формы, предназначенные для введения в полости тела (ректальные, вагинальные свечи); суппозитории могут иметь форму шарика, конуса, цилиндра, сигары и т. д. пилюли – дозированная лекарственная форма в виде шарика весом от 0, 1 до 0, 5 г, приготовленная из однородной пластической массы, содержащей лекарственные средства и вспомогательные вещества; пилюля весом более 0, 5 г называется болюсом.
 Жидкие лекарственные формы растворы – лекарственные формы, полученные путем растворения одного или нескольких лекарственных средств; суспензии (взвеси) - системы, в которых твердое вещество взвешено в жидком и размер частиц колеблется от 0, 1 до 10 мкм; эмульсии – лекарственные формы, образованные нерастворимыми друг в друге жидкостями; настои и отвары – водяные вытяжки из лекарственного растительного сырья или водные растворы экстрактов; слизи – лекарственные формы высокой вязкости, а также приготовленные с применением крахмала из водной вытяжки растительного сырья; линименты – густые жидкости или студнеобразные массы; пластыри жидкие – при нанесении на кожу оставляют эластичную пленку; сиропы лекарственные – раствор лекарственного вещества в густом растворе сахара; настойки – спиртовое, водно-спиртовое или спирто-эфирное прозрачные извлечения из лекарственного растительного сырья, полученные без нагревания и удаления экстрактов; экстракты – концентрированные извлечения из лекарственного растительного сырья; различают жидкие, густые, сухие и другие виды экстрактов.
Жидкие лекарственные формы растворы – лекарственные формы, полученные путем растворения одного или нескольких лекарственных средств; суспензии (взвеси) - системы, в которых твердое вещество взвешено в жидком и размер частиц колеблется от 0, 1 до 10 мкм; эмульсии – лекарственные формы, образованные нерастворимыми друг в друге жидкостями; настои и отвары – водяные вытяжки из лекарственного растительного сырья или водные растворы экстрактов; слизи – лекарственные формы высокой вязкости, а также приготовленные с применением крахмала из водной вытяжки растительного сырья; линименты – густые жидкости или студнеобразные массы; пластыри жидкие – при нанесении на кожу оставляют эластичную пленку; сиропы лекарственные – раствор лекарственного вещества в густом растворе сахара; настойки – спиртовое, водно-спиртовое или спирто-эфирное прозрачные извлечения из лекарственного растительного сырья, полученные без нагревания и удаления экстрактов; экстракты – концентрированные извлечения из лекарственного растительного сырья; различают жидкие, густые, сухие и другие виды экстрактов.
 Газообразные лекарственные формы аэрозоль – лекарственная форма в специальной упаковке, в которой твердые или жидкие лекарственные средства находятся в газе или газообразном веществе
Газообразные лекарственные формы аэрозоль – лекарственная форма в специальной упаковке, в которой твердые или жидкие лекарственные средства находятся в газе или газообразном веществе
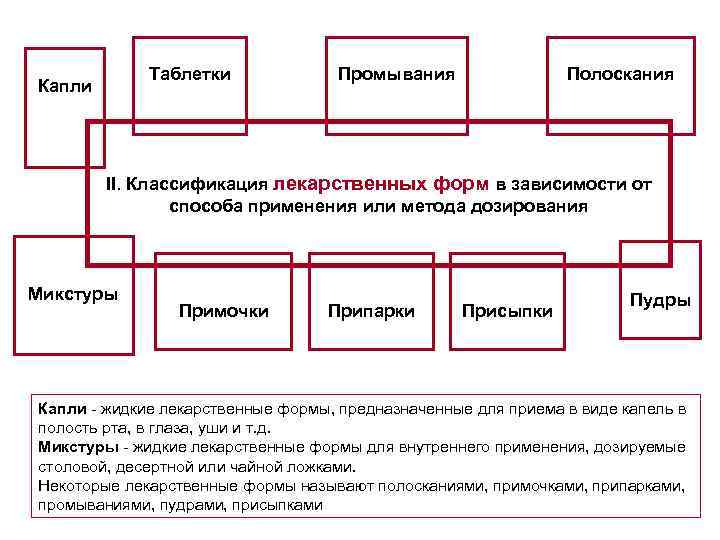 Таблетки Капли Промывания Полоскания II. Классификация лекарственных форм в зависимости от способа применения или метода дозирования Микстуры Примочки Припарки Присыпки Пудры Капли - жидкие лекарственные формы, предназначенные для приема в виде капель в полость рта, в глаза, уши и т. д. Микстуры - жидкие лекарственные формы для внутреннего применения, дозируемые столовой, десертной или чайной ложками. Некоторые лекарственные формы называют полосканиями, примочками, припарками, промываниями, пудрами, присыпками
Таблетки Капли Промывания Полоскания II. Классификация лекарственных форм в зависимости от способа применения или метода дозирования Микстуры Примочки Припарки Присыпки Пудры Капли - жидкие лекарственные формы, предназначенные для приема в виде капель в полость рта, в глаза, уши и т. д. Микстуры - жидкие лекарственные формы для внутреннего применения, дозируемые столовой, десертной или чайной ложками. Некоторые лекарственные формы называют полосканиями, примочками, припарками, промываниями, пудрами, присыпками
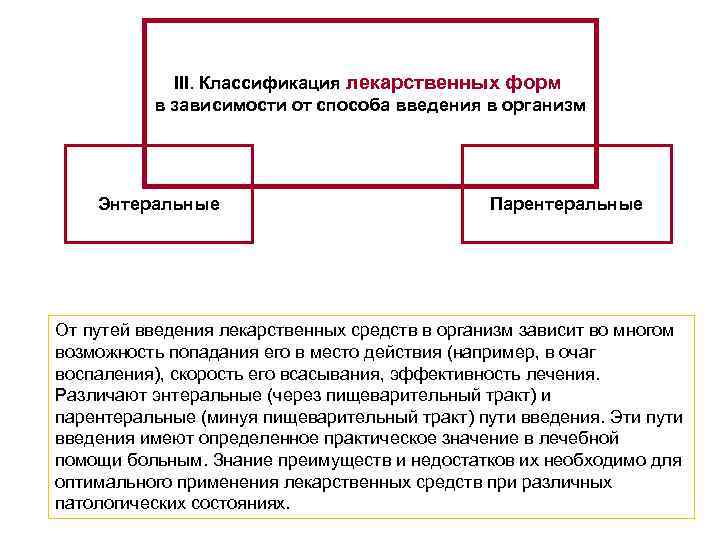 III. Классификация лекарственных форм в зависимости от способа введения в организм Энтеральные Парентеральные От путей введения лекарственных средств в организм зависит во многом вoзмoжнoсть попадания его в место действия (например, в очаг воспаления), скорость его всасывания, эффективность лечения. Различают энтеральные (через пищеварительный тракт) и парентеральные (минуя пищеварительный тракт) пути введения. Эти пути введения имеют определенное практическое значение в лечебной помощи больным. Знание преимуществ и недостатков их необходимо для оптимального применения лекарственных средств при различных патологических состояниях.
III. Классификация лекарственных форм в зависимости от способа введения в организм Энтеральные Парентеральные От путей введения лекарственных средств в организм зависит во многом вoзмoжнoсть попадания его в место действия (например, в очаг воспаления), скорость его всасывания, эффективность лечения. Различают энтеральные (через пищеварительный тракт) и парентеральные (минуя пищеварительный тракт) пути введения. Эти пути введения имеют определенное практическое значение в лечебной помощи больным. Знание преимуществ и недостатков их необходимо для оптимального применения лекарственных средств при различных патологических состояниях.
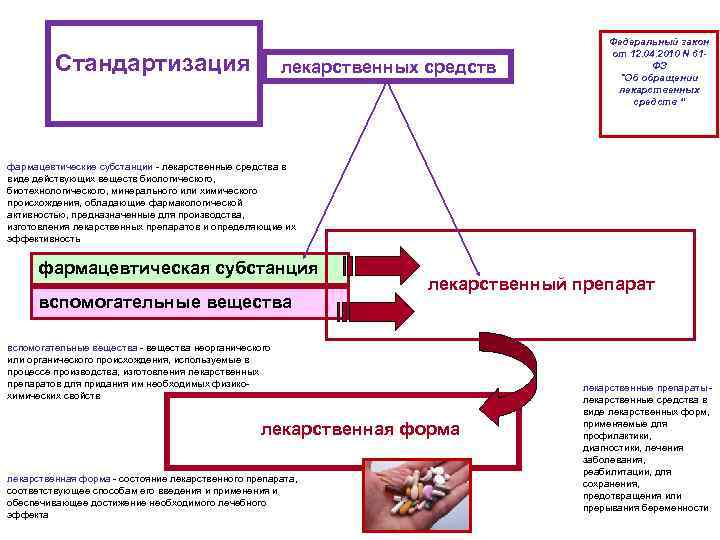 Стандартизация лекарственных средств фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность фармацевтическая субстанция вспомогательные вещества лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физикохимических свойств лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта Федеральный закон от 12. 04. 2010 N 61 ФЗ "Об обращении лекарственных средств “ лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности
Стандартизация лекарственных средств фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность фармацевтическая субстанция вспомогательные вещества лекарственный препарат вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физикохимических свойств лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта Федеральный закон от 12. 04. 2010 N 61 ФЗ "Об обращении лекарственных средств “ лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности
 http: //www. medical-enc. ru/17/standardization. shtml Стандартизация лекарственных средств (лекарственных препаратов) Стандартизация лекарственных средств — определение количественных показателей, характеризующих качество лекарственных препаратов, и доведение испытуемых образцов до установленных стандартов. В большинстве случаев стандартизация лекарственных средств проводится при помощи химических и физико-химических методов исследования. ЛФ Автор: Краснов/Кадырова Название: Стандартизация лекарственных средств. учеб. пособие Издательство: Сибир. унив. изд-во, 2008
http: //www. medical-enc. ru/17/standardization. shtml Стандартизация лекарственных средств (лекарственных препаратов) Стандартизация лекарственных средств — определение количественных показателей, характеризующих качество лекарственных препаратов, и доведение испытуемых образцов до установленных стандартов. В большинстве случаев стандартизация лекарственных средств проводится при помощи химических и физико-химических методов исследования. ЛФ Автор: Краснов/Кадырова Название: Стандартизация лекарственных средств. учеб. пособие Издательство: Сибир. унив. изд-во, 2008
 В тех случаях, когда точно не установлен химический состав лекарственных препаратов или они содержат биологически активные вещества в настолько малом весовом количестве, что оно не определяется химическим путем, их подвергают биологической валоризации или биологической стандартизации. Биологической стандартизации подлежит большинство сердечных гликозидов, органопрепараты, многие антибиотики и другие лекарственные средства. Биологическая стандартизация проводится на животных, изолированных органах, культурах микроорганизмов с помощью методов, позволяющих оценивать наиболее важную в терапевтическом отношении сторону действия данного препарата Так, например, активность препаратов сердечных гликозидов определяется по их способности вызывать систолическую остановку сердца у лягушек, кошек, голубей. Об активности инсулина судят по снижению уровня сахара в крови у кроликов, питуитрина — по сокращению гладкой мускулатуры матки морской свинки. При стандартизации антибиотиков определяют концентрацию, в которой они угнетают рост тест-микробов. . При использовании перечисленных методов активность испытываемого препарата сопоставляется со стандартным, обладающим постоянной активностью, выражаемой в условных единицах действия (ЕД). Для некоторых лекарственных препаратов установлены международные стандарты и соответственные интернациональные или международные единицы действия (ИЕ или ME). Для большей достоверности результатов биологическая стандартизация проводится на достаточном количестве животных с использованием методов математической статистики. Для препаратов, подлежащих обязательной биологической стандартизации, подробные описания стандартов и методов стандартизации приводятся в Государственной фармакопее.
В тех случаях, когда точно не установлен химический состав лекарственных препаратов или они содержат биологически активные вещества в настолько малом весовом количестве, что оно не определяется химическим путем, их подвергают биологической валоризации или биологической стандартизации. Биологической стандартизации подлежит большинство сердечных гликозидов, органопрепараты, многие антибиотики и другие лекарственные средства. Биологическая стандартизация проводится на животных, изолированных органах, культурах микроорганизмов с помощью методов, позволяющих оценивать наиболее важную в терапевтическом отношении сторону действия данного препарата Так, например, активность препаратов сердечных гликозидов определяется по их способности вызывать систолическую остановку сердца у лягушек, кошек, голубей. Об активности инсулина судят по снижению уровня сахара в крови у кроликов, питуитрина — по сокращению гладкой мускулатуры матки морской свинки. При стандартизации антибиотиков определяют концентрацию, в которой они угнетают рост тест-микробов. . При использовании перечисленных методов активность испытываемого препарата сопоставляется со стандартным, обладающим постоянной активностью, выражаемой в условных единицах действия (ЕД). Для некоторых лекарственных препаратов установлены международные стандарты и соответственные интернациональные или международные единицы действия (ИЕ или ME). Для большей достоверности результатов биологическая стандартизация проводится на достаточном количестве животных с использованием методов математической статистики. Для препаратов, подлежащих обязательной биологической стандартизации, подробные описания стандартов и методов стандартизации приводятся в Государственной фармакопее.
 Государственные стандарты качества лекарственных средств http: //www. unico 94. ru/official/docs/show/? id=184 УТВЕРЖДЕНО Приказом Министерства здравоохранения Российской Федерации от 01. 11. 2001 N 388 ОТРАСЛЕВОЙ СТАНДАРТЫ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОСТ 91500. 05. 001 -00 • I. Общие положения • 1. 1. Отраслевой стандарт 91500. 05. 001 -00 "Стандарты качества лекарственных средств. Основные положения" (далее - ОСТ) разработан в соответствии с Законом Российской Федерации от 10. 06. 1993 N 5154 -1 "О стандартизации", Федеральным законом от 22. 06. 1998 N 86 -ФЗ "О лекарственных средствах", Положением о Министерстве здравоохранения Российской Федерации, утвержденным Постановлением Правительства Российской Федерации от 03. 06. 1997 N 659 (с изменениями и дополнениями).
Государственные стандарты качества лекарственных средств http: //www. unico 94. ru/official/docs/show/? id=184 УТВЕРЖДЕНО Приказом Министерства здравоохранения Российской Федерации от 01. 11. 2001 N 388 ОТРАСЛЕВОЙ СТАНДАРТЫ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОСТ 91500. 05. 001 -00 • I. Общие положения • 1. 1. Отраслевой стандарт 91500. 05. 001 -00 "Стандарты качества лекарственных средств. Основные положения" (далее - ОСТ) разработан в соответствии с Законом Российской Федерации от 10. 06. 1993 N 5154 -1 "О стандартизации", Федеральным законом от 22. 06. 1998 N 86 -ФЗ "О лекарственных средствах", Положением о Министерстве здравоохранения Российской Федерации, утвержденным Постановлением Правительства Российской Федерации от 03. 06. 1997 N 659 (с изменениями и дополнениями).
 • 1. 2. Настоящий ОСТ устанавливает порядок разработки, оформления, экспертизы, согласования, утверждения, присвоения обозначения, регистрации государственных стандартов качества лекарственных средств и внесения в них изменений. 1. 3. Настоящий ОСТ не распространяется: - на кровь и ее компоненты, используемые в трансфузиологии; - на сырье животного происхождения, используемое только для приготовления продуктов, подлежащих дальнейшей промышленной переработке для приготовления лекарственных средств; - на лекарственные средства зарубежного производства; - на лекарственные средства, изготавливаемые в аптечных учреждениях.
• 1. 2. Настоящий ОСТ устанавливает порядок разработки, оформления, экспертизы, согласования, утверждения, присвоения обозначения, регистрации государственных стандартов качества лекарственных средств и внесения в них изменений. 1. 3. Настоящий ОСТ не распространяется: - на кровь и ее компоненты, используемые в трансфузиологии; - на сырье животного происхождения, используемое только для приготовления продуктов, подлежащих дальнейшей промышленной переработке для приготовления лекарственных средств; - на лекарственные средства зарубежного производства; - на лекарственные средства, изготавливаемые в аптечных учреждениях.
 • II. Термины и определения Для целей настоящего ОСТа используются следующие термины с соответствующими определениями: вспомогательные вещества - это вещества органической или неорганической природы, которые используют в процессе производства готовых лекарственных форм для придания им необходимых свойств. Перечень вспомогательных веществ обширен; в зависимости от вида лекарственной формы это могут быть вещества, увеличивающие вязкость, поверхностно - активные и буферные, корригенты, консерванты, стабилизаторы, наполнители, разрыхлители, скользящие и др. ; гомеопатические лекарственные средства - одно или многокомпонентные препараты, содержащие, как правило, микродозы активных соединений, производящиеся по специальной технологии и предназначенные для перорального, инъекционного или местного применения в виде различных лекарственных форм; государственный стандартный образец - это стандартный образец, параметры качества которого регламентируются фармакопейной статьей, утвержденной в установленном порядке. В анализе готовых лекарственных форм могут использоваться рабочие стандартные образцы лекарственных веществ (субстанций);
• II. Термины и определения Для целей настоящего ОСТа используются следующие термины с соответствующими определениями: вспомогательные вещества - это вещества органической или неорганической природы, которые используют в процессе производства готовых лекарственных форм для придания им необходимых свойств. Перечень вспомогательных веществ обширен; в зависимости от вида лекарственной формы это могут быть вещества, увеличивающие вязкость, поверхностно - активные и буферные, корригенты, консерванты, стабилизаторы, наполнители, разрыхлители, скользящие и др. ; гомеопатические лекарственные средства - одно или многокомпонентные препараты, содержащие, как правило, микродозы активных соединений, производящиеся по специальной технологии и предназначенные для перорального, инъекционного или местного применения в виде различных лекарственных форм; государственный стандартный образец - это стандартный образец, параметры качества которого регламентируются фармакопейной статьей, утвержденной в установленном порядке. В анализе готовых лекарственных форм могут использоваться рабочие стандартные образцы лекарственных веществ (субстанций);
 • государственная фармакопея - сборник фармакопейных статей <*>; • изготовление лекарственных средств - изготовление лекарственных средств в аптечном учреждении, имеющем лицензию на фармацевтическую деятельность, по правилам изготовления лекарственных средств, утвержденным федеральным органом контроля качества лекарственных средств; • иммунобиологические лекарственные средства - лекарственные средства, предназначенные для иммунологической профилактики и иммунологической терапии <*>; • компоненты крови - клетки и форменные элементы крови, плазма крови, полученные из крови и предназначенные для введения реципиенту; кровь - жидкость, полученная от донора - человека, состоящая из клеточных элементов и плазмы, и используемая после надлежащей проверки для получения отдельных компонентов и введения реципиенту;
• государственная фармакопея - сборник фармакопейных статей <*>; • изготовление лекарственных средств - изготовление лекарственных средств в аптечном учреждении, имеющем лицензию на фармацевтическую деятельность, по правилам изготовления лекарственных средств, утвержденным федеральным органом контроля качества лекарственных средств; • иммунобиологические лекарственные средства - лекарственные средства, предназначенные для иммунологической профилактики и иммунологической терапии <*>; • компоненты крови - клетки и форменные элементы крови, плазма крови, полученные из крови и предназначенные для введения реципиенту; кровь - жидкость, полученная от донора - человека, состоящая из клеточных элементов и плазмы, и используемая после надлежащей проверки для получения отдельных компонентов и введения реципиенту;
 • лекарственные средства - вещества, применяемые для профилактики, диагностики, лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся также вещества растительного, животного или синтетического происхождения, обладающие фармакологической активностью и предназначенные для производства и изготовления лекарственных средств <*>; • лекарственные препараты - дозированные лекарственные средства в определенной лекарственной форме; • лекарственная форма - придаваемое лекарственному средству или лекарственному растительному сырью удобное для применения состояние, при котором достигается необходимый лечебный эффект (определения лекарственных форм, которые могут быть использованы при подготовке государственных стандартов качества лекарственных средств, приведены в приложении N 1 к настоящему ОСТу);
• лекарственные средства - вещества, применяемые для профилактики, диагностики, лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся также вещества растительного, животного или синтетического происхождения, обладающие фармакологической активностью и предназначенные для производства и изготовления лекарственных средств <*>; • лекарственные препараты - дозированные лекарственные средства в определенной лекарственной форме; • лекарственная форма - придаваемое лекарственному средству или лекарственному растительному сырью удобное для применения состояние, при котором достигается необходимый лечебный эффект (определения лекарственных форм, которые могут быть использованы при подготовке государственных стандартов качества лекарственных средств, приведены в приложении N 1 к настоящему ОСТу);
 • международное непатентованное название (МНН) - название лекарственного средства, принятое Всемирной организацией здравоохранения (ВОЗ); • обращение лекарственных средств - обобщенное понятие деятельности, включающей разработку, исследования, производство, изготовление, хранение, упаковку, перевозку, государственную регистрацию, стандартизацию и контроль качества, продажу, маркировку, рекламу, применение лекарственных средств, уничтожение лекарственных средств, пришедших в негодность, или лекарственных средств с истекшим сроком годности и иные действия в сфере обращения лекарственных средств <*>; • организация - разработчик лекарственного средства - организация, обладающая патентными правами на лекарственное средство и авторскими правами на результаты его доклинических исследований <*>; • предприятие - производитель лекарственных средств - организация, осуществляющая производство лекарственных средств в соответствии с требованиями настоящего Федерального закона <*>;
• международное непатентованное название (МНН) - название лекарственного средства, принятое Всемирной организацией здравоохранения (ВОЗ); • обращение лекарственных средств - обобщенное понятие деятельности, включающей разработку, исследования, производство, изготовление, хранение, упаковку, перевозку, государственную регистрацию, стандартизацию и контроль качества, продажу, маркировку, рекламу, применение лекарственных средств, уничтожение лекарственных средств, пришедших в негодность, или лекарственных средств с истекшим сроком годности и иные действия в сфере обращения лекарственных средств <*>; • организация - разработчик лекарственного средства - организация, обладающая патентными правами на лекарственное средство и авторскими правами на результаты его доклинических исследований <*>; • предприятие - производитель лекарственных средств - организация, осуществляющая производство лекарственных средств в соответствии с требованиями настоящего Федерального закона <*>;
 • препараты крови - лекарственные препараты, получаемые из крови человека, выпускаемые в жидком, сухом и замороженном виде; патентованные лекарственные средства - лекарственные средства, право на производство и продажу которых охраняется патентным законодательством Российской Федерации <*>; • рабочий стандартный образец - это образец серийной субстанции, отвечающий требованиям соответствующего стандарта качества лекарственных средств; • серия - определенное количество лекарственного средства, полученного в результате одного технологического цикла. Основным требованием к серии является ее однородность; • стандартные образцы - это вещества, применяемые для контроля качества лекарственных средств, с которыми проводят сравнение испытуемых лекарственных средств при проведении их анализа с использованием физико - химических и биологических методов. Стандартные образцы подразделяются условно на химические и биологические; один и тот же стандартный образец в соответствии с указаниями фармакопейной статьи может быть использован и для физико - химических, и для биологических анализов;
• препараты крови - лекарственные препараты, получаемые из крови человека, выпускаемые в жидком, сухом и замороженном виде; патентованные лекарственные средства - лекарственные средства, право на производство и продажу которых охраняется патентным законодательством Российской Федерации <*>; • рабочий стандартный образец - это образец серийной субстанции, отвечающий требованиям соответствующего стандарта качества лекарственных средств; • серия - определенное количество лекарственного средства, полученного в результате одного технологического цикла. Основным требованием к серии является ее однородность; • стандартные образцы - это вещества, применяемые для контроля качества лекарственных средств, с которыми проводят сравнение испытуемых лекарственных средств при проведении их анализа с использованием физико - химических и биологических методов. Стандартные образцы подразделяются условно на химические и биологические; один и тот же стандартный образец в соответствии с указаниями фармакопейной статьи может быть использован и для физико - химических, и для биологических анализов;
 • срок годности - период, в течение которого лекарственное средство должно полностью удовлетворять всем требованиям соответствующего государственного стандарта качества лекарственного средства; • субстанция - вещество растительного, животного, микробного или синтетического происхождения, обладающее фармакологической активностью и предназначенное для производства и изготовления лекарственных препаратов; • фармакопейная статья - государственный стандарт лекарственного средства, содержащий перечень показателей и методов контроля качества лекарственного средства <*> Статья 4 Федерального закона "О лекарственных средствах
• срок годности - период, в течение которого лекарственное средство должно полностью удовлетворять всем требованиям соответствующего государственного стандарта качества лекарственного средства; • субстанция - вещество растительного, животного, микробного или синтетического происхождения, обладающее фармакологической активностью и предназначенное для производства и изготовления лекарственных препаратов; • фармакопейная статья - государственный стандарт лекарственного средства, содержащий перечень показателей и методов контроля качества лекарственного средства <*> Статья 4 Федерального закона "О лекарственных средствах
 • III. Порядок подготовки государственных стандартов качества лекарственных средств • 3. 1. Государственные стандарты качества лекарственных средств разрабатываются и утверждаются в следующих видах: 1) общая фармакопейная статья (ОФС); 2) фармакопейная статья (ФС); 3) фармакопейная статья на лекарственное средство конкретного предприятия - производителя лекарственных средств (ФСП). • 3. 2. Государственные стандарты качества лекарственных средств должны обеспечивать разработку качественного, эффективного и безопасного лекарственного средства. • 3. 3. Государственные стандарты качества лекарственных средств должны своевременно пересматриваться с учетом новых достижений медицинской, фармацевтической и других наук, и положений ведущих зарубежных фармакопей, рекомендаций ведущих международных организаций в области фармацевтической науки. • 3. 4. Общая фармакопейная статья включает в себя перечень нормируемых показателей или методов испытания для конкретной лекарственной формы, описание физических, физико - химических, биохимических, биологических, микробиологических методов анализа лекарственных средств, требования к используемым реактивам, титрованным растворам, индикаторам.
• III. Порядок подготовки государственных стандартов качества лекарственных средств • 3. 1. Государственные стандарты качества лекарственных средств разрабатываются и утверждаются в следующих видах: 1) общая фармакопейная статья (ОФС); 2) фармакопейная статья (ФС); 3) фармакопейная статья на лекарственное средство конкретного предприятия - производителя лекарственных средств (ФСП). • 3. 2. Государственные стандарты качества лекарственных средств должны обеспечивать разработку качественного, эффективного и безопасного лекарственного средства. • 3. 3. Государственные стандарты качества лекарственных средств должны своевременно пересматриваться с учетом новых достижений медицинской, фармацевтической и других наук, и положений ведущих зарубежных фармакопей, рекомендаций ведущих международных организаций в области фармацевтической науки. • 3. 4. Общая фармакопейная статья включает в себя перечень нормируемых показателей или методов испытания для конкретной лекарственной формы, описание физических, физико - химических, биохимических, биологических, микробиологических методов анализа лекарственных средств, требования к используемым реактивам, титрованным растворам, индикаторам.
 • 3. 5. Фармакопейная статья разрабатывается на лекарственное средство под международным непатентованным названием, если оно имеется (для монокомпонентных лекарственных средств), и содержит обязательный перечень показателей и методов контроля качества (с учетом его лекарственной формы), соответствующих положениям ведущих зарубежных фармакопей. • 3. 6. Разработка фармакопейной статьи на оригинальное (патентованное) лекарственное средство в течение срока действия патентной защиты и включение ее в Государственную фармакопею возможны лишь по согласованию с разработчиком лекарственного средства либо, осуществляется после окончания срока действия патента. • 3. 7. Общие фармакопейные статьи и фармакопейные статьи составляют Государственную фармакопею. • 3. 8. Государственная фармакопея издается Минздравом России и подлежит переизданию каждые 5 лет.
• 3. 5. Фармакопейная статья разрабатывается на лекарственное средство под международным непатентованным названием, если оно имеется (для монокомпонентных лекарственных средств), и содержит обязательный перечень показателей и методов контроля качества (с учетом его лекарственной формы), соответствующих положениям ведущих зарубежных фармакопей. • 3. 6. Разработка фармакопейной статьи на оригинальное (патентованное) лекарственное средство в течение срока действия патентной защиты и включение ее в Государственную фармакопею возможны лишь по согласованию с разработчиком лекарственного средства либо, осуществляется после окончания срока действия патента. • 3. 7. Общие фармакопейные статьи и фармакопейные статьи составляют Государственную фармакопею. • 3. 8. Государственная фармакопея издается Минздравом России и подлежит переизданию каждые 5 лет.
 • 3. 9. Фармакопейная статья на лекарственное средство конкретного предприятия - производителя лекарственных средств содержит перечень показателей и методов контроля качества лекарственного средства производства конкретного предприятия и разрабатывается с учетом требований Государственной фармакопеи и настоящего стандарта. Требования к качеству лекарственных средств, содержащиеся в ФСП, должны быть не ниже требований, изложенных в Государственной фармакопее, с учетом требований настоящего стандарта. • 3. 10. Срок действия ФСП устанавливается с учетом уровня технологического процесса конкретного производства лекарственного средства, но не более 5 лет. • 3. 11. При разработке нового лекарственного средства, в случае отсутствия государственного стандарта качества лекарственного средства на субстанцию одновременно с разработкой ФСП на лекарственный препарат, разрабатывается ФСП на субстанцию, используемую для его производства. При разработке нового иммунобиологического лекарственного средства ФСП на субстанцию для его производства разрабатывается в случае необходимости. 3. 12. Общие фармакопейные статьи и фармакопейные статьи разрабатываются организацией, уполномоченной Минздравом России •
• 3. 9. Фармакопейная статья на лекарственное средство конкретного предприятия - производителя лекарственных средств содержит перечень показателей и методов контроля качества лекарственного средства производства конкретного предприятия и разрабатывается с учетом требований Государственной фармакопеи и настоящего стандарта. Требования к качеству лекарственных средств, содержащиеся в ФСП, должны быть не ниже требований, изложенных в Государственной фармакопее, с учетом требований настоящего стандарта. • 3. 10. Срок действия ФСП устанавливается с учетом уровня технологического процесса конкретного производства лекарственного средства, но не более 5 лет. • 3. 11. При разработке нового лекарственного средства, в случае отсутствия государственного стандарта качества лекарственного средства на субстанцию одновременно с разработкой ФСП на лекарственный препарат, разрабатывается ФСП на субстанцию, используемую для его производства. При разработке нового иммунобиологического лекарственного средства ФСП на субстанцию для его производства разрабатывается в случае необходимости. 3. 12. Общие фармакопейные статьи и фармакопейные статьи разрабатываются организацией, уполномоченной Минздравом России •
 • IV. Порядок построения и изложения государственных стандартов качества лекарственных средств • 4. 1. В заглавии государственного стандарта качества лекарственного средства дается название лекарственного средства. • 4. 2. Перечень основных разделов ФС и ФСП и последовательность их изложения с учетом конкретных лекарственных форм приведены в приложении 2 к настоящему ОСТу. • 4. 3. Все показатели качества, содержащиеся в ФСП, должны быть представлены в сводной таблице (спецификации). Спецификация является обязательной составляющей частью ФСП. • 4. 4. Порядок построения государственных стандартов качества лекарственных средств на субстанции, лекарственные препараты и лекарственное растительное сырье приведен в приложениях 3 - 5 к настоящему ОСТу. • 4. 5. Титульные листы ОФС, ФСП должны быть оформлены в соответствии с приложениями 6, 7 и 8 к настоящему ОСТу. Последний лист ФСП должен быть оформлен в соответствии с приложением 9 к настоящему ОСТу
• IV. Порядок построения и изложения государственных стандартов качества лекарственных средств • 4. 1. В заглавии государственного стандарта качества лекарственного средства дается название лекарственного средства. • 4. 2. Перечень основных разделов ФС и ФСП и последовательность их изложения с учетом конкретных лекарственных форм приведены в приложении 2 к настоящему ОСТу. • 4. 3. Все показатели качества, содержащиеся в ФСП, должны быть представлены в сводной таблице (спецификации). Спецификация является обязательной составляющей частью ФСП. • 4. 4. Порядок построения государственных стандартов качества лекарственных средств на субстанции, лекарственные препараты и лекарственное растительное сырье приведен в приложениях 3 - 5 к настоящему ОСТу. • 4. 5. Титульные листы ОФС, ФСП должны быть оформлены в соответствии с приложениями 6, 7 и 8 к настоящему ОСТу. Последний лист ФСП должен быть оформлен в соответствии с приложением 9 к настоящему ОСТу
 4. 6. Нумерация разделов ОФС, ФС и ФСП не обозначается. 4. 7. Изложение текста должно быть кратким, без повторения и должно исключать возможность различного толкования. 4. 8. Сокращение слов в тексте и надписях под рисунками, схемами и другими иллюстрациями не допускается, за исключением сокращений, применяемых в законодательстве Российской Федерации. 4. 9. В текстовой части стандартов требования к качеству лекарственных средств излагают в повелительной форме. При изложении обязательных требований, норм и методов в тексте применяются слова "должен", "следует", "необходимо" и производные от них. 4. 10. Заголовки разделов помещаются с красной строки и выделяются полужирным шрифтом или подчеркиванием. 4. 11. Если требования, нормы, методы и т. п. , распространяемые на лекарственное средство, установлены в Государственной фармакопее, ином государственном или отраслевом стандартах, то вместо повторения их текста следует давать ссылку на источник. 4. 12. Изложение текста об используемой субстанции производстве лекарственного средства необходимо сопровождать ссылкой на нормативный документ, по которому она выпускается. 4. 13. Если в тексте ОФС, ФСП имеются ссылки на реактивы, вспомогательные материалы и др. , которые производятся по другой нормативной документации, следует указывать обозначение этой документации.
4. 6. Нумерация разделов ОФС, ФС и ФСП не обозначается. 4. 7. Изложение текста должно быть кратким, без повторения и должно исключать возможность различного толкования. 4. 8. Сокращение слов в тексте и надписях под рисунками, схемами и другими иллюстрациями не допускается, за исключением сокращений, применяемых в законодательстве Российской Федерации. 4. 9. В текстовой части стандартов требования к качеству лекарственных средств излагают в повелительной форме. При изложении обязательных требований, норм и методов в тексте применяются слова "должен", "следует", "необходимо" и производные от них. 4. 10. Заголовки разделов помещаются с красной строки и выделяются полужирным шрифтом или подчеркиванием. 4. 11. Если требования, нормы, методы и т. п. , распространяемые на лекарственное средство, установлены в Государственной фармакопее, ином государственном или отраслевом стандартах, то вместо повторения их текста следует давать ссылку на источник. 4. 12. Изложение текста об используемой субстанции производстве лекарственного средства необходимо сопровождать ссылкой на нормативный документ, по которому она выпускается. 4. 13. Если в тексте ОФС, ФСП имеются ссылки на реактивы, вспомогательные материалы и др. , которые производятся по другой нормативной документации, следует указывать обозначение этой документации.
 • V. Порядок представления государственных стандартов качества лекарственных средств на экспертизу, согласование и утверждение 5. 1. Проект государственного стандарта качества лекарственного средства, подписанный его разработчиком, представляется вместе со следующей документацией: - сопроводительным письмом; - пояснительной запиской; - таблицей аналитических данных, подтверждающих числовые показатели, приведенные в проекте государственного стандарта качества лекарственных средств не менее чем на 5 сериях образцов (для иммунобиологических лекарственных средств - на 3 сериях образцов); - таблицей аналитических данных, подтверждающих срок годности препарата, в соответствии с требованиями соответствующего стандарта отрасли; - проектом инструкции по применению лекарственного средства (для нового лекарственного средства или воспроизведенного лекарственного средства, на которое государственный стандарт качества лекарственного средства разрабатывается впервые); - таблицей сравнения показателей, предусмотренных проектом государственного стандарта качества лекарственного средства, с аналогичными показателями отечественной и зарубежных фармакопей при их наличии; - образцом препарата в упаковке с маркировкой; - справкой о метрологическом обеспечении контроля качества лекарственного средства.
• V. Порядок представления государственных стандартов качества лекарственных средств на экспертизу, согласование и утверждение 5. 1. Проект государственного стандарта качества лекарственного средства, подписанный его разработчиком, представляется вместе со следующей документацией: - сопроводительным письмом; - пояснительной запиской; - таблицей аналитических данных, подтверждающих числовые показатели, приведенные в проекте государственного стандарта качества лекарственных средств не менее чем на 5 сериях образцов (для иммунобиологических лекарственных средств - на 3 сериях образцов); - таблицей аналитических данных, подтверждающих срок годности препарата, в соответствии с требованиями соответствующего стандарта отрасли; - проектом инструкции по применению лекарственного средства (для нового лекарственного средства или воспроизведенного лекарственного средства, на которое государственный стандарт качества лекарственного средства разрабатывается впервые); - таблицей сравнения показателей, предусмотренных проектом государственного стандарта качества лекарственного средства, с аналогичными показателями отечественной и зарубежных фармакопей при их наличии; - образцом препарата в упаковке с маркировкой; - справкой о метрологическом обеспечении контроля качества лекарственного средства.
 5. 2. Пояснительная записка к проекту государственного стандарта качества лекарственного средства должна содержать следующие сведения: - наименование предприятия - производителя (разработчика) лекарственного средства; - краткое описание синтеза или технологии получения препарата; - подробное обоснование приведенных в проекте методов исследования, показателей и норм, а также описание других методов, по которым производился анализ данного лекарственного средства или субстанции; - на каком количестве образцов разрабатывался проект государственного стандарта качества лекарственного средства и по какой технологической документации; - при наличии отклонений от общих требований Государственной фармакопеи дается подробное обоснование; - в каких зарубежных фармакопеях или других источниках описано аналогичное лекарственное средство с данными о качестве его по сравнению с зарубежными лекарственными средствами, а если лекарственное средство новое или оригинальное, то должно быть указание об этом.
5. 2. Пояснительная записка к проекту государственного стандарта качества лекарственного средства должна содержать следующие сведения: - наименование предприятия - производителя (разработчика) лекарственного средства; - краткое описание синтеза или технологии получения препарата; - подробное обоснование приведенных в проекте методов исследования, показателей и норм, а также описание других методов, по которым производился анализ данного лекарственного средства или субстанции; - на каком количестве образцов разрабатывался проект государственного стандарта качества лекарственного средства и по какой технологической документации; - при наличии отклонений от общих требований Государственной фармакопеи дается подробное обоснование; - в каких зарубежных фармакопеях или других источниках описано аналогичное лекарственное средство с данными о качестве его по сравнению с зарубежными лекарственными средствами, а если лекарственное средство новое или оригинальное, то должно быть указание об этом.
 • • • 5. 3. Пояснительную записку и таблицы результатов анализа подписывает руководитель предприятия - производителя (разработчика) лекарственного средства либо уполномоченное им лицо. 5. 4. Экспертиза проекта стандарта качества лекарственных средств и его согласование проводится уполномоченными Минздравом России организациями. При необходимости по согласованию с предприятием - производителем лекарственного средства для проведения экспериментальных проверок государственного стандарта качества лекарственного средства Минздравом России могут привлекаться профильные организации. 5. 5. При экспертизе проверяется научно - технический уровень проекта государственного стандарта качества лекарственного средства и его соответствие современным требованиям, предъявляемым к нормативной документации на лекарственные средства, в том числе: - соответствие показателей и норм качества лекарственного средства и потребительской упаковки требованиям Государственной фармакопеи; - обоснованность перечня показателей, оптимальность значений норм качества и срока годности лекарственного средства; - точность и однозначность употребляемых терминов, определений, химической номенклатуры и единиц физических величин. 5. 6. Лица, участвующие в процедурах экспертизы и утверждения фармакопейной статьи на лекарственное средство конкретного предприятия - производителя лекарственных средств, должны обеспечить конфиденциальность информации, получаемой в процессе данной работы. 5. 7. Организация, уполномоченная Минздравом России для проведения экспертизы государственного стандарта качества лекарственного средства, после проведения экспертизы направляет документы на утверждение в Минздрав России.
• • • 5. 3. Пояснительную записку и таблицы результатов анализа подписывает руководитель предприятия - производителя (разработчика) лекарственного средства либо уполномоченное им лицо. 5. 4. Экспертиза проекта стандарта качества лекарственных средств и его согласование проводится уполномоченными Минздравом России организациями. При необходимости по согласованию с предприятием - производителем лекарственного средства для проведения экспериментальных проверок государственного стандарта качества лекарственного средства Минздравом России могут привлекаться профильные организации. 5. 5. При экспертизе проверяется научно - технический уровень проекта государственного стандарта качества лекарственного средства и его соответствие современным требованиям, предъявляемым к нормативной документации на лекарственные средства, в том числе: - соответствие показателей и норм качества лекарственного средства и потребительской упаковки требованиям Государственной фармакопеи; - обоснованность перечня показателей, оптимальность значений норм качества и срока годности лекарственного средства; - точность и однозначность употребляемых терминов, определений, химической номенклатуры и единиц физических величин. 5. 6. Лица, участвующие в процедурах экспертизы и утверждения фармакопейной статьи на лекарственное средство конкретного предприятия - производителя лекарственных средств, должны обеспечить конфиденциальность информации, получаемой в процессе данной работы. 5. 7. Организация, уполномоченная Минздравом России для проведения экспертизы государственного стандарта качества лекарственного средства, после проведения экспертизы направляет документы на утверждение в Минздрав России.
 • VI. Порядок присвоения обозначений и регистрации государственных стандартов качества лекарственных средств 6. 1. ОФС, ФСП после утверждения регистрируются в организации, уполномоченной на это Минздравом России, с присвоением обозначения. 6. 2. Обозначение ОФС и ФС должно состоять из сокращенного наименования вида государственного стандарта качества лекарственного средства, индекса Минздрава России, регистрационного номера, присвоенного документу, и последних двух цифр года утверждения или пересмотра, разделенных между собой знаками тире. Например: ОФС или ФС 42 -00001 -00, где ОФС или ФС - сокращенное наименование категории стандарта качества лекарственного средства; 42 - индекс, присвоенный Минздраву России для обозначения документов по стандартизации; 00001 - регистрационный номер документа; 00 - две последние цифры года утверждения документа (00 -2000 год, 01 -2001 год, 02 -2002 год и т. д. ). 6. 3. Обозначение ФСП должно состоять из сокращенного наименования вида государственного стандарта качества лекарственного средства, индекса Минздрава России, кода предприятия, регистрационного номера документа и последних двух цифр года утверждения стандарта, разделенных между собой знаками тире. Например: ФСП 420001 -00, где ФСП - сокращенное наименование вида государственного стандарта качества лекарственного средства; 42 - индекс, присвоенный Минздраву России для обозначения документов по стандартизации; 0001 - четырехразрядный код предприятия; 00001 - регистрационный номер документа; 00 - две последние цифры года утверждения документа. 6. 4. Регистрационный номер присваивается в порядке последовательной нумерации, начиная с цифры 00001. 6. 5. Код предприятия формируется из четырех знаков, начиная с цифры 0001. Код предприятия присваивается предприятию - производителю или организации - разработчику лекарственных средств при подаче заявки на утверждение первой ФСП.
• VI. Порядок присвоения обозначений и регистрации государственных стандартов качества лекарственных средств 6. 1. ОФС, ФСП после утверждения регистрируются в организации, уполномоченной на это Минздравом России, с присвоением обозначения. 6. 2. Обозначение ОФС и ФС должно состоять из сокращенного наименования вида государственного стандарта качества лекарственного средства, индекса Минздрава России, регистрационного номера, присвоенного документу, и последних двух цифр года утверждения или пересмотра, разделенных между собой знаками тире. Например: ОФС или ФС 42 -00001 -00, где ОФС или ФС - сокращенное наименование категории стандарта качества лекарственного средства; 42 - индекс, присвоенный Минздраву России для обозначения документов по стандартизации; 00001 - регистрационный номер документа; 00 - две последние цифры года утверждения документа (00 -2000 год, 01 -2001 год, 02 -2002 год и т. д. ). 6. 3. Обозначение ФСП должно состоять из сокращенного наименования вида государственного стандарта качества лекарственного средства, индекса Минздрава России, кода предприятия, регистрационного номера документа и последних двух цифр года утверждения стандарта, разделенных между собой знаками тире. Например: ФСП 420001 -00, где ФСП - сокращенное наименование вида государственного стандарта качества лекарственного средства; 42 - индекс, присвоенный Минздраву России для обозначения документов по стандартизации; 0001 - четырехразрядный код предприятия; 00001 - регистрационный номер документа; 00 - две последние цифры года утверждения документа. 6. 4. Регистрационный номер присваивается в порядке последовательной нумерации, начиная с цифры 00001. 6. 5. Код предприятия формируется из четырех знаков, начиная с цифры 0001. Код предприятия присваивается предприятию - производителю или организации - разработчику лекарственных средств при подаче заявки на утверждение первой ФСП.
 • VII. Порядок внесения изменений в государственные стандарты качества лекарственных средств 7. 1. Внесение изменений в государственные стандарты качества лекарственных средств производится в случаях, когда повышение научного и технологического уровня позволяет улучшить качество лекарственного средства или уточнить показатели качества. Вносимые изменения не должны влечь за собой ухудшения качества лекарственных средств. 7. 2. Первая страница изменения стандарта качества лекарственного средства оформляется по форме приложения 10. 7. 3. Тексты разделов (подразделов или пунктов) в старой и новой редакциях приводятся полностью. Экспертиза и утверждение изменений, вносимых в государственные стандарты качества лекарственных средств, осуществляются в порядке, установленном для проведения экспертизы и утверждения государственных стандартов качества лекарственных средств.
• VII. Порядок внесения изменений в государственные стандарты качества лекарственных средств 7. 1. Внесение изменений в государственные стандарты качества лекарственных средств производится в случаях, когда повышение научного и технологического уровня позволяет улучшить качество лекарственного средства или уточнить показатели качества. Вносимые изменения не должны влечь за собой ухудшения качества лекарственных средств. 7. 2. Первая страница изменения стандарта качества лекарственного средства оформляется по форме приложения 10. 7. 3. Тексты разделов (подразделов или пунктов) в старой и новой редакциях приводятся полностью. Экспертиза и утверждение изменений, вносимых в государственные стандарты качества лекарственных средств, осуществляются в порядке, установленном для проведения экспертизы и утверждения государственных стандартов качества лекарственных средств.
 http: //protect. gost. ru/document. aspx? control=7&base. C=6&page=0&month=9&year=2009&search=&id=174610 http: //files. stroyinf. ru/Data 1/56/56560/ GMP С 1 января 2010 года вступил в действие ГОСТ Р 52249 -2009 Правила производства и контроля качества лекарственных средств ГОСТ Р 52249 -2009 распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций и отдельных видов лекарственных средств. Стандарт не устанавливает требований к обеспечению промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств. ПОДГОТОВЛЕН Ассоциацией инженеров по контролю мижро загрязнений (АСИНКОМ) на основе собственного аутентичного перевода Правил, указанных в пункте 4 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 “Производство и контроль качества лекарственных средств” УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 20 мая 2009 г. № 159 -ст Настоящий стандарт идентичен Правилам производства лекарственных средств для человека и животных Европейского Союза (ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use) no состоянию на 31. 01. 2009 г. За исключением приложения 20. При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, указанные в разделе “Сведения о соответствии ссылочных международных стандартов национальным стандартам”
http: //protect. gost. ru/document. aspx? control=7&base. C=6&page=0&month=9&year=2009&search=&id=174610 http: //files. stroyinf. ru/Data 1/56/56560/ GMP С 1 января 2010 года вступил в действие ГОСТ Р 52249 -2009 Правила производства и контроля качества лекарственных средств ГОСТ Р 52249 -2009 распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций и отдельных видов лекарственных средств. Стандарт не устанавливает требований к обеспечению промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств. ПОДГОТОВЛЕН Ассоциацией инженеров по контролю мижро загрязнений (АСИНКОМ) на основе собственного аутентичного перевода Правил, указанных в пункте 4 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 “Производство и контроль качества лекарственных средств” УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 20 мая 2009 г. № 159 -ст Настоящий стандарт идентичен Правилам производства лекарственных средств для человека и животных Европейского Союза (ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use) no состоянию на 31. 01. 2009 г. За исключением приложения 20. При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, указанные в разделе “Сведения о соответствии ссылочных международных стандартов национальным стандартам”
 Область применения Часть I Основные требования 1 Организация работы по обеспечению качества 2 Персонал 3 Помещения и оборудование 4 Документация 5 Производство 6 Контроль качества 7 Работа по контрактам на производство продукции и проведение анализов 8 Рекламации и отзыв продукции 9 Самоинспекции Часть II Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов 1 Введение 2 Обеспечение качества 3 Персонал 4 Здания, помещения и инженерные системы 5 Технологическое оборудование 6 Документация и протоколы 7 Работа с материалами 8 Технологический процесс и внутрипроизводственный контроль 9 Упаковка и маркировка АФС и промежуточных продуктов 10 Хранение и реализация 11 Лабораторный контроль 12 Аттестация (испытания) 13 Контроль изменений 14 Отклонение и переработка материалов 15 Рекламации и отзывы 16 Работа по контракту (в т. ч. проведение анализов) 17 Реализация, хранение, переупаковка и перемаркировка 18 АФС, производимые путем культивирования клеток (ферментации) 19 АФС, предназначенные для проведения клинических исследований 20 Термины и определения Приложение 1 Производство стерильных лекарственных средств Приложение 2 Производство биологических лекарственных средств Приложение 3 Производство радиофармацевтических препаратов Приложение 4 Производство лекарственных средств для животных (кроме иммунных лекарственных средств) Приложение 5 Производство иммунных лекарственных средств для животных Приложение 6 Производство медицинских газов Приложение 7 Производство лекарственных средств из растительного сырья Приложение 8 Отбор проб исходных и упаковочных материалов Приложение 9 Производство жидкостей, кремов и мазей Приложение 10 Производство аэрозолей для ингаляций Приложение 11 Системы с компьютерным управлением и контролем Приложение 12 Использование ионизирующего излучения в производстве лекарственных средств Приложение 13 Производство лекарственных средств для клинических исследований * Приложение 14 Производство лекарственных средств из крови или плазмы человека Приложение 15 Аттестация процессов и оборудования Приложение 16 Подтверждение уполномоченным лицом соответствия серии продукции с целью ее выпуска Приложение 17 Выпуск по параметрам Приложение 18* Приложение 19 Контрольные и архивные образцы Приложение 20* Общие термины и определения Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным (региональным) стандартам Содержание
Область применения Часть I Основные требования 1 Организация работы по обеспечению качества 2 Персонал 3 Помещения и оборудование 4 Документация 5 Производство 6 Контроль качества 7 Работа по контрактам на производство продукции и проведение анализов 8 Рекламации и отзыв продукции 9 Самоинспекции Часть II Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов 1 Введение 2 Обеспечение качества 3 Персонал 4 Здания, помещения и инженерные системы 5 Технологическое оборудование 6 Документация и протоколы 7 Работа с материалами 8 Технологический процесс и внутрипроизводственный контроль 9 Упаковка и маркировка АФС и промежуточных продуктов 10 Хранение и реализация 11 Лабораторный контроль 12 Аттестация (испытания) 13 Контроль изменений 14 Отклонение и переработка материалов 15 Рекламации и отзывы 16 Работа по контракту (в т. ч. проведение анализов) 17 Реализация, хранение, переупаковка и перемаркировка 18 АФС, производимые путем культивирования клеток (ферментации) 19 АФС, предназначенные для проведения клинических исследований 20 Термины и определения Приложение 1 Производство стерильных лекарственных средств Приложение 2 Производство биологических лекарственных средств Приложение 3 Производство радиофармацевтических препаратов Приложение 4 Производство лекарственных средств для животных (кроме иммунных лекарственных средств) Приложение 5 Производство иммунных лекарственных средств для животных Приложение 6 Производство медицинских газов Приложение 7 Производство лекарственных средств из растительного сырья Приложение 8 Отбор проб исходных и упаковочных материалов Приложение 9 Производство жидкостей, кремов и мазей Приложение 10 Производство аэрозолей для ингаляций Приложение 11 Системы с компьютерным управлением и контролем Приложение 12 Использование ионизирующего излучения в производстве лекарственных средств Приложение 13 Производство лекарственных средств для клинических исследований * Приложение 14 Производство лекарственных средств из крови или плазмы человека Приложение 15 Аттестация процессов и оборудования Приложение 16 Подтверждение уполномоченным лицом соответствия серии продукции с целью ее выпуска Приложение 17 Выпуск по параметрам Приложение 18* Приложение 19 Контрольные и архивные образцы Приложение 20* Общие термины и определения Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным (региональным) стандартам Содержание
 Введение Настоящий стандарт является идентичным переводом правил GMP Европейского Союза (GMP ЕС) "Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use" no состоянию на 31 января 2009 г. Впервые правила GMP ЕС были приняты в России в 2004 г. в качестве ГОСТ Р 52249 -2004 "Правила производства и контроля качества лекарственных средств", который соответствовал правилам GMP ЕС 2003 г. За истекшее время в правила GMP ЕС внесены следующие существенные изменения и дополнения: - добавлены новые требования в основной текст; - внесены изменения в: - приложение 1 Производство стерильных лекарственных средств; - приложение 3 Производство радиофармацевтических препаратов; - приложение 7 Производство лекарственных средств из растительного сырья; - приложение 13 Производство лекарственных средств для исследований; - введены два новых приложения: - приложение 19 Контрольные и архивные образцы; - приложение 20 Анализ рисков для качества; - внесен ряд других изменений. Также была изменена структура данного стандарта. В ГОСТ Р 52249 -2004 приложение 18 содержало "Руководство по производству активных фармацевтических субстанций (АФС)", что соответствовало Правилам GMP ЕС на 2003 г. В новой редакции правил GMP ЕС требования к производству АФС перенесены из приложения в основную часть, которая содержит теперь две части: - часть I Основные требования и - часть II Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов. Приложение 18 отсутствует, хотя сохранен его номер. Такой порядок структуры стандарта сохранен и в ГОСТ Р 52249 -2009. В последнюю редакцию правил GMP ЕС введено приложение 20 об анализе рисков, являющееся текстом руководства ICH Q 9 "Анализ рисков для качества" (Quality Risk Management). Этот текст изложен неконкретно и непригоден к практическому применению. В связи с этим приложение 20 в текст нового стандарта не включено, о чем указано в сносках в тексте стандарта, выделенных курсивом. По тексту стандарта опущены ссылки на Директивы ЕС, содержащиеся в оригинале правил GMP ЕС.
Введение Настоящий стандарт является идентичным переводом правил GMP Европейского Союза (GMP ЕС) "Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use" no состоянию на 31 января 2009 г. Впервые правила GMP ЕС были приняты в России в 2004 г. в качестве ГОСТ Р 52249 -2004 "Правила производства и контроля качества лекарственных средств", который соответствовал правилам GMP ЕС 2003 г. За истекшее время в правила GMP ЕС внесены следующие существенные изменения и дополнения: - добавлены новые требования в основной текст; - внесены изменения в: - приложение 1 Производство стерильных лекарственных средств; - приложение 3 Производство радиофармацевтических препаратов; - приложение 7 Производство лекарственных средств из растительного сырья; - приложение 13 Производство лекарственных средств для исследований; - введены два новых приложения: - приложение 19 Контрольные и архивные образцы; - приложение 20 Анализ рисков для качества; - внесен ряд других изменений. Также была изменена структура данного стандарта. В ГОСТ Р 52249 -2004 приложение 18 содержало "Руководство по производству активных фармацевтических субстанций (АФС)", что соответствовало Правилам GMP ЕС на 2003 г. В новой редакции правил GMP ЕС требования к производству АФС перенесены из приложения в основную часть, которая содержит теперь две части: - часть I Основные требования и - часть II Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов. Приложение 18 отсутствует, хотя сохранен его номер. Такой порядок структуры стандарта сохранен и в ГОСТ Р 52249 -2009. В последнюю редакцию правил GMP ЕС введено приложение 20 об анализе рисков, являющееся текстом руководства ICH Q 9 "Анализ рисков для качества" (Quality Risk Management). Этот текст изложен неконкретно и непригоден к практическому применению. В связи с этим приложение 20 в текст нового стандарта не включено, о чем указано в сносках в тексте стандарта, выделенных курсивом. По тексту стандарта опущены ссылки на Директивы ЕС, содержащиеся в оригинале правил GMP ЕС.
 Область применения Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных. Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций (часть II) и отдельных видов лекарственных средств (приложения 1 - 19). Стандарт не устанавливает требований к обеспечению промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств.
Область применения Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных. Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций (часть II) и отдельных видов лекарственных средств (приложения 1 - 19). Стандарт не устанавливает требований к обеспечению промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств.
 Основные требования GMP: I Все производственные процессы должны быть четко регламентированы и должны периодически пересматриваться с учетом накопленного опыта. Следует контролировать стабильность производства лекарственных средств с заданным качеством в соответствии со спецификациями на них. II Следует проводить аттестацию (испытания) критических стадий процессов производства, в том числе при внесении существенных изменений в технологический процесс. III Следует обеспечить все необходимые условия для выполнения требований настоящего стандарта, в т. ч. , включая наличие: - обученного и аттестованного персонала; - необходимых помещений и площадей; - соответствующего оборудования и системы обслуживания; - материалов, средств упаковки и маркировки, удовлетворяющих установленным требованиям; - утвержденных инструкций и методик; - требуемых условий хранения и транспортирования. IV Инструкции и методики должны быть конкретными, изложены ясно и однозначно в письменной форме. V Персонал должен быть обучен правильному выполнению инструкций. VI В процессе производства следует составлять протоколы (заполняемые рукописным способом и/или с применением технических средств), документально подтверждающие фактическое проведение предусмотренных инструкциями технологических стадий и получение продукции требуемого качества в количестве, соответствующем установленным нормам. Все отклонения необходимо расследовать и протоколировать в полном объеме. VII Протоколы на серию продукции, в т. ч. на документацию по реализации продукции, должны давать возможность прослеживать изготовление каждой серии и храниться в полном объеме в доступной форме. VIII Порядок реализации (оптовой продажи) продукции должен сводить к минимуму любой риск для ее качества. IX Следует организовать систему отзыва любой серии продукции из продажи или поставки. X Рекламации на качество продукции следует тщательно рассматривать, а причины ухудшения качества расследовать с принятием соответствующих мер по их предотвращению.
Основные требования GMP: I Все производственные процессы должны быть четко регламентированы и должны периодически пересматриваться с учетом накопленного опыта. Следует контролировать стабильность производства лекарственных средств с заданным качеством в соответствии со спецификациями на них. II Следует проводить аттестацию (испытания) критических стадий процессов производства, в том числе при внесении существенных изменений в технологический процесс. III Следует обеспечить все необходимые условия для выполнения требований настоящего стандарта, в т. ч. , включая наличие: - обученного и аттестованного персонала; - необходимых помещений и площадей; - соответствующего оборудования и системы обслуживания; - материалов, средств упаковки и маркировки, удовлетворяющих установленным требованиям; - утвержденных инструкций и методик; - требуемых условий хранения и транспортирования. IV Инструкции и методики должны быть конкретными, изложены ясно и однозначно в письменной форме. V Персонал должен быть обучен правильному выполнению инструкций. VI В процессе производства следует составлять протоколы (заполняемые рукописным способом и/или с применением технических средств), документально подтверждающие фактическое проведение предусмотренных инструкциями технологических стадий и получение продукции требуемого качества в количестве, соответствующем установленным нормам. Все отклонения необходимо расследовать и протоколировать в полном объеме. VII Протоколы на серию продукции, в т. ч. на документацию по реализации продукции, должны давать возможность прослеживать изготовление каждой серии и храниться в полном объеме в доступной форме. VIII Порядок реализации (оптовой продажи) продукции должен сводить к минимуму любой риск для ее качества. IX Следует организовать систему отзыва любой серии продукции из продажи или поставки. X Рекламации на качество продукции следует тщательно рассматривать, а причины ухудшения качества расследовать с принятием соответствующих мер по их предотвращению.
 4 Документация Правильно составленная документация является важной частью системы обеспечения качества. Четкое оформление документации позволяет предотвратить ошибки, возможные при устном общении, и проследить все этапы производства конкретной серии продукции. Спецификации, промышленные регламенты, инструкции, методики и протоколы на серию продукции должны быть оформлены надлежащим образом и не должны содержать ошибок. Правильное и точное оформление документации имеет первостепенное значение. Общие положения 4. 1 Виды документов спецификация (specification): Документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств. промышленный регламент, технологическая инструкция и инструкция по упаковке (manufacturing formulae, processing and packaging instructions): Документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции. инструкция, методика, процедура (procedure): Документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования). протокол на серию (record): Документ, отражающий процесс производства каждой серии продукции, в т. ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.
4 Документация Правильно составленная документация является важной частью системы обеспечения качества. Четкое оформление документации позволяет предотвратить ошибки, возможные при устном общении, и проследить все этапы производства конкретной серии продукции. Спецификации, промышленные регламенты, инструкции, методики и протоколы на серию продукции должны быть оформлены надлежащим образом и не должны содержать ошибок. Правильное и точное оформление документации имеет первостепенное значение. Общие положения 4. 1 Виды документов спецификация (specification): Документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств. промышленный регламент, технологическая инструкция и инструкция по упаковке (manufacturing formulae, processing and packaging instructions): Документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции. инструкция, методика, процедура (procedure): Документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования). протокол на серию (record): Документ, отражающий процесс производства каждой серии продукции, в т. ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.
 4. 15 Технологические инструкции включают в себя: a) данные о месте нахождения производства и основном оборудовании; b) инструкции по подготовке основного (критического) оборудования (например, по очистке, сборке, калибровке (поверке), стерилизации) или ссылки на них; c) подробное постадийное описание технологического процесса (например, по контролю материалов, предварительной обработке, последовательности внесения материалов, времени перемешивания, температуре и т. д. ); d) описание всех видов внутрипроизводственного контроля с указанием допустимых пределов; е) условия хранения нерасфасованной продукции (в т. ч. требования к упаковке, маркировке) и специальные условия хранения (при необходимости); f) специальные меры предосторожности. Проведение испытаний 4. 23 Следует разработать и утвердить методики испытаний материалов и продукции на различных этапах производства с указанием используемых методов и оборудования. Результаты испытаний оформляются в виде протокола (6. 17).
4. 15 Технологические инструкции включают в себя: a) данные о месте нахождения производства и основном оборудовании; b) инструкции по подготовке основного (критического) оборудования (например, по очистке, сборке, калибровке (поверке), стерилизации) или ссылки на них; c) подробное постадийное описание технологического процесса (например, по контролю материалов, предварительной обработке, последовательности внесения материалов, времени перемешивания, температуре и т. д. ); d) описание всех видов внутрипроизводственного контроля с указанием допустимых пределов; е) условия хранения нерасфасованной продукции (в т. ч. требования к упаковке, маркировке) и специальные условия хранения (при необходимости); f) специальные меры предосторожности. Проведение испытаний 4. 23 Следует разработать и утвердить методики испытаний материалов и продукции на различных этапах производства с указанием используемых методов и оборудования. Результаты испытаний оформляются в виде протокола (6. 17).
 Досье на лекарственное средство 9 Досье на лекарственное средство должно непрерывно обновляться по мере разработки препарата, обеспечивая логическую связь с предыдущими версиями. Досье должно включать в себя следующие документы (или содержать на них ссылки): - спецификации и аналитические методики для исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции; - технологические процессы; - методики внутрипроизводственного контроля; - утвержденную копию этикетки; - протоколы клинических исследований и коды реализации (при необходимости); - технические соглашения с заказчиками по контрактам (при необходимости); - данные о стабильности; - условия хранения и транспортирования. Данный перечень не является исчерпывающим. Он может изменяться в зависимости от препарата и стадии его разработки. Содержащаяся в нем информация должна служить основой при оценке готовности для приемки и выдачи разрешения на выпуск уполномоченным лицом, которое должно иметь доступ к этой информации. Если различные производственные стадии проводят в разных местах, ответственность за которые несут разные уполномоченные лица, допускается вести отдельные досье с ограниченной информацией, относящиеся к определенному месту.
Досье на лекарственное средство 9 Досье на лекарственное средство должно непрерывно обновляться по мере разработки препарата, обеспечивая логическую связь с предыдущими версиями. Досье должно включать в себя следующие документы (или содержать на них ссылки): - спецификации и аналитические методики для исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции; - технологические процессы; - методики внутрипроизводственного контроля; - утвержденную копию этикетки; - протоколы клинических исследований и коды реализации (при необходимости); - технические соглашения с заказчиками по контрактам (при необходимости); - данные о стабильности; - условия хранения и транспортирования. Данный перечень не является исчерпывающим. Он может изменяться в зависимости от препарата и стадии его разработки. Содержащаяся в нем информация должна служить основой при оценке готовности для приемки и выдачи разрешения на выпуск уполномоченным лицом, которое должно иметь доступ к этой информации. Если различные производственные стадии проводят в разных местах, ответственность за которые несут разные уполномоченные лица, допускается вести отдельные досье с ограниченной информацией, относящиеся к определенному месту.
 Промышленные регламенты и технологические инструкции 10. Каждая производственная операция или операция по отгрузке должна выполняться в соответствие с четкой и достаточно полной письменной инструкцией и сопровождаться оформлением протокола. Если операция не является повторяемой, то не обязательно составлять промышленный регламент и технологические инструкции. Протоколы имеют особое значение для подготовки окончательных текстов документов, которые будут использоваться при серийном производстве после получения регистрационного удостоверения. 11. Информацию, содержащуюся в досье, следует использовать при разработке подробных инструкций по изготовлению, упаковке, испытаниям для контроля качества, условиям хранения и транспортирования.
Промышленные регламенты и технологические инструкции 10. Каждая производственная операция или операция по отгрузке должна выполняться в соответствие с четкой и достаточно полной письменной инструкцией и сопровождаться оформлением протокола. Если операция не является повторяемой, то не обязательно составлять промышленный регламент и технологические инструкции. Протоколы имеют особое значение для подготовки окончательных текстов документов, которые будут использоваться при серийном производстве после получения регистрационного удостоверения. 11. Информацию, содержащуюся в досье, следует использовать при разработке подробных инструкций по изготовлению, упаковке, испытаниям для контроля качества, условиям хранения и транспортирования.
 http: //www. bestpravo. ru/federalnoje/ew-postanovlenija/f 3 n. htm Письмо Росздравнадзора от 13. 07. 2005 N 01 И-343/05 О контроле качества вспомогательных веществ Федеральное законодательство Текст документа по состоянию на июль 2011 года В связи с многочисленными обращениями организаций - производителей лекарственных средств и органов по сертификации по вопросу контроля качества вспомогательных веществ Федеральная служба по надзору в сфере здравоохранения и социального развития разъясняет следующее. В соответствии с Федеральным законом от 22. 06. 98 N 86 -ФЗ "О лекарственных средствах" (ст. 4) лекарственные средства - вещества, применяемые для профилактики, диагностики, лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, минералов, методами синтеза или с применением биологических технологий. К лекарственным средствам относятся также вещества растительного, животного или синтетического происхождения, обладающие фармакологической активностью и предназначенные для производства и изготовления лекарственных средств (фармацевтические субстанции). В связи с тем, что вспомогательные вещества, используемые в производстве лекарственных средств, не обладают фармакологической активностью, они не могут быть отнесены к лекарственным средствам и, следовательно, не подлежат государственной регистрации в соответствии с требованиями ст. 19 упомянутого Федерального закона. В то же время требования к качеству вспомогательных веществ, используемых в производстве лекарственных средств, не должны быть ниже фармакопейных. В связи с изложенным качество вспомогательных веществ, используемых в производстве лекарственных средств, должно соответствовать требованиям соответствующих фармакопейных статей или требованиям соответствующих ГОСТ, ОСТ и ТУ. При отсутствии нормативной документации, а также в случае, если требования нормативной документации не отвечают фармакопейным, организациям - производителям лекарственных средств необходимо разработать нормативные документы в соответствии с действующим порядком. Руководитель Федеральной службы Р. У. ХАБРИЕВ Приложение N 1 к письму Федеральной службы от 13. 07. 2005 N 01 И-343/05 СПИСОК ОСНОВНЫХ ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ, ИСПОЛЬЗУЕМЫХ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Приложение N 2 к письму Федеральной службы от 13. 07. 2005 N 01 И-343/05 РЕКОМЕНДАЦИИ ПО ПОСТРОЕНИЮ, ИЗЛОЖЕНИЮ, ОФОРМЛЕНИЮ, СОГЛАСОВАНИЮ И УТВЕРЖДЕНИЮ ТЕХНИЧЕСКИХ УСЛОВИЙ (ТУ) НА ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА, ИСПОЛЬЗУЕМЫЕ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
http: //www. bestpravo. ru/federalnoje/ew-postanovlenija/f 3 n. htm Письмо Росздравнадзора от 13. 07. 2005 N 01 И-343/05 О контроле качества вспомогательных веществ Федеральное законодательство Текст документа по состоянию на июль 2011 года В связи с многочисленными обращениями организаций - производителей лекарственных средств и органов по сертификации по вопросу контроля качества вспомогательных веществ Федеральная служба по надзору в сфере здравоохранения и социального развития разъясняет следующее. В соответствии с Федеральным законом от 22. 06. 98 N 86 -ФЗ "О лекарственных средствах" (ст. 4) лекарственные средства - вещества, применяемые для профилактики, диагностики, лечения болезни, предотвращения беременности, полученные из крови, плазмы крови, а также органов, тканей человека или животного, растений, минералов, методами синтеза или с применением биологических технологий. К лекарственным средствам относятся также вещества растительного, животного или синтетического происхождения, обладающие фармакологической активностью и предназначенные для производства и изготовления лекарственных средств (фармацевтические субстанции). В связи с тем, что вспомогательные вещества, используемые в производстве лекарственных средств, не обладают фармакологической активностью, они не могут быть отнесены к лекарственным средствам и, следовательно, не подлежат государственной регистрации в соответствии с требованиями ст. 19 упомянутого Федерального закона. В то же время требования к качеству вспомогательных веществ, используемых в производстве лекарственных средств, не должны быть ниже фармакопейных. В связи с изложенным качество вспомогательных веществ, используемых в производстве лекарственных средств, должно соответствовать требованиям соответствующих фармакопейных статей или требованиям соответствующих ГОСТ, ОСТ и ТУ. При отсутствии нормативной документации, а также в случае, если требования нормативной документации не отвечают фармакопейным, организациям - производителям лекарственных средств необходимо разработать нормативные документы в соответствии с действующим порядком. Руководитель Федеральной службы Р. У. ХАБРИЕВ Приложение N 1 к письму Федеральной службы от 13. 07. 2005 N 01 И-343/05 СПИСОК ОСНОВНЫХ ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ, ИСПОЛЬЗУЕМЫХ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Приложение N 2 к письму Федеральной службы от 13. 07. 2005 N 01 И-343/05 РЕКОМЕНДАЦИИ ПО ПОСТРОЕНИЮ, ИЗЛОЖЕНИЮ, ОФОРМЛЕНИЮ, СОГЛАСОВАНИЮ И УТВЕРЖДЕНИЮ ТЕХНИЧЕСКИХ УСЛОВИЙ (ТУ) НА ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА, ИСПОЛЬЗУЕМЫЕ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
 milaif. lek-va. ru/ Лекарственный препарат Милайф Латинское название: Milife® Действующее вещество: Гриба фузариум биомасса Фармакологические группы: Гепатопротекторы. Детоксицирующие средства, включая антидоты. Иммуномодуляторы. Противовирусные средства. Противоопухолевые средства растительного происхождения. Регенеранты и репаранты Состав и форма выпуска: Таблетки 1 табл. биомасса мицелия гриба Fusarium sambucinum, штамм ВСБ− 917 0, 05 г вспомогательные вещества: сахар молочный; сахаррафинад; крахмал картофельный; кальций стеариновокислый Фармакологическое действие: Метаболическое, общеукрепляющее, адаптогенное, регенерирующее, дезинтоксикационное, иммуномодулирующее. Спектр действия получаемых эффектов применении препарата настолько широк, что позволяет классифицировать его в качестве системного препарата, обнаруживающего и восстанавливающего нарушения информационных (восстановление корректных генетических репликаций), функциональных, обменных, энергетических связей в организме, активизируя восстановительные, репаративные процессы на разных уровнях. Обладает прямым и непрямым вирулицидным действием
milaif. lek-va. ru/ Лекарственный препарат Милайф Латинское название: Milife® Действующее вещество: Гриба фузариум биомасса Фармакологические группы: Гепатопротекторы. Детоксицирующие средства, включая антидоты. Иммуномодуляторы. Противовирусные средства. Противоопухолевые средства растительного происхождения. Регенеранты и репаранты Состав и форма выпуска: Таблетки 1 табл. биомасса мицелия гриба Fusarium sambucinum, штамм ВСБ− 917 0, 05 г вспомогательные вещества: сахар молочный; сахаррафинад; крахмал картофельный; кальций стеариновокислый Фармакологическое действие: Метаболическое, общеукрепляющее, адаптогенное, регенерирующее, дезинтоксикационное, иммуномодулирующее. Спектр действия получаемых эффектов применении препарата настолько широк, что позволяет классифицировать его в качестве системного препарата, обнаруживающего и восстанавливающего нарушения информационных (восстановление корректных генетических репликаций), функциональных, обменных, энергетических связей в организме, активизируя восстановительные, репаративные процессы на разных уровнях. Обладает прямым и непрямым вирулицидным действием
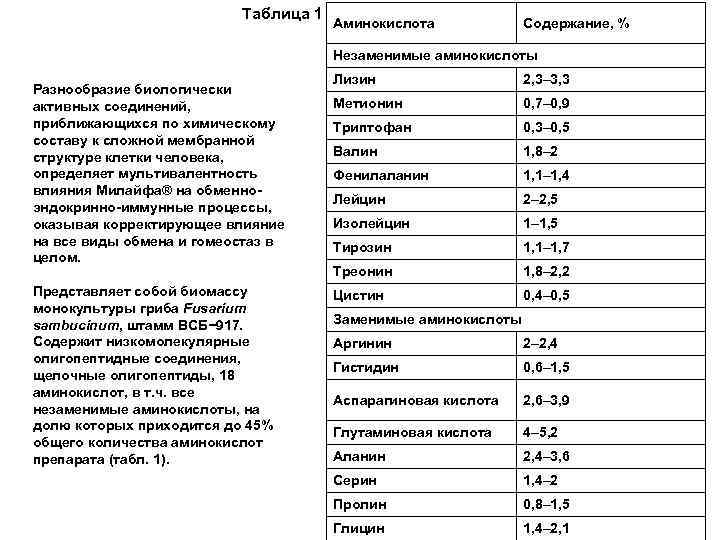 Таблица 1 Аминокислота Содержание, % Незаменимые аминокислоты Разнообразие биологически активных соединений, приближающихся по химическому составу к сложной мембранной структуре клетки человека, определяет мультивалентность влияния Милайфа® на обменноэндокринно-иммунные процессы, оказывая корректирующее влияние на все виды обмена и гомеостаз в целом. Представляет собой биомассу монокультуры гриба Fusarium sambucinum, штамм ВСБ− 917. Содержит низкомолекулярные олигопептидные соединения, щелочные олигопептиды, 18 аминокислот, в т. ч. все незаменимые аминокислоты, на долю которых приходится до 45% общего количества аминокислот препарата (табл. 1). Лизин 2, 3– 3, 3 Метионин 0, 7– 0, 9 Триптофан 0, 3– 0, 5 Валин 1, 8– 2 Фенилаланин 1, 1– 1, 4 Лейцин 2– 2, 5 Изолейцин 1– 1, 5 Тирозин 1, 1– 1, 7 Треонин 1, 8– 2, 2 Цистин 0, 4– 0, 5 Заменимые аминокислоты Аргинин 2– 2, 4 Гистидин 0, 6– 1, 5 Аспарагиновая кислота 2, 6– 3, 9 Глутаминовая кислота 4– 5, 2 Аланин 2, 4– 3, 6 Серин 1, 4– 2 Пролин 0, 8– 1, 5 Глицин 1, 4– 2, 1
Таблица 1 Аминокислота Содержание, % Незаменимые аминокислоты Разнообразие биологически активных соединений, приближающихся по химическому составу к сложной мембранной структуре клетки человека, определяет мультивалентность влияния Милайфа® на обменноэндокринно-иммунные процессы, оказывая корректирующее влияние на все виды обмена и гомеостаз в целом. Представляет собой биомассу монокультуры гриба Fusarium sambucinum, штамм ВСБ− 917. Содержит низкомолекулярные олигопептидные соединения, щелочные олигопептиды, 18 аминокислот, в т. ч. все незаменимые аминокислоты, на долю которых приходится до 45% общего количества аминокислот препарата (табл. 1). Лизин 2, 3– 3, 3 Метионин 0, 7– 0, 9 Триптофан 0, 3– 0, 5 Валин 1, 8– 2 Фенилаланин 1, 1– 1, 4 Лейцин 2– 2, 5 Изолейцин 1– 1, 5 Тирозин 1, 1– 1, 7 Треонин 1, 8– 2, 2 Цистин 0, 4– 0, 5 Заменимые аминокислоты Аргинин 2– 2, 4 Гистидин 0, 6– 1, 5 Аспарагиновая кислота 2, 6– 3, 9 Глутаминовая кислота 4– 5, 2 Аланин 2, 4– 3, 6 Серин 1, 4– 2 Пролин 0, 8– 1, 5 Глицин 1, 4– 2, 1
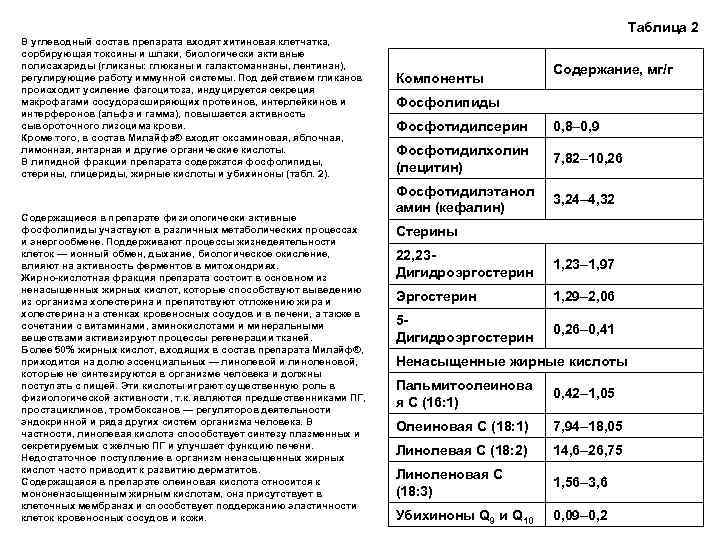 Таблица 2 В углеводный состав препарата входят хитиновая клетчатка, сорбирующая токсины и шлаки, биологически активные полисахариды (гликаны: глюканы и галактоманнаны, лентинан), регулирующие работу иммунной системы. Под действием гликанов происходит усиление фагоцитоза, индуцируется секреция макрофагами сосудорасширяющих протеинов, интерлейкинов и интерферонов (альфа и гамма), повышается активность сывороточного лизоцима крови. Кроме того, в состав Милайфа® входят оксаминовая, яблочная, лимонная, янтарная и другие органические кислоты. В липидной фракции препарата содержатся фосфолипиды, стерины, глицериды, жирные кислоты и убихиноны (табл. 2). Содержащиеся в препарате физиологически активные фосфолипиды участвуют в различных метаболических процессах и энергообмене. Поддерживают процессы жизнедеятельности клеток — ионный обмен, дыхание, биологическое окисление, влияют на активность ферментов в митохондриях. Жирно-кислотная фракция препарата состоит в основном из ненасыщенных жирных кислот, которые способствуют выведению из организма холестерина и препятствуют отложению жира и холестерина на стенках кровеносных сосудов и в печени, а также в сочетании с витаминами, аминокислотами и минеральными веществами активизируют процессы регенерации тканей. Более 50% жирных кислот, входящих в состав препарата Милайф®, приходится на долю эссенциальных — линолевой и линоленовой, которые не синтезируются в организме человека и должны поступать с пищей. Эти кислоты играют существенную роль в физиологической активности, т. к. являются предшественниками ПГ, простациклинов, тромбоксанов — регуляторов деятельности эндокринной и ряда других систем организма человека. В частности, линолевая кислота способствует синтезу плазменных и секретируемых с желчью ПГ и улучшает функцию печени. Недостаточное поступление в организм ненасыщенных жирных кислот часто приводит к развитию дерматитов. Содержащаяся в препарате олеиновая кислота относится к мононенасыщенным жирным кислотам, она присутствует в клеточных мембранах и способствует поддержанию эластичности клеток кровеносных сосудов и кожи. Компоненты Содержание, мг/г Фосфолипиды Фосфотидилсерин 0, 8– 0, 9 Фосфотидилхолин (лецитин) 7, 82– 10, 26 Фосфотидилэтанол амин (кефалин) 3, 24– 4, 32 Стерины 22, 23 Дигидроэргостерин 1, 23– 1, 97 Эргостерин 1, 29– 2, 06 5 Дигидроэргостерин 0, 26– 0, 41 Ненасыщенные жирные кислоты Пальмитоолеинова я C (16: 1) 0, 42– 1, 05 Олеиновая C (18: 1) 7, 94– 18, 05 Линолевая C (18: 2) 14, 6– 26, 75 Линоленовая C (18: 3) 1, 56– 3, 6 Убихиноны Q 9 и Q 10 0, 09– 0, 2
Таблица 2 В углеводный состав препарата входят хитиновая клетчатка, сорбирующая токсины и шлаки, биологически активные полисахариды (гликаны: глюканы и галактоманнаны, лентинан), регулирующие работу иммунной системы. Под действием гликанов происходит усиление фагоцитоза, индуцируется секреция макрофагами сосудорасширяющих протеинов, интерлейкинов и интерферонов (альфа и гамма), повышается активность сывороточного лизоцима крови. Кроме того, в состав Милайфа® входят оксаминовая, яблочная, лимонная, янтарная и другие органические кислоты. В липидной фракции препарата содержатся фосфолипиды, стерины, глицериды, жирные кислоты и убихиноны (табл. 2). Содержащиеся в препарате физиологически активные фосфолипиды участвуют в различных метаболических процессах и энергообмене. Поддерживают процессы жизнедеятельности клеток — ионный обмен, дыхание, биологическое окисление, влияют на активность ферментов в митохондриях. Жирно-кислотная фракция препарата состоит в основном из ненасыщенных жирных кислот, которые способствуют выведению из организма холестерина и препятствуют отложению жира и холестерина на стенках кровеносных сосудов и в печени, а также в сочетании с витаминами, аминокислотами и минеральными веществами активизируют процессы регенерации тканей. Более 50% жирных кислот, входящих в состав препарата Милайф®, приходится на долю эссенциальных — линолевой и линоленовой, которые не синтезируются в организме человека и должны поступать с пищей. Эти кислоты играют существенную роль в физиологической активности, т. к. являются предшественниками ПГ, простациклинов, тромбоксанов — регуляторов деятельности эндокринной и ряда других систем организма человека. В частности, линолевая кислота способствует синтезу плазменных и секретируемых с желчью ПГ и улучшает функцию печени. Недостаточное поступление в организм ненасыщенных жирных кислот часто приводит к развитию дерматитов. Содержащаяся в препарате олеиновая кислота относится к мононенасыщенным жирным кислотам, она присутствует в клеточных мембранах и способствует поддержанию эластичности клеток кровеносных сосудов и кожи. Компоненты Содержание, мг/г Фосфолипиды Фосфотидилсерин 0, 8– 0, 9 Фосфотидилхолин (лецитин) 7, 82– 10, 26 Фосфотидилэтанол амин (кефалин) 3, 24– 4, 32 Стерины 22, 23 Дигидроэргостерин 1, 23– 1, 97 Эргостерин 1, 29– 2, 06 5 Дигидроэргостерин 0, 26– 0, 41 Ненасыщенные жирные кислоты Пальмитоолеинова я C (16: 1) 0, 42– 1, 05 Олеиновая C (18: 1) 7, 94– 18, 05 Линолевая C (18: 2) 14, 6– 26, 75 Линоленовая C (18: 3) 1, 56– 3, 6 Убихиноны Q 9 и Q 10 0, 09– 0, 2
 Высокой физиологической активностью обладает также 22, 23 -дигидроэргостерин, относящийся к витаминам группы D и способствующий адекватному фосфорно-кальциевому обмену, особенно в растущем организме. Убихиноны (коэнзимы Q), входящие в состав липидных структур препарата Милайф®, принадлежат к витаминоподобным соединениям, эффективно связываются митохондриями клеток и, участвуя в реакциях окислительного фосфорилирования, способствуют выработке необходимой организму энергии, а также являются мощными антиоксидантами. Убихинон Q 10 (коэнзим Q 10) обнаружен во всех тканях и органах человека и абсолютно необходим для их нормального функционирования. В частности, показано, что при сахарном диабете и мышечной дистрофии содержание убихинонов значительно снижено по сравнению с нормой. При различных заболеваниях сердечно-сосудистой системы также выявлено снижение содержания убихинона в сердечной мышце. Убихинон Q 10 улучшает нарушенный метаболизм в сердечной мышце, увеличивает кровоток независимо от частоты пульса, купирует некоторые виды нарушений сердечного ритма, улучшает мозговое кровообращение. Установлено, что убихинон необходим для нормализации функциональной активности печени при острых инфекционных и токсических гепатитах. Естественное сочетание в составе препарата Милайф® таких антиокcидантов, как убихиноны и ненасыщенные жирные кислоты с тирозином, фенилаланином, триптофаном и микроэлементами способно обеспечить защиту организма от действия свободных радикалов, т. е. затормозить индуцированный процесс свободнорадикального окисления и защитить клетки организма от повреждения и преждевременного старения. Наличие в составе препарата Милайф® комплекса убихинонов с витаминами и легкоусвояемым железом способствует нормализации уровня клинических и биохимических показателей крови. Таблица 3 Милайф® содержит полный комплекс витаминов группы В, с дефицитом которых связывают нарушения функций нервной системы, кожи, слизистых оболочек, кишечника, сердечно-cосудистой системы и кроветворных органов, умственной деятельности (табл. 3). Содержание, мкг/г B 1 (тиамин) 8– 15 B 2 (рибофлавин) 50– 70 B 3, PP (никотиновая кислота) 230– 380 B 4 (холин) Витамины группы В играют важную роль в процессах белкового, липидного и углеводного обмена, оказывают иммуномодулирующее действие, участвуют в синтезе ПГ, ферментов и коферментов. Витамин следы B 5 (пантотеновая кислота) 38– 61 B 6 (пиридоксин) 10– 20 B 9 (фолиевая кислота) 10– 15 Биотин 1– 2 B 12
Высокой физиологической активностью обладает также 22, 23 -дигидроэргостерин, относящийся к витаминам группы D и способствующий адекватному фосфорно-кальциевому обмену, особенно в растущем организме. Убихиноны (коэнзимы Q), входящие в состав липидных структур препарата Милайф®, принадлежат к витаминоподобным соединениям, эффективно связываются митохондриями клеток и, участвуя в реакциях окислительного фосфорилирования, способствуют выработке необходимой организму энергии, а также являются мощными антиоксидантами. Убихинон Q 10 (коэнзим Q 10) обнаружен во всех тканях и органах человека и абсолютно необходим для их нормального функционирования. В частности, показано, что при сахарном диабете и мышечной дистрофии содержание убихинонов значительно снижено по сравнению с нормой. При различных заболеваниях сердечно-сосудистой системы также выявлено снижение содержания убихинона в сердечной мышце. Убихинон Q 10 улучшает нарушенный метаболизм в сердечной мышце, увеличивает кровоток независимо от частоты пульса, купирует некоторые виды нарушений сердечного ритма, улучшает мозговое кровообращение. Установлено, что убихинон необходим для нормализации функциональной активности печени при острых инфекционных и токсических гепатитах. Естественное сочетание в составе препарата Милайф® таких антиокcидантов, как убихиноны и ненасыщенные жирные кислоты с тирозином, фенилаланином, триптофаном и микроэлементами способно обеспечить защиту организма от действия свободных радикалов, т. е. затормозить индуцированный процесс свободнорадикального окисления и защитить клетки организма от повреждения и преждевременного старения. Наличие в составе препарата Милайф® комплекса убихинонов с витаминами и легкоусвояемым железом способствует нормализации уровня клинических и биохимических показателей крови. Таблица 3 Милайф® содержит полный комплекс витаминов группы В, с дефицитом которых связывают нарушения функций нервной системы, кожи, слизистых оболочек, кишечника, сердечно-cосудистой системы и кроветворных органов, умственной деятельности (табл. 3). Содержание, мкг/г B 1 (тиамин) 8– 15 B 2 (рибофлавин) 50– 70 B 3, PP (никотиновая кислота) 230– 380 B 4 (холин) Витамины группы В играют важную роль в процессах белкового, липидного и углеводного обмена, оказывают иммуномодулирующее действие, участвуют в синтезе ПГ, ферментов и коферментов. Витамин следы B 5 (пантотеновая кислота) 38– 61 B 6 (пиридоксин) 10– 20 B 9 (фолиевая кислота) 10– 15 Биотин 1– 2 B 12
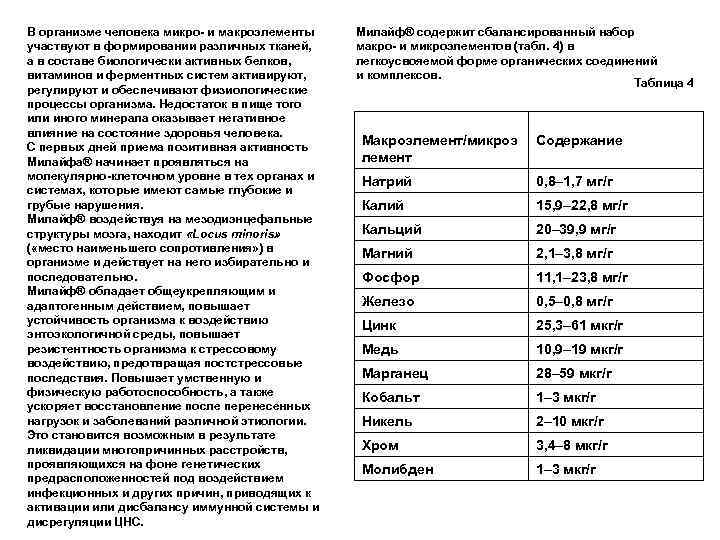 В организме человека микро- и макроэлементы участвуют в формировании различных тканей, а в составе биологически активных белков, витаминов и ферментных систем активируют, регулируют и обеспечивают физиологические процессы организма. Недостаток в пище того или иного минерала оказывает негативное влияние на состояние здоровья человека. С первых дней приема позитивная активность Милайфа® начинает проявляться на молекулярно-клеточном уровне в тех органах и системах, которые имеют самые глубокие и грубые нарушения. Милайф® воздействуя на мезодиэнцефальные структуры мозга, находит «Locus minoris» ( «место наименьшего сопротивления» ) в организме и действует на него избирательно и последовательно. Милайф® обладает общеукрепляющим и адаптогенным действием, повышает устойчивость организма к воздействию энтоэкологичной среды, повышает резистентность организма к стрессовому воздействию, предотвращая постстрессовые последствия. Повышает умственную и физическую работоспособность, а также ускоряет восстановление после перенесенных нагрузок и заболеваний различной этиологии. Это становится возможным в результате ликвидации многопричинных расстройств, проявляющихся на фоне генетических предрасположенностей под воздействием инфекционных и других причин, приводящих к активации или дисбалансу иммунной системы и дисрегуляции ЦНС. Милайф® содержит сбалансированный набор макро- и микроэлементов (табл. 4) в легкоусвояемой форме органических соединений и комплексов. Таблица 4 Макроэлемент/микроэ лемент Содержание Натрий 0, 8– 1, 7 мг/г Калий 15, 9– 22, 8 мг/г Кальций 20– 39, 9 мг/г Магний 2, 1– 3, 8 мг/г Фосфор 11, 1– 23, 8 мг/г Железо 0, 5– 0, 8 мг/г Цинк 25, 3– 61 мкг/г Медь 10, 9– 19 мкг/г Марганец 28– 59 мкг/г Кобальт 1– 3 мкг/г Никель 2– 10 мкг/г Хром 3, 4– 8 мкг/г Молибден 1– 3 мкг/г
В организме человека микро- и макроэлементы участвуют в формировании различных тканей, а в составе биологически активных белков, витаминов и ферментных систем активируют, регулируют и обеспечивают физиологические процессы организма. Недостаток в пище того или иного минерала оказывает негативное влияние на состояние здоровья человека. С первых дней приема позитивная активность Милайфа® начинает проявляться на молекулярно-клеточном уровне в тех органах и системах, которые имеют самые глубокие и грубые нарушения. Милайф® воздействуя на мезодиэнцефальные структуры мозга, находит «Locus minoris» ( «место наименьшего сопротивления» ) в организме и действует на него избирательно и последовательно. Милайф® обладает общеукрепляющим и адаптогенным действием, повышает устойчивость организма к воздействию энтоэкологичной среды, повышает резистентность организма к стрессовому воздействию, предотвращая постстрессовые последствия. Повышает умственную и физическую работоспособность, а также ускоряет восстановление после перенесенных нагрузок и заболеваний различной этиологии. Это становится возможным в результате ликвидации многопричинных расстройств, проявляющихся на фоне генетических предрасположенностей под воздействием инфекционных и других причин, приводящих к активации или дисбалансу иммунной системы и дисрегуляции ЦНС. Милайф® содержит сбалансированный набор макро- и микроэлементов (табл. 4) в легкоусвояемой форме органических соединений и комплексов. Таблица 4 Макроэлемент/микроэ лемент Содержание Натрий 0, 8– 1, 7 мг/г Калий 15, 9– 22, 8 мг/г Кальций 20– 39, 9 мг/г Магний 2, 1– 3, 8 мг/г Фосфор 11, 1– 23, 8 мг/г Железо 0, 5– 0, 8 мг/г Цинк 25, 3– 61 мкг/г Медь 10, 9– 19 мкг/г Марганец 28– 59 мкг/г Кобальт 1– 3 мкг/г Никель 2– 10 мкг/г Хром 3, 4– 8 мкг/г Молибден 1– 3 мкг/г
 Препарат Милайф® увеличивает пролиферативную активность в клетках и контролирует клеточный цикл, запускает ускоренную систему апаптоза в дефектных клетках, что ведет к замедлению накопления мутаций. Милайф® освобождает клетки от генетически избыточной (экстрахромосомной) ДНК в результате усиления везикулярного трафика (внутри - и межклеточный транспорт в мембранных пузырьках), что приводит к усилению выхода нейромедиаторов в синапсах, появлению длительной потенциации (устойчивого скачка потенциала на клеточной мембране) и, как следствие, увеличению проводимости. Результатом этого является подавление дефектных и увеличение точности репликации существующих последовательностей в ДНК, что позволяет применять препарат Милайф® для профилактики онкопроцесса и для подавления прогрессии злокачественных клеток при онкотерапии. Доказана цитотоксичность Милайфа® против опухолевых клеток при отсутствии токсичности в отношении нормальных клеток. Не вызывает резистентности у опухолевых клеток. Милайф® обладает биорегулирующим разнонаправленным эффектом, способным усиливать слабую, ослаблять сильную или оставлять без изменения нормальную реакцию иммунной системы. В результате экспериментальных исследований и клинических испытаний установлено, что Милайф® воздействует на иммунокомпетентные органы; способствует нормализации показателей как клеточного, так и гуморального иммунитета. Вызывает эффект колониестимулирующего фактора в иммунокомпетентных органах, увеличивая в 1, 7– 2, 1 раза обновление лимфоидных клеток. Восстанавливает весь интерлейкиновый ряд (с ИЛ-1 до ИЛ-18). Как индуктор альфа-, бета- и гамма-интерферона, фактора некроза опухоли (альфа/бета), препарат повышает число естественных киллеров (СD 16), повышает количество В-лимфоцитов, увеличивает иммунорегуляторный индекс (соотношение хелперов и супрессоров) за счет увеличения Т-лимфоцитов (СD 3) и Т-хелперов (СD 4). Учитывая воздействие препарата Милайф® на иммунокомпетентные органы и усиление везикулярного трафика, нейроиммунная система способна распознавать патологические изменения в клетке и причину, вызвавшую данные изменения, в частности вирус. На этом основано непрямое и прямое вирулицидное действие препарата. Происходит нарушение синтеза вирусоспецифических структур и процесса формирования вирионов, что приводит к продукции дефектной низкоинфекционной вирусной популяции. Наблюдается достоверное снижение числа вирусных отростков (пепломеры гемагглютинина и нейраминидазы) и нарушение структуры нуклеопротеида. Помимо этого, Милайф® выступает в качестве цитопротектора по отношению к зараженной вирусом клетке; оказывает гепатопротекторное действие, нормализует нарушенную дезинтоксикационную и белковообразующую функцию печени за счет активации нескольких сотен изоформ цитохрома Р-450. Милайф® не обладает канцерогенными, мутагенными, тератогенными, эмбриотоксическими свойствами. Фармакокинетика: После приема внутрь препарат быстро всасывается. Максимальная активность достигается через 90 мин. Биодоступность практически полная. Степень связывания с белками плазмы составляет до 6%, объем распределения — 1, 8– 1, 9 л/кг. Препарат быстро проникает в ткани, органы и биологические жидкости организма: сердечная мышца, клапаны, печень, селезенка, надпочечники, почки, желчный пузырь, поджелудочная железа, матка, предстательная железа, кости, брюшная полость, плевра, слюна, мокрота. Концентрация Милайфа® в тканях и органах выше концентрации в плазме крови. Препарат выводится преимущественно с мочой (до 70% в течение 72 ч) и частично с желчью — до 25%. Препарат Милайф зарегистрирован МЗ РФ Регистрационное удостоверение № 97/292/9 от 03. 10. 1997 г. Регистрационное удостоверение Р № 000880/01 - 2001 от 06. 12. 2001 г. Регистрационное удостоверение № 2000/260/1 от 14. 07. 2000 г. Свидетельство о государственной регистрации № 77. 99. 23. 3. У. 9505. 8. 05 от 18. 08. 2005 г.
Препарат Милайф® увеличивает пролиферативную активность в клетках и контролирует клеточный цикл, запускает ускоренную систему апаптоза в дефектных клетках, что ведет к замедлению накопления мутаций. Милайф® освобождает клетки от генетически избыточной (экстрахромосомной) ДНК в результате усиления везикулярного трафика (внутри - и межклеточный транспорт в мембранных пузырьках), что приводит к усилению выхода нейромедиаторов в синапсах, появлению длительной потенциации (устойчивого скачка потенциала на клеточной мембране) и, как следствие, увеличению проводимости. Результатом этого является подавление дефектных и увеличение точности репликации существующих последовательностей в ДНК, что позволяет применять препарат Милайф® для профилактики онкопроцесса и для подавления прогрессии злокачественных клеток при онкотерапии. Доказана цитотоксичность Милайфа® против опухолевых клеток при отсутствии токсичности в отношении нормальных клеток. Не вызывает резистентности у опухолевых клеток. Милайф® обладает биорегулирующим разнонаправленным эффектом, способным усиливать слабую, ослаблять сильную или оставлять без изменения нормальную реакцию иммунной системы. В результате экспериментальных исследований и клинических испытаний установлено, что Милайф® воздействует на иммунокомпетентные органы; способствует нормализации показателей как клеточного, так и гуморального иммунитета. Вызывает эффект колониестимулирующего фактора в иммунокомпетентных органах, увеличивая в 1, 7– 2, 1 раза обновление лимфоидных клеток. Восстанавливает весь интерлейкиновый ряд (с ИЛ-1 до ИЛ-18). Как индуктор альфа-, бета- и гамма-интерферона, фактора некроза опухоли (альфа/бета), препарат повышает число естественных киллеров (СD 16), повышает количество В-лимфоцитов, увеличивает иммунорегуляторный индекс (соотношение хелперов и супрессоров) за счет увеличения Т-лимфоцитов (СD 3) и Т-хелперов (СD 4). Учитывая воздействие препарата Милайф® на иммунокомпетентные органы и усиление везикулярного трафика, нейроиммунная система способна распознавать патологические изменения в клетке и причину, вызвавшую данные изменения, в частности вирус. На этом основано непрямое и прямое вирулицидное действие препарата. Происходит нарушение синтеза вирусоспецифических структур и процесса формирования вирионов, что приводит к продукции дефектной низкоинфекционной вирусной популяции. Наблюдается достоверное снижение числа вирусных отростков (пепломеры гемагглютинина и нейраминидазы) и нарушение структуры нуклеопротеида. Помимо этого, Милайф® выступает в качестве цитопротектора по отношению к зараженной вирусом клетке; оказывает гепатопротекторное действие, нормализует нарушенную дезинтоксикационную и белковообразующую функцию печени за счет активации нескольких сотен изоформ цитохрома Р-450. Милайф® не обладает канцерогенными, мутагенными, тератогенными, эмбриотоксическими свойствами. Фармакокинетика: После приема внутрь препарат быстро всасывается. Максимальная активность достигается через 90 мин. Биодоступность практически полная. Степень связывания с белками плазмы составляет до 6%, объем распределения — 1, 8– 1, 9 л/кг. Препарат быстро проникает в ткани, органы и биологические жидкости организма: сердечная мышца, клапаны, печень, селезенка, надпочечники, почки, желчный пузырь, поджелудочная железа, матка, предстательная железа, кости, брюшная полость, плевра, слюна, мокрота. Концентрация Милайфа® в тканях и органах выше концентрации в плазме крови. Препарат выводится преимущественно с мочой (до 70% в течение 72 ч) и частично с желчью — до 25%. Препарат Милайф зарегистрирован МЗ РФ Регистрационное удостоверение № 97/292/9 от 03. 10. 1997 г. Регистрационное удостоверение Р № 000880/01 - 2001 от 06. 12. 2001 г. Регистрационное удостоверение № 2000/260/1 от 14. 07. 2000 г. Свидетельство о государственной регистрации № 77. 99. 23. 3. У. 9505. 8. 05 от 18. 08. 2005 г.
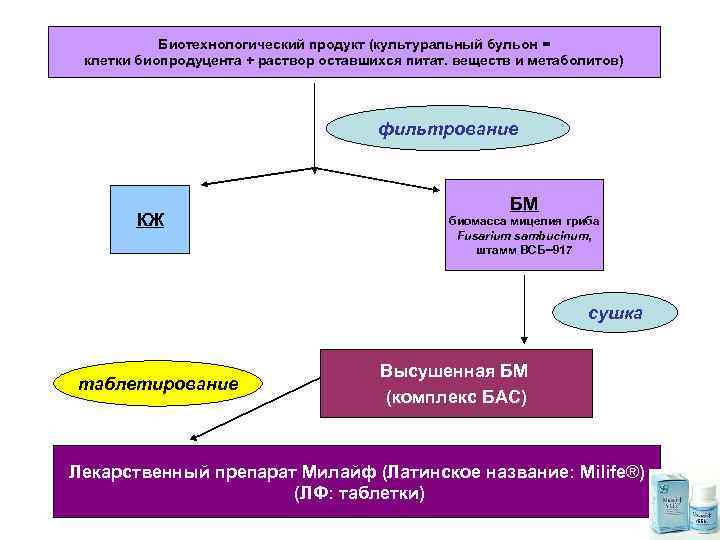 Биотехнологический продукт (культуральный бульон = клетки биопродуцента + раствор оставшихся питат. веществ и метаболитов) фильтрование КЖ БМ биомасса мицелия гриба Fusarium sambucinum, штамм ВСБ− 917 сушка таблетирование Высушенная БМ (комплекс БАС) Лекарственный препарат Милайф (Латинское название: Milife®) (ЛФ: таблетки)
Биотехнологический продукт (культуральный бульон = клетки биопродуцента + раствор оставшихся питат. веществ и метаболитов) фильтрование КЖ БМ биомасса мицелия гриба Fusarium sambucinum, штамм ВСБ− 917 сушка таблетирование Высушенная БМ (комплекс БАС) Лекарственный препарат Милайф (Латинское название: Milife®) (ЛФ: таблетки)
 ТАБЛЕТИРОВАНИЕ , формование порошкообразных или волокнистых материалов в заготовки правильной геом. формы, однородные по размеру и массе. Применяют в тех случаях, когда плавление материала невозможно или нецелесообразно. Получаемые таблетки обычно имеют цилиндрич. или прямоугольную форму. Уплотнение материала происходит под действием сжимающих усилий, причем уд. давление зависит от природы материала и составляет 50 -300 МПа; давление м. б. снижено путем предварит. подогрева материала, его увлажнения, использования смазывающих добавок и связующих. http: //www. edudic. ru/hie/4914/ Осуществляют Т. в автоматич. таблеточных машинах, технол. процесс в к-рых включает операции дозирования, прессования и выталкивания таблеток. По виду привода таблеточные машины разделяют на мех. (кривошипные и роторные) и гидравлические.
ТАБЛЕТИРОВАНИЕ , формование порошкообразных или волокнистых материалов в заготовки правильной геом. формы, однородные по размеру и массе. Применяют в тех случаях, когда плавление материала невозможно или нецелесообразно. Получаемые таблетки обычно имеют цилиндрич. или прямоугольную форму. Уплотнение материала происходит под действием сжимающих усилий, причем уд. давление зависит от природы материала и составляет 50 -300 МПа; давление м. б. снижено путем предварит. подогрева материала, его увлажнения, использования смазывающих добавок и связующих. http: //www. edudic. ru/hie/4914/ Осуществляют Т. в автоматич. таблеточных машинах, технол. процесс в к-рых включает операции дозирования, прессования и выталкивания таблеток. По виду привода таблеточные машины разделяют на мех. (кривошипные и роторные) и гидравлические.
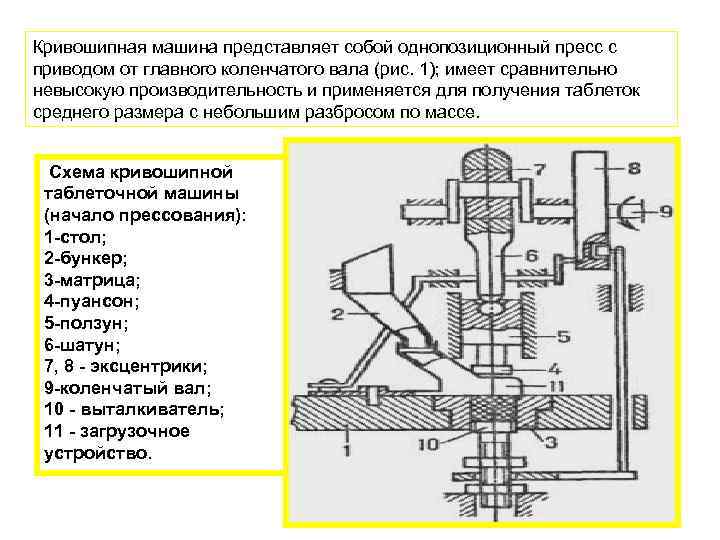 Кривошипная машина представляет собой однопозиционный пресс с приводом от главного коленчатого вала (рис. 1); имеет сравнительно невысокую производительность и применяется для получения таблеток среднего размера с небольшим разбросом по массе. Схема кривошипной таблеточной машины (начало прессования): 1 -стол; 2 -бункер; 3 -матрица; 4 -пуансон; 5 -ползун; 6 -шатун; 7, 8 - эксцентрики; 9 -коленчатый вал; 10 - выталкиватель; 11 - загрузочное устройство.
Кривошипная машина представляет собой однопозиционный пресс с приводом от главного коленчатого вала (рис. 1); имеет сравнительно невысокую производительность и применяется для получения таблеток среднего размера с небольшим разбросом по массе. Схема кривошипной таблеточной машины (начало прессования): 1 -стол; 2 -бункер; 3 -матрица; 4 -пуансон; 5 -ползун; 6 -шатун; 7, 8 - эксцентрики; 9 -коленчатый вал; 10 - выталкиватель; 11 - загрузочное устройство.
 http: //alsi-ft. ru/catalog/tabletpress/tablet-press-serii-ZP 45 A/ Таблет пресс серии ZP 45 A основные технические характеристики: Количество пуансонов (шт) Макс. давление (Кн) Макс. диаметр таблетки (мм) Макс. глубина наполнения (мм) Макс. толщина таблетки (мм) Скорость вращения турели (об/мин) Макс. производительность (таблеток/час) Мощность двигателя (Квт) Вес (кг) Занимаемая площадь (мм) Высота с бункером (мм) Высота без бункера (мм) 45 100 Φ 13 17 8 5~ 36 200, 000 5. 5 1800 1100× 940 1755 1500
http: //alsi-ft. ru/catalog/tabletpress/tablet-press-serii-ZP 45 A/ Таблет пресс серии ZP 45 A основные технические характеристики: Количество пуансонов (шт) Макс. давление (Кн) Макс. диаметр таблетки (мм) Макс. глубина наполнения (мм) Макс. толщина таблетки (мм) Скорость вращения турели (об/мин) Макс. производительность (таблеток/час) Мощность двигателя (Квт) Вес (кг) Занимаемая площадь (мм) Высота с бункером (мм) Высота без бункера (мм) 45 100 Φ 13 17 8 5~ 36 200, 000 5. 5 1800 1100× 940 1755 1500
 Таблетки, их характеристика и классификация Таблетки (лат. tabulettae от tabula - доска; medicamenta compressa, comprimata) - твердая дозированная лекарственная форма, получаемая прессованием, реже - формованием порошков и гранул, содержащих одно или более лекарственных веществ с добавлением или без вспомогательных компонентов[1]. Первые сведения о возможности прессования порошков относятся к середине XIX столетия. В нашей стране впервые начал выпускать таблетки в 1895 г. завод врачебных заготовлений в Петербурге, ныне Ленинградское производственное объединение "Октябрь". Первым исследованием, посвященным таблеткам, была диссертация проф. Л. Ф. Ильина (1900). Таблетки имеют вид плоских, и двояковыпуклых круглых, овальных дисков или иной формы пластинок. Наиболее удобны для изготовления, упаковки и применения таблетки в виде дисков, так как они легко и плотно упаковываются. Штампы и матрицы для их изготовления проще и дешевле. Диаметр таблеток колеблется от 3 до 25 мм. Таблетки с большим поперечником считаются брикетами. Высота таблеток должна быть в пределах 30 -40% их диаметра. Иногда таблетки могут иметь цилиндрическую форму. Таблетки диаметром (длиной) более 9 мм имеют одну или две перпендикулярные другу риски (насечки), позволяющие разделить таблетку на две или четыре части и таким образом изменять дозировку лекарственного вещества. Поверхность таблетки должна быть гладкой, однородной; на торцевые поверхности могут быть нанесены опознавательные надписи и условные обозначения (маркировка). Одна таблетка обычно предназначается на один прием. Таблетки могут быть предназначены для энтерального и парентерального введения, а также для приготовления растворов или суспензий для приема внутрь, аппликаций и инъекций. Таблетки классифицируют по самым разным признакам. По способу получения: прессованные (собственно таблетки); тритурационные. По пути введения: пероральные; вагинальные; ректальные.
Таблетки, их характеристика и классификация Таблетки (лат. tabulettae от tabula - доска; medicamenta compressa, comprimata) - твердая дозированная лекарственная форма, получаемая прессованием, реже - формованием порошков и гранул, содержащих одно или более лекарственных веществ с добавлением или без вспомогательных компонентов[1]. Первые сведения о возможности прессования порошков относятся к середине XIX столетия. В нашей стране впервые начал выпускать таблетки в 1895 г. завод врачебных заготовлений в Петербурге, ныне Ленинградское производственное объединение "Октябрь". Первым исследованием, посвященным таблеткам, была диссертация проф. Л. Ф. Ильина (1900). Таблетки имеют вид плоских, и двояковыпуклых круглых, овальных дисков или иной формы пластинок. Наиболее удобны для изготовления, упаковки и применения таблетки в виде дисков, так как они легко и плотно упаковываются. Штампы и матрицы для их изготовления проще и дешевле. Диаметр таблеток колеблется от 3 до 25 мм. Таблетки с большим поперечником считаются брикетами. Высота таблеток должна быть в пределах 30 -40% их диаметра. Иногда таблетки могут иметь цилиндрическую форму. Таблетки диаметром (длиной) более 9 мм имеют одну или две перпендикулярные другу риски (насечки), позволяющие разделить таблетку на две или четыре части и таким образом изменять дозировку лекарственного вещества. Поверхность таблетки должна быть гладкой, однородной; на торцевые поверхности могут быть нанесены опознавательные надписи и условные обозначения (маркировка). Одна таблетка обычно предназначается на один прием. Таблетки могут быть предназначены для энтерального и парентерального введения, а также для приготовления растворов или суспензий для приема внутрь, аппликаций и инъекций. Таблетки классифицируют по самым разным признакам. По способу получения: прессованные (собственно таблетки); тритурационные. По пути введения: пероральные; вагинальные; ректальные.
 По наличию оболочки: покрытые оболочкой; непокрытые оболочкой. В зависимости от биофармацевтических и фармакокинетических свойств: обычные; с модифицированным высвобождением. По признаку готовности к применению: готовые формы; полуфабрикаты для приготовления раствора или суспензии. В зависимости от назначения лекарственных препаратов различают следующие группы таблеток. Oriblettae - таблетки, применяемые перорально. Вещества всасываются слизистой оболочкой желудка или кишечника. Таблетки принимают внутрь, запивая водой. Иногда их предварительно растворяют в воде. Пероральные таблетки являются основной группой таблеток. [6] Resoriblettae - таблетки, применяемые сублингвально. Вещества всасываются слизистой оболочкой рта. Implantablettae - таблетки, применяемые для имплантации. Рассчитаны на замедленное всасывание лекарственных веществ с целью пролонгирования лечебного эффекта. Injectablettae - таблетки, приготовленные в асептических условиях, используемые для получения инъекционных растворов лекарственных веществ. Solublettae - таблетки, используемые для приготовления из прессованных веществ растворов разного фармацевтического назначения (полосканий, спринцеваний и Др. ). Таблетки для наружного применения, содержащие ядовитые вещества, обязательно окрашиваются раствором мегиленового синего, а содержащие ртути дихлорид - раствором эозина.
По наличию оболочки: покрытые оболочкой; непокрытые оболочкой. В зависимости от биофармацевтических и фармакокинетических свойств: обычные; с модифицированным высвобождением. По признаку готовности к применению: готовые формы; полуфабрикаты для приготовления раствора или суспензии. В зависимости от назначения лекарственных препаратов различают следующие группы таблеток. Oriblettae - таблетки, применяемые перорально. Вещества всасываются слизистой оболочкой желудка или кишечника. Таблетки принимают внутрь, запивая водой. Иногда их предварительно растворяют в воде. Пероральные таблетки являются основной группой таблеток. [6] Resoriblettae - таблетки, применяемые сублингвально. Вещества всасываются слизистой оболочкой рта. Implantablettae - таблетки, применяемые для имплантации. Рассчитаны на замедленное всасывание лекарственных веществ с целью пролонгирования лечебного эффекта. Injectablettae - таблетки, приготовленные в асептических условиях, используемые для получения инъекционных растворов лекарственных веществ. Solublettae - таблетки, используемые для приготовления из прессованных веществ растворов разного фармацевтического назначения (полосканий, спринцеваний и Др. ). Таблетки для наружного применения, содержащие ядовитые вещества, обязательно окрашиваются раствором мегиленового синего, а содержащие ртути дихлорид - раствором эозина.
 Положительные и отрицательные стороны таблеток Таблетки, как и другие лекарственные формы, имеют положительные и отрицательные стороны. К положительным качествам таблеток и их производства относятся: 1) полная механизация процесса изготовления, обеспечивающая высокую производительность, чистоту и гигиеничность таблеток; 2) точность дозирования вводимых в таблетки лекарственных веществ; 3) портативность таблеток, обеспечивающая удобство отпуска, хранение и транспортировку лекарств; 4) сохранность (относительно длительная) лекарственных веществ в спрессованном состоянии. Для недостаточно устойчивых веществ возможно нанесение защитных оболочек; 5) маскировка неприятных органолептических свойств (вкус, запах, красящая способность). Достигается наложением оболочек из сахара, какао, шоколада и др. ; 6) возможность сочетания лекарственных веществ, несовместимых по их физико-химическим свойствам в других лекарственных формах; 7) локализация действия лекарственного вещества; достигается путем нанесения оболочек специального состава, растворимых преимущественно в кислой (желудок) или в щелочной (кишечник) среде; 8) пролонгирование действия лекарственных веществ; 9) регулирование последовательного всасывания нескольких лекарственных веществ из таблетки в определенные промежутки времени - создание многослойных таблеток; 10) предупреждение ошибок при отпуске и приеме лекарств, достигаемое выпрессовыванием на таблетке надписей. [11] Наряду с этим таблетки не свободны и от некоторых недостатков: 1) при хранении таблетки могут терять распадаемость и цементироваться или, наоборот, разрушаться; 2) с таблетками в организм вводятся вещества, не имеющие терапевтической ценности, а иногда вызывающие некоторые побочные явления (например, тальк раздражает слизистую оболочку), но имеется возможность ограничить их количество; 3) отдельные лекарственные препараты (например, натрия или калия бромид) образуют в зоне растворения высококонцентрированные растворы, которые могут вызывать сильное раздражение слизистых оболочек. Недостаток этого устраним: такие таблетки перед приемом размельчают и растворяют в определенном количестве воды; 4) не все больные, особенно дети, могут свободно проглатывать таблетки.
Положительные и отрицательные стороны таблеток Таблетки, как и другие лекарственные формы, имеют положительные и отрицательные стороны. К положительным качествам таблеток и их производства относятся: 1) полная механизация процесса изготовления, обеспечивающая высокую производительность, чистоту и гигиеничность таблеток; 2) точность дозирования вводимых в таблетки лекарственных веществ; 3) портативность таблеток, обеспечивающая удобство отпуска, хранение и транспортировку лекарств; 4) сохранность (относительно длительная) лекарственных веществ в спрессованном состоянии. Для недостаточно устойчивых веществ возможно нанесение защитных оболочек; 5) маскировка неприятных органолептических свойств (вкус, запах, красящая способность). Достигается наложением оболочек из сахара, какао, шоколада и др. ; 6) возможность сочетания лекарственных веществ, несовместимых по их физико-химическим свойствам в других лекарственных формах; 7) локализация действия лекарственного вещества; достигается путем нанесения оболочек специального состава, растворимых преимущественно в кислой (желудок) или в щелочной (кишечник) среде; 8) пролонгирование действия лекарственных веществ; 9) регулирование последовательного всасывания нескольких лекарственных веществ из таблетки в определенные промежутки времени - создание многослойных таблеток; 10) предупреждение ошибок при отпуске и приеме лекарств, достигаемое выпрессовыванием на таблетке надписей. [11] Наряду с этим таблетки не свободны и от некоторых недостатков: 1) при хранении таблетки могут терять распадаемость и цементироваться или, наоборот, разрушаться; 2) с таблетками в организм вводятся вещества, не имеющие терапевтической ценности, а иногда вызывающие некоторые побочные явления (например, тальк раздражает слизистую оболочку), но имеется возможность ограничить их количество; 3) отдельные лекарственные препараты (например, натрия или калия бромид) образуют в зоне растворения высококонцентрированные растворы, которые могут вызывать сильное раздражение слизистых оболочек. Недостаток этого устраним: такие таблетки перед приемом размельчают и растворяют в определенном количестве воды; 4) не все больные, особенно дети, могут свободно проглатывать таблетки.
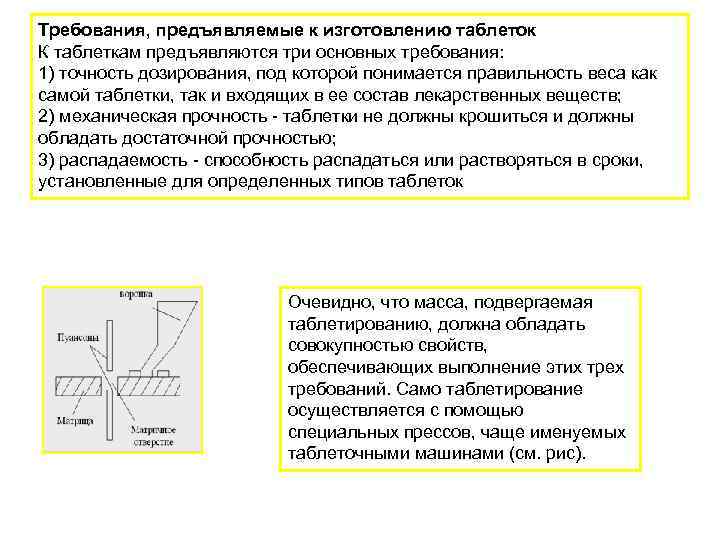 Требования, предъявляемые к изготовлению таблеток К таблеткам предъявляются три основных требования: 1) точность дозирования, под которой понимается правильность веса как самой таблетки, так и входящих в ее состав лекарственных веществ; 2) механическая прочность - таблетки не должны крошиться и должны обладать достаточной прочностью; 3) распадаемость - способность распадаться или растворяться в сроки, установленные для определенных типов таблеток Очевидно, что масса, подвергаемая таблетированию, должна обладать совокупностью свойств, обеспечивающих выполнение этих требований. Само таблетирование осуществляется с помощью специальных прессов, чаще именуемых таблеточными машинами (см. рис).
Требования, предъявляемые к изготовлению таблеток К таблеткам предъявляются три основных требования: 1) точность дозирования, под которой понимается правильность веса как самой таблетки, так и входящих в ее состав лекарственных веществ; 2) механическая прочность - таблетки не должны крошиться и должны обладать достаточной прочностью; 3) распадаемость - способность распадаться или растворяться в сроки, установленные для определенных типов таблеток Очевидно, что масса, подвергаемая таблетированию, должна обладать совокупностью свойств, обеспечивающих выполнение этих требований. Само таблетирование осуществляется с помощью специальных прессов, чаще именуемых таблеточными машинами (см. рис).
 Точность дозирования зависит от многих условий, которые должны обеспечить безотказное истечение сыпучего материала и заполнения им матричного гнезда. [4] 1. Дозирование будет точным, если в матричное гнездо в течение всего процесса таблетирования будет поступать всегда строго определенное количество таблетируемой массы. Это зависит от постоянства объема матричного гнезда, от положения нижнего пуансона. 2. Точность дозирования зависит от быстроты и безотказности заполнение матричного гнезда. Если за короткое время пребывания воронки над матричным отверстием высыпается меньше материала, чем может принять матричное гнездо, таблетки всегда будут меньшей массы. Необходимая скорость заполнения зависит от формы воронки и угла ската, а также от достаточного скольжения частиц таблетируемой массы. Этого можно добиться добавления к материалу фракционных веществ или гранулированием. 3. Точность дозирования обусловлена также однородностью таблетируемой массы, которая обеспечивается при тщательном перемешивании лекарственных и вспомогательных веществ и равномерном распределении их в общей массе. Если масса состоит из частиц разного размера, то при встряхивании загрузочной воронки смесь расслаивается: крупные частицы остаются сверху, мелкие опускаются вниз. Это вызывает изменение массы таблеток. Иногда расслаивание можно предупредить установлением в воронке небольшой мешалки, но более радикальной мерой является гранулирование. Говоря об однородности материала, имеют в виду также однородность его по форме частичек. Частички, имеющие разную форму при одной и той же массе, будут размещаться в матричном гнезде с разной компактностью, что также отразится на массе таблеток. Выравнивание формы частичек достигается тем же гранулированим. Механическая прочность. Прочность таблеток зависит от природных (физико-химических) и технологических свойств таблетируемых веществ, а также от применяемого давления. Для образования таблеток необходимым условием является взаимосцепляемость частиц. В начале процесса прессование таблетируемая масса уплотняется, происходит более тесное сближение частиц и создаются условия для проявления сил межмолекулярного и электростатического взаимодействия. На первой стадии прессования материала происходит сближение и уплотнение частиц материал за счет смещения частиц относительно друга заполнение пустот. На второй стадии с увеличением давления прессования происходит интенсивное уплотнение материала за счет заполнения пустот и различных видов деформаций, которые способствуют более компактной упаковке частиц. Деформация помогает частицам взаимно вклиниваться, что увеличивает контактную поверхность. На второй стадии прессования и сыпучего материала образуется компактное пористое тело, обладающее достаточной механической прочностью.
Точность дозирования зависит от многих условий, которые должны обеспечить безотказное истечение сыпучего материала и заполнения им матричного гнезда. [4] 1. Дозирование будет точным, если в матричное гнездо в течение всего процесса таблетирования будет поступать всегда строго определенное количество таблетируемой массы. Это зависит от постоянства объема матричного гнезда, от положения нижнего пуансона. 2. Точность дозирования зависит от быстроты и безотказности заполнение матричного гнезда. Если за короткое время пребывания воронки над матричным отверстием высыпается меньше материала, чем может принять матричное гнездо, таблетки всегда будут меньшей массы. Необходимая скорость заполнения зависит от формы воронки и угла ската, а также от достаточного скольжения частиц таблетируемой массы. Этого можно добиться добавления к материалу фракционных веществ или гранулированием. 3. Точность дозирования обусловлена также однородностью таблетируемой массы, которая обеспечивается при тщательном перемешивании лекарственных и вспомогательных веществ и равномерном распределении их в общей массе. Если масса состоит из частиц разного размера, то при встряхивании загрузочной воронки смесь расслаивается: крупные частицы остаются сверху, мелкие опускаются вниз. Это вызывает изменение массы таблеток. Иногда расслаивание можно предупредить установлением в воронке небольшой мешалки, но более радикальной мерой является гранулирование. Говоря об однородности материала, имеют в виду также однородность его по форме частичек. Частички, имеющие разную форму при одной и той же массе, будут размещаться в матричном гнезде с разной компактностью, что также отразится на массе таблеток. Выравнивание формы частичек достигается тем же гранулированим. Механическая прочность. Прочность таблеток зависит от природных (физико-химических) и технологических свойств таблетируемых веществ, а также от применяемого давления. Для образования таблеток необходимым условием является взаимосцепляемость частиц. В начале процесса прессование таблетируемая масса уплотняется, происходит более тесное сближение частиц и создаются условия для проявления сил межмолекулярного и электростатического взаимодействия. На первой стадии прессования материала происходит сближение и уплотнение частиц материал за счет смещения частиц относительно друга заполнение пустот. На второй стадии с увеличением давления прессования происходит интенсивное уплотнение материала за счет заполнения пустот и различных видов деформаций, которые способствуют более компактной упаковке частиц. Деформация помогает частицам взаимно вклиниваться, что увеличивает контактную поверхность. На второй стадии прессования и сыпучего материала образуется компактное пористое тело, обладающее достаточной механической прочностью.
 И, наконец, на третьей стадии прессования происходит объемное сжатие образовавшегося компактного тела. При прессовании большинства препаратов требуется высокое давление, но для каждой таблеточной массы давление прессования должно быть оптимальным, то есть при достаточной механической прочности необходимо обеспечить хорошую распадаемость таблетки. Кроме того, высокое давление может отрицательно влиять на качество таблеток и способствовать износу машин. Часто обеспечивать сцепляемость частиц может вода, обладающая достаточным дипольным моментом. Но связыванию труднорастворимых и нерастворимых лекарственных препаратов вода может даже препятствовать. В этом случае требуется добавление веществ с более высокой силой сцепления (растворы крахмала, желатина и др. ). В случае, если природный свойства лекарственного вещества не могут обеспечить необходимой прочности таблеток при непосредственном таблетировании, прочность достигается гранулированием. При гранулировании в таблетируемую массу вводят связывающие вещества, с помощью которых повышается пластичность лекарственного вещества. Очень важно, чтобы количество связывающих веществ было оптимальным. Распадаемость Слишком высокая прочность таблетки влияет на ее распадаемость: время распадаемости возрастает, что отрицательно сказывается на качестве таблетки. При достаточной механической прочности необходимо обеспечить хорошую распадаемость таблетки. Распадаемость зависит от многих причин: 1) от количества связывающих веществ. Таблетки должны содержать их столько, сколько необходимо для достижения требуемой прочности; 2) от степени прессования: чрезмерное давление ухудшает распадаемость таблетки; 3) от количества разрыхляющих веществ, способствующих распадаемости таблеток; 4) от свойства веществ, входящих в таблетку, от их способности растворяться в воде, смачиваться ею, набухать. Важен подбор связывающих и разрыхляющих веществ для нерастворимых в воде лекарственных веществ. По физической структуре таблетки представляют собой пористое тело. При погружении их в жидкость, последняя проникает во все капилляры, пронизывающие толщу таблетки. Если в таблетке будут иметься хорошо растворимые добавки, то они будут способствовать быстрой распадаемости ее. Таким образом, для изготовления точно дозированных, легко распадающихся и достаточно прочных таблеток необходимо, чтобы: таблетируемая масса наряду с основными содержала вспомогательные вещества; гранулят по способности скольжения, равномерности и абсолютной величине зерен обеспечивал максимальную точность дозирования; давление было бы таким, чтобы скорость распадения оставалась нормальной при достаточной прочности таблеток.
И, наконец, на третьей стадии прессования происходит объемное сжатие образовавшегося компактного тела. При прессовании большинства препаратов требуется высокое давление, но для каждой таблеточной массы давление прессования должно быть оптимальным, то есть при достаточной механической прочности необходимо обеспечить хорошую распадаемость таблетки. Кроме того, высокое давление может отрицательно влиять на качество таблеток и способствовать износу машин. Часто обеспечивать сцепляемость частиц может вода, обладающая достаточным дипольным моментом. Но связыванию труднорастворимых и нерастворимых лекарственных препаратов вода может даже препятствовать. В этом случае требуется добавление веществ с более высокой силой сцепления (растворы крахмала, желатина и др. ). В случае, если природный свойства лекарственного вещества не могут обеспечить необходимой прочности таблеток при непосредственном таблетировании, прочность достигается гранулированием. При гранулировании в таблетируемую массу вводят связывающие вещества, с помощью которых повышается пластичность лекарственного вещества. Очень важно, чтобы количество связывающих веществ было оптимальным. Распадаемость Слишком высокая прочность таблетки влияет на ее распадаемость: время распадаемости возрастает, что отрицательно сказывается на качестве таблетки. При достаточной механической прочности необходимо обеспечить хорошую распадаемость таблетки. Распадаемость зависит от многих причин: 1) от количества связывающих веществ. Таблетки должны содержать их столько, сколько необходимо для достижения требуемой прочности; 2) от степени прессования: чрезмерное давление ухудшает распадаемость таблетки; 3) от количества разрыхляющих веществ, способствующих распадаемости таблеток; 4) от свойства веществ, входящих в таблетку, от их способности растворяться в воде, смачиваться ею, набухать. Важен подбор связывающих и разрыхляющих веществ для нерастворимых в воде лекарственных веществ. По физической структуре таблетки представляют собой пористое тело. При погружении их в жидкость, последняя проникает во все капилляры, пронизывающие толщу таблетки. Если в таблетке будут иметься хорошо растворимые добавки, то они будут способствовать быстрой распадаемости ее. Таким образом, для изготовления точно дозированных, легко распадающихся и достаточно прочных таблеток необходимо, чтобы: таблетируемая масса наряду с основными содержала вспомогательные вещества; гранулят по способности скольжения, равномерности и абсолютной величине зерен обеспечивал максимальную точность дозирования; давление было бы таким, чтобы скорость распадения оставалась нормальной при достаточной прочности таблеток.
 Список литературы 1. http: // protabletki. ru, январь 2012 г. 2. www. gmpua. com январь 2012 г. 3. www. golkom. ru январь 2012 г. 4. www. pharm. witec. com. январь 2012 г. 5. www. rosapteki. ru январь 2012 г. 6. Государственная фармакопея СССР. Вып. 1, 2. МЗ СССР - 11 -е изд. , 7. И. Чуешов, Промышленная технология лекарств: учебник. - Харьков, НФАУ, 2002. 715 с. 8. Краснюк И. Н. Фармацевтическая технология: Технология лекарственных форм. М. : Издательский центр "Академия", 2004. 9. М. Д. Машковский. Лекарственные средства. В 2 -х томах. Изд. 13. Медицина, 1991. - 304 с. : ил. 10. Милованова Л. Н. Технология изготовления лекарственных форм. Ростов на Дону: Медицина, 2002. 11. Муравьев И. А. Технология лекарств. 2 -е издание перераб. и дополн. - М. : Медицина, 1988. Представление рефератов: с 28. 01. 2013 г.
Список литературы 1. http: // protabletki. ru, январь 2012 г. 2. www. gmpua. com январь 2012 г. 3. www. golkom. ru январь 2012 г. 4. www. pharm. witec. com. январь 2012 г. 5. www. rosapteki. ru январь 2012 г. 6. Государственная фармакопея СССР. Вып. 1, 2. МЗ СССР - 11 -е изд. , 7. И. Чуешов, Промышленная технология лекарств: учебник. - Харьков, НФАУ, 2002. 715 с. 8. Краснюк И. Н. Фармацевтическая технология: Технология лекарственных форм. М. : Издательский центр "Академия", 2004. 9. М. Д. Машковский. Лекарственные средства. В 2 -х томах. Изд. 13. Медицина, 1991. - 304 с. : ил. 10. Милованова Л. Н. Технология изготовления лекарственных форм. Ростов на Дону: Медицина, 2002. 11. Муравьев И. А. Технология лекарств. 2 -е издание перераб. и дополн. - М. : Медицина, 1988. Представление рефератов: с 28. 01. 2013 г.
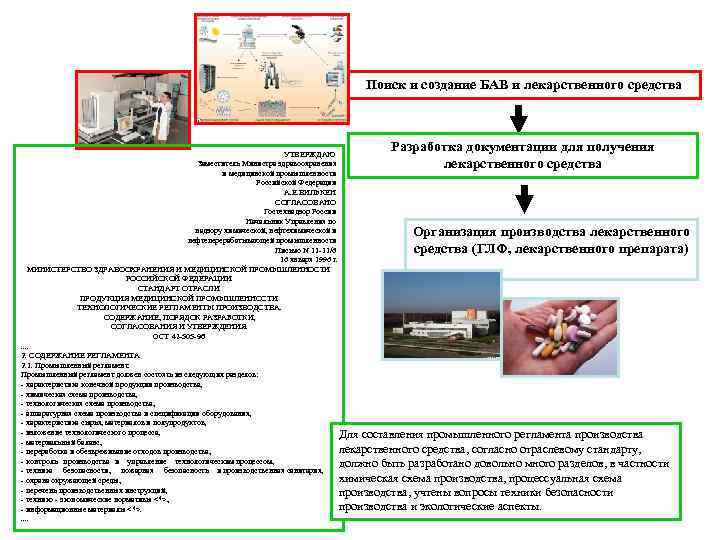 Поиск и создание БАВ и лекарственного средства Разработка документации для получения лекарственного средства УТВЕРЖДАЮ Заместитель Министра здравоохранения и медицинской промышленности Российской Федерации А. Е. ВИЛЬКЕН СОГЛАСОВАНО Гостехнадзор России Начальник Управления по надзору химической, нефтехимической и нефтеперерабатывающей промышленности Письмо N 11 -11/6 16 января 1996 г. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ ФЕДЕРАЦИИ СТАНДАРТ ОТРАСЛИ ПРОДУКЦИЯ МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ. ТЕХНОЛОГИЧЕСКИЕ РЕГЛАМЕНТЫ ПРОИЗВОДСТВА. СОДЕРЖАНИЕ, ПОРЯДОК РАЗРАБОТКИ, СОГЛАСОВАНИЯ И УТВЕРЖДЕНИЯ. ОСТ 42 -505 -96. . 2. СОДЕРЖАНИЕ РЕГЛАМЕНТА 2. 1. Промышленный регламент должен состоять из следующих разделов: - характеристика конечной продукции производства, - химическая схема производства, - технологическая схема производства, - аппаратурная схема производства и спецификации оборудования, - характеристика сырья, материалов и полупродуктов, - изложение технологического процесса, Для составления промышленного регламента производства - материальный баланс, лекарственного средства, согласно отраслевому стандарту, - переработка и обезвреживание отходов производства, - контроль производства и управление технологическим процессом, должно быть разработано довольно много разделов, в частности - техника безопасности, пожарная безопасность и производственная санитария, химическая схема производства, процессуальная схема - охрана окружающей среды, - перечень производственных инструкций, производства, учтены вопросы техники безопасности - технико - экономические нормативы <*>, производства и экологические аспекты. - информационные материалы <*>. . . Организация производства лекарственного средства (ГЛФ, лекарственного препарата)
Поиск и создание БАВ и лекарственного средства Разработка документации для получения лекарственного средства УТВЕРЖДАЮ Заместитель Министра здравоохранения и медицинской промышленности Российской Федерации А. Е. ВИЛЬКЕН СОГЛАСОВАНО Гостехнадзор России Начальник Управления по надзору химической, нефтехимической и нефтеперерабатывающей промышленности Письмо N 11 -11/6 16 января 1996 г. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ ФЕДЕРАЦИИ СТАНДАРТ ОТРАСЛИ ПРОДУКЦИЯ МЕДИЦИНСКОЙ ПРОМЫШЛЕННОСТИ. ТЕХНОЛОГИЧЕСКИЕ РЕГЛАМЕНТЫ ПРОИЗВОДСТВА. СОДЕРЖАНИЕ, ПОРЯДОК РАЗРАБОТКИ, СОГЛАСОВАНИЯ И УТВЕРЖДЕНИЯ. ОСТ 42 -505 -96. . 2. СОДЕРЖАНИЕ РЕГЛАМЕНТА 2. 1. Промышленный регламент должен состоять из следующих разделов: - характеристика конечной продукции производства, - химическая схема производства, - технологическая схема производства, - аппаратурная схема производства и спецификации оборудования, - характеристика сырья, материалов и полупродуктов, - изложение технологического процесса, Для составления промышленного регламента производства - материальный баланс, лекарственного средства, согласно отраслевому стандарту, - переработка и обезвреживание отходов производства, - контроль производства и управление технологическим процессом, должно быть разработано довольно много разделов, в частности - техника безопасности, пожарная безопасность и производственная санитария, химическая схема производства, процессуальная схема - охрана окружающей среды, - перечень производственных инструкций, производства, учтены вопросы техники безопасности - технико - экономические нормативы <*>, производства и экологические аспекты. - информационные материалы <*>. . . Организация производства лекарственного средства (ГЛФ, лекарственного препарата)
 Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61 -ФЗ "Об обращении лекарственных средств" Опубликовано 14 апреля 2010 г. Вступает в силу 1 сентября 2010 г. Принят Государственной Думой 24 марта 2010 года Одобрен Советом Федерации 31 марта 2010 года Глава 1. Общие положения Статья 1. Предмет регулирования настоящего Федерального закона 1. Настоящий Федеральный закон регулирует отношения, возникающие в связи с обращением - разработкой, доклиническими исследованиями, экспертизой, государственной регистрацией, со стандартизацией и с контролем качества, производством, изготовлением, хранением, перевозкой, ввозом на территорию Российской Федерации, вывозом с территории Российской Федерации, рекламой, отпуском, реализацией, передачей, применением, уничтожением лекарственных средств. 2. Настоящий Федеральный закон устанавливает приоритет государственного контроля безопасности, качества и эффективности лекарственных средств при их обращении. Статья 2. Сфера применения настоящего Федерального закона Настоящий Федеральный закон применяется к отношениям, возникающим при обращении лекарственных средств на территории Российской Федерации. Статья 3. Законодательство об обращении лекарственных средств 1. Законодательство об обращении лекарственных средств состоит из настоящего Федерального закона, других федеральных законов и иных нормативных правовых актов Российской Федерации. 2. Действие настоящего Федерального закона распространяется на обращение наркотических лекарственных средств и психотропных лекарственных средств с учетом особенностей, установленных законодательством Российской Федерации о наркотических средствах, психотропных веществах и об их прекурсорах. 3. Действие настоящего Федерального закона распространяется на обращение радиофармацевтических лекарственных средств с учетом особенностей, установленных законодательством Российской Федерации в области обеспечения радиационной безопасности. 4. Если международным договором Российской Федерации установлены иные правила, чем те, которые предусмотрены настоящим Федеральным законом, применяются правила международного договора. 5. В Российской Федерации в соответствии с международными договорами Российской Федерации и (или) на основе принципа взаимности признаются результаты клинических исследований лекарственных препаратов для медицинского применения, проведенных за пределами территории Российской Федерации. http: //www. rg. ru/2010/04/14/lekarstva-dok. html
Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61 -ФЗ "Об обращении лекарственных средств" Опубликовано 14 апреля 2010 г. Вступает в силу 1 сентября 2010 г. Принят Государственной Думой 24 марта 2010 года Одобрен Советом Федерации 31 марта 2010 года Глава 1. Общие положения Статья 1. Предмет регулирования настоящего Федерального закона 1. Настоящий Федеральный закон регулирует отношения, возникающие в связи с обращением - разработкой, доклиническими исследованиями, экспертизой, государственной регистрацией, со стандартизацией и с контролем качества, производством, изготовлением, хранением, перевозкой, ввозом на территорию Российской Федерации, вывозом с территории Российской Федерации, рекламой, отпуском, реализацией, передачей, применением, уничтожением лекарственных средств. 2. Настоящий Федеральный закон устанавливает приоритет государственного контроля безопасности, качества и эффективности лекарственных средств при их обращении. Статья 2. Сфера применения настоящего Федерального закона Настоящий Федеральный закон применяется к отношениям, возникающим при обращении лекарственных средств на территории Российской Федерации. Статья 3. Законодательство об обращении лекарственных средств 1. Законодательство об обращении лекарственных средств состоит из настоящего Федерального закона, других федеральных законов и иных нормативных правовых актов Российской Федерации. 2. Действие настоящего Федерального закона распространяется на обращение наркотических лекарственных средств и психотропных лекарственных средств с учетом особенностей, установленных законодательством Российской Федерации о наркотических средствах, психотропных веществах и об их прекурсорах. 3. Действие настоящего Федерального закона распространяется на обращение радиофармацевтических лекарственных средств с учетом особенностей, установленных законодательством Российской Федерации в области обеспечения радиационной безопасности. 4. Если международным договором Российской Федерации установлены иные правила, чем те, которые предусмотрены настоящим Федеральным законом, применяются правила международного договора. 5. В Российской Федерации в соответствии с международными договорами Российской Федерации и (или) на основе принципа взаимности признаются результаты клинических исследований лекарственных препаратов для медицинского применения, проведенных за пределами территории Российской Федерации. http: //www. rg. ru/2010/04/14/lekarstva-dok. html
 Статья 4. Основные понятия, используемые в настоящем Федеральном законе Для целей настоящего Федерального закона используются следующие основные понятия: 1) лекарственные средства - вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты; 2) фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность; 3) вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств; 4) лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности; 5) лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта;
Статья 4. Основные понятия, используемые в настоящем Федеральном законе Для целей настоящего Федерального закона используются следующие основные понятия: 1) лекарственные средства - вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты; 2) фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность; 3) вспомогательные вещества - вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств; 4) лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности; 5) лекарственная форма - состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта;
 6) перечень жизненно необходимых и важнейших лекарственных препаратов - ежегодно утверждаемый Правительством Российской Федерации перечень лекарственных препаратов для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации; 7) иммунобиологические лекарственные препараты - лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний; 8) наркотические лекарственные средства - лекарственные препараты и фармацевтические субстанции, содержащие наркотические средства и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Единой конвенцией о наркотических средствах 1961 года; 9) психотропные лекарственные средства - лекарственные препараты и фармацевтические субстанции, содержащие психотропные вещества и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Конвенцией о психотропных веществах 1971 года; 10) радиофармацевтические лекарственные средства - лекарственные средства, которые содержат в готовой для использования форме один радионуклид или несколько радионуклидов (радиоактивных изотопов);
6) перечень жизненно необходимых и важнейших лекарственных препаратов - ежегодно утверждаемый Правительством Российской Федерации перечень лекарственных препаратов для медицинского применения, обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации; 7) иммунобиологические лекарственные препараты - лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний; 8) наркотические лекарственные средства - лекарственные препараты и фармацевтические субстанции, содержащие наркотические средства и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Единой конвенцией о наркотических средствах 1961 года; 9) психотропные лекарственные средства - лекарственные препараты и фармацевтические субстанции, содержащие психотропные вещества и включенные в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, в соответствии с законодательством Российской Федерации, международными договорами Российской Федерации, в том числе Конвенцией о психотропных веществах 1971 года; 10) радиофармацевтические лекарственные средства - лекарственные средства, которые содержат в готовой для использования форме один радионуклид или несколько радионуклидов (радиоактивных изотопов);
 11) оригинальное лекарственное средство - лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов; 12) воспроизведенное лекарственное средство - лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства; 13) лекарственное растительное сырье - свежие или высушенные растения либо их части, используемые для производства лекарственных средств организациями - производителями лекарственных средств или изготовления лекарственных препаратов аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность; 14) лекарственный растительный препарат - лекарственный препарат, произведенный или изготовленный из одного вида лекарственного растительного сырья или нескольких видов такого сырья и реализуемый в расфасованном виде во вторичной (потребительской) упаковке; 15) гомеопатическое лекарственное средство - лекарственное средство, произведенное или изготовленное по специальной технологии;
11) оригинальное лекарственное средство - лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов; 12) воспроизведенное лекарственное средство - лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства; 13) лекарственное растительное сырье - свежие или высушенные растения либо их части, используемые для производства лекарственных средств организациями - производителями лекарственных средств или изготовления лекарственных препаратов аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность; 14) лекарственный растительный препарат - лекарственный препарат, произведенный или изготовленный из одного вида лекарственного растительного сырья или нескольких видов такого сырья и реализуемый в расфасованном виде во вторичной (потребительской) упаковке; 15) гомеопатическое лекарственное средство - лекарственное средство, произведенное или изготовленное по специальной технологии;
 16) международное непатентованное наименование лекарственного средства - наименование фармацевтической субстанции, рекомендованное Всемирной организацией здравоохранения; 17) торговое наименование лекарственного средства - наименование лекарственного средства, присвоенное его разработчиком; 18) общая фармакопейная статья - документ, утвержденный уполномоченным федеральным органом исполнительной власти и содержащий перечень показателей качества и (или) методов контроля качества конкретной лекарственной формы, лекарственного растительного сырья, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа лекарственного средства для медицинского применения, а также требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам; 19) фармакопейная статья - документ, утвержденный уполномоченным федеральным органом исполнительной власти и содержащий перечень показателей качества и методов контроля качества лекарственного средства для медицинского применения; 20) нормативная документация - документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества лекарственного средства для медицинского применения, методов контроля его качества и установленный его производителем; 21) нормативный документ - документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества и (или) методов контроля качества лекарственной формы, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа лекарственных средств для ветеринарного применения, требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам и установленный его производителем;
16) международное непатентованное наименование лекарственного средства - наименование фармацевтической субстанции, рекомендованное Всемирной организацией здравоохранения; 17) торговое наименование лекарственного средства - наименование лекарственного средства, присвоенное его разработчиком; 18) общая фармакопейная статья - документ, утвержденный уполномоченным федеральным органом исполнительной власти и содержащий перечень показателей качества и (или) методов контроля качества конкретной лекарственной формы, лекарственного растительного сырья, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа лекарственного средства для медицинского применения, а также требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам; 19) фармакопейная статья - документ, утвержденный уполномоченным федеральным органом исполнительной власти и содержащий перечень показателей качества и методов контроля качества лекарственного средства для медицинского применения; 20) нормативная документация - документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества лекарственного средства для медицинского применения, методов контроля его качества и установленный его производителем; 21) нормативный документ - документ, содержащий перечень определяемых по результатам соответствующих экспертиз показателей качества и (или) методов контроля качества лекарственной формы, описания биологических, биохимических, микробиологических, физико-химических, физических, химических и других методов анализа лекарственных средств для ветеринарного применения, требования к используемым в целях проведения данного анализа реактивам, титрованным растворам, индикаторам и установленный его производителем;
 22) качество лекарственного средства - соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа; 23) безопасность лекарственного средства - характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью; 24) эффективность лекарственного препарата - характеристика степени положительного влияния лекарственного препарата на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности; 25) серия лекарственного средства - количество лекарственного средства, произведенное в результате одного технологического цикла его производителем; 26) регистрационное удостоверение лекарственного препарата - документ, подтверждающий факт государственной регистрации лекарственного препарата; 27) регистрационный номер - кодовое обозначение, присвоенное лекарственному препарату при его государственной регистрации; 28) обращение лекарственных средств - разработка, доклинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз на территорию Российской Федерации, вывоз с территории Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств; 29) субъекты обращения лекарственных средств - физические лица, в том числе индивидуальные предприниматели, и юридические лица, осуществляющие деятельность при обращении лекарственных средств;
22) качество лекарственного средства - соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа; 23) безопасность лекарственного средства - характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью; 24) эффективность лекарственного препарата - характеристика степени положительного влияния лекарственного препарата на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности; 25) серия лекарственного средства - количество лекарственного средства, произведенное в результате одного технологического цикла его производителем; 26) регистрационное удостоверение лекарственного препарата - документ, подтверждающий факт государственной регистрации лекарственного препарата; 27) регистрационный номер - кодовое обозначение, присвоенное лекарственному препарату при его государственной регистрации; 28) обращение лекарственных средств - разработка, доклинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества, производство, изготовление, хранение, перевозка, ввоз на территорию Российской Федерации, вывоз с территории Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных средств; 29) субъекты обращения лекарственных средств - физические лица, в том числе индивидуальные предприниматели, и юридические лица, осуществляющие деятельность при обращении лекарственных средств;
 30) разработчик лекарственного средства - организация, обладающая правами на результаты доклинических исследований лекарственного средства, клинических исследований лекарственного препарата, а также на технологию производства лекарственного средства; 31) производство лекарственных средств - деятельность по производству лекарственных средств организациями - производителями лекарственных средств на одной стадии, нескольких или всех стадиях технологического процесса, а также по хранению и реализации произведенных лекарственных средств; 32) производитель лекарственных средств - организация, осуществляющая производство лекарственных средств в соответствии с требованиями настоящего Федерального закона; 33) фармацевтическая деятельность - деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов;
30) разработчик лекарственного средства - организация, обладающая правами на результаты доклинических исследований лекарственного средства, клинических исследований лекарственного препарата, а также на технологию производства лекарственного средства; 31) производство лекарственных средств - деятельность по производству лекарственных средств организациями - производителями лекарственных средств на одной стадии, нескольких или всех стадиях технологического процесса, а также по хранению и реализации произведенных лекарственных средств; 32) производитель лекарственных средств - организация, осуществляющая производство лекарственных средств в соответствии с требованиями настоящего Федерального закона; 33) фармацевтическая деятельность - деятельность, включающая в себя оптовую торговлю лекарственными средствами, их хранение, перевозку и (или) розничную торговлю лекарственными препаратами, их отпуск, хранение, перевозку, изготовление лекарственных препаратов;
 34) организация оптовой торговли лекарственными средствами - организация, осуществляющая оптовую торговлю лекарственными средствами, их хранение, перевозку в соответствии с требованиями настоящего Федерального закона; 35) аптечная организация - организация, структурное подразделение медицинской организации, осуществляющие розничную торговлю лекарственными препаратами, хранение, изготовление и отпуск лекарственных препаратов для медицинского применения в соответствии с требованиями настоящего Федерального закона; 36) ветеринарная аптечная организация - организация, структурное подразделение ветеринарной организации, осуществляющие розничную торговлю лекарственными препаратами, хранение, изготовление и отпуск лекарственных препаратов для ветеринарного применения в соответствии с требованиями настоящего Федерального закона; 37) фальсифицированное лекарственное средство - лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе; 38) недоброкачественное лекарственное средство - лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа; 39) контрафактное лекарственное средство - лекарственное средство, находящееся в обороте с нарушением гражданского законодательства;
34) организация оптовой торговли лекарственными средствами - организация, осуществляющая оптовую торговлю лекарственными средствами, их хранение, перевозку в соответствии с требованиями настоящего Федерального закона; 35) аптечная организация - организация, структурное подразделение медицинской организации, осуществляющие розничную торговлю лекарственными препаратами, хранение, изготовление и отпуск лекарственных препаратов для медицинского применения в соответствии с требованиями настоящего Федерального закона; 36) ветеринарная аптечная организация - организация, структурное подразделение ветеринарной организации, осуществляющие розничную торговлю лекарственными препаратами, хранение, изготовление и отпуск лекарственных препаратов для ветеринарного применения в соответствии с требованиями настоящего Федерального закона; 37) фальсифицированное лекарственное средство - лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе; 38) недоброкачественное лекарственное средство - лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа; 39) контрафактное лекарственное средство - лекарственное средство, находящееся в обороте с нарушением гражданского законодательства;
 40) доклиническое исследование лекарственного средства - биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства; 41) клиническое исследование лекарственного препарата - изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами; 42) многоцентровое клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в двух и более медицинских организациях по единому протоколу клинического исследования лекарственного препарата; 43) международное многоцентровое клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в различных странах по единому протоколу клинического исследования лекарственного препарата; 44) пострегистрационное клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое производителем лекарственного препарата, гражданский оборот которого осуществляется после государственной регистрации, в целях дополнительного сбора данных о его безопасности и эффективности, расширения показаний к применению данного лекарственного препарата, а также выявления нежелательных реакций пациентов на его действие; 45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату; 46) исследование терапевтической эквивалентности лекарственных препаратов - вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении; 47) протокол клинического исследования лекарственного препарата - документ, в котором определяются цели, формы организации и методология проведения клинического исследования, статистические методы обработки результатов такого исследования и меры по обеспечению безопасности физических лиц, участвующих в клиническом исследовании лекарственного препарата; 48) брошюра исследователя - сводное изложение результатов доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для медицинского применения;
40) доклиническое исследование лекарственного средства - биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства; 41) клиническое исследование лекарственного препарата - изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами; 42) многоцентровое клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в двух и более медицинских организациях по единому протоколу клинического исследования лекарственного препарата; 43) международное многоцентровое клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в различных странах по единому протоколу клинического исследования лекарственного препарата; 44) пострегистрационное клиническое исследование лекарственного препарата для медицинского применения - клиническое исследование лекарственного препарата для медицинского применения, проводимое производителем лекарственного препарата, гражданский оборот которого осуществляется после государственной регистрации, в целях дополнительного сбора данных о его безопасности и эффективности, расширения показаний к применению данного лекарственного препарата, а также выявления нежелательных реакций пациентов на его действие; 45) исследование биоэквивалентности лекарственного препарата - вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату; 46) исследование терапевтической эквивалентности лекарственных препаратов - вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении; 47) протокол клинического исследования лекарственного препарата - документ, в котором определяются цели, формы организации и методология проведения клинического исследования, статистические методы обработки результатов такого исследования и меры по обеспечению безопасности физических лиц, участвующих в клиническом исследовании лекарственного препарата; 48) брошюра исследователя - сводное изложение результатов доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для медицинского применения;
 49) информационный листок пациента - документ, в котором содержатся в доступной форме сведения, касающиеся проводимого клинического исследования лекарственного препарата, и в письменной форме добровольное согласие пациента на участие в клиническом исследовании лекарственного препарата после ознакомления с особенностями клинического исследования, имеющими значение для выражения такого согласия; 50) побочное действие - реакция организма, возникшая в связи с применением лекарственного препарата в дозах, рекомендуемых в инструкции по его применению, для профилактики, диагностики, лечения заболевания или для реабилитации; 51) серьезная нежелательная реакция - нежелательная реакция организма, связанная с применением лекарственного препарата, приведшая к смерти, врожденным аномалиям или порокам развития либо представляющая собой угрозу жизни, требующая госпитализации или приведшая к стойкой утрате трудоспособности и (или) инвалидности; 52) непредвиденная нежелательная реакция - нежелательная реакция организма (в том числе связанная с применением лекарственного препарата в соответствии с инструкцией по его применению), сущность и тяжесть которой не соответствуют информации о лекарственном препарате, содержащейся в инструкции по его применению; 53) рецепт на лекарственный препарат - письменное назначение лекарственного препарата по установленной форме, выданное медицинским или ветеринарным работником, имеющим на это право, в целях отпуска лекарственного препарата или его изготовления и отпуска; 54) требование медицинской организации, ветеринарной организации - документ установленной формы, который выписан медицинским или ветеринарным работником, имеющим на это право, и содержит в письменной форме указание аптечной организации об отпуске лекарственного препарата или о его изготовлении и об отпуске для обеспечения лечебного процесса в медицинской организации, ветеринарной организации.
49) информационный листок пациента - документ, в котором содержатся в доступной форме сведения, касающиеся проводимого клинического исследования лекарственного препарата, и в письменной форме добровольное согласие пациента на участие в клиническом исследовании лекарственного препарата после ознакомления с особенностями клинического исследования, имеющими значение для выражения такого согласия; 50) побочное действие - реакция организма, возникшая в связи с применением лекарственного препарата в дозах, рекомендуемых в инструкции по его применению, для профилактики, диагностики, лечения заболевания или для реабилитации; 51) серьезная нежелательная реакция - нежелательная реакция организма, связанная с применением лекарственного препарата, приведшая к смерти, врожденным аномалиям или порокам развития либо представляющая собой угрозу жизни, требующая госпитализации или приведшая к стойкой утрате трудоспособности и (или) инвалидности; 52) непредвиденная нежелательная реакция - нежелательная реакция организма (в том числе связанная с применением лекарственного препарата в соответствии с инструкцией по его применению), сущность и тяжесть которой не соответствуют информации о лекарственном препарате, содержащейся в инструкции по его применению; 53) рецепт на лекарственный препарат - письменное назначение лекарственного препарата по установленной форме, выданное медицинским или ветеринарным работником, имеющим на это право, в целях отпуска лекарственного препарата или его изготовления и отпуска; 54) требование медицинской организации, ветеринарной организации - документ установленной формы, который выписан медицинским или ветеринарным работником, имеющим на это право, и содержит в письменной форме указание аптечной организации об отпуске лекарственного препарата или о его изготовлении и об отпуске для обеспечения лечебного процесса в медицинской организации, ветеринарной организации.
 • • • • • • • Глава 2. Полномочия федеральных органов исполнительной власти, органов исполнительной власти субъектов Российской Федерации при обращении лекарственных средств Статья 5. Полномочия федеральных органов исполнительной власти при обращении лекарственных средств К полномочиям федеральных органов исполнительной власти при обращении лекарственных средств относятся: 1) проведение в Российской Федерации единой государственной политики в области обеспечения лекарственными препаратами граждан на территории Российской Федерации; 2) утверждение общих фармакопейных статей, издание государственной фармакопеи; 3) осуществление государственного контроля и надзора; 4) лицензирование производства лекарственных средств и фармацевтической деятельности в соответствии с законодательством Российской Федерации; 5) организация экспертизы лекарственных средств, этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения; 6) выдача разрешений на проведение клинических исследований лекарственных препаратов, ведение реестра выданных разрешений на проведение клинических исследований лекарственных препаратов; 7) государственная регистрация лекарственных препаратов, ведение государственного реестра лекарственных средств; 8) инспектирование производства лекарственных средств на соответствие правилам организации производства и контроля качества лекарственных средств, выдача заключений о соответствии производителя лекарственных средств требованиям правил организации производства и контроля качества лекарственных средств; 9) государственная регистрация установленных производителями лекарственных препаратов предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты и ведение государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов; 10) установление порядка ввоза лекарственных средств на территорию Российской Федерации и вывоза лекарственных средств с территории Российской Федерации; 11) создание советов по вопросам, связанным с обращением лекарственных средств; 12) аттестация и сертификация специалистов; 13) утверждение образовательных программ по подготовке специалистов; 14) мониторинг безопасности лекарственных препаратов; 15) участие в международном сотрудничестве; 16) получение по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов Российской Федерации, а также от субъектов обращения лекарственных средств для медицинского применения информации по вопросам установления и применения цен на лекарственные препараты и надбавок к ним; 17) применение мер ответственности за нарушение законодательства Российской Федерации. Статья 6. Полномочия органов исполнительной власти субъекта Российской Федерации при обращении лекарственных средств К полномочиям органов исполнительной власти субъекта Российской Федерации при обращении лекарственных средств относятся: 1) разработка и реализация региональных программ обеспечения населения лекарственными препаратами; 2) установление предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных препаратов, на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов; 3) осуществление контроля за применением цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, организациями оптовой торговли, аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность.
• • • • • • • Глава 2. Полномочия федеральных органов исполнительной власти, органов исполнительной власти субъектов Российской Федерации при обращении лекарственных средств Статья 5. Полномочия федеральных органов исполнительной власти при обращении лекарственных средств К полномочиям федеральных органов исполнительной власти при обращении лекарственных средств относятся: 1) проведение в Российской Федерации единой государственной политики в области обеспечения лекарственными препаратами граждан на территории Российской Федерации; 2) утверждение общих фармакопейных статей, издание государственной фармакопеи; 3) осуществление государственного контроля и надзора; 4) лицензирование производства лекарственных средств и фармацевтической деятельности в соответствии с законодательством Российской Федерации; 5) организация экспертизы лекарственных средств, этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения; 6) выдача разрешений на проведение клинических исследований лекарственных препаратов, ведение реестра выданных разрешений на проведение клинических исследований лекарственных препаратов; 7) государственная регистрация лекарственных препаратов, ведение государственного реестра лекарственных средств; 8) инспектирование производства лекарственных средств на соответствие правилам организации производства и контроля качества лекарственных средств, выдача заключений о соответствии производителя лекарственных средств требованиям правил организации производства и контроля качества лекарственных средств; 9) государственная регистрация установленных производителями лекарственных препаратов предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты и ведение государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов; 10) установление порядка ввоза лекарственных средств на территорию Российской Федерации и вывоза лекарственных средств с территории Российской Федерации; 11) создание советов по вопросам, связанным с обращением лекарственных средств; 12) аттестация и сертификация специалистов; 13) утверждение образовательных программ по подготовке специалистов; 14) мониторинг безопасности лекарственных препаратов; 15) участие в международном сотрудничестве; 16) получение по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов Российской Федерации, а также от субъектов обращения лекарственных средств для медицинского применения информации по вопросам установления и применения цен на лекарственные препараты и надбавок к ним; 17) применение мер ответственности за нарушение законодательства Российской Федерации. Статья 6. Полномочия органов исполнительной власти субъекта Российской Федерации при обращении лекарственных средств К полномочиям органов исполнительной власти субъекта Российской Федерации при обращении лекарственных средств относятся: 1) разработка и реализация региональных программ обеспечения населения лекарственными препаратами; 2) установление предельных размеров оптовых надбавок и предельных размеров розничных надбавок к фактическим отпускным ценам, установленным производителями лекарственных препаратов, на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов; 3) осуществление контроля за применением цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, организациями оптовой торговли, аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность.
 Глава 3. Государственная фармакопея Статья 7. Разработка и издание государственной фармакопеи, размещение данных о ней 1. Под государственной фармакопеей понимается свод общих фармакопейных статей и фармакопейных статей. 2. Разработка общих фармакопейных статей и включение их в государственную фармакопею осуществляются в порядке, установленном уполномоченным федеральным органом исполнительной власти. 3. Разработка фармакопейной статьи на оригинальное лекарственное средство и включение ее в государственную фармакопею в течение срока действия защиты исключительного права, удостоверенного патентом на оригинальное лекарственное средство, осуществляются с согласия его разработчика. 4. Государственная фармакопея издается уполномоченным федеральным органом исполнительной власти за счет средств федерального бюджета и подлежит переизданиям не реже чем один раз в пять лет, в период между которыми издаются приложения к государственной фармакопее, содержащие общие фармакопейные статьи и (или) фармакопейные статьи, утвержденные после издания или переиздания государственной фармакопеи. 5. Уполномоченный федеральный орган исполнительной власти размещает данные о государственной фармакопее и приложениях к ней на своем официальном сайте в сети "Интернет" в установленном им порядке.
Глава 3. Государственная фармакопея Статья 7. Разработка и издание государственной фармакопеи, размещение данных о ней 1. Под государственной фармакопеей понимается свод общих фармакопейных статей и фармакопейных статей. 2. Разработка общих фармакопейных статей и включение их в государственную фармакопею осуществляются в порядке, установленном уполномоченным федеральным органом исполнительной власти. 3. Разработка фармакопейной статьи на оригинальное лекарственное средство и включение ее в государственную фармакопею в течение срока действия защиты исключительного права, удостоверенного патентом на оригинальное лекарственное средство, осуществляются с согласия его разработчика. 4. Государственная фармакопея издается уполномоченным федеральным органом исполнительной власти за счет средств федерального бюджета и подлежит переизданиям не реже чем один раз в пять лет, в период между которыми издаются приложения к государственной фармакопее, содержащие общие фармакопейные статьи и (или) фармакопейные статьи, утвержденные после издания или переиздания государственной фармакопеи. 5. Уполномоченный федеральный орган исполнительной власти размещает данные о государственной фармакопее и приложениях к ней на своем официальном сайте в сети "Интернет" в установленном им порядке.
 • • • • • Глава 4. Государственный контроль при обращении лекарственных средств Статья 8. Лицензирование производства лекарственных средств и фармацевтической деятельности 1. Лицензирование производства лекарственных средств и фармацевтической деятельности осуществляется в соответствии с законодательством Российской Федерации. 2. Обязательным условием предоставления лицензии на производство лекарственных средств является приложение к заявлению соискателя лицензии перечня лекарственных форм и (или) видов фармацевтических субстанций, которые производитель лекарственных средств намерен производить. 3. В случае необходимости расширения производства лекарственных средств за счет новых лекарственных форм и видов фармацевтических субстанций производитель лекарственных средств должен получить новую лицензию на производство лекарственных средств. Статья 9. Государственный контроль при обращении лекарственных средств 1. Государственному контролю подлежат все лекарственные средства, произведенные на территории Российской Федерации и ввозимые на территорию Российской Федерации. 2. Государственный контроль при обращении лекарственных средств осуществляется уполномоченными федеральными органами исполнительной власти субъектов Российской Федерации в соответствии с их полномочиями. 3. Государственный контроль при обращении лекарственных средств включает в себя контроль за доклиническими исследованиями лекарственных средств, клиническими исследованиями лекарственных препаратов, качеством, производством лекарственных средств, изготовлением лекарственных препаратов, хранением, перевозкой, ввозом на территорию Российской Федерации, рекламой, отпуском, реализацией, уничтожением лекарственных средств, применением лекарственных препаратов. 4. Государственный контроль при обращении лекарственных средств осуществляется посредством: 1) проведения проверок соблюдения субъектами обращения лекарственных средств правил лабораторной практики и правил клинической практики проведении доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для медицинского применения, правил проведения доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения, правил организации производства и контроля качества лекарственных средств, правил оптовой торговли лекарственными средствами, правил отпуска лекарственных препаратов, правил изготовления и отпуска лекарственных препаратов, правил хранения лекарственных средств, правил уничтожения лекарственных средств; 2) лицензирования производства лекарственных средств и фармацевтической деятельности, проведения проверок соблюдения лицензионных требований и условий; 3) контроля качества лекарственных средств при гражданском обороте: а) в форме выборочного контроля; б) при выявлении несоответствия лицензионным требованиям и условиям условий производства и контроля качества лекарственных средств, осуществления оптовой торговли лекарственными средствами, осуществления розничной торговли лекарственными препаратами, правил изготовления лекарственных препаратов, правил хранения лекарственных средств; 4) выдачи разрешений на ввоз лекарственных средств на территорию Российской Федерации; 5) проведения мониторинга безопасности лекарственных препаратов; 6) получения по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов Российской Федерации, от субъектов обращения лекарственных средств для медицинского применения информации по вопросам установления и применения цен и надбавок к ним. 5. Осуществление государственного контроля при обращении лекарственных средств является расходным обязательством Российской Федерации или расходным обязательством субъектов Российской Федерации по видам контроля, отнесенным соответственно к полномочиям федеральных органов исполнительной власти и к полномочиям органов исполнительной власти субъектов Российской Федерации.
• • • • • Глава 4. Государственный контроль при обращении лекарственных средств Статья 8. Лицензирование производства лекарственных средств и фармацевтической деятельности 1. Лицензирование производства лекарственных средств и фармацевтической деятельности осуществляется в соответствии с законодательством Российской Федерации. 2. Обязательным условием предоставления лицензии на производство лекарственных средств является приложение к заявлению соискателя лицензии перечня лекарственных форм и (или) видов фармацевтических субстанций, которые производитель лекарственных средств намерен производить. 3. В случае необходимости расширения производства лекарственных средств за счет новых лекарственных форм и видов фармацевтических субстанций производитель лекарственных средств должен получить новую лицензию на производство лекарственных средств. Статья 9. Государственный контроль при обращении лекарственных средств 1. Государственному контролю подлежат все лекарственные средства, произведенные на территории Российской Федерации и ввозимые на территорию Российской Федерации. 2. Государственный контроль при обращении лекарственных средств осуществляется уполномоченными федеральными органами исполнительной власти субъектов Российской Федерации в соответствии с их полномочиями. 3. Государственный контроль при обращении лекарственных средств включает в себя контроль за доклиническими исследованиями лекарственных средств, клиническими исследованиями лекарственных препаратов, качеством, производством лекарственных средств, изготовлением лекарственных препаратов, хранением, перевозкой, ввозом на территорию Российской Федерации, рекламой, отпуском, реализацией, уничтожением лекарственных средств, применением лекарственных препаратов. 4. Государственный контроль при обращении лекарственных средств осуществляется посредством: 1) проведения проверок соблюдения субъектами обращения лекарственных средств правил лабораторной практики и правил клинической практики проведении доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для медицинского применения, правил проведения доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения, правил организации производства и контроля качества лекарственных средств, правил оптовой торговли лекарственными средствами, правил отпуска лекарственных препаратов, правил изготовления и отпуска лекарственных препаратов, правил хранения лекарственных средств, правил уничтожения лекарственных средств; 2) лицензирования производства лекарственных средств и фармацевтической деятельности, проведения проверок соблюдения лицензионных требований и условий; 3) контроля качества лекарственных средств при гражданском обороте: а) в форме выборочного контроля; б) при выявлении несоответствия лицензионным требованиям и условиям условий производства и контроля качества лекарственных средств, осуществления оптовой торговли лекарственными средствами, осуществления розничной торговли лекарственными препаратами, правил изготовления лекарственных препаратов, правил хранения лекарственных средств; 4) выдачи разрешений на ввоз лекарственных средств на территорию Российской Федерации; 5) проведения мониторинга безопасности лекарственных препаратов; 6) получения по запросам уполномоченного федерального органа исполнительной власти от органов исполнительной власти субъектов Российской Федерации, от субъектов обращения лекарственных средств для медицинского применения информации по вопросам установления и применения цен и надбавок к ним. 5. Осуществление государственного контроля при обращении лекарственных средств является расходным обязательством Российской Федерации или расходным обязательством субъектов Российской Федерации по видам контроля, отнесенным соответственно к полномочиям федеральных органов исполнительной власти и к полномочиям органов исполнительной власти субъектов Российской Федерации.
 Глава 5. Разработка, доклинические исследования лекарственных средств, а также клинические исследования лекарственных препаратов для ветеринарного применения Статья 10. Разработка лекарственных средств 1. Разработка лекарственных средств включает в себя поиск новых фармакологически активных веществ, последующее изучение их лекарственных свойств, доклинические исследования, разработку технологий производства фармацевтических субстанций, разработку составов и технологий производства лекарственных препаратов. 2. Финансовое обеспечение разработки лекарственных средств осуществляется за счет: 1) средств федерального бюджета; 2) средств разработчиков лекарственных средств; 3) средств производителей лекарственных средств при выполнении научно-исследовательских работ по договору между разработчиком лекарственных средств и производителем лекарственных средств; 4) иных не запрещенных законодательством Российской Федерации источников. 3. Права разработчика лекарственного средства охраняются гражданским законодательством. Статья 11. Доклиническое исследование лекарственного средства для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства. 2. Доклиническое исследование лекарственного средства для медицинского применения проводится в соответствии с правилами лабораторной практики, утвержденными уполномоченным федеральным органом исполнительной власти. 3. Для организации и проведения доклинического исследования лекарственного средства для медицинского применения разработчики лекарственных средств могут привлекать научно-исследовательские организации, образовательные учреждения высшего профессионального образования, имеющие необходимую материальнотехническую базу и квалифицированных специалистов в соответствующей области исследования. 4. Доклиническое исследование лекарственного средства для медицинского применения проводится по утвержденному разработчиком лекарственного средства плану с ведением протокола этого исследования и составлением отчета, в котором содержатся результаты этого исследования и заключение о возможности проведения клинического исследования лекарственного препарата для медицинского применения. 5. Проведение проверок соблюдения правил лабораторной практики и правовых норм использования животных при проведении доклинических исследований лекарственных средств для медицинского применения осуществляется уполномоченным федеральным органом исполнительной власти. 6. Результаты доклинического исследования лекарственного средства для медицинского применения могут быть представлены в уполномоченный федеральный орган исполнительной власти в установленном порядке в целях государственной регистрации лекарственного препарата.
Глава 5. Разработка, доклинические исследования лекарственных средств, а также клинические исследования лекарственных препаратов для ветеринарного применения Статья 10. Разработка лекарственных средств 1. Разработка лекарственных средств включает в себя поиск новых фармакологически активных веществ, последующее изучение их лекарственных свойств, доклинические исследования, разработку технологий производства фармацевтических субстанций, разработку составов и технологий производства лекарственных препаратов. 2. Финансовое обеспечение разработки лекарственных средств осуществляется за счет: 1) средств федерального бюджета; 2) средств разработчиков лекарственных средств; 3) средств производителей лекарственных средств при выполнении научно-исследовательских работ по договору между разработчиком лекарственных средств и производителем лекарственных средств; 4) иных не запрещенных законодательством Российской Федерации источников. 3. Права разработчика лекарственного средства охраняются гражданским законодательством. Статья 11. Доклиническое исследование лекарственного средства для медицинского применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства. 2. Доклиническое исследование лекарственного средства для медицинского применения проводится в соответствии с правилами лабораторной практики, утвержденными уполномоченным федеральным органом исполнительной власти. 3. Для организации и проведения доклинического исследования лекарственного средства для медицинского применения разработчики лекарственных средств могут привлекать научно-исследовательские организации, образовательные учреждения высшего профессионального образования, имеющие необходимую материальнотехническую базу и квалифицированных специалистов в соответствующей области исследования. 4. Доклиническое исследование лекарственного средства для медицинского применения проводится по утвержденному разработчиком лекарственного средства плану с ведением протокола этого исследования и составлением отчета, в котором содержатся результаты этого исследования и заключение о возможности проведения клинического исследования лекарственного препарата для медицинского применения. 5. Проведение проверок соблюдения правил лабораторной практики и правовых норм использования животных при проведении доклинических исследований лекарственных средств для медицинского применения осуществляется уполномоченным федеральным органом исполнительной власти. 6. Результаты доклинического исследования лекарственного средства для медицинского применения могут быть представлены в уполномоченный федеральный орган исполнительной власти в установленном порядке в целях государственной регистрации лекарственного препарата.
 • • • • Статья 12. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения 1. Доклиническое исследование лекарственного средства для ветеринарного применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства, в том числе определения срока его выведения из организма животного, в целях обеспечения безопасности продукции животного происхождения после применения соответствующего лекарственного препарата. 2. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения, исследование биоэквивалентности указанного лекарственного препарата проводятся в соответствии с правилами, утвержденными уполномоченным федеральным органом исполнительной власти. 3. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения проводятся по утвержденному разработчиком лекарственного средства плану с ведением протоколов этих исследований и составлением отчетов, в которых содержатся результаты этих исследований. 4. Для организации и проведения доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения разработчик лекарственного средства может привлекать организации, имеющие необходимую материально-техническую базу и квалифицированных специалистов в соответствующей области исследования. 5. Клинические исследования лекарственных препаратов для ветеринарного применения проводятся в ветеринарных организациях и в организациях, осуществляющих разведение, выращивание и содержание животных, в целях: 1) установления переносимости лекарственных препаратов здоровыми животными; 2) подбора оптимальных дозировок лекарственных препаратов и курса лечения на конкретной группе животных с определенным заболеванием; 3) установления безопасности и эффективности лекарственного препарата, предназначенного для лечения определенных заболеваний животных, или эффективности лекарственного препарата для профилактики заболеваний здоровых животных; 4) изучения возможностей расширения показаний к применению зарегистрированного лекарственного препарата и выявления ранее неизвестных побочных действий. 6. Клиническое исследование лекарственного препарата для ветеринарного применения осуществляется за счет средств разработчика лекарственного средства. 7. Отчеты о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения составляются разработчиком лекарственного средства с учетом заключений организаций, принимавших участие в организации и проведении этих исследований. 8. Контроль за проведением доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения осуществляется уполномоченным федеральным органом исполнительной власти.
• • • • Статья 12. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения 1. Доклиническое исследование лекарственного средства для ветеринарного применения проводится путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства, в том числе определения срока его выведения из организма животного, в целях обеспечения безопасности продукции животного происхождения после применения соответствующего лекарственного препарата. 2. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения, исследование биоэквивалентности указанного лекарственного препарата проводятся в соответствии с правилами, утвержденными уполномоченным федеральным органом исполнительной власти. 3. Доклиническое исследование лекарственного средства и клиническое исследование лекарственного препарата для ветеринарного применения проводятся по утвержденному разработчиком лекарственного средства плану с ведением протоколов этих исследований и составлением отчетов, в которых содержатся результаты этих исследований. 4. Для организации и проведения доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения разработчик лекарственного средства может привлекать организации, имеющие необходимую материально-техническую базу и квалифицированных специалистов в соответствующей области исследования. 5. Клинические исследования лекарственных препаратов для ветеринарного применения проводятся в ветеринарных организациях и в организациях, осуществляющих разведение, выращивание и содержание животных, в целях: 1) установления переносимости лекарственных препаратов здоровыми животными; 2) подбора оптимальных дозировок лекарственных препаратов и курса лечения на конкретной группе животных с определенным заболеванием; 3) установления безопасности и эффективности лекарственного препарата, предназначенного для лечения определенных заболеваний животных, или эффективности лекарственного препарата для профилактики заболеваний здоровых животных; 4) изучения возможностей расширения показаний к применению зарегистрированного лекарственного препарата и выявления ранее неизвестных побочных действий. 6. Клиническое исследование лекарственного препарата для ветеринарного применения осуществляется за счет средств разработчика лекарственного средства. 7. Отчеты о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения составляются разработчиком лекарственного средства с учетом заключений организаций, принимавших участие в организации и проведении этих исследований. 8. Контроль за проведением доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов для ветеринарного применения осуществляется уполномоченным федеральным органом исполнительной власти.
 • • • • • Глава 6. Осуществление государственной регистрации лекарственных препаратов Статья 13. Государственная регистрация лекарственных препаратов 1. Лекарственные препараты вводятся в гражданский оборот на территории Российской Федерации, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. 2. Государственной регистрации подлежат: 1) оригинальные лекарственные препараты; 2) воспроизведенные лекарственные препараты; 3) новые комбинации зарегистрированных ранее лекарственных препаратов; 4) лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке. 3. Государственная регистрация лекарственных препаратов для медицинского применения осуществляется по результатам экспертизы лекарственных средств и этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения (далее - этическая экспертиза). Государственная регистрация лекарственных препаратов для ветеринарного применения осуществляется по результатам экспертизы лекарственных средств для ветеринарного применения. 4. Государственная регистрация лекарственных препаратов осуществляется соответствующим уполномоченным федеральным органом исполнительной власти в срок, не превышающий двухсот десяти рабочих дней со дня принятия заявления о государственной регистрации лекарственного препарата. В указанный срок включается время, необходимое для повторного проведения экспертизы лекарственных средств и (или) этической экспертизы в соответствии со статьей 25 настоящего Федерального закона. Срок государственной регистрации лекарственного препарата исчисляется со дня принятия соответствующим уполномоченным федеральным органом исполнительной власти заявления о государственной регистрации лекарственного препарата с приложением необходимых документов по день выдачи регистрационного удостоверения лекарственного препарата. Время проведения клинического исследования лекарственного препарата не учитывается при исчислении срока его государственной регистрации. 5. Государственной регистрации не подлежат: 1) лекарственные препараты, изготовленные аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, которые имеют лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты и требованиям медицинских организаций, ветеринарных организаций; 2) лекарственное растительное сырье; 3) лекарственные препараты, приобретенные физическими лицами за пределами территории Российской Федерации и предназначенные для личного использования; 4) лекарственные препараты, предназначенные для экспорта; 5) радиофармацевтические лекарственные препараты, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти. 6. Не допускается государственная регистрация: 1) различных лекарственных препаратов под одинаковым торговым наименованием; 2) одного лекарственного препарата, выпускаемого производителем под различными торговыми наименованиями и представленного на государственную регистрацию в виде двух и более лекарственных препаратов.
• • • • • Глава 6. Осуществление государственной регистрации лекарственных препаратов Статья 13. Государственная регистрация лекарственных препаратов 1. Лекарственные препараты вводятся в гражданский оборот на территории Российской Федерации, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. 2. Государственной регистрации подлежат: 1) оригинальные лекарственные препараты; 2) воспроизведенные лекарственные препараты; 3) новые комбинации зарегистрированных ранее лекарственных препаратов; 4) лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах, в новой дозировке. 3. Государственная регистрация лекарственных препаратов для медицинского применения осуществляется по результатам экспертизы лекарственных средств и этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения (далее - этическая экспертиза). Государственная регистрация лекарственных препаратов для ветеринарного применения осуществляется по результатам экспертизы лекарственных средств для ветеринарного применения. 4. Государственная регистрация лекарственных препаратов осуществляется соответствующим уполномоченным федеральным органом исполнительной власти в срок, не превышающий двухсот десяти рабочих дней со дня принятия заявления о государственной регистрации лекарственного препарата. В указанный срок включается время, необходимое для повторного проведения экспертизы лекарственных средств и (или) этической экспертизы в соответствии со статьей 25 настоящего Федерального закона. Срок государственной регистрации лекарственного препарата исчисляется со дня принятия соответствующим уполномоченным федеральным органом исполнительной власти заявления о государственной регистрации лекарственного препарата с приложением необходимых документов по день выдачи регистрационного удостоверения лекарственного препарата. Время проведения клинического исследования лекарственного препарата не учитывается при исчислении срока его государственной регистрации. 5. Государственной регистрации не подлежат: 1) лекарственные препараты, изготовленные аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, которые имеют лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты и требованиям медицинских организаций, ветеринарных организаций; 2) лекарственное растительное сырье; 3) лекарственные препараты, приобретенные физическими лицами за пределами территории Российской Федерации и предназначенные для личного использования; 4) лекарственные препараты, предназначенные для экспорта; 5) радиофармацевтические лекарственные препараты, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти. 6. Не допускается государственная регистрация: 1) различных лекарственных препаратов под одинаковым торговым наименованием; 2) одного лекарственного препарата, выпускаемого производителем под различными торговыми наименованиями и представленного на государственную регистрацию в виде двух и более лекарственных препаратов.
 Статья 14. Принципы экспертизы лекарственных средств и этической экспертизы 1. Экспертиза лекарственных средств и этическая экспертиза основываются на принципах законности, соблюдения прав и свобод человека и гражданина, прав юридического лица, независимости эксперта, объективности, всесторонности и полноты исследований, проводимых с использованием современных достижений науки и техники, ответственности федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств и экспертов за проведение и качество экспертизы. 2. Экспертиза лекарственных средств для медицинского применения проводится поэтапно: 1) на первом этапе - экспертиза документов для получения разрешения на проведение клинического исследования лекарственного препарата, за исключением: а) лекарственных препаратов, которые разрешены для медицинского применения на территории Российской Федерации более двадцати лет и в отношении которых невозможно проведение исследования биоэквивалентности; б) лекарственных препаратов для медицинского применения, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации; 2) на втором этапе - экспертиза предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов (далее - экспертиза качества лекарственного средства) и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата, осуществляемые после проведения его клинического исследования. 3. Экспертиза лекарственных средств для ветеринарного применения проводится одноэтапно и включает в себя экспертизу качества лекарственного средства и экспертизу отношения ожидаемой пользы к возможному риску применения лекарственного препарата. Статья 15. Федеральное государственное бюджетное учреждение по проведению экспертизы лекарственных средств Экспертиза лекарственных средств проводится федеральным государственным бюджетным учреждением соответствующего уполномоченного федерального органа исполнительной власти, созданным для обеспечения исполнения полномочий этого федерального органа по выдаче разрешений на проведение клинических исследований лекарственных препаратов и (или) по государственной регистрации лекарственных препаратов (далее - экспертное учреждение). Статья 16. Организация проведения экспертизы лекарственных средств в целях их государственной регистрации 1. Экспертиза лекарственных средств проводится комиссией экспертов экспертного учреждения, назначенной его руководителем, на основании задания на проведение экспертизы лекарственного средства, выданного уполномоченным федеральным органом исполнительной власти. Руководитель экспертного учреждения обеспечивает надлежащее проведение экспертизы лекарственных средств в соответствии с заданием, выданным уполномоченным федеральным органом исполнительной власти, и организует подготовку сводного заключения этой комиссии. В состав этой комиссии по решению руководителя экспертного учреждения могут быть включены в качестве экспертов лица, не работающие в данном экспертном учреждении, если их специальные знания необходимы для проведения экспертизы и такие эксперты отсутствуют в данном экспертном учреждении. 2. Экспертом по проведению экспертизы лекарственных средств является аттестованный работник экспертного учреждения, который имеет высшее медицинское, фармацевтическое, биологическое, ветеринарное или химическое образование и проводит экспертизу лекарственных средств в порядке исполнения своих должностных обязанностей (далее - эксперт). 3. При проведении экспертизы лекарственных средств эксперт не может находиться в какой-либо зависимости от лица, назначившего эту экспертизу, разработчика лекарственного средства или других заинтересованных в результатах экспертизы лиц. 4. При проведении экспертизы лекарственных средств не допускается истребовать у заявителя либо иных лиц материалы, необходимые для проведения экспертизы. В случае недостаточности представленных эксперту материалов для дачи заключения эксперт вправе поставить вопрос о предоставлении ему необходимых материалов перед руководителем экспертного учреждения, который обращается с просьбой об этом в уполномоченный федеральный орган исполнительной власти, выдавший задание на проведение экспертизы лекарственного средства. 5. Эксперт при проведении порученной ему руководителем экспертного учреждения экспертизы лекарственного средства обязан: 1) провести полное исследование представленных ему объектов, материалов, дать обоснованное и объективное заключение по поставленным перед ним вопросам или мотивированное заключение о невозможности проведения им экспертизы лекарственного средства, если поставленные вопросы выходят за пределы специальных знаний эксперта, объекты исследований и материалы непригодны или недостаточны для проведения исследований и дачи заключения либо современный уровень развития науки не позволяет ответить на поставленные вопросы; 2) не разглашать сведения, которые стали ему известны в связи с проведением экспертизы лекарственного средства, а также сведения, составляющие государственную, коммерческую или иную охраняемую законом тайну; 3) обеспечить сохранность представленных объектов исследований и материалов. 6. Эксперт не вправе: 1) проводить экспертизу лекарственного средства по обращению непосредственно к нему организаций или физических лиц; 2) самостоятельно собирать материалы для проведения экспертизы лекарственного средства; 3) проводить экспертизу лекарственного средства в качестве негосударственного эксперта. 7. В случае необходимости эксперт вправе ходатайствовать перед руководителем экспертного учреждения о привлечении к проведению экспертизы лекарственного средства других экспертов. 8. Каждый эксперт, входящий в состав комиссии экспертов, которой поручено проведение экспертизы лекарственного средства, независимо и самостоятельно проводит исследования, оценивает результаты, полученные им лично и другими экспертами, и формулирует выводы относительно поставленных вопросов в пределах своих специальных знаний. 9. Результаты экспертизы лекарственного средства оформляются заключением комиссии экспертов. В заключении комиссии экспертов указываются перечень исследований, объем проведенных каждым экспертом исследований, установленные каждым из них факты и сделанные в результате исследований выводы. Эксперт, мнение которого не совпадает с решением комиссии экспертов, вправе выразить свое мнение в письменной форме, которое приобщается к заключению комиссии экспертов. 10. Эксперты, входящие в состав комиссии, предупреждаются об ответственности в соответствии с законодательством Российской Федерации за дачу заключения, содержащего необоснованные или фальсифицированные выводы, о чем они дают подписку. 11. Определение уровня профессиональной подготовки экспертов и аттестация их на право проведения экспертизы лекарственных средств осуществляются экспертноквалификационными комиссиями в порядке, установленном соответствующим уполномоченным федеральным органом исполнительной власти. Уровень профессиональной подготовки экспертов подлежит пересмотру указанными комиссиями не реже чем один раз в пять лет. 12. Правила проведения экспертизы лекарственных средств и форма заключения комиссии экспертов устанавливаются соответствующим уполномоченным федеральным органом исполнительной власти.
Статья 14. Принципы экспертизы лекарственных средств и этической экспертизы 1. Экспертиза лекарственных средств и этическая экспертиза основываются на принципах законности, соблюдения прав и свобод человека и гражданина, прав юридического лица, независимости эксперта, объективности, всесторонности и полноты исследований, проводимых с использованием современных достижений науки и техники, ответственности федерального государственного бюджетного учреждения по проведению экспертизы лекарственных средств и экспертов за проведение и качество экспертизы. 2. Экспертиза лекарственных средств для медицинского применения проводится поэтапно: 1) на первом этапе - экспертиза документов для получения разрешения на проведение клинического исследования лекарственного препарата, за исключением: а) лекарственных препаратов, которые разрешены для медицинского применения на территории Российской Федерации более двадцати лет и в отношении которых невозможно проведение исследования биоэквивалентности; б) лекарственных препаратов для медицинского применения, в отношении которых проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации; 2) на втором этапе - экспертиза предложенных методов контроля качества лекарственного средства и качества представленных образцов лекарственного средства с использованием этих методов (далее - экспертиза качества лекарственного средства) и экспертиза отношения ожидаемой пользы к возможному риску применения лекарственного препарата, осуществляемые после проведения его клинического исследования. 3. Экспертиза лекарственных средств для ветеринарного применения проводится одноэтапно и включает в себя экспертизу качества лекарственного средства и экспертизу отношения ожидаемой пользы к возможному риску применения лекарственного препарата. Статья 15. Федеральное государственное бюджетное учреждение по проведению экспертизы лекарственных средств Экспертиза лекарственных средств проводится федеральным государственным бюджетным учреждением соответствующего уполномоченного федерального органа исполнительной власти, созданным для обеспечения исполнения полномочий этого федерального органа по выдаче разрешений на проведение клинических исследований лекарственных препаратов и (или) по государственной регистрации лекарственных препаратов (далее - экспертное учреждение). Статья 16. Организация проведения экспертизы лекарственных средств в целях их государственной регистрации 1. Экспертиза лекарственных средств проводится комиссией экспертов экспертного учреждения, назначенной его руководителем, на основании задания на проведение экспертизы лекарственного средства, выданного уполномоченным федеральным органом исполнительной власти. Руководитель экспертного учреждения обеспечивает надлежащее проведение экспертизы лекарственных средств в соответствии с заданием, выданным уполномоченным федеральным органом исполнительной власти, и организует подготовку сводного заключения этой комиссии. В состав этой комиссии по решению руководителя экспертного учреждения могут быть включены в качестве экспертов лица, не работающие в данном экспертном учреждении, если их специальные знания необходимы для проведения экспертизы и такие эксперты отсутствуют в данном экспертном учреждении. 2. Экспертом по проведению экспертизы лекарственных средств является аттестованный работник экспертного учреждения, который имеет высшее медицинское, фармацевтическое, биологическое, ветеринарное или химическое образование и проводит экспертизу лекарственных средств в порядке исполнения своих должностных обязанностей (далее - эксперт). 3. При проведении экспертизы лекарственных средств эксперт не может находиться в какой-либо зависимости от лица, назначившего эту экспертизу, разработчика лекарственного средства или других заинтересованных в результатах экспертизы лиц. 4. При проведении экспертизы лекарственных средств не допускается истребовать у заявителя либо иных лиц материалы, необходимые для проведения экспертизы. В случае недостаточности представленных эксперту материалов для дачи заключения эксперт вправе поставить вопрос о предоставлении ему необходимых материалов перед руководителем экспертного учреждения, который обращается с просьбой об этом в уполномоченный федеральный орган исполнительной власти, выдавший задание на проведение экспертизы лекарственного средства. 5. Эксперт при проведении порученной ему руководителем экспертного учреждения экспертизы лекарственного средства обязан: 1) провести полное исследование представленных ему объектов, материалов, дать обоснованное и объективное заключение по поставленным перед ним вопросам или мотивированное заключение о невозможности проведения им экспертизы лекарственного средства, если поставленные вопросы выходят за пределы специальных знаний эксперта, объекты исследований и материалы непригодны или недостаточны для проведения исследований и дачи заключения либо современный уровень развития науки не позволяет ответить на поставленные вопросы; 2) не разглашать сведения, которые стали ему известны в связи с проведением экспертизы лекарственного средства, а также сведения, составляющие государственную, коммерческую или иную охраняемую законом тайну; 3) обеспечить сохранность представленных объектов исследований и материалов. 6. Эксперт не вправе: 1) проводить экспертизу лекарственного средства по обращению непосредственно к нему организаций или физических лиц; 2) самостоятельно собирать материалы для проведения экспертизы лекарственного средства; 3) проводить экспертизу лекарственного средства в качестве негосударственного эксперта. 7. В случае необходимости эксперт вправе ходатайствовать перед руководителем экспертного учреждения о привлечении к проведению экспертизы лекарственного средства других экспертов. 8. Каждый эксперт, входящий в состав комиссии экспертов, которой поручено проведение экспертизы лекарственного средства, независимо и самостоятельно проводит исследования, оценивает результаты, полученные им лично и другими экспертами, и формулирует выводы относительно поставленных вопросов в пределах своих специальных знаний. 9. Результаты экспертизы лекарственного средства оформляются заключением комиссии экспертов. В заключении комиссии экспертов указываются перечень исследований, объем проведенных каждым экспертом исследований, установленные каждым из них факты и сделанные в результате исследований выводы. Эксперт, мнение которого не совпадает с решением комиссии экспертов, вправе выразить свое мнение в письменной форме, которое приобщается к заключению комиссии экспертов. 10. Эксперты, входящие в состав комиссии, предупреждаются об ответственности в соответствии с законодательством Российской Федерации за дачу заключения, содержащего необоснованные или фальсифицированные выводы, о чем они дают подписку. 11. Определение уровня профессиональной подготовки экспертов и аттестация их на право проведения экспертизы лекарственных средств осуществляются экспертноквалификационными комиссиями в порядке, установленном соответствующим уполномоченным федеральным органом исполнительной власти. Уровень профессиональной подготовки экспертов подлежит пересмотру указанными комиссиями не реже чем один раз в пять лет. 12. Правила проведения экспертизы лекарственных средств и форма заключения комиссии экспертов устанавливаются соответствующим уполномоченным федеральным органом исполнительной власти.
 • • Статья 17. Этическая экспертиза 1. Этическая экспертиза проводится в целях выдачи заключения об этической обоснованности возможности проведения клинического исследования лекарственного препарата для медицинского применения советом по этике, созданным в порядке, установленном уполномоченным федеральным органом исполнительной власти. 2. Экспертами совета по этике могут быть представители медицинских, научных организаций, образовательных учреждений высшего профессионального образования, а также представители общественных организаций, религиозных организаций и средств массовой информации. Данные эксперты не должны находиться в какой-либо зависимости от разработчиков лекарственных препаратов и других лиц, заинтересованных в результатах этической экспертизы. 3. Оплата труда экспертов совета по этике осуществляется в соответствии с договором, заключенным между уполномоченным федеральным органом исполнительной власти, которым создан совет по этике, и экспертом совета по этике. 4. Эксперты совета по этике несут ответственность в соответствии с законодательством Российской Федерации. 5. Состав совета по этике, положение об этом совете, порядок его деятельности, требования к квалификации и опыту работы по экспертной оценке научных, медицинских и этических аспектов клинических исследований лекарственных препаратов для медицинского применения, предъявляемые к экспертам совета по этике, порядок организации и проведения этической экспертизы, форма заключения совета по этике устанавливаются уполномоченным федеральным органом исполнительной власти. Число представителей медицинских организаций не может превышать половину от общего числа экспертов совета по этике. 6. Информация о составе совета по этике, планах его работы и текущей деятельности размещается на официальном сайте уполномоченного федерального органа исполнительной власти в сети "Интернет" в установленном им порядке.
• • Статья 17. Этическая экспертиза 1. Этическая экспертиза проводится в целях выдачи заключения об этической обоснованности возможности проведения клинического исследования лекарственного препарата для медицинского применения советом по этике, созданным в порядке, установленном уполномоченным федеральным органом исполнительной власти. 2. Экспертами совета по этике могут быть представители медицинских, научных организаций, образовательных учреждений высшего профессионального образования, а также представители общественных организаций, религиозных организаций и средств массовой информации. Данные эксперты не должны находиться в какой-либо зависимости от разработчиков лекарственных препаратов и других лиц, заинтересованных в результатах этической экспертизы. 3. Оплата труда экспертов совета по этике осуществляется в соответствии с договором, заключенным между уполномоченным федеральным органом исполнительной власти, которым создан совет по этике, и экспертом совета по этике. 4. Эксперты совета по этике несут ответственность в соответствии с законодательством Российской Федерации. 5. Состав совета по этике, положение об этом совете, порядок его деятельности, требования к квалификации и опыту работы по экспертной оценке научных, медицинских и этических аспектов клинических исследований лекарственных препаратов для медицинского применения, предъявляемые к экспертам совета по этике, порядок организации и проведения этической экспертизы, форма заключения совета по этике устанавливаются уполномоченным федеральным органом исполнительной власти. Число представителей медицинских организаций не может превышать половину от общего числа экспертов совета по этике. 6. Информация о составе совета по этике, планах его работы и текущей деятельности размещается на официальном сайте уполномоченного федерального органа исполнительной власти в сети "Интернет" в установленном им порядке.
 Статья 18. Подача и рассмотрение заявлений о государственной регистрации лекарственных препаратов и представление необходимых документов 1. Для государственной регистрации лекарственного препарата разработчик лекарственного препарата или уполномоченное им другое юридическое лицо (далее - заявитель) представляет в соответствующий уполномоченный федеральный орган исполнительной власти, осуществляющий государственную регистрацию лекарственных препаратов, заявление о государственной регистрации лекарственного препарата, а также в порядке, установленном соответствующим уполномоченным федеральным органом исполнительной власти, необходимые документы, из которых формируется регистрационное досье на лекарственный препарат (далее - регистрационное досье). 2. В заявлении о государственной регистрации лекарственного препарата указываются: 1) наименование и адрес заявителя и (или) производителя лекарственного препарата и адрес места осуществления производства лекарственного препарата; 2) наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования); 3) перечень веществ, входящих в состав лекарственного препарата, с указанием количества каждого из них; 4) лекарственная форма, дозировка, способы введения и применения, срок годности лекарственного препарата; 5) описание фармакологических и фармакодинамических или иммунобиологических свойств лекарственного препарата; 6) заявленная производителем лекарственного препарата предельная отпускная цена на лекарственный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов, в случае его государственной регистрации; 7) отсутствие необходимости проведения клинического исследования, исследования биоэквивалентности лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, с указанием нормативных правовых актов, подтверждающих данный срок применения.
Статья 18. Подача и рассмотрение заявлений о государственной регистрации лекарственных препаратов и представление необходимых документов 1. Для государственной регистрации лекарственного препарата разработчик лекарственного препарата или уполномоченное им другое юридическое лицо (далее - заявитель) представляет в соответствующий уполномоченный федеральный орган исполнительной власти, осуществляющий государственную регистрацию лекарственных препаратов, заявление о государственной регистрации лекарственного препарата, а также в порядке, установленном соответствующим уполномоченным федеральным органом исполнительной власти, необходимые документы, из которых формируется регистрационное досье на лекарственный препарат (далее - регистрационное досье). 2. В заявлении о государственной регистрации лекарственного препарата указываются: 1) наименование и адрес заявителя и (или) производителя лекарственного препарата и адрес места осуществления производства лекарственного препарата; 2) наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования); 3) перечень веществ, входящих в состав лекарственного препарата, с указанием количества каждого из них; 4) лекарственная форма, дозировка, способы введения и применения, срок годности лекарственного препарата; 5) описание фармакологических и фармакодинамических или иммунобиологических свойств лекарственного препарата; 6) заявленная производителем лекарственного препарата предельная отпускная цена на лекарственный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов, в случае его государственной регистрации; 7) отсутствие необходимости проведения клинического исследования, исследования биоэквивалентности лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, с указанием нормативных правовых актов, подтверждающих данный срок применения.
 3. Регистрационное досье формируется из следующих документов: 1) проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата; 2) документ, переведенный на русский язык, подтверждающий соответствие производителя регистрируемого лекарственного препарата требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке; 3) проект нормативной документации или нормативного документа на лекарственный препарат либо указание соответствующей фармакопейной статьи; 4) схема технологического процесса производства лекарственного препарата, ее описание и (или) схема технологического процесса производства фармацевтической субстанции, ее описание; 5) документ, переведенный на русский язык, подтверждающий соответствие производителя фармацевтической субстанции требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя фармацевтической субстанции, заверенный в установленном порядке и содержащий: а) наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; 6) документ, содержащий сведения о показателях качества фармацевтической субстанции, используемой при производстве лекарственных препаратов; 7) нормативная документация или нормативный документ на фармацевтическую субстанцию либо указание соответствующей фармакопейной статьи; 8) информация об условиях хранения, перевозки лекарственного препарата и иная информация; 9) отчет о результатах доклинического исследования лекарственного средства для медицинского применения, содержащий описание, результаты и статистический анализ результатов данного доклинического исследования; 10) отчет о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения; 11) проект протокола клинического исследования лекарственного препарата для медицинского применения; 12) брошюра исследователя; 13) информационный листок пациента; 14) информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности; 15) отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена на территории Российской Федерации;
3. Регистрационное досье формируется из следующих документов: 1) проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата; 2) документ, переведенный на русский язык, подтверждающий соответствие производителя регистрируемого лекарственного препарата требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке; 3) проект нормативной документации или нормативного документа на лекарственный препарат либо указание соответствующей фармакопейной статьи; 4) схема технологического процесса производства лекарственного препарата, ее описание и (или) схема технологического процесса производства фармацевтической субстанции, ее описание; 5) документ, переведенный на русский язык, подтверждающий соответствие производителя фармацевтической субстанции требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя фармацевтической субстанции, заверенный в установленном порядке и содержащий: а) наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; 6) документ, содержащий сведения о показателях качества фармацевтической субстанции, используемой при производстве лекарственных препаратов; 7) нормативная документация или нормативный документ на фармацевтическую субстанцию либо указание соответствующей фармакопейной статьи; 8) информация об условиях хранения, перевозки лекарственного препарата и иная информация; 9) отчет о результатах доклинического исследования лекарственного средства для медицинского применения, содержащий описание, результаты и статистический анализ результатов данного доклинического исследования; 10) отчет о результатах доклинического исследования лекарственного средства и клинического исследования лекарственного препарата для ветеринарного применения; 11) проект протокола клинического исследования лекарственного препарата для медицинского применения; 12) брошюра исследователя; 13) информационный листок пациента; 14) информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности; 15) отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена на территории Российской Федерации;
 16) проект инструкции по применению лекарственного препарата, содержащий следующие сведения: а) наименование лекарственного средства (международное непатентованное или химическое и торговое наименования); б) лекарственная форма с указанием наименований и количественного содержания (активности) фармацевтических субстанций и вспомогательных веществ; в) фармакотерапевтическая группа лекарственного препарата; г) показания для применения; д) противопоказания для применения; е) режим дозирования, способ введения, при необходимости время приема лекарственного препарата, продолжительность лечения (в том числе у детей до и после одного года); ж) меры предосторожности применении; з) симптомы передозировки, меры по оказанию помощи при передозировке; и) указание, при необходимости, особенностей действия лекарственного препарата при первом приеме или при его отмене; к) описание, при необходимости, действий врача (фельдшера), специалиста в области ветеринарии, пациента, владельца животного при пропуске приема одной или нескольких доз лекарственного препарата; л) возможные побочные действия применении лекарственного препарата; м) взаимодействие с другими лекарственными препаратами и (или) пищевыми продуктами, кормами; н) указание возможности и особенностей медицинского применения лекарственного препарата беременными женщинами, женщинами в период грудного вскармливания, детьми, взрослыми, имеющими хронические заболевания; о) сведения о возможном влиянии лекарственного препарата для медицинского применения на способность управлять транспортными средствами, механизмами; п) срок годности и указание на запрет применения лекарственного препарата по истечении срока годности; р) условия хранения; с) указание на необходимость хранения лекарственного препарата в местах, недоступных для детей; т) указание, при необходимости, специальных мер предосторожности при уничтожении неиспользованных лекарственных препаратов; у) сроки возможного использования продукции животного происхождения после введения животному лекарственного препарата для ветеринарного применения; ф) наименование, адрес производителя лекарственного препарата и адрес места производства лекарственного препарата;
16) проект инструкции по применению лекарственного препарата, содержащий следующие сведения: а) наименование лекарственного средства (международное непатентованное или химическое и торговое наименования); б) лекарственная форма с указанием наименований и количественного содержания (активности) фармацевтических субстанций и вспомогательных веществ; в) фармакотерапевтическая группа лекарственного препарата; г) показания для применения; д) противопоказания для применения; е) режим дозирования, способ введения, при необходимости время приема лекарственного препарата, продолжительность лечения (в том числе у детей до и после одного года); ж) меры предосторожности применении; з) симптомы передозировки, меры по оказанию помощи при передозировке; и) указание, при необходимости, особенностей действия лекарственного препарата при первом приеме или при его отмене; к) описание, при необходимости, действий врача (фельдшера), специалиста в области ветеринарии, пациента, владельца животного при пропуске приема одной или нескольких доз лекарственного препарата; л) возможные побочные действия применении лекарственного препарата; м) взаимодействие с другими лекарственными препаратами и (или) пищевыми продуктами, кормами; н) указание возможности и особенностей медицинского применения лекарственного препарата беременными женщинами, женщинами в период грудного вскармливания, детьми, взрослыми, имеющими хронические заболевания; о) сведения о возможном влиянии лекарственного препарата для медицинского применения на способность управлять транспортными средствами, механизмами; п) срок годности и указание на запрет применения лекарственного препарата по истечении срока годности; р) условия хранения; с) указание на необходимость хранения лекарственного препарата в местах, недоступных для детей; т) указание, при необходимости, специальных мер предосторожности при уничтожении неиспользованных лекарственных препаратов; у) сроки возможного использования продукции животного происхождения после введения животному лекарственного препарата для ветеринарного применения; ф) наименование, адрес производителя лекарственного препарата и адрес места производства лекарственного препарата;
 17) переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации; 18) документы, представляемые в соответствии со статьями 19 - 23 настоящего Федерального закона. 4. По желанию заявителя могут быть представлены отчеты о проведенных в стране заявителя и других странах результатах клинических исследований, исследований биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата (включая эпидемиологические или эпизоотологические исследования иммунобиологических лекарственных препаратов, предназначенных для иммунологической профилактики и лечения инфекционных заболеваний, в том числе у детей), содержащие описания проведенных исследований лекарственного препарата, их результаты и статистический анализ полученных результатов. 5. К заявлению о государственной регистрации лекарственного препарата прилагаются: 1) документ, подтверждающий уплату государственной пошлины за проведение экспертизы документов для получения разрешений на проведение клинических исследований лекарственного препарата для медицинского применения и этической экспертизы при обращении за государственной регистрацией лекарственного препарата; 2) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; 3) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации, при государственной регистрации лекарственного препарата; 4) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации.
17) переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации; 18) документы, представляемые в соответствии со статьями 19 - 23 настоящего Федерального закона. 4. По желанию заявителя могут быть представлены отчеты о проведенных в стране заявителя и других странах результатах клинических исследований, исследований биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата (включая эпидемиологические или эпизоотологические исследования иммунобиологических лекарственных препаратов, предназначенных для иммунологической профилактики и лечения инфекционных заболеваний, в том числе у детей), содержащие описания проведенных исследований лекарственного препарата, их результаты и статистический анализ полученных результатов. 5. К заявлению о государственной регистрации лекарственного препарата прилагаются: 1) документ, подтверждающий уплату государственной пошлины за проведение экспертизы документов для получения разрешений на проведение клинических исследований лекарственного препарата для медицинского применения и этической экспертизы при обращении за государственной регистрацией лекарственного препарата; 2) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, при государственной регистрации лекарственного препарата; 3) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для медицинского применения, в отношении которого проведены международные многоцентровые клинические исследования, часть из которых проведена на территории Российской Федерации, при государственной регистрации лекарственного препарата; 4) документ, подтверждающий уплату государственной пошлины за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации.
 Статья 33. Государственный реестр лекарственных средств 1. Государственный реестр лекарственных средств содержит перечень лекарственных препаратов, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав лекарственных препаратов, и следующую информацию: 1) в отношении лекарственных препаратов: а) наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования); б) лекарственная форма с указанием дозировки лекарственного препарата и его количества в потребительской упаковке; в) наименование разработчика лекарственного препарата; г) наименование и адрес производителя лекарственного препарата; д) фармакотерапевтическая группа лекарственного препарата; е) показания и противопоказания к применению лекарственного препарата; ж) побочные действия лекарственного препарата; з) срок годности лекарственного препарата; и) условия хранения лекарственного препарата; к) условия отпуска лекарственного препарата; л) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа; м) дата государственной регистрации лекарственного препарата и его регистрационный номер; 2) в отношении фармацевтических субстанций: а) наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; г) условия хранения фармацевтической субстанции; д) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа. 2. Фармацевтическая субстанция, неиспользуемая при производстве лекарственных препаратов, может быть включена в государственный реестр лекарственных средств на основании заявления разработчика, производителя лекарственного средства либо уполномоченного ими юридического лица при условии проведения в отношении такой фармацевтической субстанции экспертизы качества фармацевтической субстанции в порядке, установленном статьей 34 настоящего Федерального закона. 3. Порядок ведения государственного реестра лекарственных средств для медицинского применения и порядок ведения государственного реестра лекарственных средств для ветеринарного применения утверждаются соответствующим уполномоченным федеральным органом исполнительной власти.
Статья 33. Государственный реестр лекарственных средств 1. Государственный реестр лекарственных средств содержит перечень лекарственных препаратов, прошедших государственную регистрацию, перечень фармацевтических субстанций, входящих в состав лекарственных препаратов, и следующую информацию: 1) в отношении лекарственных препаратов: а) наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования); б) лекарственная форма с указанием дозировки лекарственного препарата и его количества в потребительской упаковке; в) наименование разработчика лекарственного препарата; г) наименование и адрес производителя лекарственного препарата; д) фармакотерапевтическая группа лекарственного препарата; е) показания и противопоказания к применению лекарственного препарата; ж) побочные действия лекарственного препарата; з) срок годности лекарственного препарата; и) условия хранения лекарственного препарата; к) условия отпуска лекарственного препарата; л) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа; м) дата государственной регистрации лекарственного препарата и его регистрационный номер; 2) в отношении фармацевтических субстанций: а) наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования); б) наименование и адрес производителя фармацевтической субстанции; в) срок годности фармацевтической субстанции; г) условия хранения фармацевтической субстанции; д) номер фармакопейной статьи или в случае ее отсутствия номер нормативной документации либо нормативного документа. 2. Фармацевтическая субстанция, неиспользуемая при производстве лекарственных препаратов, может быть включена в государственный реестр лекарственных средств на основании заявления разработчика, производителя лекарственного средства либо уполномоченного ими юридического лица при условии проведения в отношении такой фармацевтической субстанции экспертизы качества фармацевтической субстанции в порядке, установленном статьей 34 настоящего Федерального закона. 3. Порядок ведения государственного реестра лекарственных средств для медицинского применения и порядок ведения государственного реестра лекарственных средств для ветеринарного применения утверждаются соответствующим уполномоченным федеральным органом исполнительной власти.
 Статья 34. Экспертиза качества фармацевтической субстанции, неиспользуемой при производстве лекарственных препаратов 1. Для включения фармацевтической субстанции, неиспользуемой при производстве лекарственных препаратов, в государственный реестр лекарственных средств, проводится экспертиза ее качества. 2. Экспертиза качества указанной в части 1 настоящей статьи фармацевтической субстанции, составление комиссией экспертов заключений по результатам такой экспертизы и их направление в уполномоченный федеральный орган исполнительной власти осуществляются в срок, не превышающий шестидесяти рабочих дней со дня получения экспертным учреждением соответствующего задания уполномоченного федерального органа исполнительной власти и документов, указанных в пунктах 4 - 7 части 3 статьи 18 настоящего Федерального закона. ……
Статья 34. Экспертиза качества фармацевтической субстанции, неиспользуемой при производстве лекарственных препаратов 1. Для включения фармацевтической субстанции, неиспользуемой при производстве лекарственных препаратов, в государственный реестр лекарственных средств, проводится экспертиза ее качества. 2. Экспертиза качества указанной в части 1 настоящей статьи фармацевтической субстанции, составление комиссией экспертов заключений по результатам такой экспертизы и их направление в уполномоченный федеральный орган исполнительной власти осуществляются в срок, не превышающий шестидесяти рабочих дней со дня получения экспертным учреждением соответствующего задания уполномоченного федерального органа исполнительной власти и документов, указанных в пунктах 4 - 7 части 3 статьи 18 настоящего Федерального закона. ……
 Глава 8. Производство и маркировка лекарственных средств Статья 45. Производство лекарственных средств 1. Производство лекарственных средств должно соответствовать правилам организации производства и контроля качества лекарственных средств, утвержденным Правительством Российской Федерации. 2. Производство лекарственных средств на территории Российской Федерации осуществляется производителями лекарственных средств, имеющими лицензию на производство лекарственных средств. 3. Производство лекарственных средств осуществляется с соблюдением требований промышленного регламента, который утверждается руководителем производителя лекарственных средств и включает в себя перечень используемых фармацевтических субстанций и вспомогательных веществ с указанием количества каждого из них, данные об используемом оборудовании, описание технологического процесса и методов контроля на всех этапах производства лекарственных средств. 4. При производстве лекарственных средств используются фармацевтические субстанции, включенные в государственный реестр лекарственных средств. 5. Запрещается производство: 1) лекарственных средств, не включенных в государственный реестр лекарственных средств, за исключением лекарственных средств, производимых для проведения клинических исследований и для экспорта; 2) фальсифицированных лекарственных средств; 3) лекарственных средств без лицензии на производство лекарственных средств; 4) лекарственных средств с нарушением правил организации производства и контроля качества лекарственных средств. 6. При вводе лекарственных средств в гражданский оборот уполномоченное лицо производителя лекарственных средств осуществляет подтверждение соответствия лекарственных средств требованиям, установленным при их государственной регистрации, и гарантирует, что лекарственные средства произведены в соответствии с правилами производства и контроля качества лекарственных средств. 7. Уполномоченным лицом производителя лекарственных средств является его работник, имеющий высшее фармацевтическое, химическое или биологическое образование либо при производстве лекарственных средств для ветеринарного применения ветеринарное образование, стаж работы не менее чем пять лет в области производства и контроля качества лекарственных средств и аттестованный в порядке, установленном уполномоченным федеральным органом исполнительной власти.
Глава 8. Производство и маркировка лекарственных средств Статья 45. Производство лекарственных средств 1. Производство лекарственных средств должно соответствовать правилам организации производства и контроля качества лекарственных средств, утвержденным Правительством Российской Федерации. 2. Производство лекарственных средств на территории Российской Федерации осуществляется производителями лекарственных средств, имеющими лицензию на производство лекарственных средств. 3. Производство лекарственных средств осуществляется с соблюдением требований промышленного регламента, который утверждается руководителем производителя лекарственных средств и включает в себя перечень используемых фармацевтических субстанций и вспомогательных веществ с указанием количества каждого из них, данные об используемом оборудовании, описание технологического процесса и методов контроля на всех этапах производства лекарственных средств. 4. При производстве лекарственных средств используются фармацевтические субстанции, включенные в государственный реестр лекарственных средств. 5. Запрещается производство: 1) лекарственных средств, не включенных в государственный реестр лекарственных средств, за исключением лекарственных средств, производимых для проведения клинических исследований и для экспорта; 2) фальсифицированных лекарственных средств; 3) лекарственных средств без лицензии на производство лекарственных средств; 4) лекарственных средств с нарушением правил организации производства и контроля качества лекарственных средств. 6. При вводе лекарственных средств в гражданский оборот уполномоченное лицо производителя лекарственных средств осуществляет подтверждение соответствия лекарственных средств требованиям, установленным при их государственной регистрации, и гарантирует, что лекарственные средства произведены в соответствии с правилами производства и контроля качества лекарственных средств. 7. Уполномоченным лицом производителя лекарственных средств является его работник, имеющий высшее фармацевтическое, химическое или биологическое образование либо при производстве лекарственных средств для ветеринарного применения ветеринарное образование, стаж работы не менее чем пять лет в области производства и контроля качества лекарственных средств и аттестованный в порядке, установленном уполномоченным федеральным органом исполнительной власти.
 законодательством Российской Федерации порядке: 1) другим производителям лекарственных средств для производства лекарственных средств; 2) организациям оптовой торговли лекарственными средствами; 3) аптечным организациям, ветеринарным аптечным организациям, индивидуальным предпринимателям, имеющим лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность; 4) научно-исследовательским организациям для научно-исследовательской работы; 5) медицинским организациям и ветеринарным организациям; 6) организациям, осуществляющим разведение, выращивание и содержание животных. Статья 46. Маркировка лекарственных средств 1. Лекарственные препараты, за исключением лекарственных препаратов, изготовленных аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, должны поступать в обращение, если: 1) на их первичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное, или химическое, или торговое наименование), номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), срок годности, доза и форма выпуска, объем и количество доз (для иммунобиологических лекарственных препаратов); 2) на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования), наименование производителя лекарственного препарата, номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), номер регистрационного удостоверения, срок годности, способ применения, доза и количество доз в упаковке, форма выпуска, условия отпуска, условия хранения, меры предосторожности применении лекарственного препарата, предупредительные надписи. 2. Фармацевтические субстанции должны поступать в обращение, если на их первичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования), наименование производителя фармацевтической субстанции, номер серии и дата изготовления, количество в упаковке и единицы измерения количества, срок годности и условия хранения. 3. Лекарственные средства в качестве сывороток должны поступать в обращение с указанием животного, из крови, плазмы крови, органов и тканей которого они получены. 4. На вторичную (потребительскую) упаковку лекарственных средств, полученных из крови, плазмы крови, органов и тканей человека, должна наноситься надпись: "Антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита С и поверхностный антиген вируса гепатита В отсутствуют". 5. На первичную упаковку и вторичную (потребительскую) упаковку радиофармацевтических лекарственных средств должен наноситься знак радиационной опасности. 6. На вторичную (потребительскую) упаковку гомеопатических лекарственных препаратов должна наноситься надпись: "Гомеопатический". 7. На вторичную (потребительскую) упаковку лекарственных растительных препаратов должна наноситься надпись: "Продукция прошла радиационный контроль". 8. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных препаратов, предназначенных для клинических исследований, должна наноситься надпись: "Для клинических исследований". 9. Упаковка лекарственных средств, предназначенных исключительно для экспорта, маркируется в соответствии с требованиями страныимпортера. 10. На транспортную тару, которая не предназначена для потребителей и в которую помещено лекарственное средство, должна наноситься информация о наименовании, серии лекарственного средства, дате выпуска, количестве вторичных (потребительских) упаковок лекарственного средства, производителе лекарственного средства с указанием наименования и местонахождения производителя лекарственного средства (адрес, в том числе страна и (или) место производства лекарственного средства), а также о сроке годности лекарственного средства и об условиях его хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки. 11. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных средств для ветеринарного применения должна наноситься надпись: "Для ветеринарного применения".
законодательством Российской Федерации порядке: 1) другим производителям лекарственных средств для производства лекарственных средств; 2) организациям оптовой торговли лекарственными средствами; 3) аптечным организациям, ветеринарным аптечным организациям, индивидуальным предпринимателям, имеющим лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность; 4) научно-исследовательским организациям для научно-исследовательской работы; 5) медицинским организациям и ветеринарным организациям; 6) организациям, осуществляющим разведение, выращивание и содержание животных. Статья 46. Маркировка лекарственных средств 1. Лекарственные препараты, за исключением лекарственных препаратов, изготовленных аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, должны поступать в обращение, если: 1) на их первичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное, или химическое, или торговое наименование), номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), срок годности, доза и форма выпуска, объем и количество доз (для иммунобиологических лекарственных препаратов); 2) на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования), наименование производителя лекарственного препарата, номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), номер регистрационного удостоверения, срок годности, способ применения, доза и количество доз в упаковке, форма выпуска, условия отпуска, условия хранения, меры предосторожности применении лекарственного препарата, предупредительные надписи. 2. Фармацевтические субстанции должны поступать в обращение, если на их первичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование фармацевтической субстанции (международное непатентованное или химическое и торговое наименования), наименование производителя фармацевтической субстанции, номер серии и дата изготовления, количество в упаковке и единицы измерения количества, срок годности и условия хранения. 3. Лекарственные средства в качестве сывороток должны поступать в обращение с указанием животного, из крови, плазмы крови, органов и тканей которого они получены. 4. На вторичную (потребительскую) упаковку лекарственных средств, полученных из крови, плазмы крови, органов и тканей человека, должна наноситься надпись: "Антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита С и поверхностный антиген вируса гепатита В отсутствуют". 5. На первичную упаковку и вторичную (потребительскую) упаковку радиофармацевтических лекарственных средств должен наноситься знак радиационной опасности. 6. На вторичную (потребительскую) упаковку гомеопатических лекарственных препаратов должна наноситься надпись: "Гомеопатический". 7. На вторичную (потребительскую) упаковку лекарственных растительных препаратов должна наноситься надпись: "Продукция прошла радиационный контроль". 8. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных препаратов, предназначенных для клинических исследований, должна наноситься надпись: "Для клинических исследований". 9. Упаковка лекарственных средств, предназначенных исключительно для экспорта, маркируется в соответствии с требованиями страныимпортера. 10. На транспортную тару, которая не предназначена для потребителей и в которую помещено лекарственное средство, должна наноситься информация о наименовании, серии лекарственного средства, дате выпуска, количестве вторичных (потребительских) упаковок лекарственного средства, производителе лекарственного средства с указанием наименования и местонахождения производителя лекарственного средства (адрес, в том числе страна и (или) место производства лекарственного средства), а также о сроке годности лекарственного средства и об условиях его хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки. 11. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных средств для ветеринарного применения должна наноситься надпись: "Для ветеринарного применения".
 Статья 71. Вступление в силу настоящего Федерального закона 1. Настоящий Федеральный закон вступает в силу с 1 сентября 2010 года. 2. Лекарственные средства, зарегистрированные до дня вступления в силу настоящего Федерального закона, подлежат включению в государственные реестры лекарственных средств с внесением указанных в части 1 статьи 33 настоящего Федерального закона сведений об этих лекарственных средствах без прохождения вновь процедуры государственной регистрации лекарственных препаратов. 3. Государственная регистрация лекарственных препаратов, представленных на указанную регистрацию до дня вступления в силу настоящего Федерального закона, осуществляется в соответствии с настоящим Федеральным законом на основании документов и данных, представленных до дня вступления в силу настоящего Федерального закона. 4. Со дня вступления в силу настоящего Федерального закона и по 30 апреля 2011 года включительно допускается проведение экспертизы лекарственных средств экспертами экспертного учреждения до прохождения ими аттестации в порядке, установленном уполномоченным федеральным органом исполнительной власти. 5. Со дня вступления в силу настоящего Федерального закона и по 31 декабря 2013 года включительно осуществляется переход к производству лекарственных средств в соответствии с правилами организации производства и контроля качества лекарственных средств, указанными в части 1 статьи 45 настоящего Федерального закона, в полном объеме. Сроки перехода производства лекарственных средств к их производству в соответствии с конкретными требованиями данных правил, включая сроки аттестации уполномоченных лиц, указанных в частях 6 и 7 статьи 45 настоящего Федерального закона, устанавливаются Правительством Российской Федерации. 6. Лицензии на производство лекарственных средств, выданные до 1 января 2014 года, действуют после 1 января 2014 года до истечения срока их действия при условии соответствия лицензиата правилам организации производства и контроля качества лекарственных средств, указанным в части 1 статьи 45 настоящего Федерального закона. Президент Российской Федерации Д. Медведев
Статья 71. Вступление в силу настоящего Федерального закона 1. Настоящий Федеральный закон вступает в силу с 1 сентября 2010 года. 2. Лекарственные средства, зарегистрированные до дня вступления в силу настоящего Федерального закона, подлежат включению в государственные реестры лекарственных средств с внесением указанных в части 1 статьи 33 настоящего Федерального закона сведений об этих лекарственных средствах без прохождения вновь процедуры государственной регистрации лекарственных препаратов. 3. Государственная регистрация лекарственных препаратов, представленных на указанную регистрацию до дня вступления в силу настоящего Федерального закона, осуществляется в соответствии с настоящим Федеральным законом на основании документов и данных, представленных до дня вступления в силу настоящего Федерального закона. 4. Со дня вступления в силу настоящего Федерального закона и по 30 апреля 2011 года включительно допускается проведение экспертизы лекарственных средств экспертами экспертного учреждения до прохождения ими аттестации в порядке, установленном уполномоченным федеральным органом исполнительной власти. 5. Со дня вступления в силу настоящего Федерального закона и по 31 декабря 2013 года включительно осуществляется переход к производству лекарственных средств в соответствии с правилами организации производства и контроля качества лекарственных средств, указанными в части 1 статьи 45 настоящего Федерального закона, в полном объеме. Сроки перехода производства лекарственных средств к их производству в соответствии с конкретными требованиями данных правил, включая сроки аттестации уполномоченных лиц, указанных в частях 6 и 7 статьи 45 настоящего Федерального закона, устанавливаются Правительством Российской Федерации. 6. Лицензии на производство лекарственных средств, выданные до 1 января 2014 года, действуют после 1 января 2014 года до истечения срока их действия при условии соответствия лицензиата правилам организации производства и контроля качества лекарственных средств, указанным в части 1 статьи 45 настоящего Федерального закона. Президент Российской Федерации Д. Медведев


