Gidroliz_soli.ppt
- Количество слайдов: 11
 от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
 Гидролиз солей Водные растворы солей имеют разные значения p. H и различные типы сред – кислую (p. H < 7), щелочную (p. H > 7), нейтральную (p. H = 7). Сущность гидролиза сводится к обменному химическому взаимодействию катионов и анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов H⁺ или OH¯, и раствор соли становится кислотным или щелочным соответственно.
Гидролиз солей Водные растворы солей имеют разные значения p. H и различные типы сред – кислую (p. H < 7), щелочную (p. H > 7), нейтральную (p. H = 7). Сущность гидролиза сводится к обменному химическому взаимодействию катионов и анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов H⁺ или OH¯, и раствор соли становится кислотным или щелочным соответственно.
 4 типа солей. Соль образована сильным основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована слабым основанием и сильной кислотой Соль образована слабым основанием и слабой кислотой
4 типа солей. Соль образована сильным основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована слабым основанием и сильной кислотой Соль образована слабым основанием и слабой кислотой
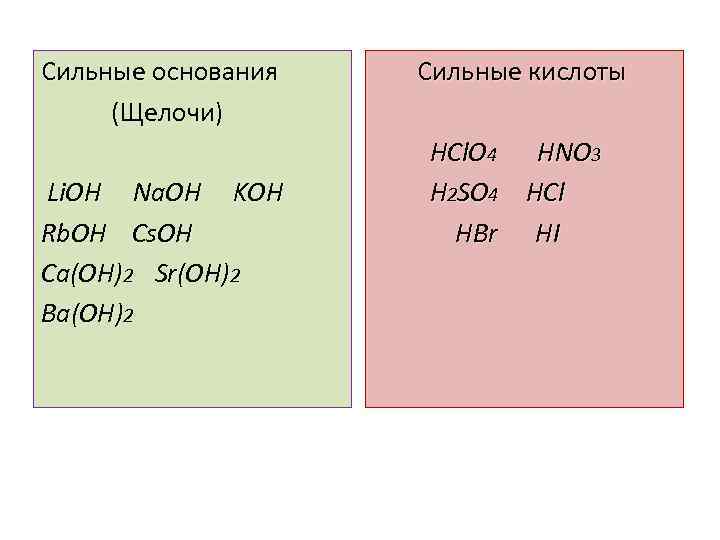 Сильные основания (Щелочи) Li. OH Na. OH KOH Rb. OH Cs. OH Ca(OH)2 Sr(OH)2 Ba(OH)2 Cильные кислоты HCl. O 4 HNO 3 H 2 SO 4 HCl HBr HI
Сильные основания (Щелочи) Li. OH Na. OH KOH Rb. OH Cs. OH Ca(OH)2 Sr(OH)2 Ba(OH)2 Cильные кислоты HCl. O 4 HNO 3 H 2 SO 4 HCl HBr HI
 Гидролиз по аниону (соль образована сильным основанием и слабой кислотой) KNO 2 = K⁺ + NO 2¯ + HOH HNO 2 + OH ¯ сокращенное ионное уравнение KNO 2 +H 2 O HNO 2 + KOH молекулярное уравнение • • Выводы: По аниону соли, как правило, гидролизуются обратимо; Химическое равновесие смещено влево; Реакция среды – щелочная (p. H > 7); При гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Гидролиз по аниону (соль образована сильным основанием и слабой кислотой) KNO 2 = K⁺ + NO 2¯ + HOH HNO 2 + OH ¯ сокращенное ионное уравнение KNO 2 +H 2 O HNO 2 + KOH молекулярное уравнение • • Выводы: По аниону соли, как правило, гидролизуются обратимо; Химическое равновесие смещено влево; Реакция среды – щелочная (p. H > 7); При гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
 Гидролиз по катиону (соль образована слабым основанием и сильной кислотой) Ni(NO 3)2 = Ni²⁺ + 2 NO 3¯ Ni²⁺ + HOH Ni. OH⁺ + H⁺ сокращенное ионное уравнение Ni(NO 3)2 + H 2 O Ni. OHNO 3 + HNO 3 молекулярное уравнение • • Выводы: По катиону соли, как правило, гидролизуются обратимо; Химическое равновесие смещено влево; Реакция среды – кислотная (p. H < 7); При гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
Гидролиз по катиону (соль образована слабым основанием и сильной кислотой) Ni(NO 3)2 = Ni²⁺ + 2 NO 3¯ Ni²⁺ + HOH Ni. OH⁺ + H⁺ сокращенное ионное уравнение Ni(NO 3)2 + H 2 O Ni. OHNO 3 + HNO 3 молекулярное уравнение • • Выводы: По катиону соли, как правило, гидролизуются обратимо; Химическое равновесие смещено влево; Реакция среды – кислотная (p. H < 7); При гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
 Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой) Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S NH 4(CH 3 COO) + H 2 O NH 3 ∙ H 2 O + CH 3 COOH Выводы: • Если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; • Реакция среды при этом нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты; • Гидролиз необратим, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой) Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S NH 4(CH 3 COO) + H 2 O NH 3 ∙ H 2 O + CH 3 COOH Выводы: • Если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; • Реакция среды при этом нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты; • Гидролиз необратим, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
 Изменение направления гидролиза е илени Ус воды; ь бавит • До створ; в а реть р одукто р • Наг н из п и ать од з • Свя лиза в е гидро астворимо овую аз ор трудн ние или в г е оедин с фазу. Подав ление • Увеличить концентрацию растворенного вещества; • Охладить раствор; • Ввести в раствор один из продуктов гидролиза (подкислять раствор, если его среда кислотная, или подщелачивать, если щелочная).
Изменение направления гидролиза е илени Ус воды; ь бавит • До створ; в а реть р одукто р • Наг н из п и ать од з • Свя лиза в е гидро астворимо овую аз ор трудн ние или в г е оедин с фазу. Подав ление • Увеличить концентрацию растворенного вещества; • Охладить раствор; • Ввести в раствор один из продуктов гидролиза (подкислять раствор, если его среда кислотная, или подщелачивать, если щелочная).
 Контрольный тест 1. Гидролиз солей – это взаимодействие с водой а) катионов или анионов любой (по растворимости) соли б) катионов или анионов некоторых растворимых солей в) молекул некоторых растворимых солей г) только анионов некоторых растворимых солей 2. При гидролизе соли по аниону взаимодействует с водой а) анион любой кислоты б) анион любой слабой кислоты в) анион любой сильной кислоты
Контрольный тест 1. Гидролиз солей – это взаимодействие с водой а) катионов или анионов любой (по растворимости) соли б) катионов или анионов некоторых растворимых солей в) молекул некоторых растворимых солей г) только анионов некоторых растворимых солей 2. При гидролизе соли по аниону взаимодействует с водой а) анион любой кислоты б) анион любой слабой кислоты в) анион любой сильной кислоты
 3. Соль, гидролизуемая по аниону, - это а) Rb 2 CO 3 б) Rb. Cl в) Ag. Cl г) Ca. CO 3 4. При гидролизе соли по катиону взаимодействует с водой а) катион щелочи б) катион гидроксида любого металла в) катион любого гидроксида металла, кроме щелочей 5. Соль гидролизуемая по катиону а) Сa(NO 3)2 б) Fe. Cl 3 в) Rb. SO 4 г) KBr 6. Гидролизу не подвергается а) Sn. Cl 4 б) Fe. Cl 3 в) Zn. Cl 2 г) Rb. Cl
3. Соль, гидролизуемая по аниону, - это а) Rb 2 CO 3 б) Rb. Cl в) Ag. Cl г) Ca. CO 3 4. При гидролизе соли по катиону взаимодействует с водой а) катион щелочи б) катион гидроксида любого металла в) катион любого гидроксида металла, кроме щелочей 5. Соль гидролизуемая по катиону а) Сa(NO 3)2 б) Fe. Cl 3 в) Rb. SO 4 г) KBr 6. Гидролизу не подвергается а) Sn. Cl 4 б) Fe. Cl 3 в) Zn. Cl 2 г) Rb. Cl
 7. В растворе соли по катиону химическая среда а) щелочная б) кислая в) нейтральная г) может быть любой 8. Водный раствор будет кислым для соли а) Na 2 Si. O 3 б) Ba(NO 3)2 в)KI г) (NH 4)2 SO 4 9. Щелочная среда характеризует раствор соли а) KNO 3 б) Ca. CO 3 в)K 3 PO 4 г)Ca. Br 2 10. Гидролиз идет до конца в растворе соли а) Cu. SO 4 б) Cu. SO 3 в) Cu. S г) Cu(NO 3)2
7. В растворе соли по катиону химическая среда а) щелочная б) кислая в) нейтральная г) может быть любой 8. Водный раствор будет кислым для соли а) Na 2 Si. O 3 б) Ba(NO 3)2 в)KI г) (NH 4)2 SO 4 9. Щелочная среда характеризует раствор соли а) KNO 3 б) Ca. CO 3 в)K 3 PO 4 г)Ca. Br 2 10. Гидролиз идет до конца в растворе соли а) Cu. SO 4 б) Cu. SO 3 в) Cu. S г) Cu(NO 3)2


