Острые лейкозы!.ppt
- Количество слайдов: 24
Острый миелобластный лейкоз Острый миелолейкоз, иначе называемый как острая миелоидная лейкемия, или ОМЛ, Оне. ЛЛ – злокачественное заболевание, возникающее в результате злокачественной транформации и нарушения дифференцировки гемопоэтических клеток на уровне миелоидных клеток-предшественниц. • Выполнила студентка 3 курса 17 группы Назарова Катерина
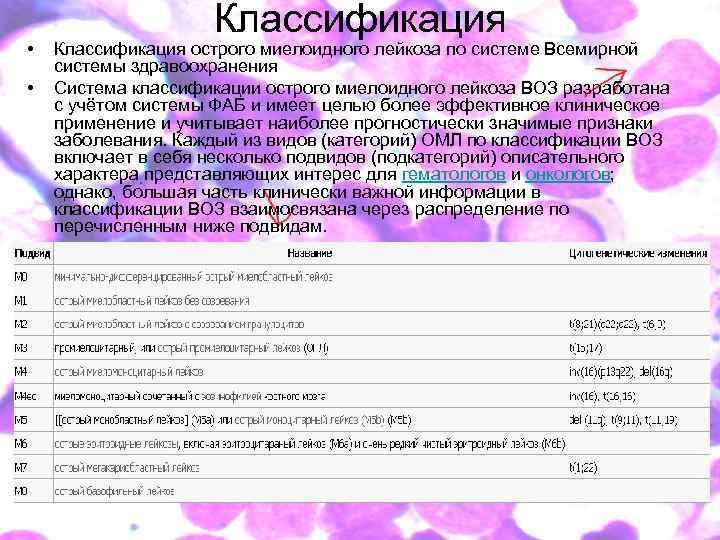
• • Классификация острого миелоидного лейкоза по системе Всемирной системы здравоохранения Система классификации острого миелоидного лейкоза ВОЗ разработана с учётом системы ФАБ и имеет целью более эффективное клиническое применение и учитывает наиболее прогностически значимые признаки заболевания. Каждый из видов (категорий) ОМЛ по классификации ВОЗ включает в себя несколько подвидов (подкатегорий) описательного характера представляющих интерес для гематологов и онкологов; однако, бо льшая часть клинически важной информации в классификации ВОЗ взаимосвязана через распределение по перечисленным ниже подвидам.
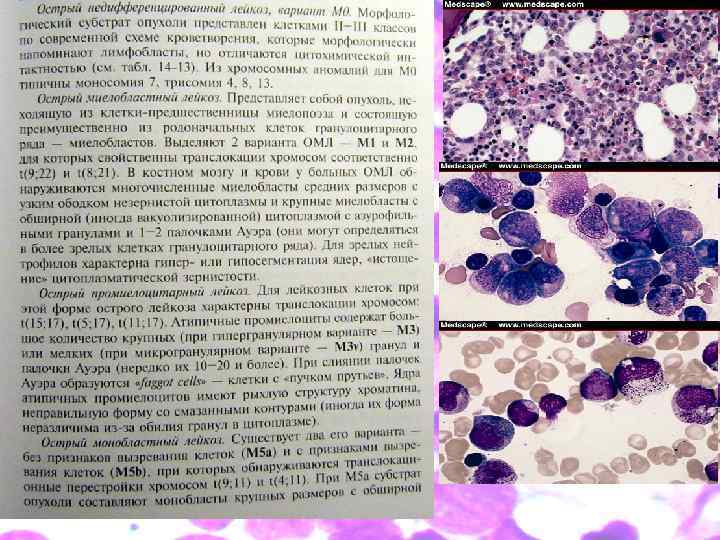
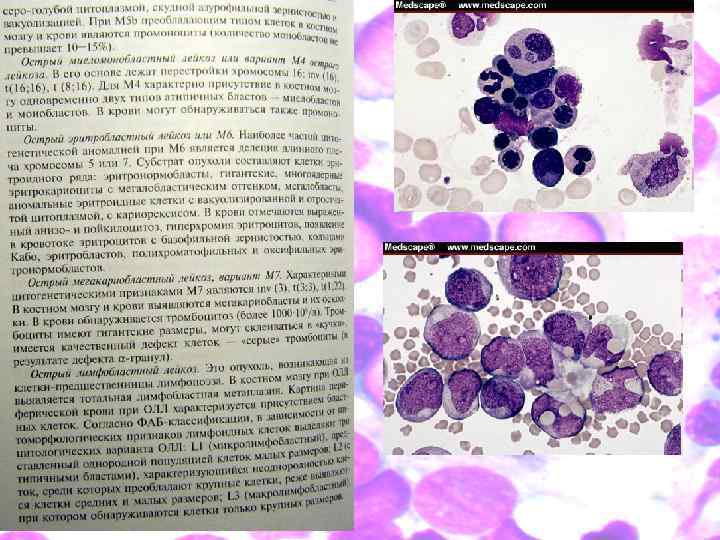

Франко-американско-британская классификация Франко-американско-британская классификационная (ФАБ) система разделяет ОМЛ на 8 подвидов, от М 0 по M 7, основываясь на типах клеток — предшественниц лейкоза, и на степени зрелости изменённых клеток. Определение злокачественных клеток проводят на основании внешних признаков при световой микроскопии и/или цитогенетически, выявляя лежащие в основе отклонений изменения в хромосомах. У разных подвидов ОМЛ разные прогноз и ответ на лечение. Несмотря на преимущества классификации ВОЗ, система ФАБ до сих пор широко применяется. По ФАБ существует восемь подтипов ОМЛ.
Необычные фенотипы острого миелоидного лейкоза • Морфологические подтипы ОМЛ включают многие исключительно редкие подтипы не включённые в классификацию ФАБ. В списке ниже перечислены эти подтипы. • Острый базофильный лейкоз • Острый эозинофильный лейкоз • Тучноклеточный лейкоз • Острый миелоидный дендритноклеточный лейкоз • Острый панмиелоз с миелофиброзом • Миелоидная саркома.
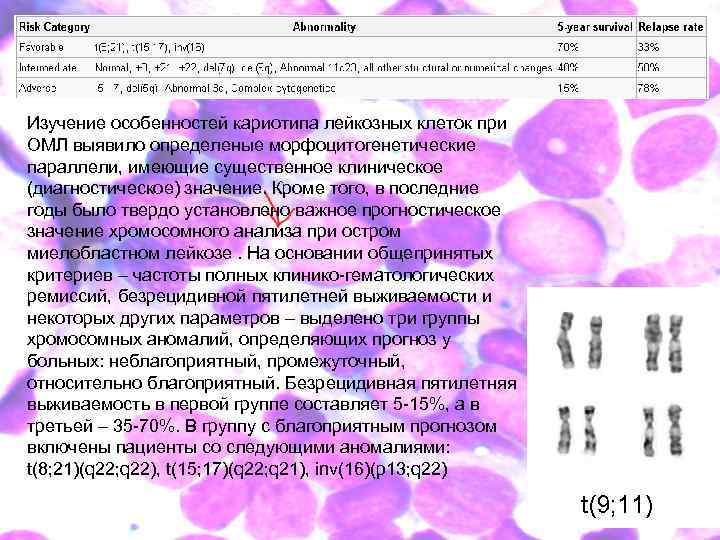
Изучение особенностей кариотипа лейкозных клеток при ОМЛ выявило определеные морфоцитогенетические параллели, имеющие существенное клиническое (диагностическое) значение. Кроме того, в последние годы было твердо установлено важное прогностическое значение хромосомного анализа при остром миелобластном лейкозе. На основании общепринятых критериев – частоты полных клинико-гематологических ремиссий, безрецидивной пятилетней выживаемости и некоторых других параметров – выделено три группы хромосомных аномалий, определяющих прогноз у больных: неблагоприятный, промежуточный, относительно благоприятный. Безрецидивная пятилетняя выживаемость в первой группе составляет 5 -15%, а в третьей – 35 -70%. В группу с благоприятным прогнозом включены пациенты со следующими аномалиями: t(8; 21)(q 22; q 22), t(15; 17)(q 22; q 21), inv(16)(p 13; q 22)

• • Генетические аномалии при острых миелоидных лейкозах Основными молекулярными событиями, ведущими к формированию лейкемического клона при миелоидных лейкозах, являются либо возникновение специфических транслокаций, зачастую с вовлечением протоокогенов, либо мутации генов, участвующих в контроле пролиферации и дифференцировки миелоидной ткани. Для миелоидных опухолей наиболее характерными являются реципрокные транслокации, при которых происходит обмен генетическим материалом между различными хромосомами с образованием патологических хромосомных структур, самой известной из которых является Филадельфийская хромосома. На молекулярном уровне в процессе такой транслокации образуется так называемый химерный ген, состоящий из активных участков (доменов) двух генов-участников перестройки и ведущий к экспрессии химерного белка, который способен, как правило, либо блокировать миелоидную дифференцировку, либо стимулировать бесконтрольную клеточную пролиферации за счет следующих событий: нарушение функционирования ядерных рецепторов (характерный пример – острый промиелоцитарный лейкоз); подавление транскрипции (считывания РНК с ДНК) за счет связывания ключевого белкового комплекса CBF (core binding factor), что характерно для острых лейкозов с транслокациями, вовлекающими 21 и 16 хромосомы (гены RUNX-1, бывший AML-1, и CBFB); подавление генов гомеобокса, или регуляторов клеточного развития (характерно для ОМЛ с транслокациями, в которых участвует ген MLL – mixed lineage leukemia-, расположенный на 11 хромосоме); бесконтрольная активация ферментов-тирозинкиназ (BCR-ABL позитивные миелоидные лейкозы, мутации гена FLT 3); Особо хотелось бы отметить важность мутаций генов, не вовлеченных в транслокации, но являющихся медиаторами процессов, описанных выше. К ним относятся частичная тандемная дупликация гена MLL в случае соматической мутации 11 q 23, внутренняя тандемная дупликация гена FLT 3, ведущая к активации киназного каскада за счет маскировки под нормальный киназный рецептор, мутации генов СЕВРА и RUNX 1 (AML 1), подавляющих транскрипцию за счет связывания комплекса CBF, мутации гена NPМ, приводящие к блоку образования белков в рибосомах.

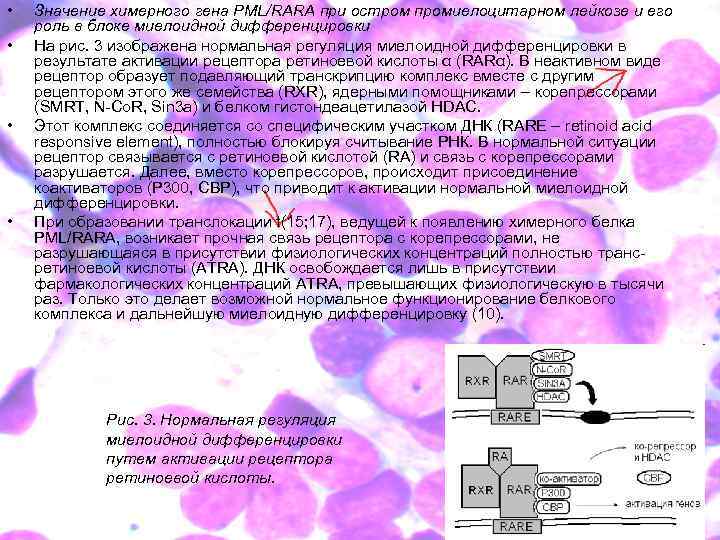
• • Значение химерного гена PML/RARA при остром промиелоцитарном лейкозе и его роль в блоке миелоидной дифференцировки На рис. 3 изображена нормальная регуляция миелоидной дифференцировки в результате активации рецептора ретиноевой кислоты α (RARα). В неактивном виде рецептор образует подавляющий транскрипцию комплекс вместе с другим рецептором этого же семейства (RXR), ядерными помощниками – корепрессорами (SMRT, N-Co. R, Sin 3 a) и белком гистондеацетилазой HDAC. Этот комплекс соединяется со специфическим участком ДНК (RARE – retinoid acid responsive element), полностью блокируя считывание РНК. В нормальной ситуации рецептор связывается с ретиноевой кислотой (RA) и связь с корепрессорами разрушается. Далее, вместо корепрессоров, происходит присоединение коактиваторов (P 300, CBP), что приводит к активации нормальной миелоидной дифференцировки. При образовании транслокации t(15; 17), ведущей к появлению химерного белка PML/RARA, возникает прочная связь рецептора с корепрессорами, не разрушающаяся в присутствии физиологических концентраций полностью трансретиноевой кислоты (ATRA). ДНК освобождается лишь в присутствии фармакологических концентраций ATRA, превышающих физиологическую в тысячи раз. Только это делает возможной нормальное функционирование белкового комплекса и дальнейшую миелоидную дифференцировку (10). Рис. 3. Нормальная регуляция миелоидной дифференцировки путем активации рецептора ретиноевой кислоты.
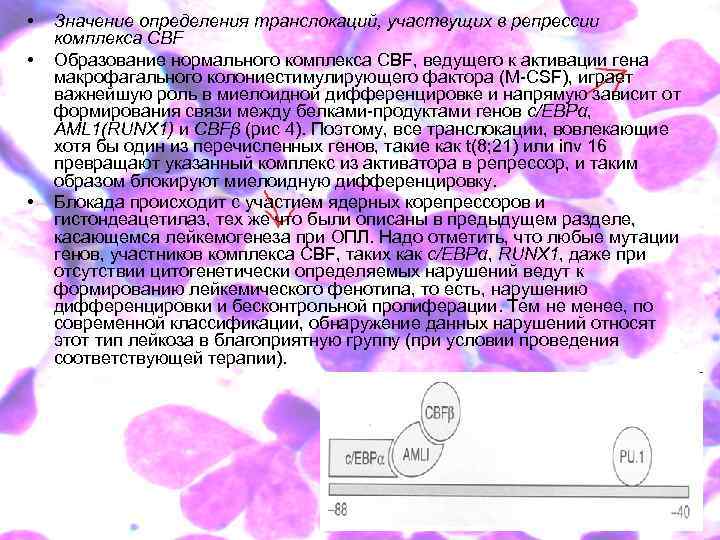
• • • Значение определения транслокаций, участвущих в репрессии комплекса CBF Образование нормального комплекса CBF, ведущего к активации гена макрофагального колониестимулирующего фактора (M-CSF), играет важнейшую роль в миелоидной дифференцировке и напрямую зависит от формирования связи между белками-продуктами генов c/EBPα, AML 1(RUNX 1) и CBFβ (рис 4). Поэтому, все транслокации, вовлекающие хотя бы один из перечисленных генов, такие как t(8; 21) или inv 16 превращают указанный комплекс из активатора в репрессор, и таким образом блокируют миелоидную дифференцировку. Блокада происходит с участием ядерных корепрессоров и гистондеацетилаз, тех же что были описаны в предыдущем разделе, касающемся лейкемогенеза при ОПЛ. Надо отметить, что любые мутации генов, участников комплекса CBF, таких как c/EBPα, RUNX 1, даже при отсутствии цитогенетически определяемых нарушений ведут к формированию лейкемического фенотипа, то есть, нарушению дифференцировки и бесконтрольной пролиферации. Тем не менее, по современной классификации, обнаружение данных нарушений относят этот тип лейкоза в благоприятную группу (при условии проведения соответствующей терапии).

Определение транслокаций, ведущих к активации тирозинкиназ и киназных рецепторов. Самой известной транслокацией, приводящей к аномальной активации киназного каскада и неконтролируемой клеточной пролиферации, является Филадельфийская хромосома или t(9; 22), ведущая к образованию химерного гена BCR/ABL (рис 5). В зависимости от локализации точки разрыва на 22 хромосоме образуется химерный онкоген различной длины (от 190 до 230 килодальтон). Продукт этого гена (тирозинкиназа) ведет к фосфорилированию огромного количества протеинов (RAS, PI-3, Grb 2, Crkl), участвующих в процессе сигнальной трансдукции – передаче сигнала с рецепторов клеточной мембраны ядерному генетическому материалу. Активация такого количества различных сигнальных путей ведет к независимой от ростовых факторов пролиферации, нарушению адгезии клеток к стромальному окружению и устойчивости к апоптозу – программированной клеточной гибели. При остром миелоидном лейкозе встречается как тип транслокации с точкой разрыва M-bcr, ведущий к образованию протеина размером 210 килодальтон (р210), так и m-bcr, с образованием протеина p 190. Рис. 5. Образование химерного гена BCR/ABL.

• • • Значение выявления транслокаций, ведущих к нарушению экспрессии генов гомеобокса К генам гомеобокса относят целый ряд генов, кодирующих транскрипционные факторы, которые принимают участие в регуляции эмбрионального развития. Эти гены имеют высоко гомологичную структуру у большинства эукариот, от самых низших до наиболее высоко организованных. Наиболее значимым геном-регулятором экспрессии генов гомеобокса у млекопитающих является ген MLL (mixed lineage leukemia). Партнерами этого гена являются гены-регуляторы транскрипции, поэтому любые мутации, вовлекающие MLL, ведут к подавлению транскрипции генов гомеобокса. Точный механизм лейкемогенеза в данном случае пока до конца не определен. MLL участвует в образовании более 25 различных транслокаций, которые (кроме t(4; 11)) обычно характерны для ОМЛ М 4/М 5. Наиболее известным и распространенным нарушением является соматическая мутация 11 q 23, приводящая к образованию частичной внутренней тандемной дупликации, в которой участвуют экзоны со 2 по 6 или со 2 по 8. Подобное нарушение определяется в случаях трисомии 11 хромосомы и в 11 -20% случаев ОМЛ без цитогенетических нарушений. Следует отметить, что любое нарушение структуры гена MLL однозначно определяет неблагоприятный вариант течения ОМЛ. Мутации гена NPM В норме продукт нуклеофозмина играет ключевую роль в образовании протеосом и, таким образом, опосредованно влияет на синтез белков в клетке. Ген NPM-1 участвует в ряде реципрокных транслокаций, характерных для анаплазированной Т-клеточной лимфомы t(2; 5), редко встречающихся форм МДС с транслокацией t(3; 5), и крайне редкого типа ОПЛ с t(5; 17). Для ОМЛ более характерны мутации NPM-1, наиболее частой из которых является дупликация тетрануклеотида TCTG в позиции 956 -959 в 5 экзоне (75 -80% случаев). Во всех случаях мутаций или транслокаций с участием NPM-1 происходит изменение нормального внутриядерного расположения белка на цитоплазматическое и нарушается его взаимодействие с генами – партнерами (ТР 53 и ARF), что инактивирует их как опухолевые супрессоры. Тем не менее, обнаружение мутаций NPM-1, как правило, ассоциируется с благоприятным течением ОМЛ (за исключением случаев ассоциации с мутациями гена FLT-3). В настоящее время продолжается активное изучение этого гена с целью уточнения его роли в лейкемогенезе и возможного использования его как маркера при исследовании минимальной остаточной болезни.


Острый миелоидный лейкоз: этиология • • • В возникновении острых миелоидных лейкозов играют роль наследственность, воздействие ионизирующих излучений , профессиональные вредности и некоторые лекарственные средства. Прямых доказательств вирусной этиологии острых миелоидных лейкозов нет. Наследственность. Некоторые хромосомные аномалии, в частности синдром Дауна ( трисомия по 21 -й хромосоме ), синдром Клайнфельтера (полисемия по Х-хромосоме у мужчин - кариотип 47, XXY и другие варианты) и синдром Патау ( трисомия по 13 -й хромосоме ), предрасполагают к развитию острых миелоидных лейкозов. Заболеваемость ими возрастает также при наследственных болезнях, сопровождающихся повышенной ломкостью хромосом , - анемии Фанкони , атаксиителеангиэктазии , синдроме Костмана и синдроме Блума. Ионизирующее излучение. Атомная бомбардировка в Японии во время Второй мировой войны вызвала увеличение заболеваемости миелоидными лейкозами. Пик заболеваемости отмечался через 5 -7 лет после взрыва. Лучевая терапия , повидимому, лишь в незначительной степени увеличивает риск острых лейкозов. В то же время при сочетании лучевой терапии с химиотерапией алкилирующими средствами риск острых лейкозов возрастает. Химические соединения. Воздействие бензола , который применяется в качестве растворителя при производстве пластмасс, резины и лекарственных средств, увеличивает заболеваемость острыми миелоидными лейкозами. Риск острых миелоидных лейкозов увеличивают также курение , работа с нефтепродуктами , красителями , этиленоксидом , гербицидами , пестицидами , формальдегидом и другими фиксирующими жидкостями, воздействие электромагнитного излучения. Лекарственные средства. Среди лекарственных средств развитие острых миелоидных лейкозов чаще всего вызывают цитостатики. После лечения алкилирующими средствами лейкозы развиваются в среднем через 48 -72 мес и характеризуются аберрациями 5 -й и 7 -й хромосом. Лейкозы, вызванные применением ингибиторов ДНКтопоизомеразы II , возникают через 1 -3 года после лечения и обычно сопровождаются повреждением длинного плеча 11 -й хромосомы (сегмент Hq 23). Сообщалось, что хлорамфеникол , фенилбутазон и, реже, хлорохин и метоксален вызывают аплазию костного мозга с исходом в острый миелоидный лейкоз.
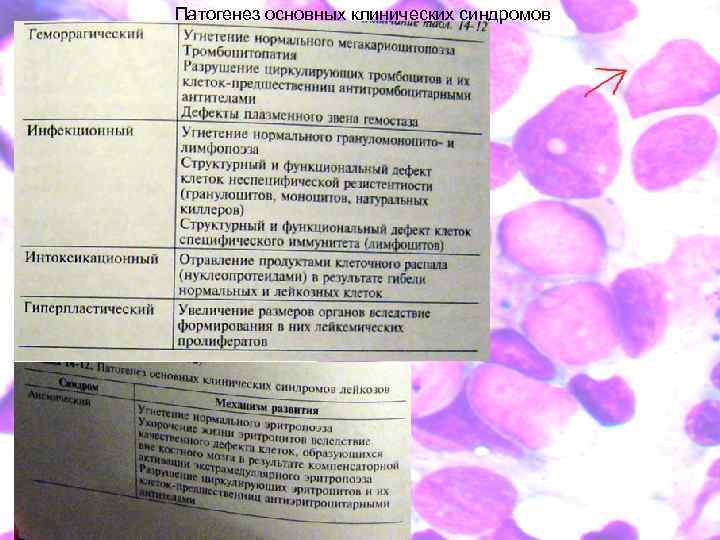
Патогенез основных клинических синдромов

Острый миелоидный лейкоз: жалобы • • Симптоматика острых миелоидных лейкозов не специфична, может развиваться быстро или постепенно. Клинические проявления чаще всего обусловлены анемией , гиперлейкоцитозом , лейкопенией или нарушениями фагоцитоза, тромбоцитопенией. Примерно у половины больных первые проявления заболевания отмечаются за 3 мес и больше до постановки диагноза. В половине случаев первым симптомом служит повышенная утомляемость. К моменту постановки диагноза на утомляемость и слабость жалуются большинство больных. Другие характерные жалобы - снижение аппетита и похудание. Примерно в 10% случаев первым симптомом является лихорадка (признаков инфекции при этом может не быть), примерно в 5% случаев - нарушения свертывания крови ( кровотечения , склонность к кровоподтекам ). Иногда причиной обращения к врачу служат боли в костях , увеличение лимфоузлов , кашель , головная боль , потливость. В редких случаях первые симптомы связаны с объемными образованиями в мягких тканях, молочных железах, матке, яичниках, твердой оболочке головного и спинного мозга, ЖКТ, легких, средостении, предстательной железе, костях или других органах. Они представляют собой локальные разрастания опухолевых клеток и носят название хлорома, или гранулоцитарная саркома. Лейкозное поражение костного мозга у таких больных развивается либо параллельно с хлоромой, либо с опозданием, либо вообще не развивается. Хлорома чаще встречается у больных с транслокацией t(8; 21).
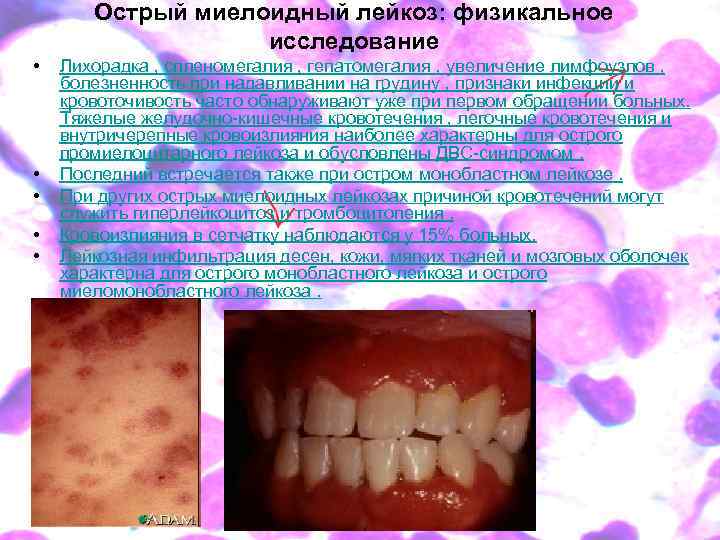
Острый миелоидный лейкоз: физикальное исследование • • • Лихорадка , спленомегалия , гепатомегалия , увеличение лимфоузлов , болезненность при надавливании на грудину , признаки инфекции и кровоточивость часто обнаруживают уже при первом обращении больных. Тяжелые желудочно-кишечные кровотечения , легочные кровотечения и внутричерепные кровоизлияния наиболее характерны для острого промиелоцитарного лейкоза и обусловлены ДВС-синдромом. Последний встречается также при остром монобластном лейкозе. При других острых миелоидных лейкозах причиной кровотечений могут служить гиперлейкоцитоз и тромбоцитопения. Кровоизлияния в сетчатку наблюдаются у 15% больных. Лейкозная инфильтрация десен, кожи, мягких тканей и мозговых оболочек характерна для острого монобластного лейкоза и острого миеломонобластного лейкоза.

Острый миелоидный лейкоз: анализ крови Острый миелобластный лейкоз характеризуется резкой пролиферацией миелоидного ростка кроветворения и почти полным отсутствием дифференцировки клеток этого ростка. В результате в периферическую кровь выбрасывается большое количество бластных элементов, которые присутствуют в крови вместе со зрелыми клетками миелоидного ростка кроветворения. Таким образом, при исследовании периферической крови у больных острым лейкозом выявляются следующие гематологические признаки: 1. увеличение числа лейкоцитов до 100 x 109 / л, хотя нередко встречаются и лейкопенические формы острого лейкоза; 2. появление в крови большого количества бластных клеток (миелобластов); 3. уменьшение числа зрелых клеток миелоидного ростка при отсутствии переходных форм (hiatus leucemicus); 4. анемия, чаще нормохромного (нормоцитарного) характера; 5. тромбоцитопения. Запомните При остром миелобластном лейкозе появляется характерный гематологический признак — лейкемическое зияние (hiatus leucemicus): в периферической крови присутствуют бластные формы и (в небольшом количестве) зрелые клетки и полностью отсутствуют переходные формы.

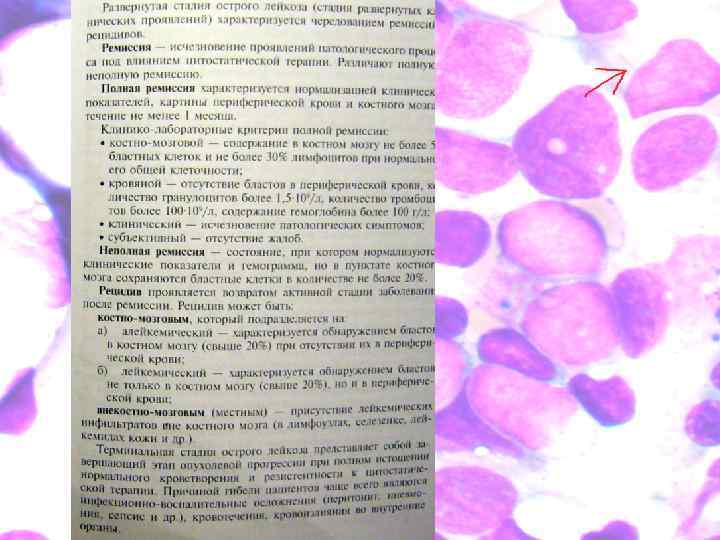
• • Острый миелоидный лейкоз: план обследования Больные острыми миелоидными лейкозами нуждаются в скорейшем начале лечения, поэтому необходимо как можно быстрее провести все исследования Помимо уточнения варианта лейкоза нужно оценить состояние сердечно-сосудистой и дыхательной систем, исследовать функцию печени и почек. Во всех случаях необходимо исключить инфекцию. Кроме того, перед началом лечения оценивают вероятность достижения полной ремиссии и ее ожидаемую продолжительность. Для последующего изучения опухолевых клеток обязательно прибегают к криоконсервации проб крови и костного мозга. В случае необходимости до начала химиотерапии переливают компоненты крови: эритроцитарную массу, свежезамороженную плазму, тромбоцитарную массу. Показанием к экстренному переливанию тромбоцитарной массы служит не тромбоцитопения, а наличие кровоточивости. Это обусловлено тем, что при острых миелоидных лейкозах риск кровотечения определяется не только уровнем тромбоцитов (он может быть лишь умеренно пониженным), но и нарушением их функции вследствие инфекции и ДВС-синдрома. Биохимические показатели функции печени изменены примерно у 20% больных, в связи с чем может потребоваться снижение доз цитостатиков , которые обезвреживаются и экскретируются печенью. Следует также помнить о гепатотоксическом действии некоторых цитостатиков, в частности антрациклинов и аналогов пуринов. Примерно у половины больных выявляют легкую или умеренную гиперурикемию (у 10% уровень мочевой кислоты поднят значительно). Химиотерапия может усилить гиперурикемию, что чревато развитием острой мочекислой нефропатии. Поэтому всем больным сразу же после постановки диагноза назначают аллопуринол и бикарбонат натрия. При остром монобластном лейкозе и остром миеломонобластном лейкозе дополнительным фактором, усугубляющим нарушение функции почек, является экскреция с мочой лизоцима (маркера клеток моноцитарного ряда).

Лечение • Лечебная тактика при остром миелолейкозе имеет сходство с лечением лимфоидного лейкоза, однако часто в процессе лечения развиваются осложнения. Среди самых частых осложнений выделяют геморрагии и инфекции. Необходимо активно заниматься профилактикой и лечением такого рода осложнений. Отличия касаются не только большим вниманием к осложнениям, но и отличной от лимфоидных лейкозов комбинации химиотерапевтических препаратов. В качестве базисного препарата на всех этапах лечения ОМЛ обычно используют цитарабин. Используются также винкристин, рубомицин, вепезид, доксорубицина гидрохлорид (Адриабластин, Адриамицин) , циклофосфан, 6 -тиогуанин, митоксантрон. При выявлении острой промиелоцитарной лейкемии (M 3), становится возможным перевести заболевание в полную ремиссию благодаря применению all-транс-ретиноевой кислоты, способствующей дифференцировке промиелоцитов. Данный вид миелолейкоза встречается примерно в 10% случаев всех ОМЛ. Результативность лечения зависит от использования оптимального сочетания данного препарата с химиотерапией.
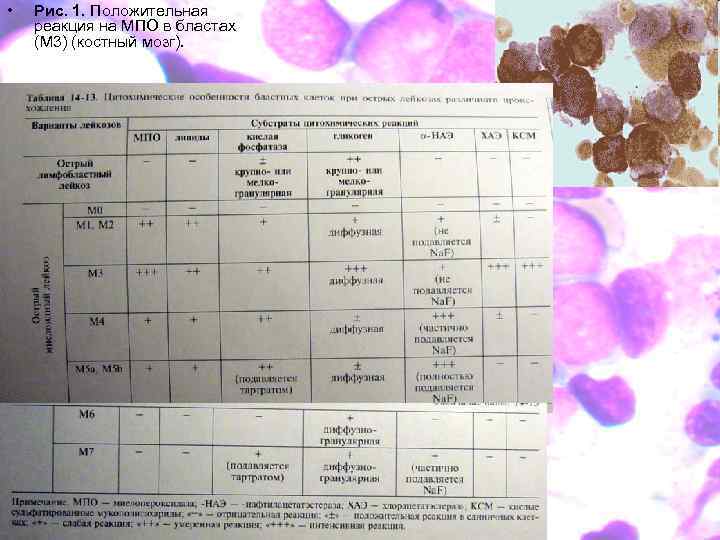
• Рис. 1. Положительная реакция на МПО в бластах (М 3) (костный мозг).

• Последнее исследование в области онкологии объединяет сложные междисциплинарные подходы в решении молекулярной загадки и может привести к альтернативным стратегиям лечения острого миелолейкоза (ОМЛ). Результаты исследования, опубликованные в октябрьском выпуске журнала Cancer Cell, указывают на ранее неизвестную молекулярную мишень в патогенезе данного заболевания, которую возможно эффективно поражать фармакологическими препаратами. ОМЛ – онкологическое заболевание крови, обусловленное нарушением процесса нормального кроветворения. «Продолжительность жизни больных острым миелолейкозом весьма невелика, несмотря на интенсивную химиотерапию. Особо тяжело переносят эту процедуру люди пожилого возраста» , – говорит ведущий исполнитель исследования доктор Кимберли Стегмэйер (Kimberly Stegmaier) из Dana-Farber Cancer Institute. Другая проблема заключалась в необходимости понять молекулярные механизмы ингибирования развития острого миелолейкоза и возвращения лейкозных клеток в нормальное состояние. Обнаружение терапевтических мишеней необходимо для усовершенствования лекарственной терапии. Доктор Стегмэйер и ее коллеги ранее показали, что ингибиторы рецептора эпидермального фактора роста (EGFR) обладают активностью против ОМЛ. Однако полученные результаты вызывали некоторое недоумение, поскольку EGFR не экспрессируется при ОМЛ. Ученые применили сложные междисциплинарные подходы при изучении экспрессии генов (этим занимается генетика) и структуры и функции белков (этим занимается протеомика) для объяснения молекулярных основ действия ингибиторов EGFR при остром миелолейкозе. В качестве мишени при ОМЛ в недавнем исследовании был избран фермент селезенки тирозин-киназа Syk. Эта тирозин-киназа экспрессируется в клетках крови и играет важную роль в кроветворении. Последнее исследование связало воедино биохимические пути, активируемые киназой Syk, и злокачественные новообразования крови, в частности, лимфомы и лейкемии. Генетическая и лекарственная инактивация Syk in vitro проявилась в гибели лейкозных клеток, полученных от пациентов, страдающих от ОМЛ, и от животных, у которых было смоделировано данное заболевание. В настоящее время ингибиторы Syk проходят клинические испытания. Полученные результаты указывают на Syk как на перспективную мишень при лечении острой миелоидной лейкемии. «Сейчас разрабатывается препарат ингибитора Syk для перорального применения с целью расширения спектра его использования. Наши результаты должны найти практическое применение в клинической практике лечения больных ОМЛ. Это исследование подтверждает плодотворность интеграции генетики и протеомики в целях идентификации небольших молекул и механизма их действия» , – говорит доктор Стегмэйер.
Острые лейкозы!.ppt