d7a6a9f3810ae42b34d1b8e8ef8c3dc3.ppt
- Количество слайдов: 160

Особенности подготовки к ЕГЭ по химии 2015 г. Задания повышенной сложности части 1
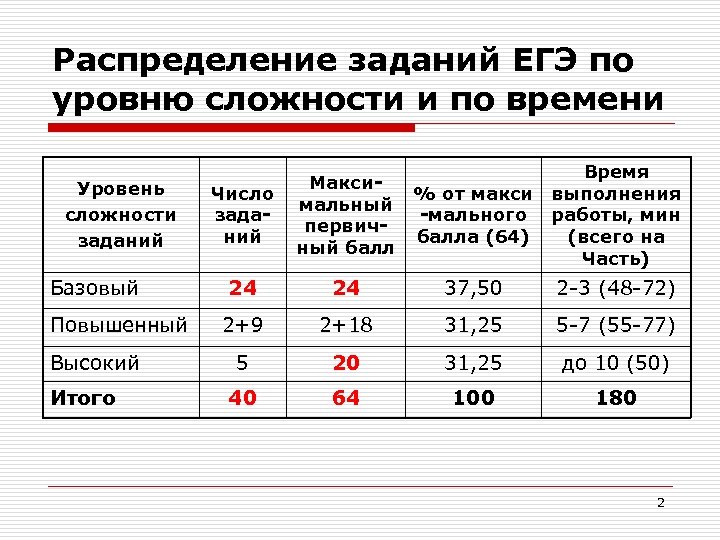
Распределение заданий ЕГЭ по уровню сложности и по времени Уровень сложности заданий Базовый Повышенный Высокий Итого Время % от макси выполнения -мального работы, мин балла (64) (всего на Часть) Число заданий Максимальный первичный балл 24 24 37, 50 2 -3 (48 -72) 2+9 2+18 31, 25 5 -7 (55 -77) 5 20 31, 25 до 10 (50) 40 64 100 180 2

Дополнительные материалы и оборудование В аудитории во время экзамена у каждого экзаменующегося должны быть следующие материалы и оборудование: 1. периодическая система химических элементов Д. И. Менделеева*; 2. таблица растворимости солей, кислот и оснований в воде*; 3. электрохимический ряд напряжения металлов; 4. непрограммируемый калькулятор. * Ч-б таблицы по учебнику Н. Е. Кузьменко, Еремин В. В. , Попков В. А. «Начала химии» 3

Система оценивания работ Части 1: задания 1 -26 Ответы на задания Части 1 (1 -26) автоматически обрабатываются после сканирования бланков ответов № 1. o Верное выполнение каждого задания Части 1 оценивается в 1 балл. o Задание считается выполненным верно, если учащийся указал код правильного ответа. o Задание считается выполненным неверно: 1. выбран другой ответ; 2. выбрано два ответа, среди которых может быть и правильный; 3. ответ на вопрос отсутствует. 4

Часть 1 5

Часть 1 Бланк ответов № 1 6

24 (А 26) Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей Умения и виды деятельности, проверяемые заданиями КИМ: o уметь проводить вычисления по химическим формулам и уравнениям. 7

24 (А 26) Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе Из раствора хлорида бария массой 50 г с массовой долей соли 3 % выпарили 6 г воды и добавили 1, 5 г соли. Массовая доля соли в полученном растворе равна а) 6, 6 % б) 6, 5 % в) 6, 8 % г) 3, 3 % m(Ba. Cl 2) = m(р-ра). ω = 50 г. 0, 03 = 1, 5 г m(в-ва) = 1, 5 г + 1, 5 г = 3, 0 г m(р-ра) = 50 г – 6 г + 1, 5 г = 45, 5 г ω (Ba. Cl 2) = m(в-ва) m(р-ра) · 100 % = = (3, 0 г / 45, 5 г)· 100 % = = 6, 5934… % = 6, 6 % 32, 4– 60, 1 % 37, 3 % 56, 2 % (56, 6 %, 60, 2 %, 82, 3 %) 8

24 (А 26) Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе Из раствора хлорида бария массой 50 г с массовой долей соли 3 % выпарили 6 г воды и добавили 1, 5 г соли. Массовая доля соли в полученном растворе равна а) 6, 6 % б) 6, 5 % в) 6, 8 % г) 3, 3 % m(1 р-ра). ω1 + m(2 р-ра). ω2 = (m(1 р-ра) + m(2 р-ра)). ω3 . 0, 03 – 6. 0 50 m 1. ω1 – m 2. ω2 + 1, 5. 1, 0 = (m 1 – 6 + + m 3 ). ω4 + m 3. ω3 (50 – m 2 1, 5). ω4 ω (Ba. Cl 2) = 0, 065934…. 100 % = 6, 6 % 9

24 (А 26) Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10 % для получения раствора с массовой долей 12 %, равна 1) 0, 3 г 2) 2, 0 г 3) 3, 0 г 4) 3, 4 г . m 1. ω (m 1 150. 0, 11 + m 2. . 1, 0 = (150 + m 2). 0, 12 m 2 ω2 = 2 ) ω3 15 + m 2 = 18 + 0, 12 m 2 – 0, 12 m 2 = 18 – 15 0, 88 m 2 = 3 m (KNO 3) = 3, 40909… = 3, 4 г 10

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции Умения и виды деятельности, проверяемые заданиями КИМ: o уметь проводить вычисления по химическим формулам и уравнениям. 11

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции Закон А. Авогадро (1811 г. ): в равных объемах газов при заданных температуре и давлении содержит одинаковое число молекул. Объемы газов прямо пропорциональны их количествам V 1/V 2 = n 1/n 2 o В газовых реакциях объемы реагирующих веществ относятся как соответствующие коэффициенты в уравнении реакции. o Тепловой эффект прямо пропорционален количеству вещества. 12

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции С 2 Н 2 + 5/2 О 2 = 2 СО 2 + Н 2 О 1 моль 2, 5 моль – по уравнению 16 л x л 13

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции n = m/M = 80/32 = 2, 5 моль S + О 2 = SО 2 + 296 к. Дж 1 моль 2, 5 моль 296 к. Дж – по уравнению x к. Дж 14

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции n = V/VM = 112/22, 4 = 5 моль 2 KCl. O 3 = 2 KCl + 3 О 2 + 78 к. Дж 3 моль 78 к. Дж 5 моль x к. Дж 15

25 (А 27) Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции m = n·M = 2· 16 = 32 г CH 4 + 2 О 2 = CО 2 + 2 H 2 O + 896 к. Дж 1 моль x моль 896 к. Дж 1792 к. Дж 16

26 (А 28) Расчеты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ Умения и виды деятельности, проверяемые заданиями КИМ: o уметь проводить вычисления по химическим формулам и уравнениям. 17

26 (А 28) Расчеты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ Цинк массой 14, 5 г растворили в избытке водного раствора гидроксида натрия. Объём (н. у. ) газа, выделившегося в результате этой реакции равен 1) 4, 48 л 2) 5 л 3) 2, 5 л 4) 4 л Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2↑ 1 моль 0, 223 моль 1 моль – по теории 0, 223 моль – на практике n = m/M = 14, 5 г / 65 г/моль = 0, 223 моль 5 л V = n · Vm = 0, 223 моль · 22, 4 л/моль = 4, 9952 л 18

26 (А 28) Расчеты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ Сульфид железа (II) массой 66, 8 г обработали избытком водного раствора хлороводородной кислоты. Объем (н. у. ) газа, выделившегося в результате этой реакции равен 1) 17, 9 л 2) 15, 7 л 3) 17 л 4) 25, 8 л Fe. S + 2 HCl = Fe. Cl 2 + H 2 S↑ 1 моль – по теории 0, 759 моль – на практике n = m/M = 66, 8 г / 88, 0 г/моль = 0, 759 моль 17 л V = n · Vm = 0, 759 моль · 22, 4 л/моль = 17, 0018 л 19

Система оценивания работ Части 1: задания 27 -35 o Задание Части 1 (27 -35) считается выполненным верно, если правильно указана последовательность цифр. o За полный правильный ответ на задания В 1–В 9 ставится 2 балла, допущена одна ошибка – 1 балл, за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов. 20

Часть 1 21
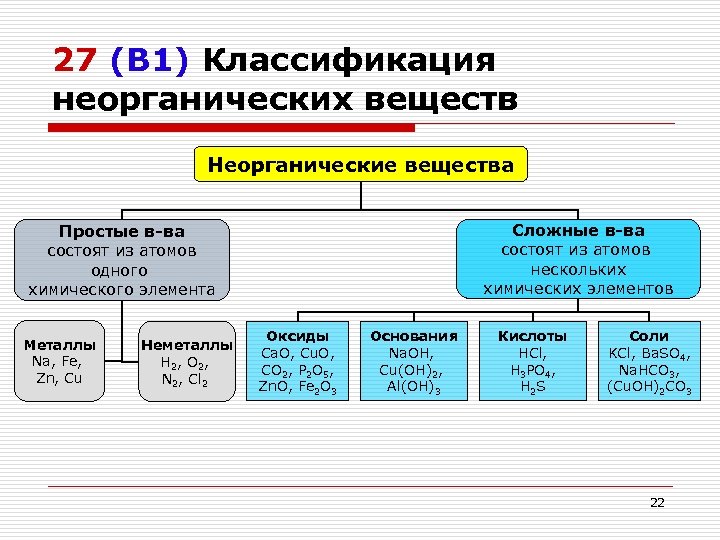
27 (В 1) Классификация неорганических веществ Неорганические вещества Сложные в-ва состоят из атомов нескольких химических элементов Простые в-ва состоят из атомов одного химического элемента Металлы Na, Fe, Zn, Cu Неметаллы H 2, O 2, N 2, Cl 2 Оксиды Ca. O, Cu. O, CO 2, P 2 O 5, Zn. O, Fe 2 O 3 Основания Na. OH, Cu(OH)2, Al(OH)3 Кислоты HCl, H 3 PO 4, H 2 S Соли KCl, Ba. SO 4, Na. HCO 3, (Cu. OH)2 CO 3 22

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений Тривиальная номенклатура некоторых неорганических веществ: Бертолетова соль (хлорат калия) – KCl. O 3 Веселящий газ (закись азота) – N 2 O Генераторный газ – N 2 + CO Гипс (алебастр) – Ca. SO 4. 2 H 2 O Глёт свинцовый - Pb. O Железная окалина – Fe 3 O 4 (Fe. O·Fe 2 O 3) Жидкое стекло (конторский клей) – Na 2 Si. O 3 Известь негашеная (кипелка) – Ca. O Известь гашеная (пушенка, известковое молоко) – Ca(OH)2 Каменная (поваренная) соль – Na. Cl Купорос медный (синий) – Cu. SO 4. 5 H 2 O Купоросное масло – H 2 SO 4 Магнезия жженая - Mg. O Мел (мрамор, известняк) – Ca. СO 3 Нашатырный спирт – NH 4 OH Нашатырь – NH 4 Cl Олеум - H 2 SO 4·n. SO 3 Плавиковая кислота – HF Поташ – K 2 CO 3 Селитра аммиачная – NH 4 NO 3 Синтез-газ (водяной газ) – H 2 + CO Сода кальцинированная – Na 2 CO 3 Сода каустическая – Na. OH Сода пищевая (питьевая, двууглекислая) – Na. HCO 3 Сурик свинцовый – Pb 3 O 4 (Pb 2 Pb. O 4) Сухой лед – CO 2 (твердый) Угарный газ – CO Углекислый газ – CO 2 23

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений Органические соединения Углеводороды Кислородсодержащие Азотсодержащие Алканы Cn. H 2 n+2 Алкены Cn. H 2 n Одноатомные спирты* Cn. H 2 n+1 OH Альдегиды* Cn. H 2 n+1 CHО Амины* (Cn. H 2 n+1)x. NH(3 -x) Анилин C 6 H 5 NH 2 Алкины Cn. H 2 n-2 Алкадиены Cn. H 2 n-2 Монокарбоновые кислоты* Cn. H 2 n+1 COOH Сложные эфиры* Cn. H 2 n+1 COOCn. H 2 n+1 Аминокислоты (NH 2)Cn. H 2 n. COOH Белки Циклоалканы Cn. H 2 n Арены Cn. H 2 n-6 Углеводы Cn(H 2 O)m Фенол C 6 H 5 OH Многоатомные спирты Жиры *Предельные (насыщенные) соединения 24

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений Тривиальная номенклатура некоторых органических веществ: Аланин (2 -аминопропановая кислота) – СH 3 СH(NH 2)COOH Аллилхлорид (2 -хлорпропен-1) – СН 2=СH–СН 2–Cl Амиловый спирт (пентанол– 1) – СH 3 СH 2 СH 2 CH 2 OH Ацетилен (этин) – СН≡СН Ацетон (пропанон, диметилкетон) – CH 3 C(O)CH 3 Валериановая кислота (пентановая кислота) – СH 3 СH 2 СH 2 COOH Винилхлорид (хлорэтен) – СН 2=СHCl Винный спирт (этанол) – СH 3 CH 2 OH Глицерин (пропантриол-1, 2, 3) – НОCH 2 CН(OН)CH 2 ОН Глицин (аминоуксусная кислота) – NH 2 СH 2 COOH Дивинил (бутадиен-1, 3) – СН 2=СH–СН=СH 2 Древесный спирт (метанол) – СH 3 OH Изопрен (2 -метилбутадиен-1, 3) – СН 2=С(СН 3)–СН=СH 2 Капроновая кислота (гексановая кислота) – СH 3 СH 2 СH 2 COOH Карболовая кислота (фенол) – С 6 Н 5 ОН Кумол (изопропилбензол) – С 6 Н 5 СН(СН 3)2 Масляная кислота (бутановая кислота) – СH 3 СH 2 COOH Муравьиная кислота (метановая кислота) – HCOOH Пальмитиновая кислота (гексадекановая кислота) – СH 3(СH 2)14 COOH 25

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений Тривиальная номенклатура некоторых органических веществ: Пропионовая кислота (пропановая кислота) – СH 3 СH 2 COOH Стеариновая кислота (октадекановая кислота) – СH 3(СH 2)16 COOH Стирол (винилбензол) – С 6 H 5–СН=СH 2 Уксусная кислота (этановая кислота) – СH 3 COOH Формалин (40 %-ный водный раствор формальдегида) – H 2 CO Хлоропрен (2 -хлорбутадиен-1, 3) – СН 2=С(Сl)–СН=СH 2 Хлороформ (трихлорметан) – СНСl 3 Этилен (этен) – СН 2=СН 2 Этиленгликоль (этандиол-1, 2) – НОCH 2 ОН 26

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений 7, 14– 69, 23 % – диапазон выполнения во 2 -й волне 3 1 2 5 36, 36– 66, 67 % – диапазон выполнения задания В 1 36, 36 % – полностью справились с данным примером (374 в. ) 27 54, 75 % (81, 94 %, 53, 4 % – процент выполнения в 2013 -2012 гг. )

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений 3 4 2 3 28

27 (В 1) Классификация неорганических веществ. Классификация и номенклатура органических соединений 3 1 2 5 29

28 (В 2) Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее Окислительно-восстановительными называют реакции, в результате которых происходит изменение степени окисления элементов. Восстановитель – атом или ион, отдающий электрон. Окислитель – атом или ион, принимающий электрон. 30

28 (В 2) Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее 3 5 5 2 54, 7– 87, 7 % 37, 5 % 26, 0 % (39, 5 %, 39, 6 %, 41, 6 %) 31

28 (В 2) Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее +7 – 2 – 1 0 +5 – 1 +7 +5 – 2 – 1 0 +1 – 1 +5 2 6 2 5 39, 5 (39, 6 %, 41, 6 %, 34, 2 %) 50, 1– 72, 7 % 49, 8 % 32

28 (В 2) Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее +1 0 0 +1 – 2 +1 0 – 2 0 – 3 +1 2 4 2 1 33

29 (В 3) Электролиз расплавов и растворов (солей, щелочей, кислот) 34 Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H 2 Cu Hg Ag Pt Au

29 (В 3) Электролиз расплавов и растворов (солей, щелочей, кислот) 3 3 5 3 38, 5– 64, 3 % 31, 1 % 46, 9 % (46, 7 %, 50, 7 %, 46, 8 %) 35

29 (В 3) Электролиз расплавов и растворов (солей, щелочей, кислот) 2 1 1 2 36

29 (В 3) Электролиз расплавов и растворов (солей, щелочей, кислот) 3 2 1 1 37

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная o Сильные основания (щелочи): Li. OH, Na. OH, KOH, Rb. OH, Cs. OH, Ca(OH)2, Sr(OH)2, Ba(OH)2. o Сильные кислоты: HCl, HBr, HI, HNO 3, H 2 SO 4, H 2 Cr. O 4, HMn. O 4, HCl. O 4 38

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная 1. Гидролиз солей осуществляется по слабому компоненту (например, по катиону: NH 4+, Cu 2+, Cr 3+, Al 3+, Fe 3+ и др. или аниону: CO 32–, Si. O 32–, Cl. O–, CN–, CH 3 COO– и др. ); 2. Среда водных растворов определяется по сильному компоненту (у кого больше Кдис) например, по катиону: Li+, Na+, K+, Rb+, Ca 2+, Sr 2+, Ba 2+ – щелочная среда; или аниону: l–, Br–, Cl–, NO 3–, Cl. O 4–, SO 42– – кислая среда. 39

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная 4 3 1 2 9, 8– 50, 98 % 9, 8 % (370 в. ) 47, 46 % (65, 7 %, 45, 5 %) 55, 56– 66, 67 % 40

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная 1 3 1 2 41

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная 1 3 2 4 42

30 (В 4) Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная 2 3 1 1 43

31 (В 5) Характерные химические свойства неорганических веществ - - простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа); простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; оксидов: оснóвных, амфотерных, кислотных; оснований и амфотерных гидроксидов; кислот; солей: средних, кислых и основных); комплексных (на примере соединений алюминия и цинка). 44

31 (В 5) Характерные химические свойства неорганических веществ Порядок рассмотрения вопроса по формуле вещества и реагентам: 1. Классифицировать неорганическое вещество в определенной степени окисления основного элемента; 2. Отметить его характерные свойства; 3. Отметить его специфические свойства (ОВР). 4. Пересекающие свойства удовлетворяют требованиям задания – реакция возможна. 45
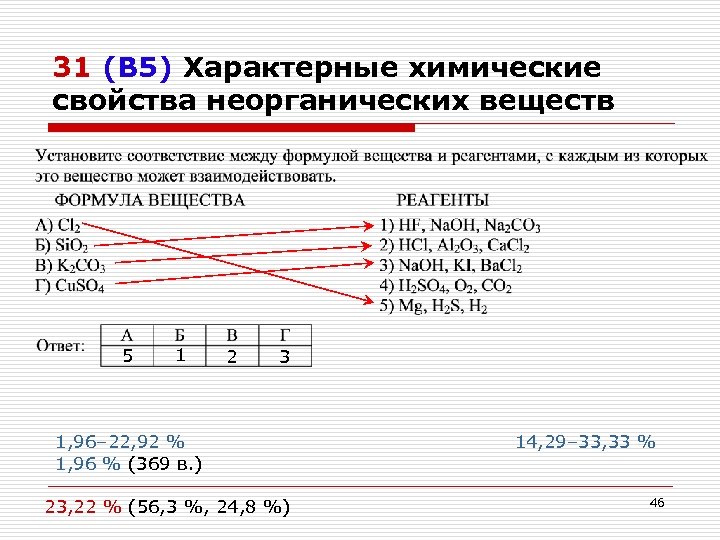
31 (В 5) Характерные химические свойства неорганических веществ 5 1 2 3 1, 96– 22, 92 % 1, 96 % (369 в. ) 23, 22 % (56, 3 %, 24, 8 %) 14, 29– 33, 33 % 46

31 (В 5) Характерные химические свойства неорганических веществ неметалл, вос-ль с более Э. О. неметаллами, ок-ль с менее Э. О. элементами, спецефич. ОВР со щелочами и кислотами-окислителями амф. оксид щелочь осн. оксид неметалл, вос-ль с более Э. О. неметаллами и оксидами металлов, водой, ок-ль с менее Э. О. элементами (металлами, водородом), спецефич. силь. ок-ль, к-та вос-ль силь. ок-ль ОВР с кислотами-окислителями осн. оксид в низшей ст. ок. , вос-ль с сильными ок-лями, ок-ль с восстановителями сл. ок-ль вос-ль ок-ль кисл. оксид в высшей ст. ок. , ок-ль с восстановителями силь. ок-ль кисл. оксид, сл. ок-ль осн. оксид к-та, вос-ль инерт. мет. сильн. вос-ль 2 4 2 1 47

31 (В 5) Характерные химические свойства неорганических веществ соль сильн. осн-я и сильн. к-ты, р-ции ионного обмена неметалл, сильн. ок-ль, спецефич. ОВР со щелочами осн. оксид сильн. ок-ль сл. ок-ль щелочь сильн. ок-ль, к-та сл. ок-ль и вос-ль осн. оксид амф. оксид ср. вос-ль вос-ль, сл. ок-ль кисл. оксид сл. к-та амф. оксид, сл. ок-ль раств. соль сл. к-ты сильн. ок-ль и к-та раств. соль. сл. осн-я 5 3 4 2 48

32 (В 6) Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений Умения и виды деятельности, проверяемые заданиями КИМ: o планировать/проводить эксперимент по получению и распознаванию важнейших неорганических и органических соединений, с учетом приобретенных знаний о правилах безопасной работы с веществами в лаборатории и в быту; o определять характер среды водных растворов веществ. 49
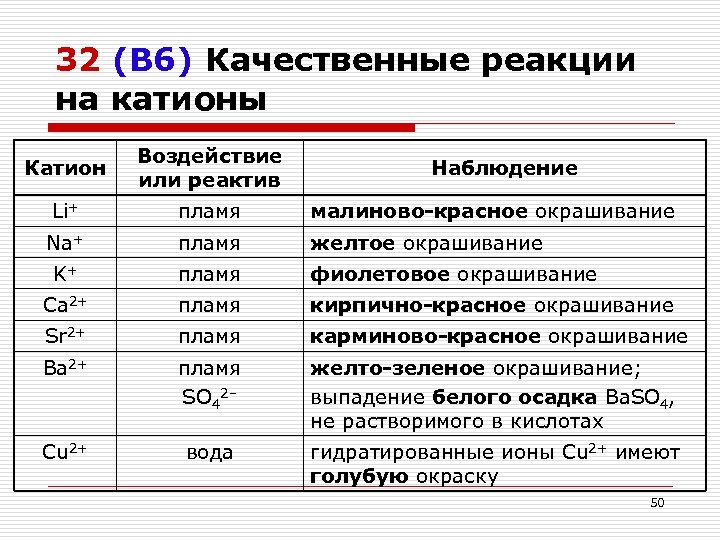
32 (В 6) Качественные реакции на катионы Катион Воздействие или реактив Li+ пламя малиново-красное окрашивание Na+ пламя желтое окрашивание K+ пламя фиолетовое окрашивание Ca 2+ пламя кирпично-красное окрашивание Sr 2+ пламя карминово-красное окрашивание Ba 2+ пламя SO 42– желто-зеленое окрашивание; выпадение белого осадка Ba. SO 4, не растворимого в кислотах Cu 2+ вода гидратированные ионы Cu 2+ имеют голубую окраску Наблюдение 50
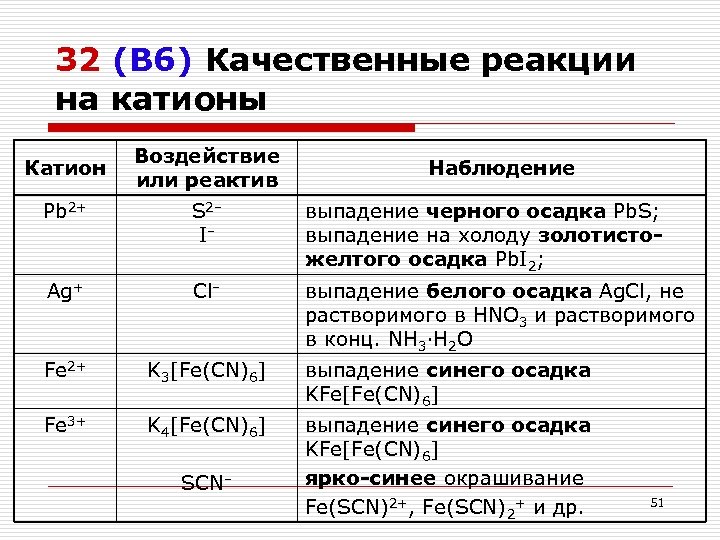
32 (В 6) Качественные реакции на катионы Катион Воздействие или реактив Наблюдение Pb 2+ S 2– I– выпадение черного осадка Pb. S; выпадение на холоду золотистожелтого осадка Pb. I 2; Ag+ Cl– выпадение белого осадка Ag. Cl, не растворимого в HNO 3 и растворимого в конц. NH 3·H 2 O Fe 2+ K 3[Fe(CN)6] выпадение синего осадка KFe[Fe(CN)6] Fe 3+ K 4[Fe(CN)6] выпадение синего осадка KFe[Fe(CN)6] ярко-синее окрашивание Fe(SCN)2+, Fe(SCN)2+ и др. SCN– 51
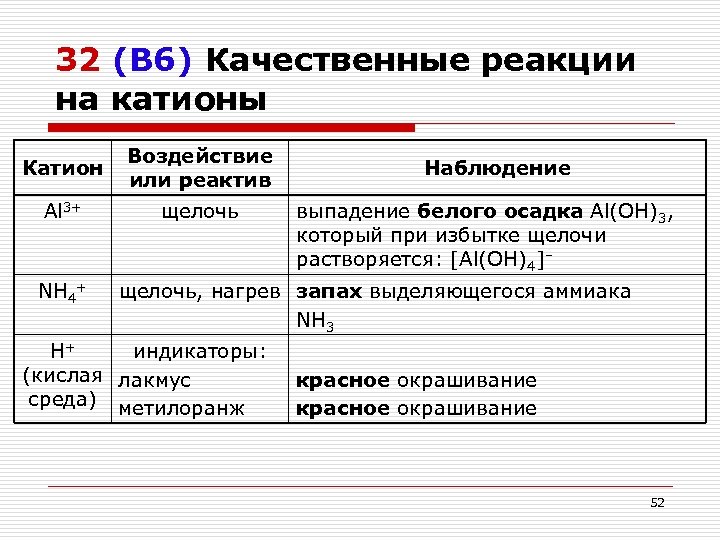
32 (В 6) Качественные реакции на катионы Катион Воздействие или реактив Al 3+ щелочь NH 4+ Наблюдение выпадение белого осадка Al(OH)3, который при избытке щелочи растворяется: [Al(OH)4]– щелочь, нагрев запах выделяющегося аммиака NH 3 H+ индикаторы: (кислая лакмус среда) метилоранж красное окрашивание 52
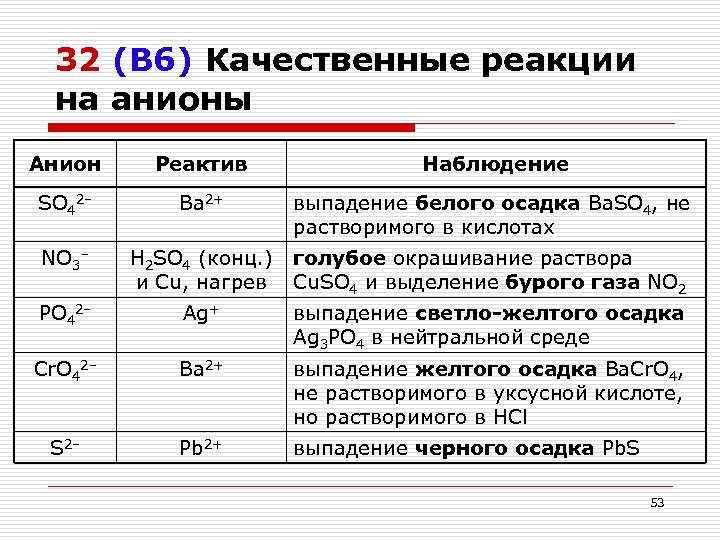
32 (В 6) Качественные реакции на анионы Анион Реактив Наблюдение SO 42– Ba 2+ выпадение белого осадка Ba. SO 4, не растворимого в кислотах NO 3– H 2 SO 4 (конц. ) голубое окрашивание раствора и Cu, нагрев Cu. SO 4 и выделение бурого газа NO 2 PO 42– Ag+ выпадение светло-желтого осадка Ag 3 PO 4 в нейтральной среде Cr. O 42– Ba 2+ выпадение желтого осадка Ba. Cr. O 4, не растворимого в уксусной кислоте, но растворимого в HCl S 2– Pb 2+ выпадение черного осадка Pb. S 53

32 (В 6) Качественные реакции на анионы Анион, в-во Реактив CO 32– Ca 2+ выпадение белого осадка Ca. CO 3, растворимого в кислотах CO 2 Ca(ОН)2 выпадение белого осадка Ca. CO 3, растворимого при избытке углекислого газа Ca(HCO 3)2 SO 32– H+ F– Ca 2+ выпадение белого осадка Ca. F 2 Cl– Ag+ выпадение белого творожестого осадка Ag. Cl, не растворимого в HNO 3 и растворимого в конц. NH 3·H 2 O Наблюдение появление характерного запаха SO 2 54
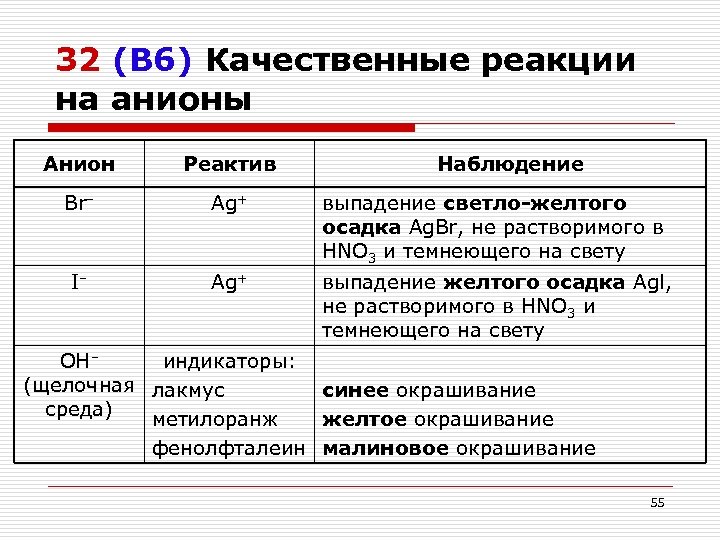
32 (В 6) Качественные реакции на анионы Анион Реактив Наблюдение Br– Ag+ выпадение светло-желтого осадка Ag. Br, не растворимого в HNO 3 и темнеющего на свету I– Ag+ выпадение желтого осадка Agl, не растворимого в HNO 3 и темнеющего на свету OH– индикаторы: (щелочная лакмус синее окрашивание среда) метилоранж желтое окрашивание фенолфталеин малиновое окрашивание 55

32 (В 6) Идентификация органических соединений Класс соединений Реактив Алканы пламя Алкены Br 2 (вода) KMn. O 4, H 2 O Наблюдение низшие алканы горят голубоватым пламенем пламя обесцвечивание раствора; обесцвечивание раствора и выпадение бурого осадка Mn. O 2; горят желтоватым пламенем Бензол пламя горит коптящим пламенем Фенол Br 2 (вода) обесцвечивание раствора и выпадение белого осадка 2, 4, 6 трибромфенола, в избытке брома переходящий в желтый осадок; темно-фиолетовое окрашивание; Fe. Cl 3 (р-р) 56 Na 2 CO 3 (р-р) выделение углекислого газа

32 (В 6) Идентификация органических соединений Класс соединений Спирты Многоатомные спирты Реактив Наблюдение Na горение выделение водорода; горят светлым голубоватым пламенем; Cu. O восстановление красной (прокаленная окраски меди Cu- проволока) Cu(OH)2 ярко-синее окрашивание (свежеосажраствора денный), Na. OH 57
![32 (В 6) Идентификация органических соединений Класс соединений Альдегиды Реактив Наблюдение Ag[(NH 3)2]OH, образование 32 (В 6) Идентификация органических соединений Класс соединений Альдегиды Реактив Наблюдение Ag[(NH 3)2]OH, образование](https://present5.com/presentation/d7a6a9f3810ae42b34d1b8e8ef8c3dc3/image-58.jpg)
32 (В 6) Идентификация органических соединений Класс соединений Альдегиды Реактив Наблюдение Ag[(NH 3)2]OH, образование серебряного нагрев налета или темно-серого осадка Ag; Cu(OH)2, выпадение красного осадка нагрев Cu 2 O Карбоновые индикаторы: кислоты лакмус метилоранж Na 2 CO 3 (р-р) красное окрашивание; выделение углекислого газа 58

32 (В 6) Идентификация органических соединений Класс соединений Глюкоза (углевод) Крахмал (углевод) Реактив Наблюдение Ag[(NH 3)2]OH, образование серебряного нагрев налета или темно-серого осадка Ag; Cu(OH)2, ярко-синий раствор, при нагревании выпадение красного осадка Cu 2 O I 2 (р-р в KI или синее окрашивание спиртовой р-р) 59

32 (В 6) Идентификация органических соединений Класс соединений Реактив Наблюдение Амины лакмус HHal синее окрашивание; образование солей, после упаривания образуется твердый белый осадок Анилин Br 2 (вода) обесцвечивание раствора и выпадение белого осадка 2, 4, 6 -триброманилина; образование солей, после упаривания образуется твердый белый осадок HHal или H 2 SO 4 60

32 (В 6) Идентификация органических соединений Класс соединений Белки Реактив Наблюдение HNO 3 (конц. ) желтый осадок, при добавлении аммиака – оранжевый; Na. OH, Cu. SO 4 красно-фиолетовое окрашивание 61

32 (В 6) Качественные реакции на неорганические вещества и ионы 4 3 3, 77– 25, 0 % 3, 77 % (373 в. ) 27, 12 % 3 3 0– 17, 86 % 62

32 (В 6) Качественные реакции на неорганические вещества и ионы 5 5 5 2 63

Часть 1 64

33 (В 7) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В. В. Марковникова) и радикальный механизмы реакций в органической химии 1. Характерные химические реакции алканов: o замещения (радикальный механизм – образование новой σ-связи); o дегидрирование; o окисления (горение). 2. Характерные химические реакции циклоалканов: o присоединения (циклопропан и циклобутан); o замещения (циклопентан, циклогексан); o окисления (горение). 65

33 (В 7) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В. В. Марковникова) и радикальный механизмы реакций в органической химии 3. Характерные химические реакции алкенов, диенов и алкинов: o присоединения (ионный механизм – разрыв π-связи); o полимеризация; o восстановления; o окисления (горение). 4. Характерные химические реакции аренов (бензола и толуола): o замещения (электрофильное по кольцу; радикальное в боковой цепи толуола); o окисления (горение); o окисления боковой цепи толуола; o восстановления. 66

33 (В 7) Радикальный механизм реакций в органической химии 1 стадия: Инициирование – образование свободных радикалов галогенов (атомов хлора или брома). o o Молекула хлора (брома) поглощает ультрафиолетовое излучение. Происходит гомолитический разрыв связи, в результате чего образуются два свободных радикала хлора (брома). Так как эта реакция протекает под воздействием света, она является фотохимической реакцией. 67

33 (В 7) Радикальный механизм реакций в органической химии 2 -я стадия: Рост цепи радикалов – взаимодействие между свободным радикалом и молекулой алкана, в результате которого образуется свободный углеводородный радикал. и т. д. o o o Поскольку последовательно протекающие реакции, в которых каждая предыдущая инициирует последующую, подобные реакции называются цепными. Существует много реакций, обеспечивающих продолжение цепи, что приводит к смеси продуктов. Устойчивость свободных радикалов увеличивается в ряду: . . . CH 3 CH 2 < (CH 3)2 CH < (CH 3)3 C первичный вторичный третичный 68

33 (В 7) Радикальный механизм реакций в органической химии 3 -я стадия: Обрыв цепи радикалов – взаимодействие между двумя свободными радикалами (рекомбинация радикалов) в результате которой образуются молекулы. o Могут встречаться любые два свободных радикала, поэтому в таких реакциях всегда образуется смесь продуктов. 69

33 (В 7) Ионный механизм реакций в органической химии (правило В. В. Марковникова) o o Присоединение воды (в присутствии кислоты) и галогеноводородов к несимметричным алкенам протекает по известной закономерности – правило В. В. Марковникова (1869): водород присоединяется к наиболее гидрогенизированному атому углерода (с большим числом атомов водорода), а галоген (или ОН) к наименее гидрогенизированному атому углерода. Все галогеноводороды (НХ, где Х = F, Cl, Br и I) присоединяются к двойной связи. Относительная легкость их присоединения увеличивается в таком же ряду, как и их кислотные свойства: HI > HBr > HCl > HF 70

33 (В 7) Ионный механизм реакций в органической химии (правило В. В. Марковникова) 1 -я стадия: Образование -комплекса – взаимная координация молекул алкена и галогеноводорода (источника протона водорода). 71

33 (В 7) Ионный механизм реакций в органической химии (правило В. В. Марковникова) 2 -я стадия: Образование интермедиата – взаимодействие алкена и протона водорода с образованием карбокатиона (промежуточной частицы – интермедиата). o o Первоначальное протонирование происходит по наименее замещенному атому углерода. Устойчивость карбокатионов увеличивается в ряду: + + + CH 3 CH 2 < (CH 3)2 CH < (CH 3)3 C первичный вторичный третичный 72
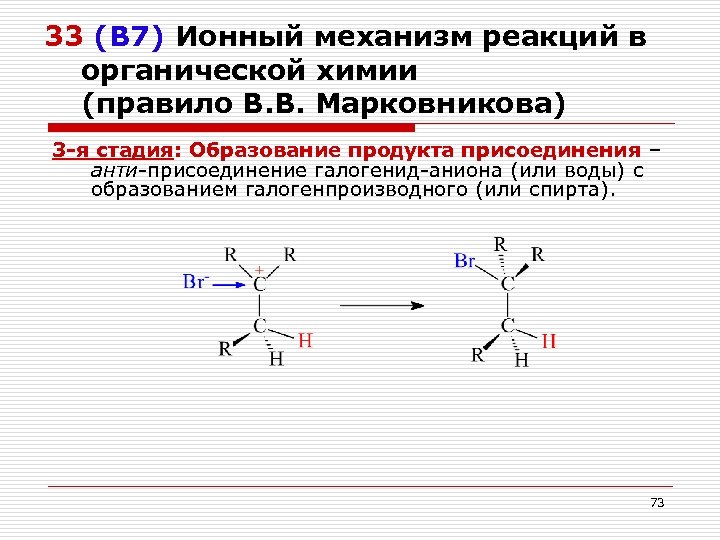
33 (В 7) Ионный механизм реакций в органической химии (правило В. В. Марковникова) 3 -я стадия: Образование продукта присоединения – анти-присоединение галогенид-аниона (или воды) с образованием галогенпроизводного (или спирта). 73

33 (В 7) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В. В. Марковникова) и радикальный механизмы реакций в органической химии 2 3 6 36, 9– 57, 6 % 15, 5 % 54, 4 % (32, 1 %, 51, 8 %, 63, 3 %) 74

33 (В 7) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В. В. Марковникова) и радикальный механизмы реакций в органической химии 2 5 6 75

33 (В 7) Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В. В. Марковникова) и радикальный механизмы реакций в органической химии 1 3 4 76

34 (В 8) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров 1. o o o 2. o 3. o o Характерные химические реакции предельных одноатомных спиртов: замещения; этерификации; слабые кислотные свойства; дегидратация; окисления и восстановления. Характерные химические реакции многоатомных спиртов: кислотные свойства (комплекс с Cu(OH)2 – качественная реакция). Характерные химические реакции фенола: кислотные свойства; замещения в кольце (в т. ч. с Br 2 (aq) – качественная реакция); комплексные соединения с Fe. Cl 3 – качественная реакция; окисления. 77

34 (В 8) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров 4. Характерные химические реакции альдегидов: o присоединения (присоединение-отщепление); o окисления (с Ag 2 O (NH 3), Cu(OH)2 – качественные реакции); o восстановления. 5. Характерные химические реакции предельных карбоновых кислот: o кислотные свойства; o этерификации; o окисления (горение); o восстановления. 6. Характерные химические реакции сложных эфиров: o гидролиз. 78

34 (В 8) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров 1 2 9, 80– 60, 42 % 9, 80 % (375 в. ) 53, 28 % (70, 5 %, 53, 3 %) 6 17, 86– 38, 10 % 79

34 (В 8) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров 2 4 5 2 3 4 80

34 (В 8) Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, предельных карбоновых кислот, сложных эфиров 1 3 5 1 2 6 81

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 1. o o o 2. Характерные химические реакции аминов: оснóвные свойства; горение (азот, углекислый газ и вода); с Br 2 (aq) - качественная реакция на анилин. Характерные химические реакции аминокислот: o амфотерные свойства; o этерификация; o пептизация. 3. Характерные химические реакции белков: o денатурация; o цветные реакции (биуретовая, ксантопротеиновая, реакция на серу). 82

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 4. Характерные химические реакции жиров: o омыление (гидролиз); o гидрогенизация (восстановление) непредельных жиров. 5. Характерные химические реакции углеводов (моносахариды, дисахариды, полисахариды): o образование комплексных соединений с Cu(OH)2; o замещения; o окисление (моносахариды, дисахариды); o восстановление (моносахариды, дисахариды); o гидролиз (дисахариды, полисахариды). 83

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 3 5 12, 0– 50, 98 % 12, 0 % (365 в. ) 50, 23 % (68, 6 %, 47, 0 %) 6 23, 81– 55, 56 % 84

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 2 4 6 4 5 6 85

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 3 5 6 2 3 5 86

35 (В 9) Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки 1 4 6 2 3 5 87

Часть 2 88

36 (С 1) Реакции окислительновосстановительные. Коррозия металлов и способы защиты от нее 1. Уравнения ОВР даны в неявном (не полном) виде и необходимо определить недостающие в схеме вещества. 2. Обычно три компонента вступают в реакции ОВР: восстановитель, окислитель и среда (в такой же последовательности и записываются). 3. Если есть среда, то обязательно будет вода (кислота → вода, щелочь → вода, вода → щелочь или щелочь+вода). 4. Ионы определяются по среде. 5. Часто нужно знать существование ионов в различных средах (Mn, Cr). 6. Наиболее часто встречаются реакции со следующими элементами: S, Mn, Hal, N, Cr, P, С (в орг. соединениях). 89

Типичные восстановители o Нейтральные атомы и молекулы: Al, Zn, Cr, Fe, H, С, Li. Al. H 4, H 2, NH 3, и др. o Отрицательно заряженные ионы неметаллов: S 2–, I–, Br–, Cl– и др. o Положительно заряженные ионы металлов в низшей степени окисления: Cr 2+, Fe 2+, Cu+ и др. o Сложные ионы и молекулы, содержащие атомы в состоянии промежуточной степени окисления: SO 32–, NO 2–, Cr. O 2–, CO, SO 2, NO, P 4 O 6, C 2 H 5 OH, CH 3 CHO, HCOOH, H 2 C 2 O 4, C 6 H 12 O 6 и др. o Электрический ток на катоде. 90

Типичные окислители o Нейтральные молекулы: F 2, Cl 2, Br 2, O 3, S, H 2 O 2 и др. o Положительно заряженные ионы металлов и водорода: Cr 3+, Fe 3+, Cu 2+, Ag+, H+ и др. o Сложные молекулы и ионы, содержащие атомы металла в состоянии высшей степени окисления: KMn. O 4, Na 2 Cr 2 O 7, Na 2 Cr. O 4, Cu. O, Ag 2 O, Mn. O 2, Cr. O 3, Pb. O 2, Pb 4+, Sn 4+ и др. o Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления: NO 3–, HNO 3, H 2 SO 4(конц. ), SO 3, KCl. O, Ca(Cl. O)Cl и др. o Электрический ток на аноде. 91

Среда o Кислая: H 2 SO 4, реже HCl и HNO 3 o Щелочная: Na. OH или KOH o Нейтральная: H 2 O 92

Полуреакции Mn и Cr кислая среда: Mn. O 4– + 8 H+ + 5ē → Mn 2+ + 4 H 2 O Mn+7 + 5ē → Mn+2 щелочная среда: Mn. O 4– + ē → Mn. O 42– Mn+7 + ē → Mn+6 нейтральная среда: Mn. O 4– + 2 H 2 O + 3ē → Mn. O 2 + 4 OH– Mn+7 + 3ē → Mn+4 кислая среда: Cr 2 O 72– + 14 H+ + 6ē → 2 Cr 3+ + 7 H 2 O 2 Cr+6 + 6ē → 2 Cr+3 щелочная среда: Cr 3+ + 8 OH– – 3ē → Cr. O 42– + 4 H 2 O Cr+3 – 3ē → Cr+6 93

Наиболее известные полуреакции восстановления окислителей O 2 + 4ē → 2 O− 2; O 3 + 6ē → 3 O− 2; F 2 + 2ē → 2 F−; Cl 2 + 2ē → 2 Cl−; S+6 + 2ē → S+4 (H 2 SO 4 → SO 2); N+5 + ē → N+4 (концентрированная HNO 3 → NO 2); N+5 + 3ē → N+2 (разбавленная HNO 3 → NO; реакции со слабыми восстановителями); N+5 + 8ē → N− 3 (разбавленная HNO 3 → NH 4 NO 3; реакции с сильными восстановителями); 2 O− 1 + 2ē → 2 O− 2 (H 2 O 2) 94

36 (С 1) Реакции окислительновосстановительные. Коррозия металлов и способы защиты от нее Используя метод электронного баланса, составьте уравнение реакции: Са 3 P 2 +. . . + H 2 O → Ca 3(PO 4)2 + Mn. O 2 +. . Определите окислитель и восстановитель. 25, 93– 35, 81 % – диапазон полного выполнения задания С 1 25, 93 % – полностью справилось с данным заданием 95 19, 23– 66, 67 % – диапазон полного выполнения задания С 1 во второй волне

36 (С 1) -3 +5 +4 Са 3 P 2 +. . . + H 2 O → Ca 3(PO 4)2 + Mn. O 2 +. . 1) Определяем недостающие в схеме вещества и составляем электронный баланс: 3 окисление 2 P-3 – 16ē → 2 P+5 Mn+7 + 3ē → Mn+4 16 восстановление 2) Расставляем коэффициенты в уравнении реакции: 3 Ca 3 P 2 + 16 KMn. O 4 + 8 H 2 O = 3 Ca 3(PO 4)2 + 16 Mn. O 2 + 16 KOH вос-тель ок-тель 3) Определяем восстановитель и окислитель 96 50, 51 % (67, 61 %, 36, 93 % – процент выполнения в 2013 -2012 гг. )

Типичный пример ошибок в задании 36 (С 1) o o o Из-за отсутствия систематических знаний об окислителевосстановителе учащийся проставляет степени окисления у всех элементов. Необходимо помнить, что если элемент (не простое вещество) имеет индекс, то его нужно проставить перед элементом (в виде коэффициента). Отсюда и неправильный баланс и, как следствие, не правильно уравнена реакция. Окислитель-восстановитель в месте процесса не указывается. 97

36 (С 1) Используя метод электронного баланса, составьте уравнение реакции: HCHO + KMn. O 4 +. . . → CO 2 + K 2 SO 4 +. . . . Определите окислитель и восстановитель. 29, 1– 65, 1 % – диапазон выполнения 30, 0 % – полностью справились с заданием 98

36 (С 1) 0 +7 +4 HCHO + KMn. O 4 +. . . → CO 2 + K 2 SO 4 +. . . 1) Составляем электронный баланс: C 0 – 4ē → C+4 5 окисление Mn+7 + 5ē → Mn+2 4 восстановление 2) Расставляем коэффициенты в уравнении реакции: 5 HCOH + 4 KMn. O 4 + 6 H 2 SO 4 = 5 CO 2 + 2 K 2 SO 4 + 4 Mn. SO 4 + 11 H 2 O вос-тель ок-тель 3) Определяем окислитель и восстановитель 99

36 (С 1) Используя метод электронного баланса, составьте уравнение реакции: Ca(HS)2 + HNO 3 (конц. ) → . . . + Ca. SO 4 + NO 2 +. . Определите окислитель и восстановитель. 26, 3– 57, 7 % – диапазон выполнения задания С 1 4, 9 % – полностью справились с этим заданием 100

36 (С 1) -2 +5 +6 +4 Ca(HS)2 + HNO 3 (конц. ) → . . . + Ca. SO 4 + NO 2 +. . 1) Составляем электронный баланс: -2 +6 1 окисление 2 S – 16ē → 2 S N+5 + ē → N+4 16 восстановление 2) Расставляем коэффициенты в уравнении реакции: Ca(HS)2 + 16 HNO 3 (конц. ) → H 2 SO 4 + Ca. SO 4 + 16 NO 2 + 8 H 2 O вос-тель ок-тель 3) Определяем окислитель и восстановитель 101

37 (С 2) Реакции, подтверждающие взаимосвязь различных классов неорганических веществ 1. Изобразите генетическую связь неорганических веществ (схему превращений). 2. Отметьте характерные свойства вещества: кислотноосновные и окислительно-восстановительные (специфические). 3. Обратите внимание на концентрации веществ (если указывается): твердое, раствор, концентрированное вещество. 4. Необходимо записать четыре уравнения реакций (не схемы). 5. Как правило, две реакции являются ОВР, для амфотерных металлов – реакции комплексообразования, для реакций ионного обмена – совместный гидролиз. 102

Словарь терминов 1. Навеска – это некоторая порция вещества определенной массы (её взвесили на весах) для проведения анализа. 2. Прокалить – нагреть вещество до высокой температуры и греть до окончания химических реакций. 3. «Взорвали смесь газов» – это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются! 4. Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла и света. Горение – это не всегда взаимодействие с кислородом, но и с другими веществами, например, водороде, хлоре и др. 103

Словарь терминов 5. Растворение вещества – это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде твердой соли Na. Cl получается раствор этой же соли Na. Cl), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении Ba. O получится раствор Ba(OH)2). Растворять можно вещества не только в воде, но и в кислотах, в щелочах, в спиртах и т. д. 6. Выпаривание – это удаление из раствора воды и летучих веществ без разложения остающихся твёрдых веществ. 7. Упаривание – это просто уменьшение массы воды в растворе с помощью кипячения. 8. Отфильтровать – отделить осадок от раствора. 9. Фильтрат – это отфильтрованный (прозрачный) раствор. 104

Словарь терминов 10. Сплавление – это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. 11. «Реакция протекает с выделением осадка» – это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы). 12. Остаток – это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком. 105

Словарь терминов 13. Насыщенный раствор – это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется. 14. Ненасыщенный раствор – это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным. 15. Разбавленный и «очень» разбавленный раствор – это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика. Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 36 %. А концентрированная серная – это безводная, 100 %-ная кислота. 106

Рекомендации 1. 2. − − − 3. − − − Для решения заданий 37 (С 2) необходимо помнить, что все реакции протекают в лаборатории с помощью лабораторных установок, приборов и лабораторной посуды. Необходимо чётко знать физические (цвете, агрегатное состоянии, для некоторых специфический запах) и химические свойства: металлов (щелочных, щелочноземельных, Al, Zn, Cr, Fe, Cu); неметаллов (H 2, Hal 2, O 2, S, N 2, P, C, Si); оксидов; гидроксидов (оснований) и кислот; солей. Необходимо повторить свойства: азотной и серной кислот; перманганата и дихромата калия; окислительно-восстановительные свойства различных 107 соединений.

Рекомендации 4. Повторить такие лабораторные способы получения веществ как: − электролиз растворов и расплавов различных веществ; − реакции разложения соединений разных классов (нитратов, карбонатов, гидроксидов) 5. Отметить некоторые особенности веществ, происходящие без изменения степени окисления: − амфотерность; − гидролиз солей и других соединений; − взаимный гидролиз двух солей. 108

37 (С 2) Реакции, подтверждающие взаимосвязь различных классов неорганических веществ Сероводород пропустили через бромную воду. Образовавшийся при этом осадок обработали горячей концентрированной азотной кислотой. Выделившийся бурый газ пропустили через раствор гидроксида бария. При взаимодействии одной из образовавшихся солей с водным раствором перманганата калия образовался бурый осадок. Напишите уравнения четырёх описанных реакций. 5, 02– 6, 12 % – диапазон полного выполнения задания С 2 5, 02 % – полностью справилось с данным заданием 109 3, 70– 15, 38 % – диапазон полного выполнения задания С 2 во второй волне

37 (С 2) H 2 S (газ), S (тв), NO 2 (газ), Ba(NO 2)2, Mn. O 2 (тв. ) вос-ль бурый газ соль с элементом бурый осадок диспропорц. в переменной ст. ок. Записываем возможные уравнения реакций: 1) H 2 S + Br 2 = S↓ + 2 HBr to 2) S + 6 HNO 3 = H 2 SO 4 + 6 NO 2↑ + 2 H 2 O 3) 2 Ba(OH)2 + 4 NO 2 = Ba(NO 3)2 + Ba(NO 2)2 + 2 H 2 O 4) 3 Ba(NO 2)2 + 4 KMn. O 4 + 2 H 2 O = 3 Ba(NO 3)2 + 4 Mn. O 2↓+ 4 KOH 21, 98 % (49, 90 %, 16, 75 %) 110

Типичный пример ошибок в задании 37 (С 2) o o Не верно записано второе уравнение – сера при нагревании окисляется до серной кислоты. Не уравнено третье уравнение. 111

37 (С 2) Реакции, подтверждающие взаимосвязь различных классов неорганических веществ Твёрдый хлорид лития нагрели с концентрированной серной кислотой. Выделившийся при этом газ растворили в воде. При взаимодействии полученного раствора с перманганатом калия образовалось простое газообразное вещество жёлто-зелёного цвета. При горении железной проволоки в этом веществе получили соль. Соль растворили в воде и смешали с раствором карбоната натрия. Напишите уравнения четырёх описанных реакций. 11, 3– 24, 2 % – диапазон выполнения задания С 2 2, 7 % – полностью справились с этим примером 112

37 (С 2) Li. Cl(тв), H 2 SO 4 (конц. ), KMn. O 4, Fe, Na 2 CO 3 (р-р) соль ок-ль, к-та ок-ль мет. , в-ль соль сл. к-ты Записываем возможные уравнения реакций: 1) Li. Cl + H 2 SO 4 = HCl↑ + Li. HSO 4 2) 2 KMn. O 4 + 16 HCl = 2 Mn. Cl 2 + 5 Cl 2↑ + 2 KCl + 8 H 2 O 3) 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 4) 2 Fe. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Fe(OH)3↓ + 6 Na. Cl + 3 CO 2↑ 113

38 (С 3) Реакции, подтверждающие взаимосвязь органических соединений 1. Участвуют все классы органических соединений, изучаемых в школьной программе. 2. Цепочки представлены в неявном виде (по продукту или по условиям реакции). 3. Особое внимание необходимо обратить на условия протекания реакций. 4. Все реакции необходимо уравнивать (в т. ч. ОВР). Никаких схем реакций быть не должно! 5. В случае затруднения выполнения цепи в прямом направлении, решайте с конца цепи или фрагментарно. Пытайтесь что-либо выполнить! 6. Органические вещества записывать в виде структурных формул! 114
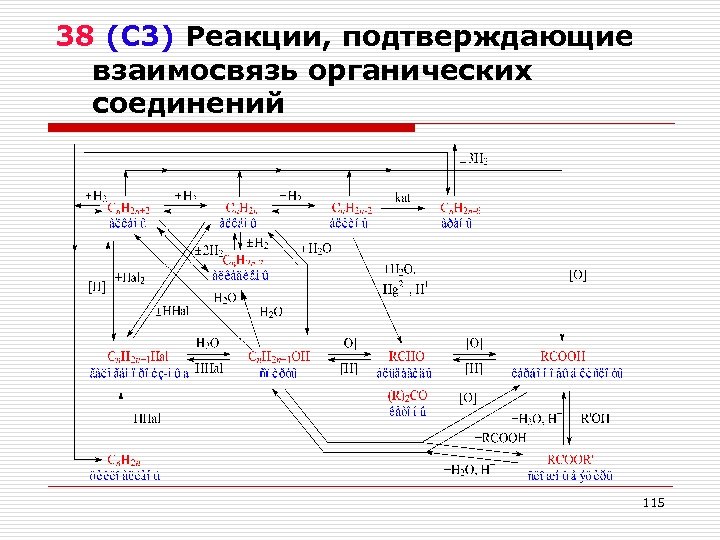
38 (С 3) Реакции, подтверждающие взаимосвязь органических соединений 115

О структурных формулах органических соединений o При записи уравнений реакций, экзаменуемые должны использовать структурные формулы органических веществ (это указание дается в условии задания). Структурные формулы могут быть представлены на разных уровнях, не искажающий химический смысл: 1) для ациклических соединений принято изображать полные или сокращенные структурные формулы; 2) для циклических соединений принято изображать скелетные (схематические) структурные формулы. Не допускается (даже фрагментарно) совмещение этих пунктов. 116
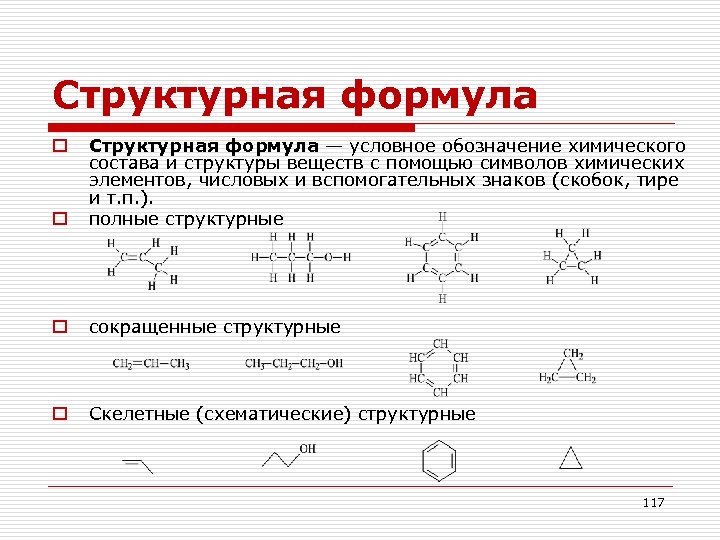
Структурная формула o Структурная формула — условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п. ). полные структурные o сокращенные структурные o Скелетные (схематические) структурные o 117

Типичные ошибки в структурных формулах 118
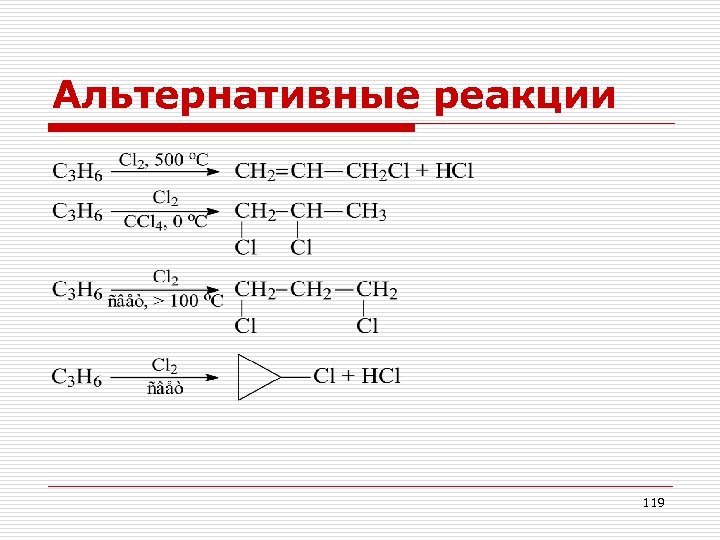
Альтернативные реакции 119
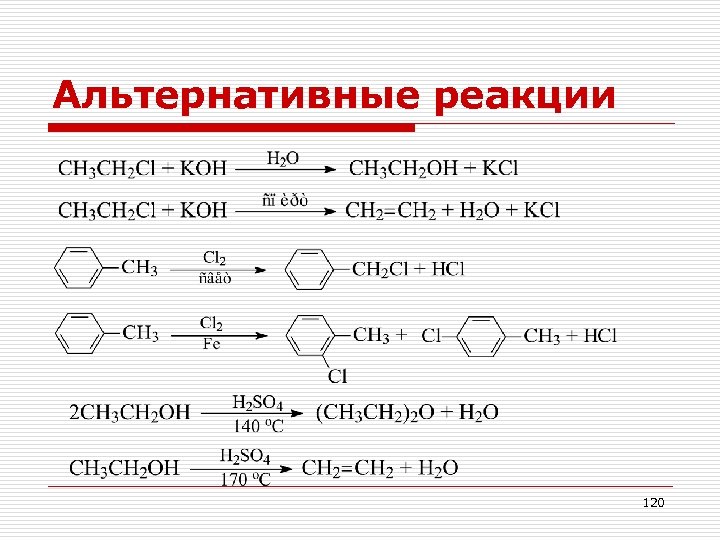
Альтернативные реакции 120

Типичные ошибки в составлении уравнений реакций 121

38 (С 3) Реакции, подтверждающие взаимосвязь органических соединений Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. 0, 49– 3, 55 % – диапазон полного выполнения задания С 3 0, 49 % – полностью справилось с данным заданием 122 3, 57– 23, 81 % – диапазон полного выполнения задания С 3 во второй волне

38 (С 3) Записываем уравнения реакций: 1) CH 3 CH 2 CH 2 CH 2 CH 3 2) 3) 4) 5) 16, 32 % (36, 68 %, 23, 82 %) 123

Типичный пример ошибок в задании 38 (С 3) 1) 2) 3) 4) 5) o 124 Не верно составлены уравнения 2 и 5. Не уравнено 3 уравнение.

Типичный пример ошибок в задании 38 (С 3) 2) 3) o o Не допускается написание схемы и многостадийности реакции (вторая реакция). При написании уравнений реакции органических соединений нельзя забывать про неорганические вещества – ни как в учебнике, а как в условии задания (третье уравнение). 125

38 (С 3) Реакции, подтверждающие взаимосвязь органических соединений Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. 3, 16 % – полностью справилось с данным заданием 126

38 (С 3) Записываем уравнения реакций: 1) 2) 3) 4) 5) 127

Типичный пример ошибок в задании 38 (С 3) o o o Не сформировано представление о структурной формуле циклических соединений (вторая и третья реакции). Не верно второе уравнение (реакция замещения). Условия лучше записывать над стрелочкой. 128

Типичный пример ошибок в задании 38 (С 3) o Не внимательность к формулам (как циклогексен, так и формула дикарбоновой кислоты в пятой реакции). 129

Типичный пример ошибок в задании 38 (С 3) o Не внимательность к условиям задания: не оксид меди (II) дан, а медь (как катализатор в реакции дегидрирования). o Из альдегидов при восстановлении образуются первичные спирты. 130

Типичный пример ошибок в задании 38 (С 3) o Как из двух получается три атома углерода, да еще один из них в трехвалентном состоянии. 131

39 (С 4) Расчетные задачи на растворы и смеси 1. 2. 3. 4. 5. 6. 7. 8. Записываем уравнение(ия) реакции(ий). Выбираем алгоритм решения задачи: на избыток (или примесь), выход продукта реакции от теоретически возможного и определяем массовую долю (массу) химического соединения в смеси. Всего 4 этапа решения задачи. В расчетах ссылаться на уравнения реакций и использовать соответствующие математические формулы. Не забывайте проверять единицы измерения. Если количество вещества менее 1 моль, то необходимо округлять до трех цифр после запятой. Массовые доли и процент отделяйте скобками или пишите через союз или. Не забудьте записать ответ. 132

39 (С 4) Расчетные задачи на растворы и смеси Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси. В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. 3, 13– 10, 15 % – диапазон полного выполнения задания С 4 3, 13 % – полностью справилось с данным заданием 133 0– 15, 38 % – диапазон полного выполнения задания С 4 во второй волне

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. Дано: V(H 2 О) = 1, 0 л V(HCl) = 44, 8 л m(Ca. O) = 14 г ω(Ca. Cl 2) – ? ω(HCl) – ? Vm = 22, 4 л/моль M(Ca. O) = 56 г/моль M(HCl) = 36, 5 г/моль Решение: Ca. O + CO 2 = Ca. CO 3 2 HCl + Ca. CO 3 = Ca. Cl 2 + H 2 O + CO 2 134

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. Ca. O + CO 2 = Ca. CO 3 1 моль 0, 25 моль 0, 25 моль 2) Рассчитываем количества веществ реагентов: n = m / M n(Ca. O) = 14 г / 56 г/моль = 0, 25 моль n(Ca. CO 3) = n(Ca. O) = 0, 25 моль 135

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. 2 HCl + Ca. CO 3 = Ca. Cl 2 + H 2 O + CO 2 2 моль 1 моль 0, 50 моль 0, 25 моль 3) Вычисляем избыток и количество вещества хлороводорода: n(HCl)общ. = V / Vm = 44, 8 л / 22, 4 л/моль = 2 моль (в избытке) m(HCl)общ. = 2 моль · 36, 5 г/моль = 73 г n(HCl)прореаг. = 2 n(Ca. CO 3) = 0, 50 моль 136

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. 2 HCl + Ca. CO 3 = Ca. Cl 2 + H 2 O + CO 2 2 моль 1 моль 0, 50 моль 0, 25 моль 3) Вычисляем количество вещества углекислого газа и хлорида кальция: n(HCl)ост. = 2 моль – 0, 50 моль = 1, 5 моль n(CO 2) = n(Ca. CO 3) = 0, 25 моль n(Ca. Cl 2) = n(CO 2) = 0, 25 моль 137

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. 4) Рассчитываем массу раствора и массовые доли веществ: m = n · M m(HCl)ост. = 1, 5 моль · 36, 5 г/моль = 54, 75 г m(Ca. CO 3) = 0, 25 моль · 100 г/моль = 25 г m(CO 2) = 0, 25 моль · 44 г/моль = 11 г m(Ca. Cl 2) = 0, 25 моль · 111 г/моль = 27, 75 г 138

39 (С 4) В 1 л воды растворили 44, 8 л (н. у. ) хлороводорода. К этому раствору добавили вещество, полученное в результате реакции оксида кальция массой 14 г с избытком углекислого газа. Определите массовую долю веществ в полученном растворе. 4) Рассчитываем массу раствора и массовые доли веществ: m = n · M m(р-ра) = 1000 г + 73 г + 25 г – 11 г = 1087 г ω = m(в-ва) / m(р-ра) ω(HCl) = 54, 75 г / 1087 г = 0, 050 или 5, 0 % ω(Ca. Cl 2) = 27, 75 г / 1087 г = 0, 026 или 2, 6 % Ответ: массовая доля соляной кислоты и хлорида кальция в 139 полученном растворе составляет 5, 0 % и 2, 6 % соответственно.

39 (С 4) Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из трёх элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл. 140

39 (С 4) Расчетные задачи на растворы и смеси Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 0 % – полностью справилось с данным заданием 141

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. Дано: m(P) = 1, 24 г V(H 2 SO 4) = 16, 84 мл ω(H 2 SO 4) = 0, 97 ρ(H 2 SO 4) = 1, 8 г/мл ω(Na. OH) = 0, 32 ρ(Na. OH) = 1, 35 г/мл V(Na. OH) – ? M(P) = 31 г/моль M(H 2 SO 4) = 98 г/моль M(Na. OH) = 40 г/моль Решение: 2 P + 5 H 2 SO 4 = 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O 142

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 2) Рассчитываем избыток и количества веществ реагентов: 2 P + 5 H 2 SO 4 = 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O 2 моль 5 моль 0, 04 моль 0, 1 моль n = m / M n = (V · ρ · ω) / M n(P) = 1, 24 г / 31 г/моль = 0, 040 моль n(H 2 SO 4)общ. = (16, 84 мл · 1, 8 г/мл· 0, 97) / 98 г/моль = 0, 30 моль (избыток) 143

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 2) Рассчитываем количества веществ реагентов: 2 P + 5 H 2 SO 4 = 2 H 3 PO 4 + 5 SO 2 + 2 H 2 O 2 моль 5 моль 2 моль 0, 04 моль 0, 1 моль 0, 04 моль n(H 3 PO 4) = n(P) = 0, 04 моль n(H 2 SO 4)прореаг. = 5/2 n(P) = 0, 1 моль n(H 2 SO 4)ост. = 0, 3 моль – 0, 1 моль = 0, 2 моль 144

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 3) Вычисляем избыток и количество вещества щелочи: H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O 1 моль 3 моль 0, 04 моль 0, 12 моль n(Na. OH)H 3 PO 4 = 3 n(H 3 PO 4) = 3 · 0, 04 моль = 0, 12 моль 145

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 3) Вычисляем избыток и количество вещества щелочи: H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O 1 моль 2 моль 0, 4 моль n(Na. OH)H 2 SO 4 = 2 n(H 3 PO 4) = 2 · 0, 2 моль = 0, 4 моль n(Na. OH)общ. = 0, 12 моль + 0, 4 моль = 0, 52 моль 146

39 (С 4) Фосфор массой 1, 24 г прореагировал с 16, 84 мл 97 %-ного раствора серной кислоты (ρ = 1, 8 г/мл) с образованием ортофосфорной кислоты. Для полной нейтрализации полученного раствора добавили 32 %-ный раствор гидроксида натрия (ρ = 1, 35 г/мл). Вычислить объём раствора гидроксида натрия. 4) Рассчитываем объем щелочи: m = n · M V = m / (ρ · ω) m(Na. OH) = 0, 52 моль · 40 г/моль = 20, 8 г V(р-ра) = 65 г / (1, 35 г/мл · 0, 32 ) = 48, 15 мл Ответ: объем раствора гидроксида натрия для нейтрализации ортофосфорной кислоты составляет 48, 15 мл. 147

40 (С 5) Нахождение молекулярной формулы веществ (с 2015 г. ) Решение задачи будет включать четыре последовательные операции: 1. нахождение количества вещества по химической реакции (продуктам горения); 2. определение молекулярной формулы вещества; 3. составление структурной формулы вещества, исходя из молекулярной формулы и качественной реакции; 4. составление уравнения качественной реакции. 148

Формула o o o Химическая формула — условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п. ). Брутто-формула (истинная формула или эмпирическая) – отражает состав (точное количество атомов каждого элемента в одной молекуле), но не структуру молекул вещества. Молекулярная формула (рациональная формула) – формула, в которой выделяются группы атомов (функциональные группы), характерные для классов химических соединений. Простейшая формула – формула, в которой отражено минимальное целочисленное отношение химических элементов. Структурная формула – это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. 149

Типичный пример ошибок в задании С 5 o o Реакция не уравнена. Хотя эта не сказалось на математических расчетах. Переход от общей молекулярной формулы к искомой молекулярной формуле не верен, вследствие использования на практике в основном брутто-формул. 150

Типичный пример ошибок в задании С 5 o o o Реакция составлена с помощью бруттоформул. Математическая часть задачи решена верно (методом пропорции). Разницу между брутто-формулой и молекулярной формулой не усвоена. 151

40 При сжигании образца некоторого органического соединения массой 14, 8 г получено 35, 2 г углекислого газа и 18, 0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди (II) образуется кетон. На основании данных условия задания: 1) произведите необходимые вычисления; 2) установите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции этого вещества с оксидом меди (II). 152

При сжигании образца некоторого органического соединения массой 14, 8 г получено 35, 2 г углекислого газа и 18, 0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37. 40 Дано: m(Сх. Hy. Oz) = 14, 8 г m(CO 2) = 35, 2 г m(H 2 O) = 18 г DH 2 = 37 Сх. Hy. Oz – ? M(CO 2) = 44 г/моль M(H 2 O) = 18 г/моль Решение: 1) а) С → CO 2 0, 80 моль n(CO 2) = m / M = 35, 2 г / 44 г/моль = 0, 80 моль n(CO 2) = n(C) = 0, 8 моль б) 2 Н → H 2 O 2, 0 моль 1, 0 моль n(H 2 O) = 18, 0 г / 18 г/моль = 1, 0 моль n(Н) = 2 n(H 2 O) = 2, 0 моль 153

40 в) m(C) + m(H) = 0, 8· 12 + 2, 0· 1 = 11, 6 г (кислород имеется) m(О) = 14, 8 г – 11, 6 г = 3, 2 г n(O) = 3, 2 / 16 = 0, 20 моль 2) Определяем истинную формулу вещества: Mист(Сх. Hу. Oz) = DH 2·MH 2 = 37 · 2 = 74 г/моль х : y : z = 0, 80 : 2, 0 : 0, 20 = 4 : 10 : 1 Вычисленная простейшая формула – С 4 H 10 O Mвыч(С 4 H 10 O) = 74 г/моль Истинная формула (брутто-формула) исходного вещества – С 4 H 10 O 154

40 3) Составляем структурную формулу вещества исходя из истинной формулы и качественной реакции: 4) Записываем уравнение реакции вещества с оксидом меди (II): 155

Литература 1. 2. 3. 4. 5. 6. 7. Кузьменко Н. Е. , Еремин В. В. , Попков В. А. Начала химии. В 2 Т. – М. : Экзамен, 2010. Дроздов А. А. , Еремин В. В. Пособие для подготовки к ЕГЭ по химии. – М. : БИНОМ. Лаборатория знаний, 2012. – 191 с. ЕГЭ-2015: Химия: 12 вариантов / А. А. Каверина, М. Г. Снастина, И. В. Котикова. –М. : Интеллект-Центр, 2015. – 144 с. Химия. Подготовка к ЕГЭ-2012: учебно-методическое пособие / под ред. В. Н. Доронькина – Ростов н/Д: Легион. М, 2012. – 329 с. Егоров А. С. , Аминова Г. Х. Химия: экспресс-репетитор для подготовки к ЕГЭ. – Ростов н/Д: Феникс, 2011. – 279 с. Мешкова О. В. ЕГЭ. Химия: универсальный справочник. – М. : Эксмо, 2010. – 368 с. ЕГЭ 2009. Химия. Репетитор / П. А. Оржековский, Н. Н. Богданова, В. В. Загорский и др. – М. : Эксмо, 2009. – 112 с. 156
www. edu. ru/moodle 157

Официальные сайты ЕГЭ Официальный информационный портал ЕГЭ http: //www 1. ege. edu. ru Официальный сайт Федерального института педагогических измерений (ФИПИ) http: //www. fipi. ru Сайт информационной поддержки ЕГЭ в Алтайском крае http: //ege. uni-altai. ru/

Химический факультет Алт. ГУ Декан: Базарнова Наталья Григорьевна, д. х. н. , профессор Деканат: ауд. 102 К (пр-т, Красноармейский, 90) Телефон: 8(3852) 66 -66 -82 Сайт: www. chem. asu. ru E-mail: dekanat@chem. asu. ru

Спасибо за внимание! До следующей встречи!
d7a6a9f3810ae42b34d1b8e8ef8c3dc3.ppt