Молекулярная биология ч.2 Нуклеиновые.pptx
- Количество слайдов: 19

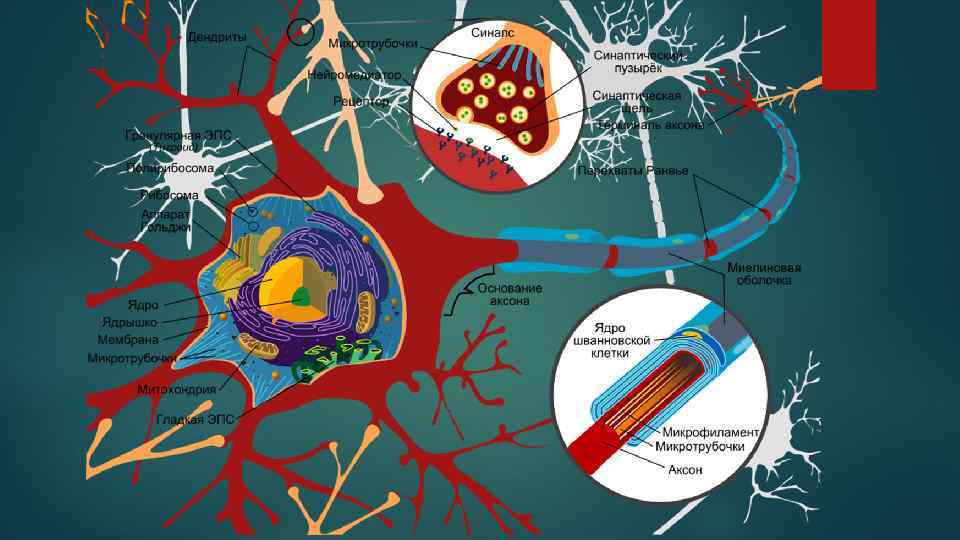
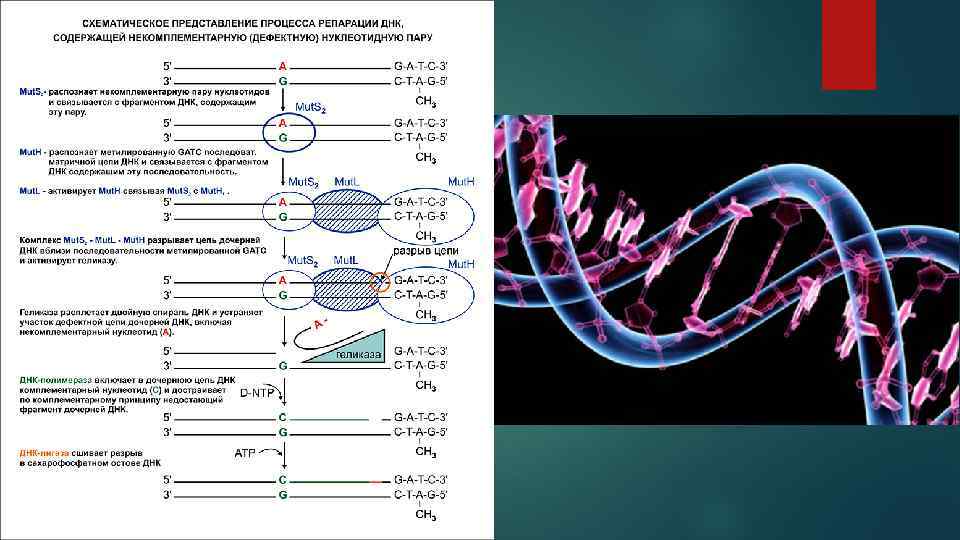
Особенности нуклеиновых кислот и хроматина нервной ткани: • содержание ДНК в нервных клетках, • синтез и пролиферация нервных клеток, • репарация ДНК, особенности организации хроматина, • экспрессия генома, связанная со специфичностью головного мозга
В паре хромосом нейроцитов головного мозга человека содержится около 6109 пар нуклеотидов
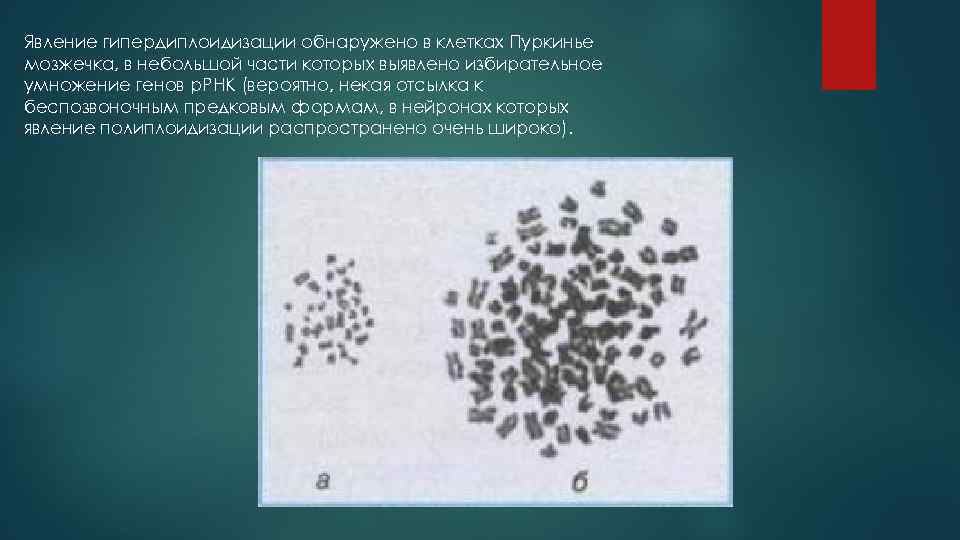
Явление гипердиплоидизации обнаружено в клетках Пуркинье мозжечка, в небольшой части которых выявлено избирательное умножение генов р. РНК (вероятно, некая отсылка к беспозвоночным предковым формам, в нейронах которых явление полиплоидизации распространено очень широко).
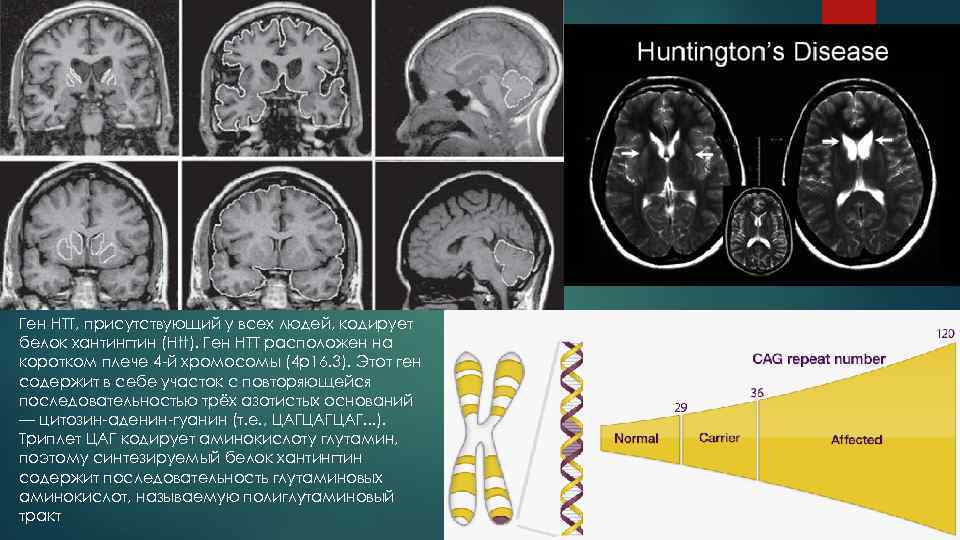
Ген HTT, присутствующий у всех людей, кодирует белок хантингтин (Htt). Ген HTT расположен на коротком плече 4 -й хромосомы (4 p 16. 3). Этот ген содержит в себе участок с повторяющейся последовательностью трёх азотистых оснований — цитозин-аденин-гуанин (т. е. , ЦАГЦАГЦАГ. . . ). Триплет ЦАГ кодирует аминокислоту глутамин, поэтому синтезируемый белок хантингтин содержит последовательность глутаминовых аминокислот, называемую полиглутаминовый тракт
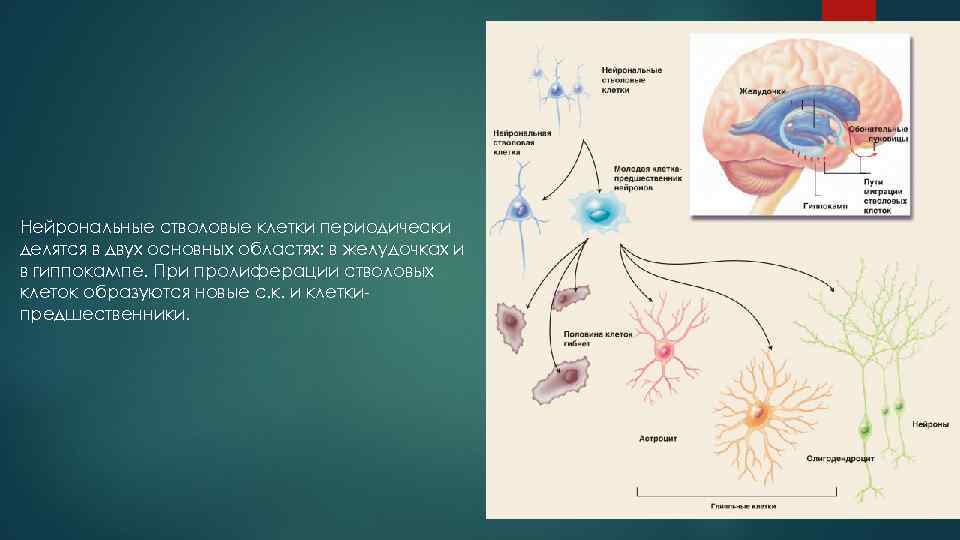
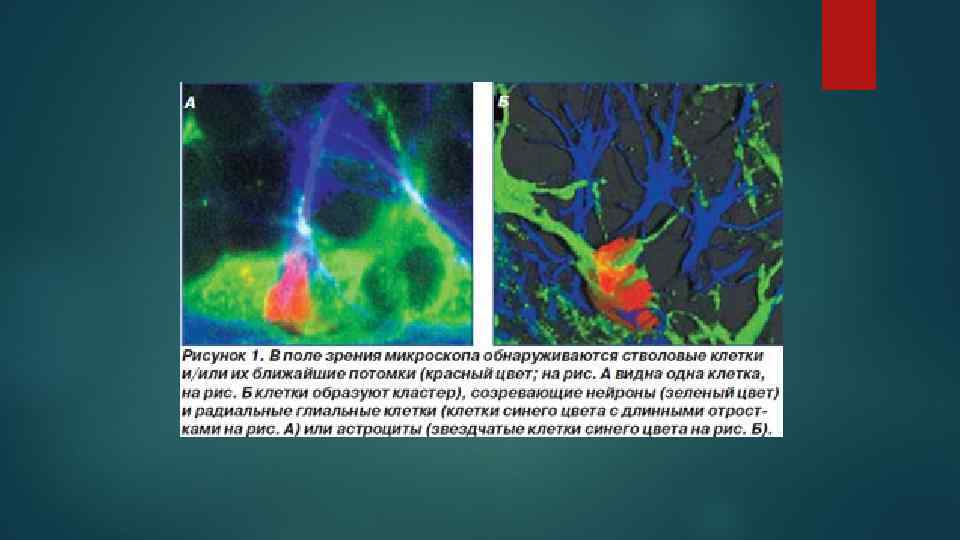
Нейрональные стволовые клетки периодически делятся в двух основных областях: в желудочках и в гиппокампе. При пролиферации стволовых клеток образуются новые с. к. и клеткипредшественники.
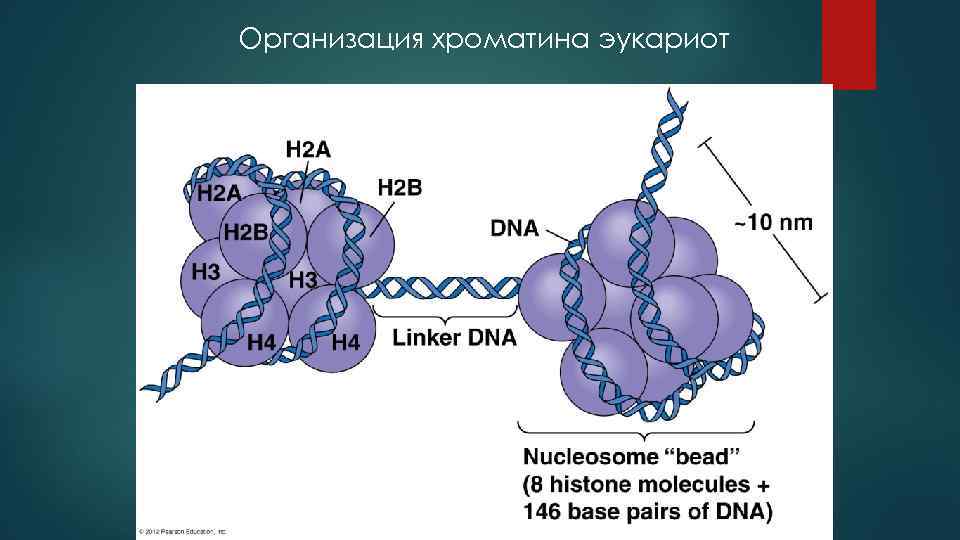
Организация хроматина эукариот

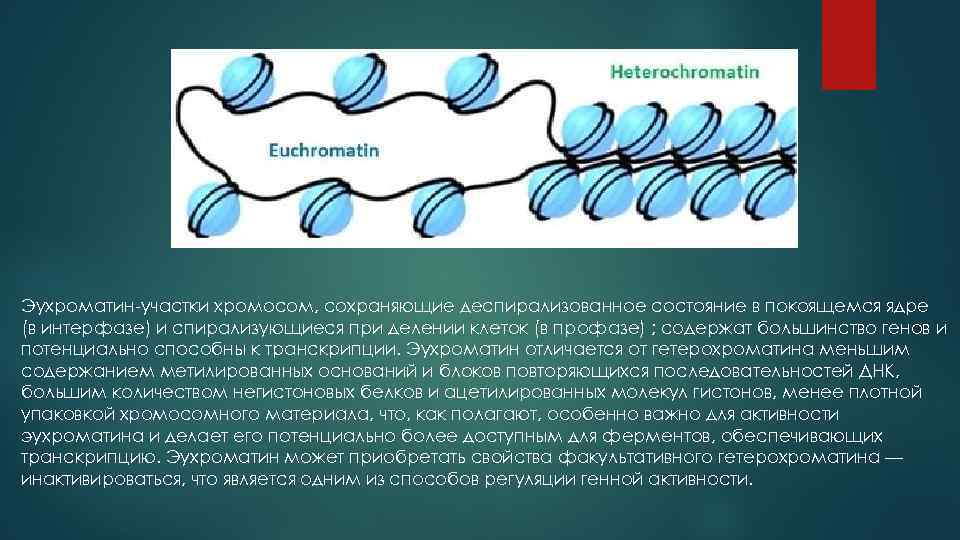
Эухроматин-участки хромосом, сохраняющие деспирализованное состояние в покоящемся ядре (в интерфазе) и спирализующиеся при делении клеток (в профазе) ; содержат большинство генов и потенциально способны к транскрипции. Эухроматин отличается от гетерохроматина меньшим содержанием метилированных оснований и блоков повторяющихся последовательностей ДНК, большим количеством негистоновых белков и ацетилированных молекул гистонов, менее плотной упаковкой хромосомного материала, что, как полагают, особенно важно для активности эухроматина и делает его потенциально более доступным для ферментов, обеспечивающих транскрипцию. Эухроматин может приобретать свойства факультативного гетерохроматина — инактивироваться, что является одним из способов регуляции генной активности.

Однозначной связи между транскрипционной активностью генов и длиной нуклеосом не существует. Транскрипционная активность хроматина определяется, как уже отмечено выше, большим числом факторов. Возможно, существование коротких нуклеосом в хроматине нейронов лишь каким-то образом облегчает действие этих факторов. В частности, могут изменяться условия взаимодействия линкерных участков хроматина с гистоном HI и негистоновыми белками. В хроматине нейронов неокортекса содержание гистона HI составляет - 0, 5 молекулы на 1 нуклеосому, что примерно в два раза ниже, чем его содержание в хроматине глиальных клеток и клеток соматических тканей. Это хорошо согласуется с данными о более высокой доле активного хроматина в мозге по сравнению с соматическими тканями и в нейронах по сравнению с глиальными клетками. Фракция активного хроматина нейронов практически не содержит гистона HI, а аналогичная фракция хроматина из клеток неастроцитарной глии содержит его в очень малом количестве. Напротив, фракции неактивного хроматина нейронов и глии содержат сравнительно высокие количества HI. Снижение доли активного хроматина в нейронах и глиальных клетках мозга человека при болезни Альцгеймера также коррелирует с повышением содержания гистона HI.

Гормон соединяется с рецептором на внешней стороне клеточной мембраны и при участии Nбелка активирует фермент аденилатциклазу (АЦ), локализованную на внутренней стороне мембраны. АЦ катализирует синтез ц. АМФ из комплекса Mg. АТФ. Образовавшийся ц. АМФ связывается с ферментом протеинкиназой, в результате чего фермент диссоциирует на регуляторную (Р) и каталитическую (К) субъединицы. К-субъединица фосфорилирует определенные белки, в том числе ферменты, увеличивая или снижая их активность, что приводит к изменению соответствующих функций клетки. Фосфорилирование К-субъединицей белков хроматина или связывание с ним Р-субъединицы приводит к изменению матричной активности хроматина и пролиферативного статуса клетки. На этапе активации аденилатциклазы гормональный сигнал усиливается в 100 — 1000 раз, а при активации протеинкиназы ещё в 100 раз, то есть одна молекула гормона может вызвать фосфорилирование 10 -5 молекул белка (каскадное усиление). Действие ц. АМФ в клетке прекращается при гидролизе его фосфодиэстеразой и дефосфорилированин белков фосфопротеннфосфатазой.

Классы РНК в нервной ткани I. «нерегулируемые» РНК – одинаково экспрессируемые молекулы РНК во всех тканях (белки «домашнего хозяйства» ), необходимы для жизнедеятельности любой клетки; II. Регулируемые – экспрессированные только в некоторых тканях (нервной, костной, плотной волокнистой оформленной); III. Мозгоспецифические – экспрессируемые только в клетках мозга; IV. Редкие – присутствуют в мозге в недостаточном количестве, которые могли бы быть обнаружены при помощи Нозерн-блоттинга

Определение нуклеотидной последовательности мозгоспецифической м. РНК позволяет воспроизвести аминокислотную последовательность кодируемого белка, например, для клона, кодирующего РНК III класса. Кодируемый этой РНК полипептид не содержит участков гомологии с ранее изученными белками. Данный полипептид обнаружен в аксонах, иннервирующих клетки Пуркинье в мозжечке, пирамидные нейроны поля CA 3 гиппокампа; в радиальных волокнах глубоких слоев цингулярной и соматосенсорной коры; в группах волокон свода, стриатума, латерального обонятельного тракта.
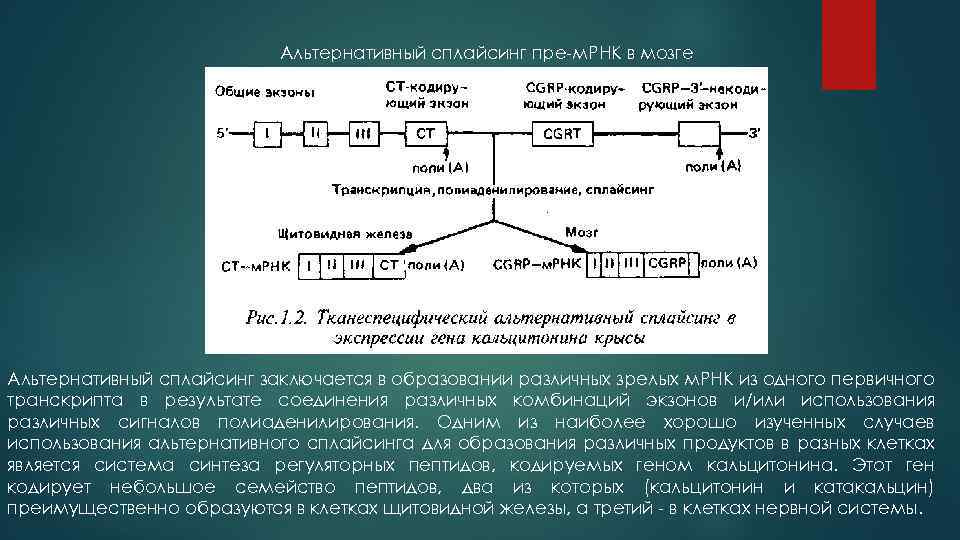
Альтернативный сплайсинг пре-м. РНК в мозге Альтернативный сплайсинг заключается в образовании различных зрелых м. РНК из одного первичного транскрипта в результате соединения различных комбинаций экзонов и/или использования различных сигналов полиаденилирования. Одним из наиболее хорошо изученных случаев использования альтернативного сплайсинга для образования различных продуктов в разных клетках является система синтеза регуляторных пептидов, кодируемых геном кальцитонина. Этот ген кодирует небольшое семейство пептидов, два из которых (кальцитонин и катакальцин) преимущественно образуются в клетках щитовидной железы, а третий - в клетках нервной системы.

Альтернативный сплайсинг первичных транскриптов обеспечивает также разнообразие белков миелина в ЦНС млекопитающих. В частности, показано, что различные основные белки миелина кодируются одним геном shi-локуса: при этом белок 21, 5 к. Д кодируется м. РНК, содержащей последовательность всех 7 экзонов гена, белок 18, 5 к. Д - всех, кроме II экзона, белок 17 к. Д - всех, кроме VI экзона, а белок 14 к. Д - всех, кроме II и VI экзонов. При этом образующиеся белки идентичны по аминокислотным последовательностям, кодируемым общими экзонами.

Первичные дефекты сплайсинга При первичных дефектах сплайсинга происходит мутация в последовательности, которая важна для правильного прохождения альтернативного сплайсинга. Следовательно, сплайсинг не происходит должным образом. Многие мутации, приводящие к заболеваниям, вызваны нарушениями сплайсинга пре-м. РНК. Примерами являются синдром Луи-Бара и нейрофиброматоз. Половина пациентов, страдающих этими заболеваниями, несет мутации, которые влияют на прохождение сплайсинга пре-м. РНК. Другой пример первичных нарушений сплайсинга был обнаружен у пациентов с лобно-височной деменцией (аутосомнодоминантное расстройство, связано с 17 хромосомой). Дефекты в сплайсинге приводят к изменению транскриптов тау-белков, ассоциированных с микротрубочками, - MAPT. Эти белки накапливаются в аксонах или растущих нейронах. Изменения в сплайсинге MAPT могут также привести к другим заболеваниям, таким как болезнь Альцгеймера, мышечная дистрофия, дисфункция глии и дегенерация спинного мозга. Мышечная дистрофия Дюшенна (МДД) — это результат мутаций в гене дистрофина. Мутации вызывают нарушения в сплайсинге и продукцию неправильных м. РНК. Разные мутации в пре-м. РНК дистрофина вызывают промежуточный вариант МДД, мышечную дистрофию Беккера (МДБ). Вторичные дефекты сплайсинга Под вторичными дефектами сплайсинга подразумеваются мутации в регуляторных факторах, которые очень важны для процесса сплайсинга. Действие различных активаторов и/или репрессоров может определять пути прохождения альтернативного сплайсинга. В зависимости от того, какой регулятор действует, прем. РНК меняется. В некоторых случаях, это может привести к серьёзным нарушениям. Примером таких нарушений является Синдром Прадера-Вилли, генетическая болезнь, характеризующаяся интеллектуальными и поведенческими отклонениями. Фермент ацетилхолинэстераза (ACh. E) собирается из серии белков. В ходе альтернативного сплайсинга может получаться три изоформы белка, которые вызывают такие нейродегенеративные заболевания, как болезнь Альцгеймера и болезнь Паркинсона. Разбалансировка регуляторов сплайсинга может приводить к избытку ACh. E-R, изоформе ACh. E, найденной у пациентов, страдающих болезнью Альцгеймера.

1. Большинство нейронов ЦНС позвоночных являются диплоидными; небольшая доля нейронов в некоторых отделах ЦНС может содержать избыточное по сравнению с диплоидным количество ДНК. 2. Репликативный синтез ДНК в дифференцированных нейронах отсутствует; в мозге взрослых млекопитающих репликация ДНК связана главным образом с ограниченными процессами размножения глиальных клеток. 3. В клетках мозга млекопитающих имеются активно функционирующие системы репарации ДНК, поддерживающие целостность и эффективность генетического аппарата. 4. Хроматин нервных клеток имеет типичную для эукариотических клеток нуклеосомную организацию. Особенностями хроматина нейронов неокортекса млекопитающих являются необычно короткие нуклеосомные единицы, присутствие редких вариантов гистонов, высокое разнообразие негистоновых белков и высокая матричная активность. 5. В мозге млекопитающих экспрессируется несколько десятков тысяч уникальных генов, из которых не менее половины имеют мозгоспецифический характер экспрессии. 6. Огромное разнообразие экспрессируемых в мозге генов складывается из перекрывающихся, но не одинаковых популяций генов, экспрессируемых в отдельных нервных клетках. 7. Наряду с разнообразнейшими мозгоспецифическими мессенджер-РНК в центральной нервной системе синтезируется ограниченное число особых малых РНК с последовательностями нуклеотидов, общими для всех отделов мозга. 8. Разнообразие белков и регуляторных пептидов, синтезируемых в мозге, определяется не только большим набором экспрессируемых генов, но и системой альтернативного сплайсинга пре-м. РНК.
Молекулярная биология ч.2 Нуклеиновые.pptx