ЦНС Особенности нейроанестезиологии 34 слайда.ppt
- Количество слайдов: 34
Особенности нейроанестезиологии ГОУ ВПО НИЖ ГМА КАФЕДРА анестезиологии и реаниматологии ФПКВ Клинический интерн Охримчук М. А.

1. Предоперационный анестезиологический осмотр -паспортные данные -Анамнез жизни -Анамнез заболевания -Жалобы с учетом ментального статуса и речевых нарушений -Неврологический и соматический статус Лабораторные исследования: общий клинический анализ крови, общий клинический анализ мочи, биохимический анализ крови, коагулограмма, основные трансмиссивные инфекции, группа крови и резус принадлежность Инструментальные методы исследования: рентгенограмма легких, нейровизуалиация, ЭКГ, ЭХОКС, ТКДС+ДС, УЗДГ вен н/к, УИ органов брюшной полости
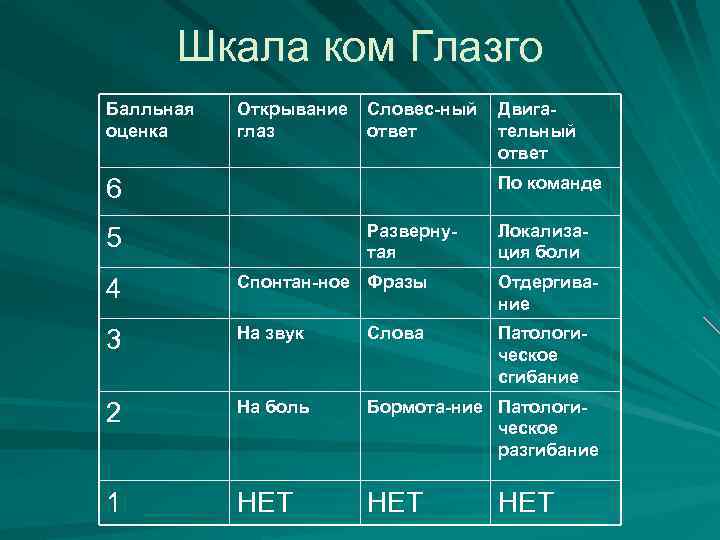
Шкала ком Глазго Балльная оценка Открывание глаз Словес-ный ответ Двигательный ответ По команде 6 Развернутая 5 Локализация боли 4 Спонтан-ное Фразы Отдергивание 3 На звук Слова Патологическое сгибание 2 На боль Бормота-ние Патологическое разгибание 1 НЕТ НЕТ

Церебральное перфузионное давление (ЦПД) Перфузия головного мозга – это отношение объемного мозгового кровотока к массе мозгового вещества. Она измеряется в миллилитрах крови на 100 гр. ткани в минуту (мл/ 100 г/ мин). Усредненный объемный мозговой кровоток в физиологических условиях приблизительно равен 50 мл/100 г/мин. Существуют региональные отличия для серого и белого вещества мозга, которые варьируют от 70 до 20 мл/100 г/мин. , соответственно. Нижние границы мозгового кровотока, при которых развиваются гипоперфузия и церебральная ишемия, хорошо изучены и установлены в экспериментальных работах: мозговой кровоток менее 30 мл/100 г/мин вызывает развитие неврологической симптоматики и изменение функциональной активности нейронов; при снижении до 15 -20 мл/100 г/мин развиваются обратимые нарушения на уровне дисфункции мембран нейронов; при снижении кровотока менее 10 -15 мл/100 г/мин развивается необратимые нейрональное повреждение и гибель нейронов
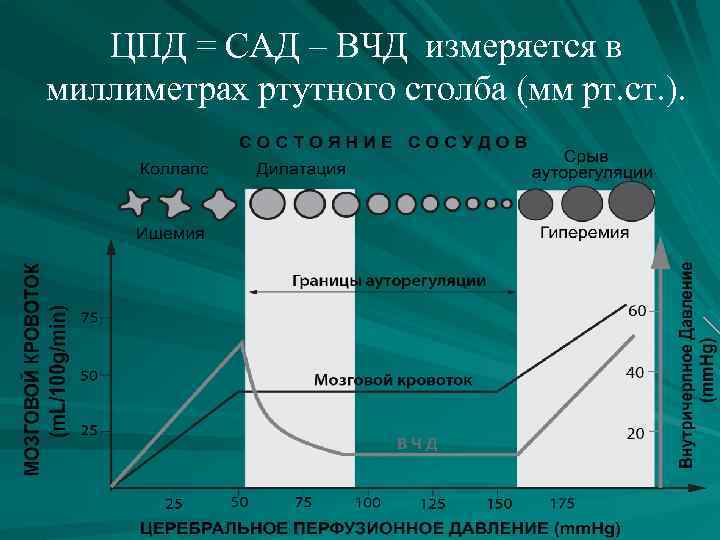
ЦПД = САД – ВЧД измеряется в миллиметрах ртутного столба (мм рт. ст. ).

2. Премедикация Методы: 1. Беседа с больным и его родственниками для оптимизации их психо-эмоционального состояния. 2. Назначение «легких» успокоительных средств и снотворных (последних при выраженных нарушениях сна). 3. Премедикация гипнотиками, наркотическими анальгетиками, транквилизаторами.

3. Основные виды нейрохирургических вмешательств Полушарные супратенториальные опухоли. Опухоли задней черепной ямки. Артериальные аневризмы, оперируемые транскраниально в остром и холодном периоде САК. Артериовенозные мальформации. Окклюзирующие и стенозирующие поражения магистральных сосудов головы и шеи. Опухоли основания черепа, оперируемые транскраниально и с применением «малоинвазивных» методик. Краниофациальные вмешательства. Спинальные нейрохирургические вмешательства. Нейрохирургические вмешательства у детей в аспекте их особенностей. Эндоваскулярные нейрохирургические вмешательства. «малая» нейрохирургия
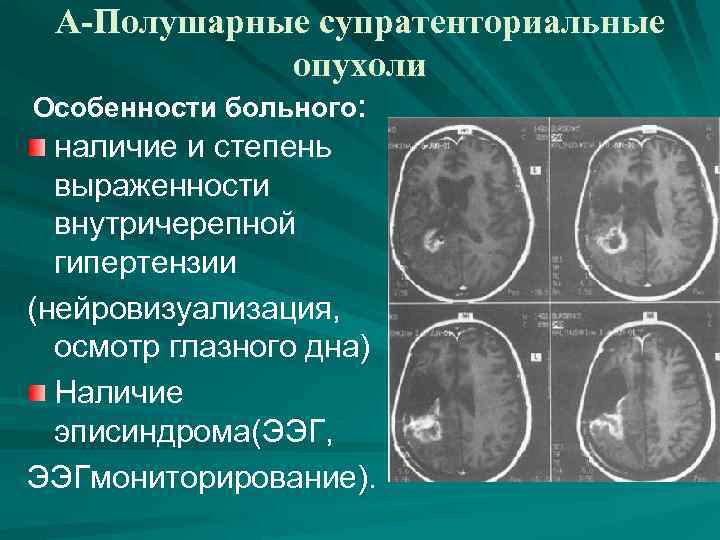
А-Полушарные супратенториальные опухоли Особенности больного: наличие и степень выраженности внутричерепной гипертензии (нейровизуализация, осмотр глазного дна) Наличие эписиндрома(ЭЭГ, ЭЭГмониторирование).

Вспомогательные методы снижения ВЧД: маннитол (инфузия внутривенно за 30 40 минут до момента вскрытия ТМО в быстром темпе в центральную вену 1 г/кг массы тела) острая гипервентиляция болюсное внутривенное введение тиопентала натрия в дозе от 350 до 500 мг на 70 кг МТ люмбальный или вентрикулярный дренаж.

Премедикация У больных находящихся в относительно удовлетворительном состоянии это пероральный прием транквилизаторов (бензодиазепинов) на ночь накануне операции и за 60 – 40 минут до подачи больного в операционную. Допустимо внутримышечная иньекция бензодиазепинов (мидазолам в дозе не более 7, 5 мг на 70 кг МТ) за 15 – 20 минут доподачи больного в операционную. . Индукция и поддержание анестезии. использование внутривенного введения барбитуратов (тиопентал натрия), пропофола, бензодиазепинов (дормикум), кетамина. Обязательным компонентом индукции анестезии должен быть наркотический анальгетик (фентанил в дозе 0, 2 мг/ 70 кг МТ), вводимый после введения гипнотика и на фоне вспомогательной ИВЛ 100% кислородом через маску наркозного аппарата. Только по специальным показаниям допускается индукция другими способами: индукция ингаляционным анестетиком (севофлуран через маску в максимальных концентрациях или другие варианты). Для поддержания анестезии у больных этой группы возможно применение различных методов: закись азота + препараты для нейролептанальгезии; тотальная внутривенная анестезия на основе пропофола и фентанила; закись азота + ингаляционные анестетики (севофлуран, изофлуран). В последнем случае следует помнить, что все ингаляционные анестетики увеличивают внутричерепной объем крови и внутричерепное давление (ВЧД), в особенности у больных с исходной внутричерепной гипертензией, поэтому их следует использовать у этих больных только на фоне гипервентиляции. Эффективным добавлением к схеме поддержания анестезии является местная и регионарная анестезия скальпа раствором местного анестетика (предпочтительно 1 % наропин), выполняемая анестезиологом после индукции анестезии.

Мониторинг: ( АД, ЧСС, капнография, пульсовая оксиметрия, ЦВД, ЭКГ в трех отведениях, ЭЭГ-мониторинг). Сосудистый доступ: катетеризация периферической вены. Показанием для катетеризации центральной вены является: прогнозируемый большой объем операционной кровопотери, необходимость проведения большой по объему инфузионно-трансфузионной терапии, риск воздушной эмболии (больные, оперируемые в положении сидя) Инфузионно-трансфузионная терапия (определяется исходным волемическим статусом больного, объемом операционной кровопотери, специальными задачами (необходимость дегидратации и т. д. ). . Исходя из влияния инфузионных раствров на систему гемостаза для профилактики индуцированных нарушений (гипокоагуляции) рекомендуется следующая последовательность выбора инфузионных раствров – синтетических коллоидов: гелофузин, волювен, гиперхаес, кристаллоиды (физиологический раствор, калия-магния аспарагинат, раствор рингера). Показаниями (триггерами) для провдения трансфузионной терапии в ходе операции являются: снижение уровня Hb менее 7 г/дл – для донорской эритромассы (для больных с тяжелой ИБС – не ниже 9 – 10 г/дл), увеличение АЧТВ более 35 секунд и снижение ПИ менее 50% - для свежезамороженной плазмы, снижение уровня тромбоцитов менее 80 тыс/мкл – для тромбоконцентрата Окончание анестезии пробужден максимально быстро для проведения динамического неврологического контроля с целью ранней диагностики такого грозного осложнения раннего послеоперационного периода, как формирование послеоперационной гематомы. Показаниями для продленной седации и ИВЛ являются тяжелые осложнения в ходе операции, тяжелая соматическая патология у больного.
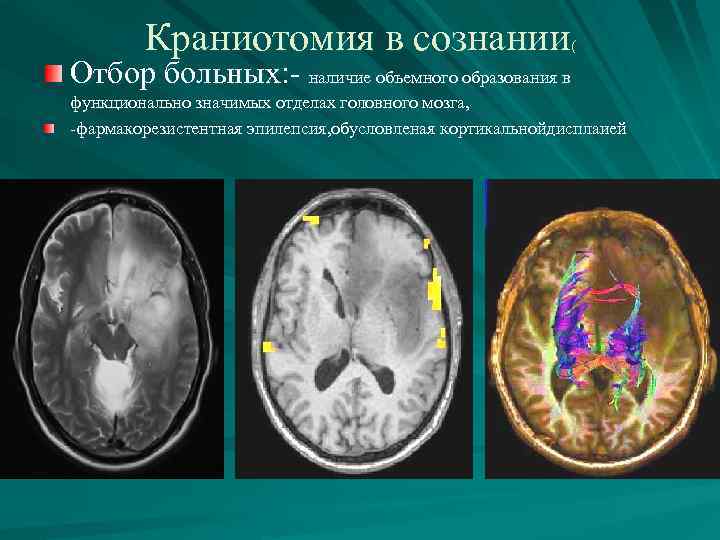
Краниотомия в сознании ( Отбор больных: - наличие объемного образования в функционально значимых отделах головного мозга, -фармакорезистентная эпилепсия, обусловленая кортикальнойдисплаией

BIS мониторинг Биспектральный индекс был разработан компанией Aspect Medical Systems в 1994 году именно для оценки уровня . сознания во время анестезии Определяется индекс глубины наркоза (Cerebral State Index = CSI), который используется для оценки уровня сознания пациента.

Анестезиологические подходы (по данныи Кулекова А. С. Москва 2012, n=106) 1. Инфузия пропофола в дозах 2 -4 мг/кг/ч без протекции дыхательных путей (74 пациента, 65 из которых составляли ретроспективную группу, данные о которой анализировались на основе медицинских документов), 2. Инфузия пропофола в дозах 4 -5 мг/кг/ч с использованием ларингеальной маски и ИВЛ (6 пациентов), 3. Ксеноновая анестезия (14 пациентов), и 4. Инфузия дексмедетомидина в дозах 0, 7 -1, 4 мкг/кг/ч (12 пациентов).
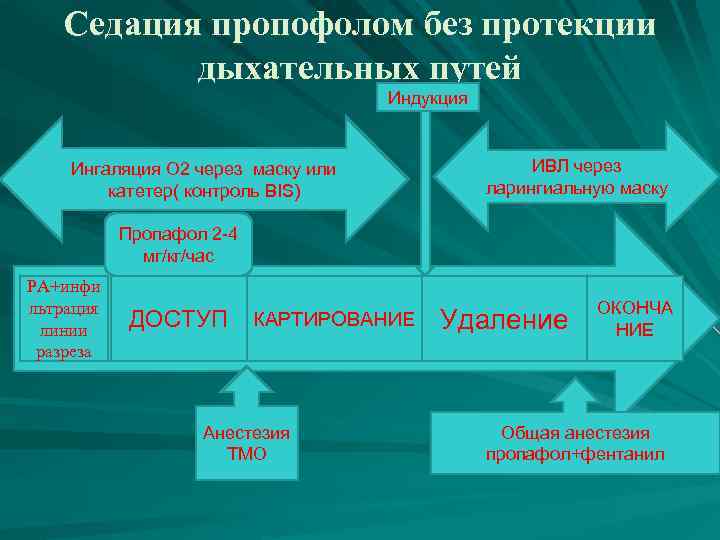
Седация пропофолом без протекции дыхательных путей Индукция Ингаляция О 2 через маску или катетер( контроль BIS) ИВЛ через ларингиальную маску Пропафол 2 -4 мг/кг/час РА+инфи льтрация линии разреза ДОСТУП КАРТИРОВАНИЕ Анестезия ТМО Удаление ОКОНЧА НИЕ Общая анестезия пропафол+фентанил
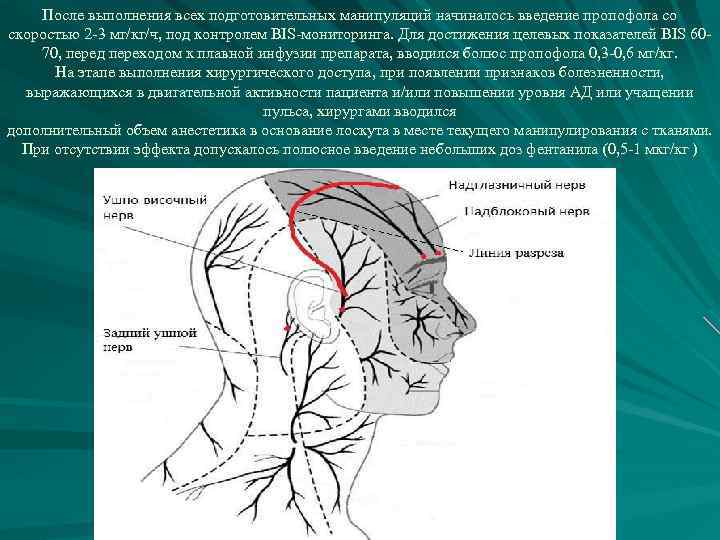
После выполнения всех подготовительных манипуляций начиналось введение пропофола со скоростью 2 -3 мг/кг/ч, под контролем BIS-мониторинга. Для достижения целевых показателей BIS 6070, перед переходом к плавной инфузии препарата, вводился болюс пропофола 0, 3 -0, 6 мг/кг. На этапе выполнения хирургического доступа, при появлении признаков болезненности, выражающихся в двигательной активности пациента и/или повышении уровня АД или учащении пульса, хирургами вводился дополнительный объем анестетика в основание лоскута в месте текущего манипулирования с тканями. При отсутствии эффекта допускалось полюсное введение небольших доз фентанила (0, 5 -1 мкг/кг )
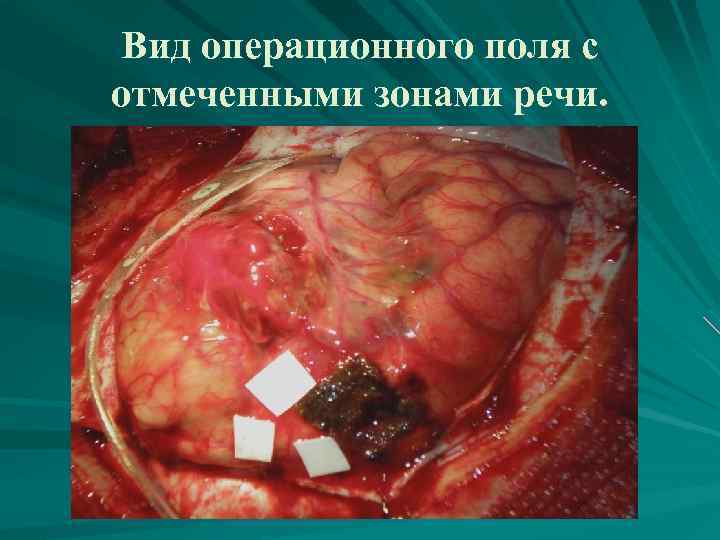
Вид операционного поля с отмеченными зонами речи.
Седация пропофолом с использованием ларингиальной маски и ИВЛ через ларингиальную маску Пропафол 4 -5 мг/кг/час РА+инфи льтрация линии разреза ДОСТУП Индукция КАРТИРОВАНИЕ Анестезия ТМО Удаление ОКОНЧА НИЕ Общая анестезия
Ксеноновая анестезия ИВЛ через ларингиальную маску Пропафол 4 -5 мг/к г/час. Режим ксеноновой анестезии по закрытому контуру с целевым Fi. O 2 – 30% и концентрацией ксенона 55 -65% РА+инфи льтрация ДОСТУП линии разреза Индукция КАРТИРОВАНИЕ Анестезия ТМО Удаление ОКОНЧА НИЕ Общая анестезия
Седация дексмедетомидином Ингаляция О 2 через маску или катетер ( контроль BIS) ИВЛ через л/м Дексмедетомидин 0, 7 -1, 4 мкг/кг/ч 0, 1 -0, 2 мкг/кг/ч РА+инфил ьтрация линии разреза ДОСТУП КАРТИРОВАНИЕ Анестезия ТМО Удаление Индукция ОКОНЧА НИЕ Общая анестезия

Выводы 1 -. Седация пациента с помощью инфузии пропофола без протекции дыхательных путей обеспечивает эффективное картирование речевых зон головного мозга при проведении краниотомии в сознании в 85% случаев. Однако в 80% случаев эта методика сопровождается клинически значимым угнетением дыхания. 2 -Использование ларингеальной маски на этапе выполнения хирургического доступа является удобной и эффективной методикой обеспечения адекватной вентиляции легких в ходе проведения краниотомии в сознании. При этом использование этого метода не приводит к снижению эффективности картирования речевых зон. 3 -Ксеноновая анестезия является высокоэффективным методом анестезиологического обеспечения краниотомии в сознании. Эта методика обеспечивает ультрабыстрое и качественное пробуждение пациента для проведения картирования в течение 5 минут 4 -Седация дексмедетомидином обеспечивает ровный и комфортный уровень седации пациента по ходу проведения краниотомии в сознании, позволяющий успешно проводить картирование речевых зон. При этом гарантируется сохранность дыхательной функции и гемодинамическая стабильность.
Опухоли задней черепной ямки Особенности больного: наличие нарушений статики – походки (ограничение подвижности –> вынужденный постельный режим –> снижение ОЦК), наличие бульбарных нарушений (возможность аспирации, аспирационной пневмонии, высокая толерантность к нахождению интубационной трубки в трахее, необходимость зондового питания), локализация опухоли в структурах каудального ствола (гемодинамические реакции в ходе удаления, возможность центральных нарушений дыхания в послеоперационном периоде – возможность проведения мониторинга самостоятельного дыхания во время удаления опухоли), наличие окклюзионной гидроцефалии (высокие цифры ВЧД, окклюзионные приступы, возможность развития пневмоцефалии в послеоперационном периоде), тошнота и рвота центрального генеза ). (снижение питания, высокая частота ПОТР

Премедикация У больных находящихся в относительно удовлетворительном состоянии это пероральный прием транквилизаторов (бензодиазепинов) на ночь накануне операции и за 60 – 40 минут до подачи больного в операционную. Допустимо внутримышечная иньекция бензодиазепинов (мидазолам в дозе не более 7, 5 мг на 70 кг МТ) за 15 – 20 минут доподачи больного в операционную. . Индукция и поддержание анестезии. с учетом особенностей предоперационного состояния больного (наличие гиповолемии, выраженной внутричерепной гипертензии, сопутствующей соматической патологии). В связи с высоким риском развития такого осложнения, как венозная воздушная эмболия, закись азота не должна использоваться (эффект экспансии объема воздушного эмбола), а режим ИВЛ должен соответствовать умеренной гиперкапнии (Ра. СО 2 = 43 – 45 мм рт ст), во всяком случае на этапах наиболее опасных в отношении воздушной эмболии (кожный 19 разрез, трепанация, зашивание раны). Наиболее оптимальным гипнотиком для выключения сознания у больных данной группы является пропофол. Использование в качестве анальгетического компонента локо-регионарной анестезии является предпочтительным. Из соображений обеспечения оптимальных условий для проведения интраоперационного нейрофизиологического мониторинга обычная схема применения миорелаксантов может быть изменена: 1 вариант – применение сукцинилхолина для интубации трахеи и пипекурония бромида сразу же после индукции анестезии в суммарной дозе 4 мг (1 мг депримирующая доза + 3 мг поддерживающая) при мониторинге функции лицевого нерва у больных мг депримирующая доза + 3 мг поддерживающая) при мониторинге функции лицевого нерва у больны с невриномой 8 го нерва; 2 вариант – применение только сукцинилхолина в комбинации с депримирующей дозой пипекурония бромида и, при необходимости, дополнительного болюсного введения сукцинилхолина по ходу операции в дозе 50 – 70 мг/ 70 кг МТ – при проведении мониторинга функции краниальных нервов.

Мониторинг: ( иваз. АД, ЧСС, капнография, пульсовая оксиметрия, ЦВД, ЭКГ в трех отведениях, ЭЭГ-мониторинг). Сосудистый доступ: катетеризация периферической и центральной вены. Показанием для катетеризации центральной вены является: прогнозируемый большой объем операционной кровопотери, необходимость проведения большой по объему инфузионнотрансфузионной терапии, риск воздушной эмболии (больные, оперируемые в положении сидя) Инфузионно-трансфузионная терапия (определяется исходным волемическим статусом больного, объемом операционной кровопотери, специальными задачами (необходимость дегидратации и т. д. ). . Исходя из влияния инфузионных раствров на систему гемостаза для профилактики индуцированных нарушений (гипокоагуляции) рекомендуется следующая последовательность выбора инфузионных раствров – синтетических коллоидов: гелофузин, волювен, гиперхаес, кристаллоиды (физиологический раствор, калия-магния аспарагинат, раствор рингера). Показаниями (триггерами) для провдения трансфузионной терапии в ходе операции являются: снижение уровня Hb менее 7 г/дл – для донорской эритромассы (для больных с тяжелой ИБС – не ниже 9 – 10 г/дл), увеличение АЧТВ более 35 секунд и снижение ПИ менее 50% - для свежезамороженной плазмы, снижение уровня тромбоцитов менее 80 тыс/мкл – для тромбоконцентрата Окончание анестезии. Наличие или даже прогнозирование выраженных бульбарных нарушений у больного, даже при условии полного восстановления сознания и мышечного тонуса, является основанием для продленной интубации трахеи, а возможно, и для проведения ранней трахеостомии
Артериальные аневризмы острый периол САК) Особенности больного: Тяжесть состояния больных с аневризматическим САК в остром периоде кровоизлияния может быть различной: от относительно удовлетворительного (больные I – II класса по классификации Ханта. Хесса) до тяжелого и крайне тяжелого (IV – V по Ханту-Хессу). К счастью больные IV – V классов оперируются редко из-за крайне высоких цифр неблагоприятных исходов (70 – 80%). У больных в остром периоде САК имеют место выраженные нарушения со стороны сердечно-сосудистой системы (артериальная гипертония, нарушения ритма и проводимости сердца, ишемические изменения на ЭКГ, носящие функциональный характер, различной степени выраженности гиповолемия) и других внутренних органов (респираторная система, почки), а так же выраженные нарушения со стороны эндокринно-метаболических параметров (гипонатриемия, гипокалиемия, гипомагнезиемия, гипергликемия). Примерно у трети этих больных имеет место гидроцефалия и повышенные значения ВЧД. Однако наиболее неприятным последствием САК является церебральный вазоспазм, развивающийся практически у всех больных и являющийся основной причиной отсроченной церебральной ишемии. При предоперационной оценке больного с аневризматическим САК анестезиолог должен оценить его состояние в двух аспектах: 1. Тяжесть церебрального повреждения (оценка тяжести состояния по шкале Ханта. Хеса, значения скорости линейного кровотока по СМА в зоне вазоспазма, наличие гидроцефалии и ВЧГ). 2. Наличие и выраженность сопутствующей соматической патологии.

Премедикация (Таблетированная пероральная премедикация бензодиазепинами применима у больных I – II класса по Ханту и Хесу. Целесообразно дополнить ее сублингвальным клофелином для профилактики стрессовой артериальной гипертензии (следует помнить о возможности постуральной гипотензии). Внутримышечное применение мидазолама так же возможно за 10 – 15 минут до подачи больного в операционную (контроль внешнего дыхания!). . Индукция и поддержание анестезии. Индукция анестезии является одним из наиболее серьезных моментов у этих больных. С одной стороны - не следует проводить излишне глубокую индукцию (депрессия системной гемодинамики на фоне утраты механизмов ауторегуляции мозгового кровотока), с другой стороны – опасность повышения АД на фоне поверхностной анестезии (прессорная реакция на ларингоскопию и интубацию трахеи) с реальной опасностью разрыва аневризмы и рецидива САК. Оптимальной комбинацией является сочетание барбитуратов в дозе 400 – 500 мг/ 70 кг МТ и фентанила в дозе 0, 2 – 0, 3 мг/ 70 кг МТ. У больных с тяжелой гипертонией и при других обстоятельствах (например, прогнозируемые трудности при интубации трахеи) оправдана катетеризация лучевой артерии под местной анестезией до индукции анестезии, применение метода двойного тиопенталового болюса или внутривенная инфузия раствора нитроглицерина под контролем значений АД.

Мониторинг: ( иваз. АД, ЧСС, капнография, пульсовая оксиметрия, ЦВД, ЭКГ в трех отведениях, ЭЭГ-мониторинг, измерение температуры пищеводным датчиком церебральная или югулярная оксиметрия, электролиты, осмоляльность, КОС и газовый состав артериальной крови, глюкоза ). Сосудистый доступ: катетеризация периферической и центральной вены. Инфузионно-трансфузионная терапия (определяется исходным волемическим статусом больного, объемом операционной кровопотери, специальными задачами (необходимость дегидратации и т. д. ). . Исходя из влияния инфузионных раствров на систему гемостаза для профилактики индуцированных нарушений (гипокоагуляции) рекомендуется следующая последовательность выбора инфузионных раствров – синтетических коллоидов: гелофузин, волювен, гиперхаес, кристаллоиды (физиологический раствор, калия-магния аспарагинат, раствор рингера). Показаниями (триггерами) для провдения трансфузионной терапии в ходе операции являются: снижение уровня Hb менее 7 г/дл – для донорской эритромассы (для больных с тяжелой ИБС – не ниже 9 – 10 г/дл), увеличение АЧТВ более 35 секунд и снижение ПИ менее 50% - для свежезамороженной плазмы, снижение уровня тромбоцитов менее 80 тыс/мкл – для тромбоконцентрата Окончание анестезии После окончания операции больной должен быть пробужден как можно раньше для проведения динамического неврологического контроля. Продленная анестезия допускается в случаях развития интраоперационных осложнений, не корригированной гипотермии, тяжелых сопутствующих соматических осложнений. Больные, оперированные в остром периоде САК, после окончания операции поступают только в отделение реанимации - интенсивной терапии.

послеорперационный болевой синдром гемодинамические (АГ с риском образования послеоперационной гематомы + возможность обострения кардиальных проблем у пациентов с ИБС) метаболические нарушения (прежде всего гипергликемия, которая достоверно ухудшает исходы течения церебральной ишемии и увеличивает риск инфекционных осложнений). Юкстамедуллярное шунтирование почечного кровотока на фоне гиперкатехоламинемии, обусловленной послеоперационным болевым синдромом, ведет к снижению диуреза и задержкежидкости, а это фактор развития отеков и в том числе отека мозга. психоэмоциональ. Психоэ-моциональный дискомфорт Хронизация болевого синдрома

Методы купирования п/о болевого синдрома: Использование локо-регионарной анестезии во время доступа (инфильтрацию краев раны раствором местного анестетика) ≪patient control analgesisa≫ морфином инфузионный парацетамол, ЦОГ- 2 ингибиторы, Центральные α 2 -адреноагонисты (клонидин и дексметомедин) препарата лорноксикама(ксефокам), причем не в режиме ≪по требованию≫, а с использованием принципа ≪preemptive analgesia≫, т. е. введение лорноксикама по схеме с периода операции использование трансдермальных форм фентанила (дюрогезик матрикс). Использование продленной эпидуральной аналгезии и аналгезии области операционной раны в спинальной нейрохирургии.
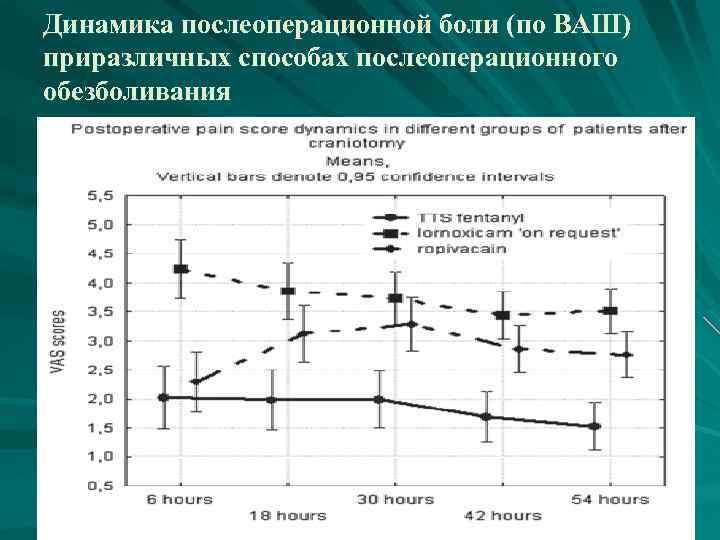
Динамика послеоперационной боли (по ВАШ) приразличных способах послеоперационного обезболивания
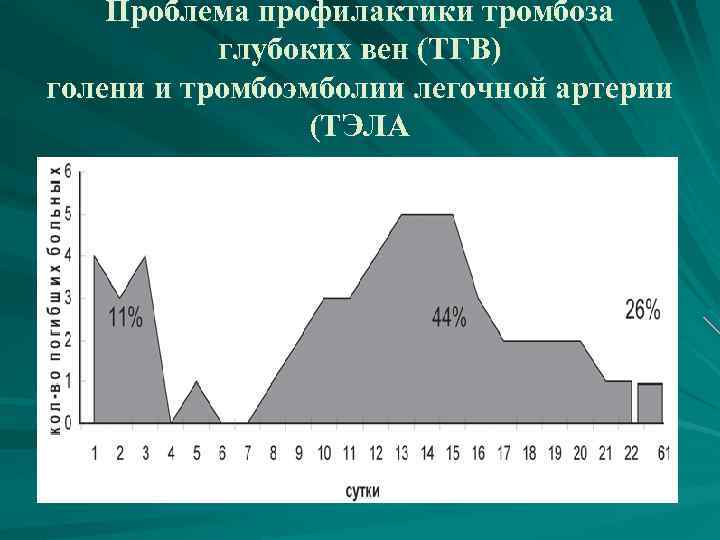
Проблема профилактики тромбоза глубоких вен (ТГВ) голени и тромбоэмболии легочной артерии (ТЭЛА

Спасибо за внимание!

Список используемой литературы: Протоколы анестезиологического обеспечения при основных видах нейрохирургических вмешательств, Москва 2008 Лубнин А. Ю. Практические проблемы современной нейроанестезиологии , Москва 2011 Исраелян Л. А. , Лубнин А. Ю. Применение гиперосмолярных солевых растворов у больных с пораженным . мозгом. 2007; 3: 53— 58 Исраелян Л. А. , Лубнин А. Ю. Влияние комбинированного гипертонического коллоидного раствора гиперхаес на гемодинамические показатели, показатели транспорта кислорода, ВЧД и церебральную оксигенацию. Анестезиол и реаниматол 2008; 2: 31— 36. Исраелян Л. А. , Лубнин А. Ю. , Громова В. В. и др. Тромбоэластография как метод предоперационного скрининга состояния системы гемостаза у нейрохирургических больных. Анестезиол и реаниматол 2009; 3: 24— 30. Петриков С. С. Коррекция вторичных поражений головного мозга у больных внутричерепными кровоизлияниями: Автореф. дис. д-ра мед. наук. М 2009. Lobo F. , Beiras A. Propofol and remifentanil effect-side concentrations estimated by pharmacokinetic simulation and BIS monitoring during craniotomy with intraoperative awakening for brain tumor surgery. JNeurosurg Anesth 2007; 19: 183— 189. Pauls R. J. , Dickson T. J. , Kaufmann A. M. et al. A comparison of the ability of the EEGo and BIS monitors to assess emergence following neurosurgery. Can J Anaesth 2009; 56: 366— 373. Powers K. S. , Nazarian E. B. , Tapyrik S. A. et al. BIS as a guide for titration of pro-pofol during procedural sedation among children. Pediatrics 2005; 115: 1666— 1674. Маркина М. С. , Лубнин А. Ю. , Мадорский С. В. и др. Венозные тромбозы и ТЭЛА у нейрохирургических больных. Анестезиол и реаниматол 2008; 2: 82— 85. Кулеков А. С. Анестезиологическое обеспечение краниотомии в сознании при удалении объемных образований, прилежащих к речевым зонам головного мозга Автореф 2013 Куликов А. С. , Лубнин А. Ю. Дексмедетомидин: новые возможности в анестезиологии. //Анестезиология и реаниматология. 2013; № 1, с 37 -41. Лубнин А. С. , Куликов А. С. , Кобяков Г. Л. , Гаврилов А. Г. Краниотомия в сознании. // Анестезиология и реаниматология. 2012; № 4, с. 28 -37.
ЦНС Особенности нейроанестезиологии 34 слайда.ppt