ЛК 9 Основы химии радикалов.pptx
- Количество слайдов: 24

Основы химии радикалов

Немного об истории радикалов 2

Радикалом называют частицу (атом, ион, молекулу или ее часть) обладающую одним или несколькими электронами. Для органического синтеза наибольшее значение имеют радикалы, содержащие неспаренные электроны у атома углерода. 3

Химические свойства свободных радикалов 1. Реакции образования свободных радикалов Образование свободных радикалов и атомов происходит при гомолитическом разрыве ковалентной связи в молекуле: Энергии разрыва связей лежат в основном в диапазоне 200 -500 к. Дж/моль. 4
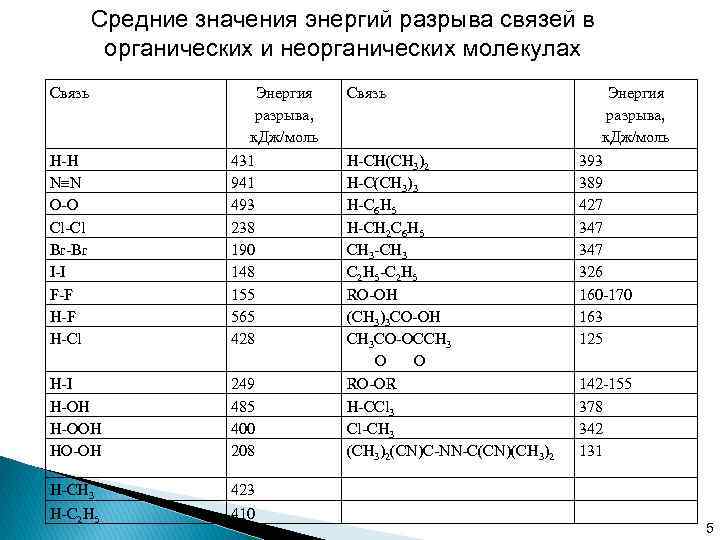
Средние значения энергий разрыва связей в органических и неорганических молекулах Связь Энергия разрыва, к. Дж/моль Н-Н N N O-O Cl-Cl Br-Br I-I F-F H-Cl 431 941 493 238 190 148 155 565 428 H-I H-OH H-OOH HO-OH 249 485 400 208 H-CH 3 H-C 2 H 5 423 410 Связь H-CH(CH 3)2 H-C(CH 3)3 H-C 6 H 5 H-CH 2 C 6 H 5 CH 3 -CH 3 C 2 H 5 -C 2 H 5 RO-OH (CH 3)3 CO-OH CH 3 CO-OCCH 3 O O RO-OR H-CCl 3 Cl-CH 3 (CH 3)2(CN)C-NN-C(CN)(CH 3)2 Энергия разрыва, к. Дж/моль 393 389 427 347 326 160 -170 163 125 142 -155 378 342 131 5

Способы инициирования радикалов а) термическое инициирование чтобы время полураспада составляло 2 часа для расщепления молекулы Cl 2 требуется 480 С, а для разрыва связи С-С в алканах – около 700 С. Азометан довольно легко распадается с образованием двух метильных радикалов, так как затрата энергии на разрыв двух связей С-N компенсируется при образовании прочной N N: 6

При фторировании углеводородов тепловой эффект образующейся связи HF (565 к. Дж/моль) полностью компенсирует, а иногда и перекрывает затраты тепла на разрыв связей С-Н (в среднем 400 к. Дж/моль) и F-F (155 к. Дж/моль). Такие процессы идут с выделением тепла и могут протекать самопроизвольно при температурах ниже 0 С: 7

Легко распадаются: • связи О-О в гидроперексидах и перекисидах, азо-бис-нитрилах: • пероксид водород сам распадается на радикалы в интервале температур 50 -115 С: • третичные алкилпероксиды (пероксид третичного бутила) полураспада = 200 ч (100 С) 8

• диацилпероксиды (пероксид ацетила, полураспада -8, 1 ч. (70 С)) • диарилпероксиды (пероксидбензоил полураспада =7, 3 ч. (70 С)) • азосоединения (диниз полураспада =17 ч. (60 С), 2 ч. (80 С), 0, 1 ч. (100 С)) 9

Итак – вещества, способные распадаться на свободные радикалы при температурах более низких, чем температуры, при которых могут вступать в реакцию вещества в их отсутствии, называются – инициаторы. Требования к инициаторам: • достаточная реакционная способность образующихся радикалов; • возможность регулирования скорости образования радикалов. 10

б) фотохимическое инициирование - называют разрыв связей вызванный поглощением ультрафиолетового излучения. При потери энергии возможны следующие процессы: • возврат к исходному состоянию, при этом избыточная энергия излучается (флуоресценция); • безизлучательный переход в менее энергетически возбужденное триплетное состояние с изменением знака спина: oтриплетное состояние может вернуться к исходному состоянию с излучением (фосфоренценция) oлибо претерпеть гомолитический распад с образованием радикалов с неспаренными электронными спинами. 11

Световая энергия достаточная для превращения одного моля вещества называется эйнштейном, который равен 12/ Дж/моль. Важной характеристикой эффективности фотохимических реакций считают квантовый выход, являющийся отношением числа прореагировавших молекул к числу поглощенных фотонов Энергия, необходимая для разрыва С-Н связи 370 -420 к. Дж/моль для разрыва С-С связи 335 -355 к. Дж/моль, Для С=С, С=О связей - границы проницаемости кварца (200 -300 нм)? 12

в) радиационно-химическое и другие виды инициирования излучением: • ренгеновские • и -излучения от радиоактивных источников или ускорителей. При облучении бензола пучком электронов с энергией 70 э. В можно обнаружить 44 промежуточных соединений. В настоящее время промышленное использование радиации ограничивается только синтезом и модификацией некоторых простых полимеров (полиэтилена). 13

г) электрохимические методы Среди образующихся частиц обнаружены радикалы, анионрадикалы и катион-радикалы. Ацетилирование ароматических углеводородов на аноде: Метанол на аноде является источником метоксильных радикалов: Однако ввиду малой селективности и производительности электрохимические методы инициирования редко используются в практике. 14

д) каталитические методы (окислительно-восстановительное инициирование) Общая схема процесса: Особенно часто используются для этих целей соли двухвалентного железа: Образовавшийся ион Fe(3+) может реагировать с новой молекулой пероксида: Однако, часть ионов может вступать в реакцию с радикалом, приводя к его уничтожению: 15

2. Реакции внутренних превращений радикалов К данному типу относят реакции разложения (фрагментации, элиминирования) и перегруппировки (изомеризация). Общее уравнение реакций разложения: К такому типу процессов относят реакции распада первичных радикалов, образовавшихся при разложении перекисей: 16

Второй тип внутрирадикальных реакций – перегруппировки. В качестве примера можно рассмотреть 1, 2 – миграцию арильных групп, галогенов, винильных, ацильных и ацетоксигрупп: 17

3. Реакции свободных радикалов с другими веществами: • реакции с другими веществами; реакции с другими веществами разделяются на 2 основных типа – реакции присоединения и реакции замещения • реакции их исчезновения путем рекомбинации или диспропорционирования. 18

Первая стадия присоединения радикала к ненасыщенной связи приводит к образованию нового промежуточного радикала: 19

Вторую группу составляют реакции замещения как в алифатическом, так и ароматическом ряду. Прямое замещение в них сразу не происходит, так как реакции идут в 2 стадии: и т. д. Все радикалы обнаруживают одинаковый общий порядок реакционной способности по отношению к положению связи С-Н в алканах: R 3 C-H R 2 CH-H RCH 2 -H CH 3 -H Это подтверждается величинами относительных скоростей газофазного хлорирования углеводородов: СН 4 (1) С 2 Н 6 (3) С 3 Н 8 (462) трет-С 4 Н 10 (590) 20
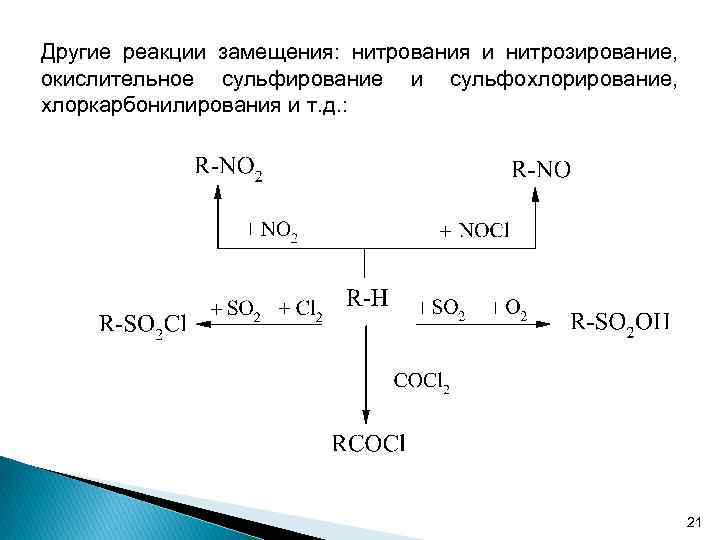
Другие реакции замещения: нитрования и нитрозирование, окислительное сульфирование и сульфохлорирование, хлоркарбонилирования и т. д. : 21

Сложнее протекает реакция окисления: Возникает индукционный период (замедление) в течении которого накапливаются радикалы R. Дальнейший процесс связан с образованием и реакциями пероксидных радикалов и гидропероксидов: 22
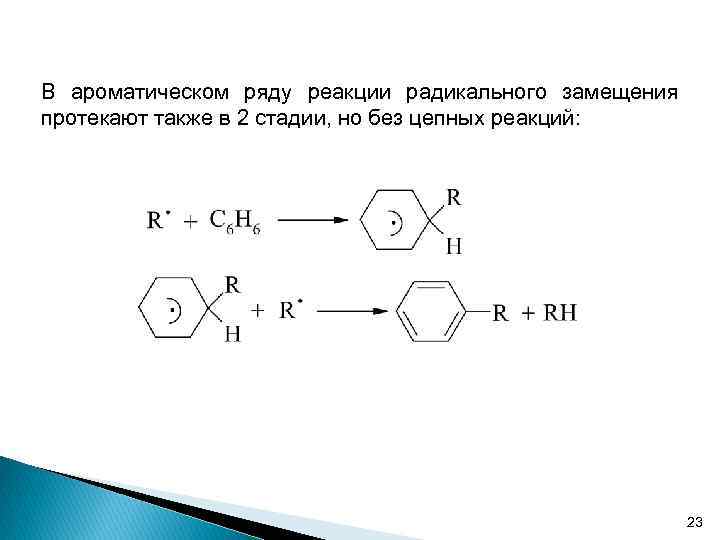
В ароматическом ряду реакции радикального замещения протекают также в 2 стадии, но без цепных реакций: 23

4. Реакции исчезновения радикалов Существуют две основные реакции исчезновения радикалов – рекомбинация (1 -3) и диспропорционирование (4): Обе реакции термодинамически почти равновероятны и имеют малые или нулевые энергии активации. Рекомбинация замедляется с ростом размеров и разветвленности радикалов – в этих случаях возрастает роль реакции диспропорционирования. Ему также способствует повышение температуры. 24
ЛК 9 Основы химии радикалов.pptx