Lektsia_1_MS.ppt
- Количество слайдов: 42

Основы взаимодействия биомолекул к. х. н. , доцент В. В. Коваль, д. х. н. , доцент Д. В. Пышный Кафедра молекулярной биологии Факультет естественных наук Новосибирский национальный исследовательский государственный университет

Основные темы курса • Биологическая масс-спектрометрия • Биосенсоры в определении взаимодействия молекул • Системы регистрации биомолекул в реальном времени • Детектирование одиночных молекул • Биологические моторы (машины) • Основные направления исследований в области бионанотехнологии • Описание эффективности комплексобразования НК • Гибридизационный анализ НК • Молекулярно импринтированные полимеры • Компьютерное моделирование комплексов биомолекул

Литература • И. Сердюк, Н. Заккаи, Дж. Заккаи. Методы в молекулярной биофизике. Структура, функция, динамика. 2 т. 2009 • I. N. Serdyuk, N. R. Zaccai, J. Zaccai. Methods in Molecular Biophysics. Structure, Dynamics, Function. 2007 • А. В. Финкельштейн, О. Б. Птицын. Физика белка. 2012 • В. Зенгер. Принципы структурной организации нуклеиновых кислот. 1987 • P. A. Serra. Biosensors. 2010 • Б. Эггинс. Химические и биологические сенсоры. Москва: Техносфера. 2005. • Г. Г. Хаммес. Методы исследования быстрых реакций. 1977 • J. H. Gross. Mass Spectrometry. 2011 • Р. Г. Ефремов, К. В. Шайтан. Молекулярное моделирование нано- и биоструктур. НОУ ДПО «Институт информационных технологий «Ай. Ти» , 2010

1 - 2 сентября 2010 г. Новосибирск СОВРЕМЕННАЯ БИОЛОГИЧЕСКАЯ МАСС-СПЕКТРОМЕТРИЯ (протеомика и метаболомика) 11 сентября 2014

МАСС-СПЕКТРОМЕТРИЯ БЕЛКОВ И ПЕПТИДОВ Общий вопрос - что измеряется? m/z Масс- спектрометрия – расчет молекулярной массы ионов по их поведению в электрических и/или магнитных полях

Типы ионов Положительные: - захват протона либо другого катиона (Na, K); - потеря электрона (катион-радикал). Отрицательные: - утрата протона; - захват электрона. Общая схема масс-спектрометра Источник ионов MALDI ESI Система разделения ионов Времяпролетные (TOF) Квадрупольные (Q) Ионные ловушки (IT) Ионно-циклотронного резонанса (ICR-FT) Детектор Микроканальные пластины (MCP) Диноды Магнит (ICR-FT)
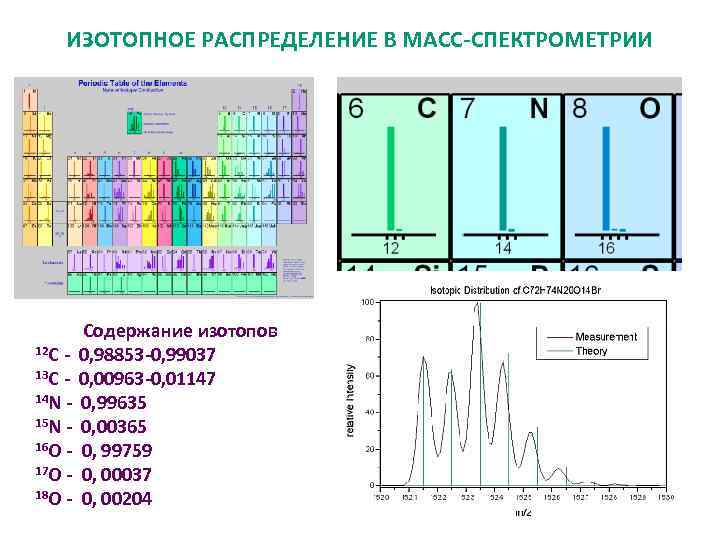
ИЗОТОПНОЕ РАСПРЕДЕЛЕНИЕ В МАСС-СПЕКТРОМЕТРИИ 12 С 13 С 14 N 15 N 16 O 17 O 18 O - Содержание изотопов 0, 98853 -0, 99037 0, 00963 -0, 01147 0, 99635 0, 00365 0, 99759 0, 00037 0, 00204
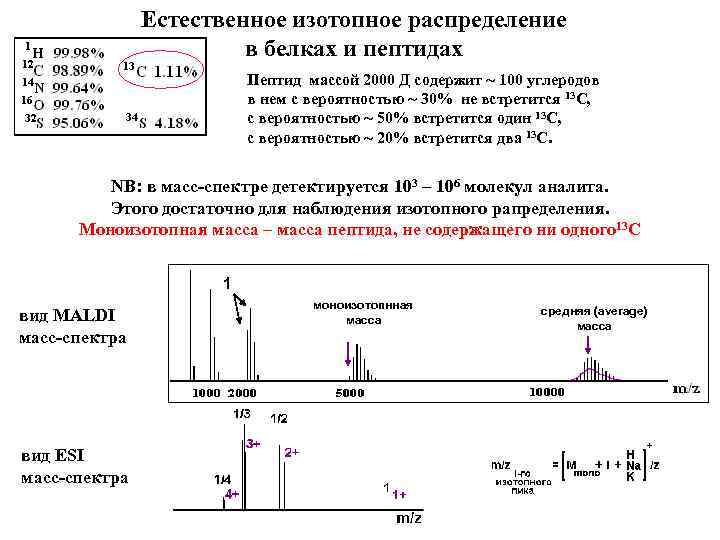
Естественное изотопное распределение в белках и пептидах Пептид массой 2000 Д содержит ~ 100 углеродов в нем с вероятностью ~ 30% не встретится 13 С, с вероятностью ~ 50% встретится один 13 С, с вероятностью ~ 20% встретится два 13 С. NB: в масс-спектре детектируется 103 – 106 молекул аналита. Этого достаточно для наблюдения изотопного рапределения. Моноизотопная масса – масса пептида, не содержащего ни одного 13 С 1 вид MALDI масс-спектра вид ESI масс-спектра моноизотопнная масса средняя (average) масса

Белки и пептиды ADLKQLMDNEVLMAFTSYATIILAKMMFLSSATAFQRLTNKVFANPEDCAGFGKGENAKKFL RTDEKVERVRRAHLNDLENIVPFLGIGLLYSLSGPDLSTALIHFRIFVGARIYHTIAYLTPLPQP NRGLAFFVGYGVTLSMAYRLLRSRLYL (Глутатион-трансфераза человека) пептидная связь аминокислотный остаток Моноизотопные массы аминокислотных остатков 9

Пептидный фингерпринт SAPASTTQPIGSTTSTTTKTAGATPATASGLFTIPDGDFFSTARAIVASNAVATNEDLSKIEAIWK DMKVPTDTMAQAAWDLVRHCADVGSSAQTEMIDTGPYSNGISRARLAAAIKEVCTLRQFCM KYAPVVWNWMLTNNSPPANWQAQGFKPEHKFAAFDFFNGVTNPAAIMPKEGLIRPPSEAEM NAAQTAAFVKITKARAQSNDFASLDAAVTRGRITGTTTAEAVVTLPPP (Белок оболочки Х-вируса картофеля) Num From-To MH+ HPLC 1 1 - 19 1836. 92 14, 27 9, 85 SAPASTTQPIGSTTSTTTK 1 1 - 19 1878. 93 14, 27 9, 85 SAPASTTQPIGSTTSTTTK 2 20 - 44 2472. 20 24, 79 3, 92 TAGATPA. . PDGDFFSTAR 3 45 - 60 1602. 83 12, 87 4, 11 AIVASNAVATNEDLSK 4 61 - 66 759. 44 19, 33 6, 99 IEAIWK 5 67 - 69 393. 18 4, 27 6, 99 DMK 6 70 - 84 1673. 83 19, 51 3, 92 VPTDTMAQAAWDLVR 7 85 -109 2595. 13 22, 48 4, 34 HCADVGSS. . GPYSNGISR 8 110 -111 246. 16 9 112 -117 586. 39 12, 82 10, 10 LAAAIK 10 118 -123 719. 36 14, 84 6, 29 EVCTLR 11 124 -128 655. 28 17, 08 8, 68 QFCMK 12 129 -157 3410. 65 28, 07 9, 42 YAPVVWNWM. . QGFKPEHK 13 158 -176 2058. 02 24, 21 6, 97 FAAFDFFNGVTNPAAIMPK 14 177 -198 2330. 18 20, 92 4, 60 EGLIRPPS. . AAQTAAFVK 15 199 -201 361. 25 6, 80 10, 15 ITK 16 202 -203 246. 16 1, 78 11, 20 AR 17 204 -218 18 219 -220 19 221 -236 1, 78 11, 20 1565. 76 14, 77 232. 14 p. I 3, 92 2, 11 11, 15 1567. 86 17, 90 3, 15 Sequence AR AQSNDFASLDAAVTR Трипсин ( /R, K) Стафилококковая протеаза V 8 ( /E) Num From-To MH+ HPLC 1 1 - 56 5430. 68 29, 08 4, 35 SAPASTTQPI…IVASNAVATNE 1 1 - 56 5472. 69 29, 08 4, 35 SAPASTTQPI…IVASNAVATNE 2 57 - 62 704. 38 12, 90 4, 11 DLSKIE 3 63 - 96 3730. 75 28, 42 4, 58 AIWKDMKVPT. . ADVGSSAQTE 4 97 -118 2334. 22 22, 73 9, 58 MIDTGPYSNGISRARLAAAIKE 5 119 -155 4353. 07 35, 01 9, 02 VCTLRQFCMKY…NWQAQGFKPE 6 156 -177 2452. 21 24, 30 7, 58 HKFAAFDFFNGVTNPAAIMPKE 7 178 -185 868. 49 16, 16 7, 04 GLIRPPSE 8 186 -187 219. 10 3, 25 AE 9 188 -228 10 229 -236 1, 83 p. I 4255. 19 24, 38 10, 52 793. 48 14, 07 6, 96 Sequence MNAAQTAAFV…RGRITGTTTAE AVVTLPPP GR ITGTTTAEAVVTLPPP Пептидный калькулятор GPMAW 4. 04

ESI - 1983 John Fenn

MALDI – 1988 Koichi Tanaka

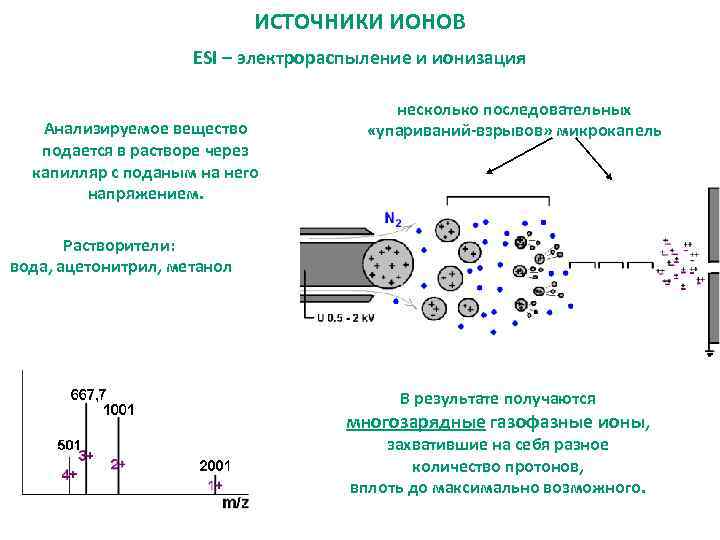
ИСТОЧНИКИ ИОНОВ ESI – электрораспыление и ионизация Анализируемое вещество подается в растворе через капилляр с поданым на него напряжением. несколько последовательных «упариваний-взрывов» микрокапель Растворители: вода, ацетонитрил, метанол В результате получаются многозарядные газофазные ионы, захватившие на себя разное количество протонов, вплоть до максимально возможного.

В масс-анализатор Электрод зе рн ый им пу ль с( 1 - 5 н с) Протонирование Кристаллы матрицыс образцом Мишень/подложка Электрическое поле Ла

MALDI - matrix assisted laser desorption / ionization лазерная десорбция и ионизация в присутствии вспомогательного вещества - матрицы Матрицы для УФ лазера (336 нм) Анализируемое вещество (раствор 10 -4 -10 -8 М, <1 мкл) смешивается с матрицей (раствор 10 -1 -10 -2 М, <1 мкл), высушивается на подложке, образуя кристаллоиды МАТРИЦА: * Поглощает энегрию лазерного излучения, “вскипая”, увлекает в газовую фазу молекулы анализируемого вещества * Способствует ионизации Лазер: 2 нс, 50 -300 мк. Дж/имп , 50 мкм

Пример MALDI масс-спектра: триптический гидролизат фрагмента белка М 1 вируса гриппа MLLTQVQTYVLSIIPSGPLKAEIAQRLEDVFAGKNTDLEVLMEWLKTRPILSPLTKGILGFVFTLTVPSERGLQ RRRFVQNALNGNGDPNNMDKAVKLYRKLKREITFHGAKEISLSYSAGALASCMGLIYNRMGAVTTEVAFGL VCATCEQIADSQHRSHRQMVTTTNPLIRHENRMVLASTTAKAMEQMAGSSEQAAEAMEVASQARQMVQAM RTIGTHPSSSAGLKNDLLENLQAYQKRMGVQMQRFK

MALDI : типы положительных ионов и вид спектра Точный механизм MALDI ионизации неизвестен, однако в результате образуются, как правило, однозарядные газофазные ионы, захватившие протон либо иной катион. DE~100 э. В
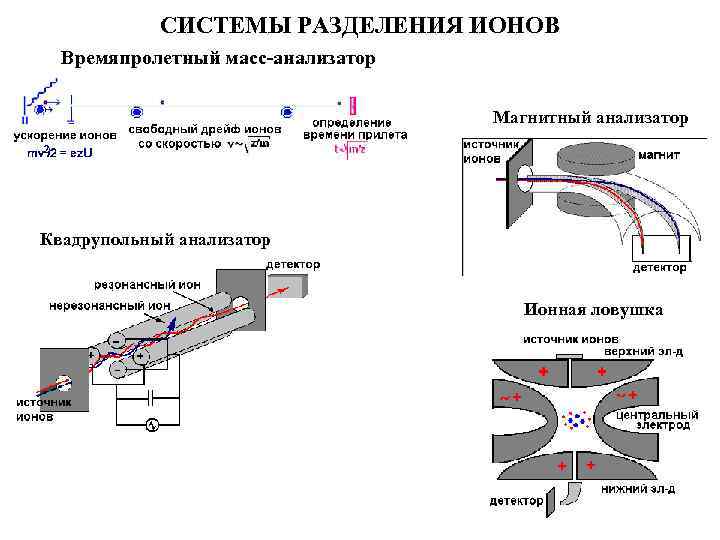
СИСТЕМЫ РАЗДЕЛЕНИЯ ИОНОВ Времяпролетный масс-анализатор Магнитный анализатор Квадрупольный анализатор Ионная ловушка

MALDI-времяпролетный масс-спектрометр с MCP детектором Микроканальные пластины Энергия ускорения 25 кэ. В и длина пути 1 м При MALDI существует разброс по энергиям, приводящий к уширению пиков. При энергии ускорения 20 кэ. В разброс в 100 э. В составляет 0. 5%. Так пик пептида м. в. 1000 Д имел бы ширину на половине высоте около 2 Да !

R - Разрешение m/∆m: (∆m - ширина пика на половине высоты (FWHM)) Зона дрейфа ионов 2500 Da R=5000 ∆m ~ 0. 5 Мишень с образцом Детектор 1 Ускоряющие электроды Линейный режим Зона дрейфа ионов Ускоряющие электроды Детектор 2 (отражательный) Рефлектрон Детектор 1 (линейный) шень бразцом Время пролета Отражательный режим Время пролета ∆m ~ 0. 12


Разрешение и точность MALDI-TOF-MS р а з р е ш е н и е Разрешение до 30 000, точность до 0. 002% (=20 ppm).

Распад ионов в процессе MALDI Когда ион, захвативший избыток энергии в процессе MALDI, распадается в области свободного дрейфа, фрагменты имеют ту же скорость, что и их родительский ион, а энергию - меньшую (~ m)

PSD (post source decay) и TOF-TOF детекция распада ионов во время свободного дрейфа для адекватного отражения дочерних ионов: U 1 ref/U 0 ref = m 1/m 0 набор масс-спектров с разным U рефлектрона компьютерно “сшиваются” в один спектр PSD точность измерения масс фрагментов 0. 02 -0. 1% получается один спектр фрагментации TOF-TOF

Способы фрагментации пептидов LID – фрагментация, индуцированная лазером Пептид поглощает энергию лазера, захваченная энергия перераспределяется по молекуле, разрушается ближайшая слабая связь. Основной тип образовавшихся пептидных фрагментов - b-ионы и y-ионы. Может происходить отщепление модификаций. CID – фрагментация, индуцированная столкновениями Пептид приобретает энергию от столкновений, захваченная энергия перераспределяется по молекуле, разрушается ближайшая слабая связь. Основной тип образовавшихся пептидных фрагментов - b-ионы и y-ионы. Дополнительно образуются a-ионы и x-ионы. Часто происходит отщепление модификаций. ECD – фрагментация, индуцированная захватом медленных электронов Точный механизм неизвестен. Пептид захватывает медленные электроны на азот пептидной связи - мгновенный разрыв пептидной цепи с образованием z- ионов. Не происходит отщепления модификаций.
![Интерпретация спектров распада пептидов TIGTHPSSSAGLK [MH]2+ Интерпретация спектров распада пептидов TIGTHPSSSAGLK [MH]2+](https://present5.com/presentation/105340030_329091911/image-27.jpg)
Интерпретация спектров распада пептидов TIGTHPSSSAGLK [MH]2+

MALDI фрагментация пептидов (LID +CID) Ограничения cиквенирования de-novo при использовании MALDI-TOF-MS : * не бывает равномерного разбиения по всем пептидным связям * не хватает точности измерения для однозначной интерпретации Степень фрагментации зависит от многих параметров и плохо предсказуема. Лабильность пептидной связи убывает в ряду D/P D/ E/ N/ Q/ l/ L/ T/ S/ A/ V/…

ESI – ионная ловушка с МСР детектором На верхний и нижний электроды подано постоянное положительное напряжение. На короткое время отталкивающее напряжение с верхнего электрода снимается, позволяя пакету ионов влететь в ловушку. На центральном электроде быстропеременное напряжение, которое заставляет ионы всех m/z двигаться со своими частотами по своим орбитам. Затем подается напряжение, последовательно вытягивающее ионы согласно их m/z. Ионные ловушки позволяют, варьируя напряжения, оставлять в ловушке определенные ионы и получать спектры их фрагментов. При этом возможен ряд последовательных фрагментаций иона. Характеристиками ловушки являются: ёмкость (верхнее значение разделяемых m/z ) до 4000, разрешение до 0. 2 Да по диапазону, точность до 0. 01% (=100 ppm) для родительских ионов и фрагментов. Ионная ловушка хорошо сочетается с жидкостным хроматографом.

ESI - масс-спектрометры ионно-циклотронног резонанса с последующим Фурье- преобразованием (ICR-FT) Ионы «запираются» в мощный (7 -14 тесла) секторный сверхпроводящий магнит, где вращаются под действием силы Лоренца с частотой, зависящей от m/z. Два сектора магнита используются для снятия токов, наведенных пролетающими мимо них ионами. Сложный сигнал от ионов разных m/z подлежит разложению по частотам (Фурье-преобразованию). Характеристики ICR-FT : разрешение до 10 000, точность до 0. 0001% (=1 ppm).

Сравнение характеристик приборов

Замечания о ESI и MALDI: * Оба метода ионизации требуют высокой химической чистоты анализируемого вещества. * Диапазон концентрации аналита при ESI и MALDI 10 -3 – 10 -7 M. * Поскольку разные вещества (например, пептиды) обладают разной способностью к ионизации (захвату протона либо другого катиона), то невозможно делать выводы о количественном соотношении компонентов сложной смеси на основании высот пиков в спектре. ESI является более «мягким» способом ионизации, чем MALDI При ESI образуется непрерывный поток ионов, при MALDI - сильно ограниченный во времени (до 10 нс) пакет ионов При ESI анализу подлежит более 10 фемтомолей вещества, при MALDI - более 1 фемтомоля вещества При ESI образуются ионы m/z 0 -5000, возможно измерение белков до ~50 000 Да. При MALDI возможно измерение белков до ~200 000 Да, диапазон измеряемых масс ограничен снизу до ~500 Да из-за присутствия с спектрах пиков матрицы

Стратегия анализа: 2 DE + MALDI-MS 2 D электрофорез белков Компьютерный анализ изображений гелей Вырезание и трипсинолиз белков в фрагментах геля Экстракция пептидов и получение MALDI масс-спектра суммарного гидролизата Поиск в базе данных измеренных масс пептидов (пептидный фингерпринт) Post Source Decay-MS, TOF-TOF фрагментация отдельных пептидов Поиск в базе данных измеренных масс фрагментов

2 D-Электрофорез Достоинства Реальные параметры разделения Эффективное разделение Полуколичественный метод Ограничения Проблемы с кислыми, щелочными и гидрофобными белками Невысокая воспроизводимость Окраска: Чувствительность: • Кумасси голубым 50 нг/пятно • Серебром, совместимая с MS анализом 2 нг/пятно • Серебром, классическая 0. 1 нг/пятно Mw k. Da 100 50 30 20 4 6 p. I 8

Методы визуализации 2 DE Coumassi Blue staining Silver-staining Cy 5 -Cy 3 staining

Схема проведения идентификации белка по его пептидному фингерпринту Вырезание отдельных белковых пятен (>20 нг/мм 2) Трипсинолиз белков в фрагментах геля Получение масс-спектра выбор базы данных ограничение поиска по видовой принадлежности учет возможных модификаций пептидов точность измеренных масс список масс пептидных фрагментов количество кандидатов www. matrixscience. com

Идентификация белка заменяется нахождением его ближайшего гомолога Изучаемый белок обычно отличен от имеющегося в базе данных массы случайное совпадение 20 кандидатов достоверный поиск Вероятность (score) 20 кандидатов в порядке убывания достоверности поиска 1. 2. 3. 4. 20. N Масса Вероятность Описание gi|8486123 27875 88 reading frame [Influenza A virus] gi|4996872 26451 74 M 1 [influenza A virus (A/Taiwan/96/1769)] gi|324260 27872 73 M 1 subunit [Influenza A virus] gi|75116 27866 73 M 1 - influenza A virus (strain A/WSN/33) ------gi|6048806 27218 58 M 1 [Influenza A virus (A/Duck/Hong Kong/698/79 (H 5 N 3))] перекрывание «совпавшими» пептидами последовательности белка 35% IVPSGPLKAE IAQRLEDVFA GKNTDLEVLM EWLKTRPILS PLTKGILGFV FTLTVPSER G LQRRRFVQNA LNGNGDPNNM DKAVKLYRKL KREITFHGAK EIALSYSAGA LASCMGLIYN RMGTVTTEVA FGLVCATCEQ IADSQHRSHR QMVTTTNPLI RHENRMVLAS TTAKAMEQMA GSSEQAAEAM DIASQAR QMV QAMRTIGTHH SSSAGLKDDL LENLQAYQKR MGVQMQRFK

Преимущества и недостатки метода - Высокая разрешающая способность - Возможно определения мутаций и модификаций - Высокая чувствительность анализа - Количественный анализ - Легко обрабатывать результаты -Необходимо подбирать специальные условия разделения для мембранных белков -2 D-электрофорез не автоматизирован

Анализ белков методом SDS-PAGE + LC +MS/MS SDS-PAGE Гидролиз трипсином Идентификация белка

Mascot Search Results: Идентификация индивидуального пептида Сравнение экспериментальных данных и теоретических спектров пептидных фрагментов

Преимущества и недостатки метода - Возможно определения мутаций и модификаций - Высокая чувствительность анализа - Высокая автоматизация анализа - Стандартные условия разделения -Количественный анализ затруднен

Современные объекты и цели протеомики: • установление полного набора белков в организме человека • построение молекулярных белковых атласов клеток, органов и тканей, схем белок-белковых взаимодействий • поиск новых маркеров патологических процессов • протеомное профилирование организмов
Lektsia_1_MS.ppt