 Основы термодинамики Лекция 1 1
Основы термодинамики Лекция 1 1
 Функции состояния Температура Т Объем V Энтальпия H Энтропия S Энергия Гиббса G Давление P Внутренняя энергия U К любой функции состояния применимо общее выражение: ∆(Функции состояния) = 2 = ∑(Функции состояния)продукты - ∑(Функции состояния)реагенты
Функции состояния Температура Т Объем V Энтальпия H Энтропия S Энергия Гиббса G Давление P Внутренняя энергия U К любой функции состояния применимо общее выражение: ∆(Функции состояния) = 2 = ∑(Функции состояния)продукты - ∑(Функции состояния)реагенты
 Энергия Гиббса Минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц. ∆G = ∑Gпродукты - ∑Gреагенты ∆p. G°(298 К) = ∑∆обр. G°(298 К)продукты - ∑∆обр. G°(298 К)реагенты Связь энтальпии и энергии Гиббса: ∆G = ∆H - T ∆S 3
Энергия Гиббса Минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц. ∆G = ∑Gпродукты - ∑Gреагенты ∆p. G°(298 К) = ∑∆обр. G°(298 К)продукты - ∑∆обр. G°(298 К)реагенты Связь энтальпии и энергии Гиббса: ∆G = ∆H - T ∆S 3
 Изменение энергии Гиббса реакции ∆G° надежно указывает направление реакции при условии достижения состояния равновесия. Если ∆G°=0, то Кp = 1. Если ∆G°<0, то Кp > 1 и продукты реакции преобладают над исходными реагентами. Если ∆G°>0, то Кp < 1 и реагенты доминируют. 4
Изменение энергии Гиббса реакции ∆G° надежно указывает направление реакции при условии достижения состояния равновесия. Если ∆G°=0, то Кp = 1. Если ∆G°<0, то Кp > 1 и продукты реакции преобладают над исходными реагентами. Если ∆G°>0, то Кp < 1 и реагенты доминируют. 4
 Изотерма реакции и константа равновесия Изотерма реакции определяется как: ∆G°= - RT ln Kp (при 1 бар) 1 бар = 105 Па = 1, 0197 атм. Величина К указывает положение равновесия и дает представление о степени протекания реакции в прямом и обратном направлениях. Кp применяется для газов. А+В↔С+D 5
Изотерма реакции и константа равновесия Изотерма реакции определяется как: ∆G°= - RT ln Kp (при 1 бар) 1 бар = 105 Па = 1, 0197 атм. Величина К указывает положение равновесия и дает представление о степени протекания реакции в прямом и обратном направлениях. Кp применяется для газов. А+В↔С+D 5
 Давление в системе Суммарное давление смеси газов равно сумме парциальных давлений отдельных компонентов этой смеси. Это закон парциальных давлений Дальтона: P = PA + PB + PC + PD + … где P – суммарное давление, - парциальное давление компонента A и т. д. Парциальное давление каждого газа пропорционально числу его молей. 6
Давление в системе Суммарное давление смеси газов равно сумме парциальных давлений отдельных компонентов этой смеси. Это закон парциальных давлений Дальтона: P = PA + PB + PC + PD + … где P – суммарное давление, - парциальное давление компонента A и т. д. Парциальное давление каждого газа пропорционально числу его молей. 6
 Окислительно-восстановительные реакции— это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Когда металл сгорает в атмосфере кислорода с образованием оксида, он окисляется: 2 Mg(тв. ) + O 2(газ) → 2 Mg. O(тв. ) При обратной реакции, когда оксид металла реагирует с водородом и превращается снова с металл, элемент восстанавливается: Cu. O(тв. ) + H 2(газ) → Cu(тв. ) + H 2 O(газ) 7
Окислительно-восстановительные реакции— это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Когда металл сгорает в атмосфере кислорода с образованием оксида, он окисляется: 2 Mg(тв. ) + O 2(газ) → 2 Mg. O(тв. ) При обратной реакции, когда оксид металла реагирует с водородом и превращается снова с металл, элемент восстанавливается: Cu. O(тв. ) + H 2(газ) → Cu(тв. ) + H 2 O(газ) 7
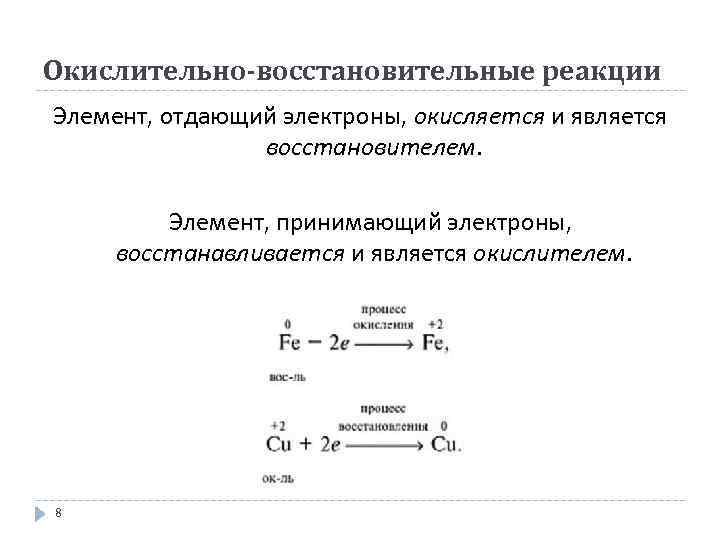 Окислительно-восстановительные реакции Элемент, отдающий электроны, окисляется и является восстановителем. Элемент, принимающий электроны, восстанавливается и является окислителем. 8
Окислительно-восстановительные реакции Элемент, отдающий электроны, окисляется и является восстановителем. Элемент, принимающий электроны, восстанавливается и является окислителем. 8
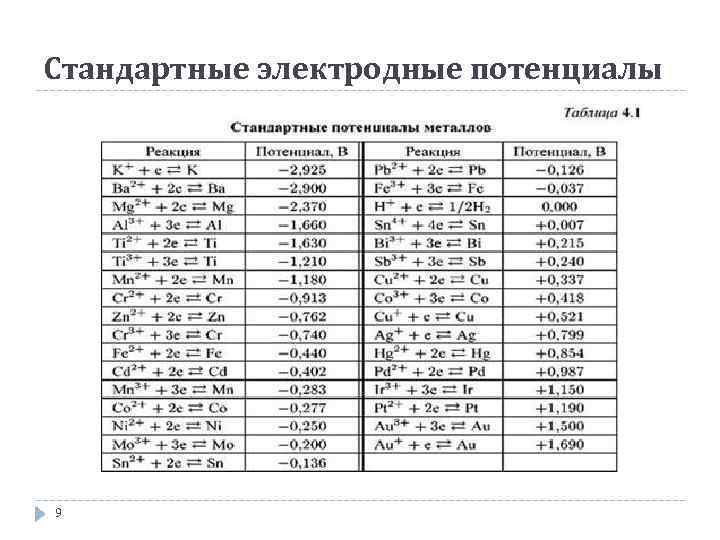 Стандартные электродные потенциалы 9
Стандартные электродные потенциалы 9
 Гомогенные и гетерогенные реакции Гомогенные реакции – химические протекающие полностью в одной фазе: реакции, N 2(газ) + 3 H 2(газ) → 2 NH 3(газ) Гетерогенные реакции – химические протекающие в различных фазах: реакции, CO 3(тв. ) + 2 HCl(раств. ) → Cl 2(раств. ) + CO 2(газ) + H 2 O(ж. ) 10
Гомогенные и гетерогенные реакции Гомогенные реакции – химические протекающие полностью в одной фазе: реакции, N 2(газ) + 3 H 2(газ) → 2 NH 3(газ) Гетерогенные реакции – химические протекающие в различных фазах: реакции, CO 3(тв. ) + 2 HCl(раств. ) → Cl 2(раств. ) + CO 2(газ) + H 2 O(ж. ) 10