Основы термодинамики 2 - 2013.pptx
- Количество слайдов: 84
 Основы термодинамики 2 Первое начало термодинамики
Основы термодинамики 2 Первое начало термодинамики
 Первое начало термодинамики • Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. • Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа.
Первое начало термодинамики • Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. • Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа.
 Первое начало термодинамики • С другой стороны, температуру газа и его внутреннюю энергию можно повысить за счет сообщения ему некоторого количества теплоты - энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Первое начало термодинамики • С другой стороны, температуру газа и его внутреннюю энергию можно повысить за счет сообщения ему некоторого количества теплоты - энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
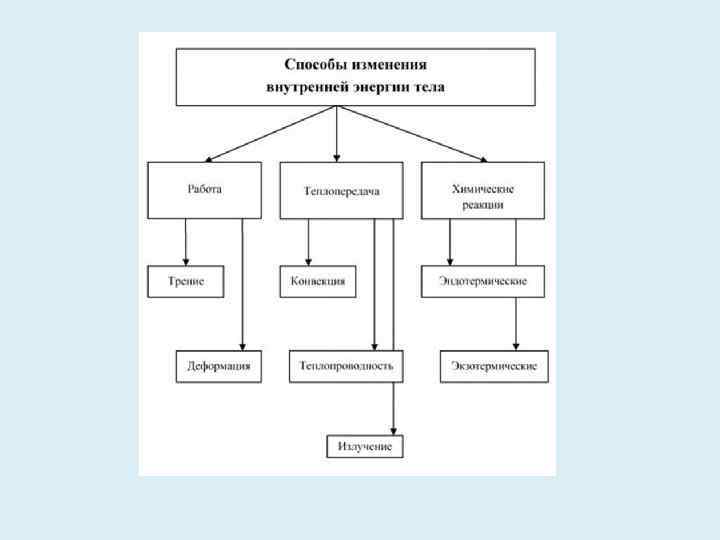

 Первое начало термодинамики • Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. • Энергия механического движения может превращаться в энергию теплового движения и наоборот. • При этих превращениях соблюдается закон сохранения и превращения энергии; • применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Первое начало термодинамики • Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. • Энергия механического движения может превращаться в энергию теплового движения и наоборот. • При этих превращениях соблюдается закон сохранения и превращения энергии; • применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
 Первое начало термодинамики • Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии Δ U = U 2 – U 1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил: Δ U = Q—A, или Q =Δ U + A Это уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Первое начало термодинамики • Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии Δ U = U 2 – U 1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил: Δ U = Q—A, или Q =Δ U + A Это уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
 Первое начало термодинамики • Первое начало термодинамики в дифференциальной форме будет иметь вид d. Q = d. U + d. A или δQ = d. U + δA , • где d. U бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. • В этом выражении d. U является полным дифференциалом, а δA и δQ таковыми не являются. Из формулы первого начала термодинамики следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Первое начало термодинамики • Первое начало термодинамики в дифференциальной форме будет иметь вид d. Q = d. U + d. A или δQ = d. U + δA , • где d. U бесконечно малое изменение внутренней энергии системы, δA - элементарная работа, δQ - бесконечно малое количество теплоты. • В этом выражении d. U является полным дифференциалом, а δA и δQ таковыми не являются. Из формулы первого начала термодинамики следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
 Первое начало термодинамики • Первое начало термодинамики позволяет сделать определенный вывод о той механической работе, которую можно получить в том или ином процессе, что представляет большой практический интерес. • Если система периодически возвращается в первоначальное состояние, что характерно для циклических тепловых двигателей, то изменение её внутренней энергии δU = 0. Тогда, согласно первому началу термодинамики, A = Q, • а это свидетельствует о невозможности построения вечного двигателя первого рода - периодически действующего двигателя, который совершал бы большую работу, чем сообщённая ему извне энергия (одна из формулировок первого начала термодинамики).
Первое начало термодинамики • Первое начало термодинамики позволяет сделать определенный вывод о той механической работе, которую можно получить в том или ином процессе, что представляет большой практический интерес. • Если система периодически возвращается в первоначальное состояние, что характерно для циклических тепловых двигателей, то изменение её внутренней энергии δU = 0. Тогда, согласно первому началу термодинамики, A = Q, • а это свидетельствует о невозможности построения вечного двигателя первого рода - периодически действующего двигателя, который совершал бы большую работу, чем сообщённая ему извне энергия (одна из формулировок первого начала термодинамики).
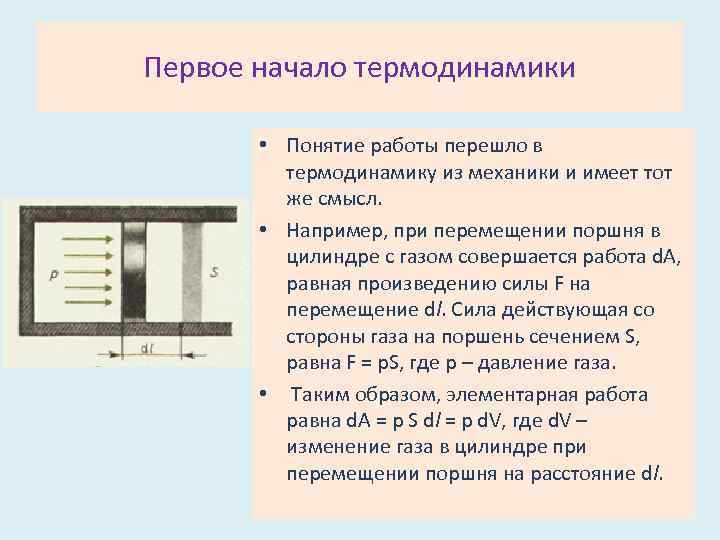 Первое начало термодинамики • Понятие работы перешло в термодинамику из механики и имеет тот же смысл. • Например, при перемещении поршня в цилиндре с газом совершается работа d. А, равная произведению силы F на перемещение dl. Сила действующая со стороны газа на поршень сечением S, равна F = p. S, где р – давление газа. • Таким образом, элементарная работа равна d. А = р S dl = p d. V, где d. V – изменение газа в цилиндре при перемещении поршня на расстояние dl.
Первое начало термодинамики • Понятие работы перешло в термодинамику из механики и имеет тот же смысл. • Например, при перемещении поршня в цилиндре с газом совершается работа d. А, равная произведению силы F на перемещение dl. Сила действующая со стороны газа на поршень сечением S, равна F = p. S, где р – давление газа. • Таким образом, элементарная работа равна d. А = р S dl = p d. V, где d. V – изменение газа в цилиндре при перемещении поршня на расстояние dl.
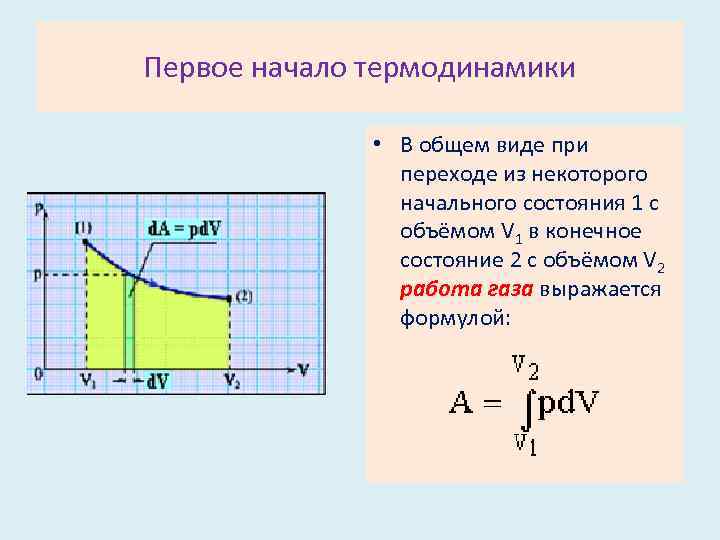 Первое начало термодинамики • В общем виде при переходе из некоторого начального состояния 1 с объёмом V 1 в конечное состояние 2 с объёмом V 2 работа газа выражается формулой:
Первое начало термодинамики • В общем виде при переходе из некоторого начального состояния 1 с объёмом V 1 в конечное состояние 2 с объёмом V 2 работа газа выражается формулой:
 Первое начало термодинамики • При расширении газ совершает положительную работу (А>0), так как направление силы и направление перемещения поршня совпадают. • Если газ сжимается, то работа газа отрицательная (А<0). Работа А`, совершаемая внешними телами над газом, отличается от работы газа А только знаком: А`= -А.
Первое начало термодинамики • При расширении газ совершает положительную работу (А>0), так как направление силы и направление перемещения поршня совпадают. • Если газ сжимается, то работа газа отрицательная (А<0). Работа А`, совершаемая внешними телами над газом, отличается от работы газа А только знаком: А`= -А.
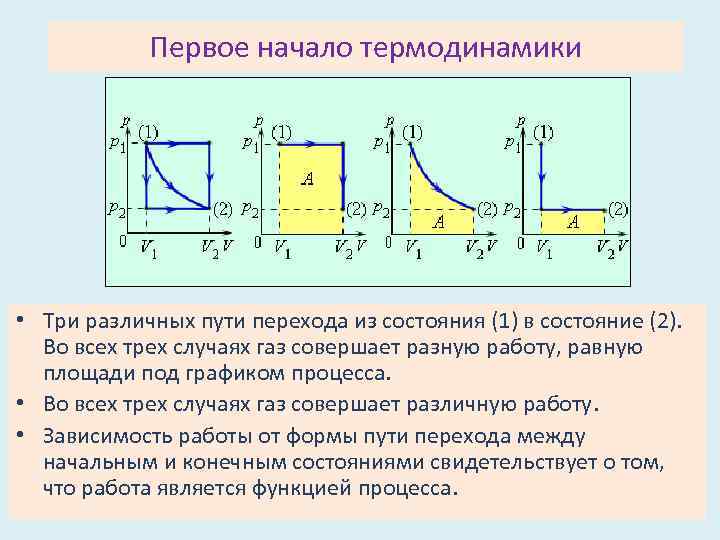 Первое начало термодинамики • Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса. • Во всех трех случаях газ совершает различную работу. • Зависимость работы от формы пути перехода между начальным и конечным состояниями свидетельствует о том, что работа является функцией процесса.
Первое начало термодинамики • Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса. • Во всех трех случаях газ совершает различную работу. • Зависимость работы от формы пути перехода между начальным и конечным состояниями свидетельствует о том, что работа является функцией процесса.
 Теплоемкость Взаимодействие, при котором термодинамическая система отдаёт или получает энергию только за счет совершения работы, называется адиабатическим, а взаимодействие, при котором термодинамическая система отдаёт или получает энергию только за счет разности, температур называется тепловым. Энергия, передаваемая системе при тепловом взаимодействии, называется теплотой. Теплота – это энергия в форме молекулярного движения. Для количественного описания величины переданного тепла вводят понятие теплоёмкости. Различают удельную и молярную теплоёмкость.
Теплоемкость Взаимодействие, при котором термодинамическая система отдаёт или получает энергию только за счет совершения работы, называется адиабатическим, а взаимодействие, при котором термодинамическая система отдаёт или получает энергию только за счет разности, температур называется тепловым. Энергия, передаваемая системе при тепловом взаимодействии, называется теплотой. Теплота – это энергия в форме молекулярного движения. Для количественного описания величины переданного тепла вводят понятие теплоёмкости. Различают удельную и молярную теплоёмкость.
 Теплоемкость • Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: • Единица удельной теплоемкости - джоуль на килограмм. Кельвин (Дж/(кг-К)).
Теплоемкость • Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: • Единица удельной теплоемкости - джоуль на килограмм. Кельвин (Дж/(кг-К)).
 Теплоемкость • Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К: где ν - количество вещества, выражающее число молей. • Единица молярной теплоемкости - джоуль на моль. Кельвин (Дж/(моль- К)). • Удельная теплоемкость Cm связана с молярной Сν соотношением Сm = Сν М, где М — молярная масса вещества.
Теплоемкость • Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К: где ν - количество вещества, выражающее число молей. • Единица молярной теплоемкости - джоуль на моль. Кельвин (Дж/(моль- К)). • Удельная теплоемкость Cm связана с молярной Сν соотношением Сm = Сν М, где М — молярная масса вещества.
 Первое начало термодинамики • Запишем выражение первого начала термодинамики для 1 моля газа с учетом формул для количества теплоты и работы: Сν d. T = d. U + p d. V • Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (d. V = 0)) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии: • т. е. молярная теплоемкость газа при постоянном объеме CV равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К.
Первое начало термодинамики • Запишем выражение первого начала термодинамики для 1 моля газа с учетом формул для количества теплоты и работы: Сν d. T = d. U + p d. V • Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (d. V = 0)) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии: • т. е. молярная теплоемкость газа при постоянном объеме CV равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К.
 Первое начало термодинамики Так как внутренняя энергия моля идеального газа равна то
Первое начало термодинамики Так как внутренняя энергия моля идеального газа равна то
 Первое начало термодинамики • Если газ нагревается при постоянном давлении, то выражение для Ср будет иметь вид • Учитывая, что d. U/d. T не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна СV ; продифференцировав уравнение Клапейрона– Менделеева p. V = RT по Т (р = const), получим Ср = СV + R
Первое начало термодинамики • Если газ нагревается при постоянном давлении, то выражение для Ср будет иметь вид • Учитывая, что d. U/d. T не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна СV ; продифференцировав уравнение Клапейрона– Менделеева p. V = RT по Т (р = const), получим Ср = СV + R
 Уравнение Майера Ср = СV + R • уравнение Майера; • оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. • Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. • При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср/СV: ϒ = Cp/Cv = (i + 2)/i.
Уравнение Майера Ср = СV + R • уравнение Майера; • оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. • Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. • При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср/СV: ϒ = Cp/Cv = (i + 2)/i.
 Коэффициент Пуассона ϒ = Cp/Cv = (i + 2)/i - коэффициент Пуассона или показатель адиабаты. Физический смысл газовой постоянной R. R - это работа, совершаемая молем идеального газа при повышении его температуры на 1 К при постоянном давлении. Молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры.
Коэффициент Пуассона ϒ = Cp/Cv = (i + 2)/i - коэффициент Пуассона или показатель адиабаты. Физический смысл газовой постоянной R. R - это работа, совершаемая молем идеального газа при повышении его температуры на 1 К при постоянном давлении. Молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры.
 Адиабатический процесс • Процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой (характерно для быстропротекающих процессов). • Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. • Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Адиабатический процесс • Процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой (характерно для быстропротекающих процессов). • Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. • Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
 Адиабатический процесс • Из первого начала термодинамики d Q = d. U + d. A для адиабатического процесса следует, что d A = – d. U * • т. е. внешняя работа совершается за счет изменения внутренней энергии системы. • Используя выражения для элементарной работы и приращения внутренней энергии, для произвольной массы газа перепишем уравнение (*) в виде **
Адиабатический процесс • Из первого начала термодинамики d Q = d. U + d. A для адиабатического процесса следует, что d A = – d. U * • т. е. внешняя работа совершается за счет изменения внутренней энергии системы. • Используя выражения для элементарной работы и приращения внутренней энергии, для произвольной массы газа перепишем уравнение (*) в виде **
 Адиабатический процесс • Продифференцировав уравнение состояния для идеального газа , получим *** • Исключим из (**) и (***) температуру Т:
Адиабатический процесс • Продифференцировав уравнение состояния для идеального газа , получим *** • Исключим из (**) и (***) температуру Т:
 Адиабатический процесс • Разделив переменные и учитывая, что Cp/Cv = ϒ , найдем Интегрируя это уравнение в пределах от р1 до р2 и соответственно от V 1 до V 2, а затем потенцируя, придем к выражению или
Адиабатический процесс • Разделив переменные и учитывая, что Cp/Cv = ϒ , найдем Интегрируя это уравнение в пределах от р1 до р2 и соответственно от V 1 до V 2, а затем потенцируя, придем к выражению или
 Адиабатический процесс • Так как состояния 1 и 2 выбраны произвольно, то можно записать Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона. Для перехода к переменным Т, V или р, Т исключим из полученного уравнения с помощью уравнения Клапейрона – Менделеева соответственно давление или объем:
Адиабатический процесс • Так как состояния 1 и 2 выбраны произвольно, то можно записать Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона. Для перехода к переменным Т, V или р, Т исключим из полученного уравнения с помощью уравнения Клапейрона – Менделеева соответственно давление или объем:
 Адиабатический процесс • Получаем • Выражения представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина ϒ = Cp/Cv = (i + 2)/ί называется показателем адиабаты (или коэффициентом Пуассона).
Адиабатический процесс • Получаем • Выражения представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина ϒ = Cp/Cv = (i + 2)/ί называется показателем адиабаты (или коэффициентом Пуассона).
 Адиабатический процесс • Для одноатомных газов (Ne, He и др. ), достаточно хорошо удовлетворяющих условию идеальности, i = 3, ϒ = 1, 67. • Для двухатомных газов (Н 2, N 2, О 2 и др. ) i=5, ϒ =1, 4. Значения ϒ , вычисленные по формуле (ϒ = (i + 2)/i), хорошо подтверждаются экспериментом.
Адиабатический процесс • Для одноатомных газов (Ne, He и др. ), достаточно хорошо удовлетворяющих условию идеальности, i = 3, ϒ = 1, 67. • Для двухатомных газов (Н 2, N 2, О 2 и др. ) i=5, ϒ =1, 4. Значения ϒ , вычисленные по формуле (ϒ = (i + 2)/i), хорошо подтверждаются экспериментом.
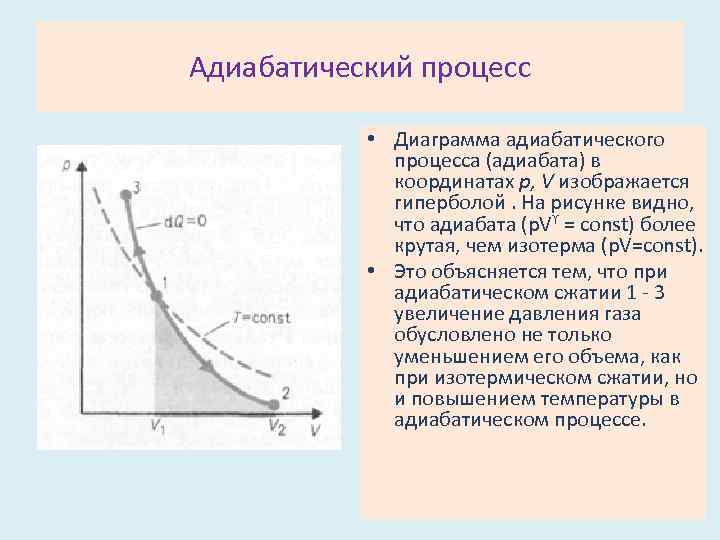 Адиабатический процесс • Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой. На рисунке видно, что адиабата (p. Vϒ = const) более крутая, чем изотерма (p. V=const). • Это объясняется тем, что при адиабатическом сжатии 1 - 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры в адиабатическом процессе.
Адиабатический процесс • Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой. На рисунке видно, что адиабата (p. Vϒ = const) более крутая, чем изотерма (p. V=const). • Это объясняется тем, что при адиабатическом сжатии 1 - 3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры в адиабатическом процессе.
 Адиабатический процесс • Запишем уравнение первое начало термодинамик для адиабатического процесса d A = – d. U в виде • Если газ адиабатически расширяется от объема Vl до V 2, то его температура уменьшается от Т 1 до Т 2 и работа расширения идеального газа равна
Адиабатический процесс • Запишем уравнение первое начало термодинамик для адиабатического процесса d A = – d. U в виде • Если газ адиабатически расширяется от объема Vl до V 2, то его температура уменьшается от Т 1 до Т 2 и работа расширения идеального газа равна
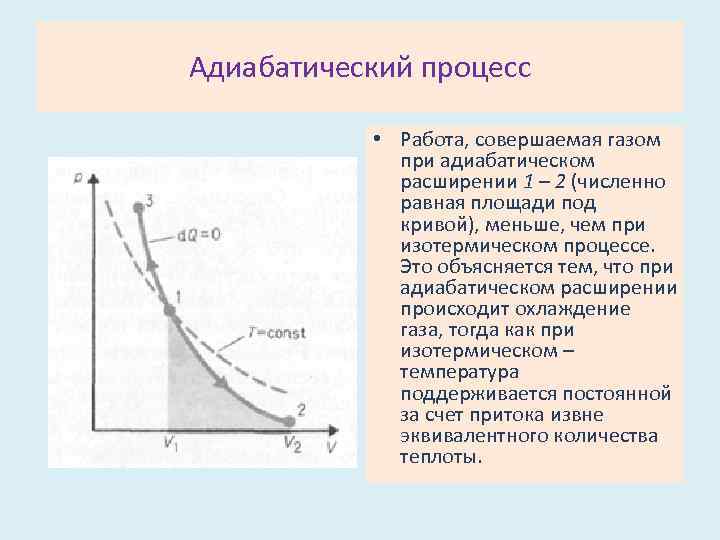 Адиабатический процесс • Работа, совершаемая газом при адиабатическом расширении 1 – 2 (численно равная площади под кривой), меньше, чем при изотермическом процессе. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Адиабатический процесс • Работа, совершаемая газом при адиабатическом расширении 1 – 2 (численно равная площади под кривой), меньше, чем при изотермическом процессе. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
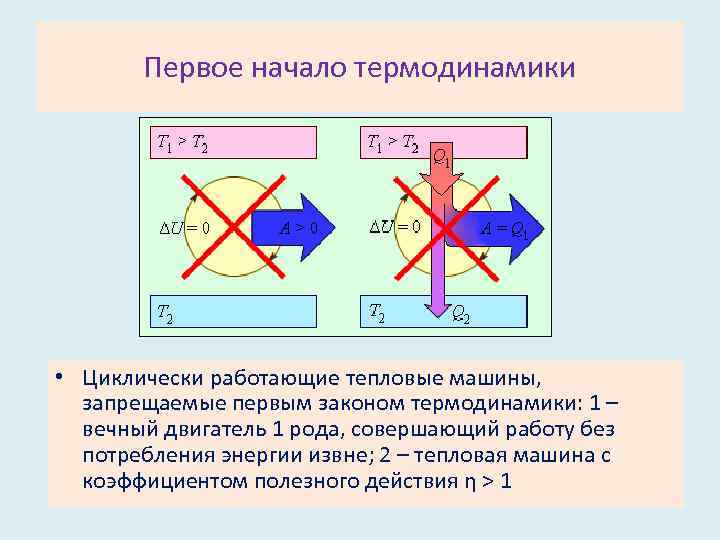 Первое начало термодинамики • Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
Первое начало термодинамики • Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
 Первое начало термодинамики • Первое начало термодинамики установило эквивалентность при преобразованиях внутренней энергии, теплоты и работы. • Это позволяет определить, возможен ли с энергетической точки зрения тот или иной процесс. • Но первое начало термодинамики ничего не говорит о возможности протекания таких процессов в природе (в частности, самопроизвольных). Так, например, первое начало термодинамики не запрещает самопроизвольный переход теплоты от тела менее нагретого к более нагретому (от холодного к горячему). Но, как известно, в природе такие процессы не наблюдаются.
Первое начало термодинамики • Первое начало термодинамики установило эквивалентность при преобразованиях внутренней энергии, теплоты и работы. • Это позволяет определить, возможен ли с энергетической точки зрения тот или иной процесс. • Но первое начало термодинамики ничего не говорит о возможности протекания таких процессов в природе (в частности, самопроизвольных). Так, например, первое начало термодинамики не запрещает самопроизвольный переход теплоты от тела менее нагретого к более нагретому (от холодного к горячему). Но, как известно, в природе такие процессы не наблюдаются.
 Второе начало термодинамики • Один из вариантов формулировки второго начала термодинамики (по Клаузиусу) как раз и запрещает такой процесс: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. • Также было установлено и неравноправие взаимных переходов теплоты и работы при циклических процессах: полный переход работы в теплоту возможен, а вот обратный – лишь частично. • Второе начало термодинамики устанавливает: • 1) направление самопроизвольных процессов в природе; • 2) условие осуществление процессов превращения теплоты в работу.
Второе начало термодинамики • Один из вариантов формулировки второго начала термодинамики (по Клаузиусу) как раз и запрещает такой процесс: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. • Также было установлено и неравноправие взаимных переходов теплоты и работы при циклических процессах: полный переход работы в теплоту возможен, а вот обратный – лишь частично. • Второе начало термодинамики устанавливает: • 1) направление самопроизвольных процессов в природе; • 2) условие осуществление процессов превращения теплоты в работу.
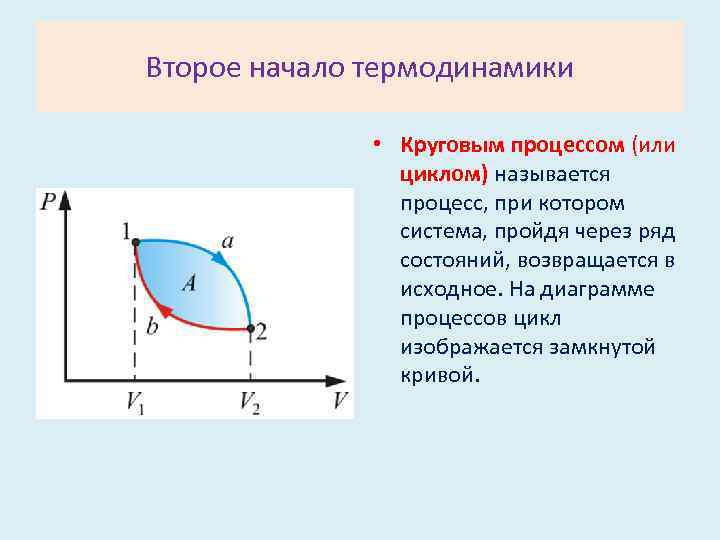 Второе начало термодинамики • Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой.
Второе начало термодинамики • Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой.
 Круговой процесс (цикл) • Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1– 2) и сжатия (2– 1) газа. • Работа расширения A 1 (определяется площадью фигуры 1 a 2 V 1 V 2 2) положительна (d. V>0)), работа сжатия A 2 (определяется площадью фигуры 1 a 2 V 1 V 2 2) отрицательна (d. V<0),
Круговой процесс (цикл) • Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1– 2) и сжатия (2– 1) газа. • Работа расширения A 1 (определяется площадью фигуры 1 a 2 V 1 V 2 2) положительна (d. V>0)), работа сжатия A 2 (определяется площадью фигуры 1 a 2 V 1 V 2 2) отрицательна (d. V<0),
 Круговой процесс (цикл) • Следовательно, работа A= A 1+ A 1, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. • Если за цикл совершается положительная работа A>0 (цикл протекает по часовой стрелке), то он называется прямым (рис. , а), если за цикл совершается отрицательная работа A<0 (цикл протекает против часовой стрелки), то он называется обратным (рис. b).
Круговой процесс (цикл) • Следовательно, работа A= A 1+ A 1, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. • Если за цикл совершается положительная работа A>0 (цикл протекает по часовой стрелке), то он называется прямым (рис. , а), если за цикл совершается отрицательная работа A<0 (цикл протекает против часовой стрелки), то он называется обратным (рис. b).
 Круговой процесс (цикл) • Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. • Обратный цикл используется в холодильных машинах периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
Круговой процесс (цикл) • Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. • Обратный цикл используется в холодильных машинах периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
 Круговой процесс (цикл) • В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю (Δ U = 0). • В общем случае при протекании кругового процесса система может теплоту как получать Q 1, так и отдавать Q 2, поэтому теплота, полученная системой Q равна Q = Q 1– Q 2 • Поэтому из первого начала термодинамики для кругового процесса (когда Δ U = 0) получаем, что работа за цикл равна А = Q 1– Q 2, т. е. работа, совершаемая за цикл, равна разности количества полученной извне теплоты Q 1 и отданной системой Q 2.
Круговой процесс (цикл) • В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю (Δ U = 0). • В общем случае при протекании кругового процесса система может теплоту как получать Q 1, так и отдавать Q 2, поэтому теплота, полученная системой Q равна Q = Q 1– Q 2 • Поэтому из первого начала термодинамики для кругового процесса (когда Δ U = 0) получаем, что работа за цикл равна А = Q 1– Q 2, т. е. работа, совершаемая за цикл, равна разности количества полученной извне теплоты Q 1 и отданной системой Q 2.
 Круговой процесс (цикл) • Поэтому коэффициент полезного действия для кругового процесса (к. п. д. )
Круговой процесс (цикл) • Поэтому коэффициент полезного действия для кругового процесса (к. п. д. )
 Обратимые и необратимые процессы • Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. • Причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. • Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Обратимые и необратимые процессы • Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. • Причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. • Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
 Обратимые и необратимые процессы • Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично» , идет процесс в прямом или обратном направлении. • Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д).
Обратимые и необратимые процессы • Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично» , идет процесс в прямом или обратном направлении. • Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д).
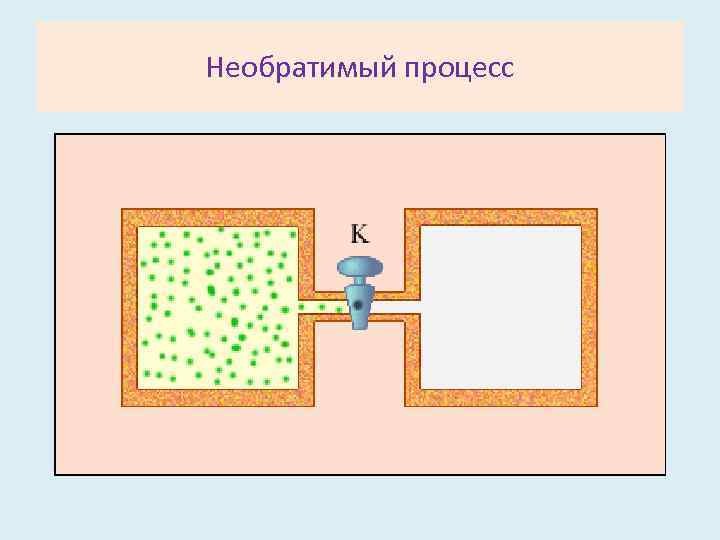 Необратимый процесс
Необратимый процесс
 Обратимые и необратимые процессы • Обратимые процессы – это идеализация реальных процессов. • Их рассмотрение важно по двум причинам: • 1) многие процессы в природе и технике практически обратимы; • 2) обратимые процессы являются наиболее экономичными; имеют максимальный коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
Обратимые и необратимые процессы • Обратимые процессы – это идеализация реальных процессов. • Их рассмотрение важно по двум причинам: • 1) многие процессы в природе и технике практически обратимы; • 2) обратимые процессы являются наиболее экономичными; имеют максимальный коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
 Второе начало термодинамики • Первый закон термодинамики не может отличить обратимые процессы от необратимых. • Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. • Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. • Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Второе начало термодинамики • Первый закон термодинамики не может отличить обратимые процессы от необратимых. • Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. • Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. • Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
 Второе начало термодинамики • Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: • В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Второе начало термодинамики • Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона: • В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
 Второе начало термодинамики • Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют вечным двигателем второго рода. • В земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 1021 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈ 1024 Дж), эквивалентное полному сжиганию 1017 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 104 раз меньше. Поэтому вечный двигатель второго рода был бы для человечества не менее привлекателен, чем вечный двигатель первого рода, запрещенный первым законом термодинамики.
Второе начало термодинамики • Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют вечным двигателем второго рода. • В земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 1021 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈ 1024 Дж), эквивалентное полному сжиганию 1017 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 104 раз меньше. Поэтому вечный двигатель второго рода был бы для человечества не менее привлекателен, чем вечный двигатель первого рода, запрещенный первым законом термодинамики.
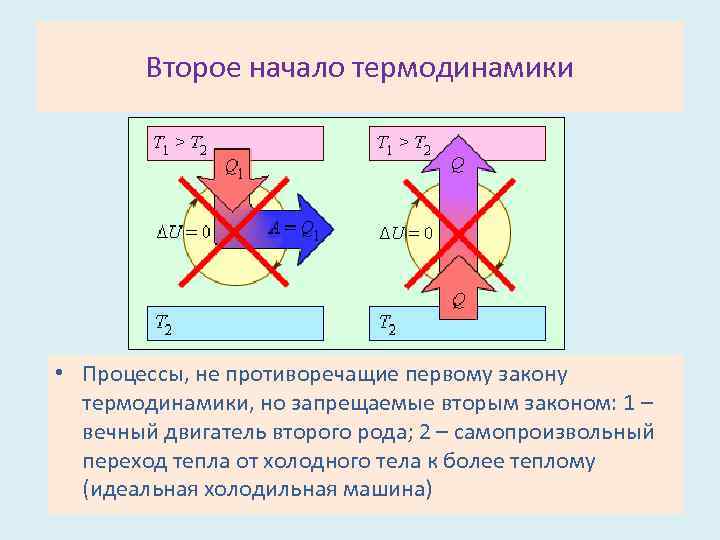 Второе начало термодинамики • Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)
Второе начало термодинамики • Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)
 Второе начало термодинамики • Второй закон термодинамики непосредственно связан с необратимостью реальных тепловых процессов. • Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. • Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, т. е. он не может быть осуществлен полностью в обратном направлении.
Второе начало термодинамики • Второй закон термодинамики непосредственно связан с необратимостью реальных тепловых процессов. • Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. • Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, т. е. он не может быть осуществлен полностью в обратном направлении.
 Энтропия • Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты. • Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно d Q/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
Энтропия • Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты. • Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно d Q/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
 Энтропия • Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение d Q/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. • Таким образом,
Энтропия • Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение d Q/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. • Таким образом,
 Энтропия • Функция состояния, дифференциалом которой является d Q/T, называется энтропией и обозначается S. Из формулы * следует, что для обратимых процессов изменение энтропии d. S = 0 ** • В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает: d. S >0. ***
Энтропия • Функция состояния, дифференциалом которой является d Q/T, называется энтропией и обозначается S. Из формулы * следует, что для обратимых процессов изменение энтропии d. S = 0 ** • В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает: d. S >0. ***
 Энтропия • Выражения ** и*** относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. • Соотношения ** и *** можно представить в виде неравенства Клаузиуса ΔS ≥ 0, • т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Энтропия • Выражения ** и*** относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. • Соотношения ** и *** можно представить в виде неравенства Клаузиуса ΔS ≥ 0, • т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
 Энтропия • Cоотношение принято называть законом возрастания энтропии. • При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается. • Таким образом, энтропия указывает направление самопроизвольно протекающих процессов. • Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия. • В состоянии равновесия энтропия принимает максимальное значение. • Закон возрастания энтропии можно принять в качестве еще одной формулировки второго закона термодинамики.
Энтропия • Cоотношение принято называть законом возрастания энтропии. • При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо остается неизменной, либо увеличивается. • Таким образом, энтропия указывает направление самопроизвольно протекающих процессов. • Рост энтропии указывает на приближение системы к состоянию термодинамического равновесия. • В состоянии равновесия энтропия принимает максимальное значение. • Закон возрастания энтропии можно принять в качестве еще одной формулировки второго закона термодинамики.
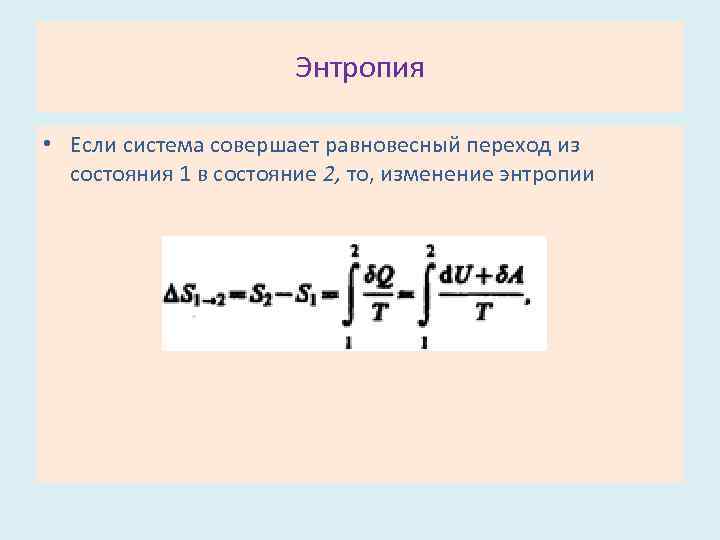 Энтропия • Если система совершает равновесный переход из состояния 1 в состояние 2, то, изменение энтропии
Энтропия • Если система совершает равновесный переход из состояния 1 в состояние 2, то, изменение энтропии
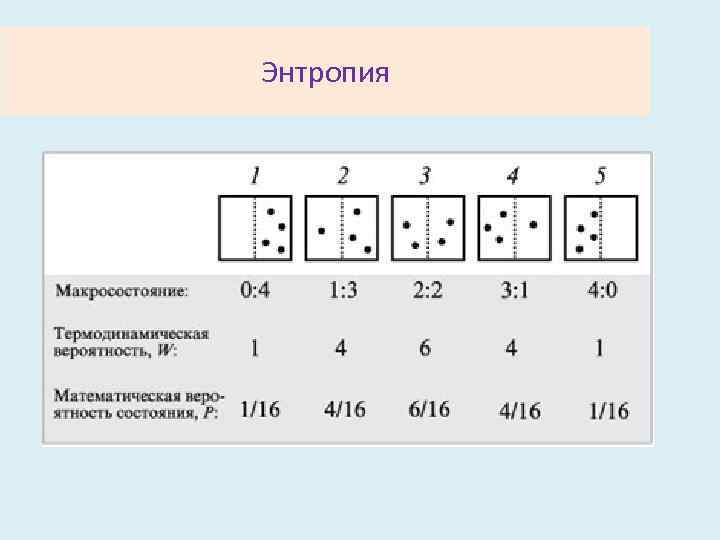
 Энтропия • Более глубокий смысл энтропии вскрывается в статистической физике, энтропия связывается с термодинамической вероятностью состояния системы. • Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или -число микросостояний, осуществляющих данное макро состояние (по определению, W ≥ 1, т. е. термодинамическая вероятность не есть вероятность в математическом смысле (последняя ≤ 1 )).
Энтропия • Более глубокий смысл энтропии вскрывается в статистической физике, энтропия связывается с термодинамической вероятностью состояния системы. • Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или -число микросостояний, осуществляющих данное макро состояние (по определению, W ≥ 1, т. е. термодинамическая вероятность не есть вероятность в математическом смысле (последняя ≤ 1 )).
 Энтропия
Энтропия
 Энтропия • Согласно Больцману (1872), энтропия S системы и термодинамическая вероятность связаны между собой следующим образом: S = k ln. W, • где k — постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние • . Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы.
Энтропия • Согласно Больцману (1872), энтропия S системы и термодинамическая вероятность связаны между собой следующим образом: S = k ln. W, • где k — постоянная Больцмана. Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние • . Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы.
 Энтропия • Формула Больцмана • позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. • В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. • В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
Энтропия • Формула Больцмана • позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. • В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. • В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
 Энтропия • Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии. • При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
Энтропия • Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии. • При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
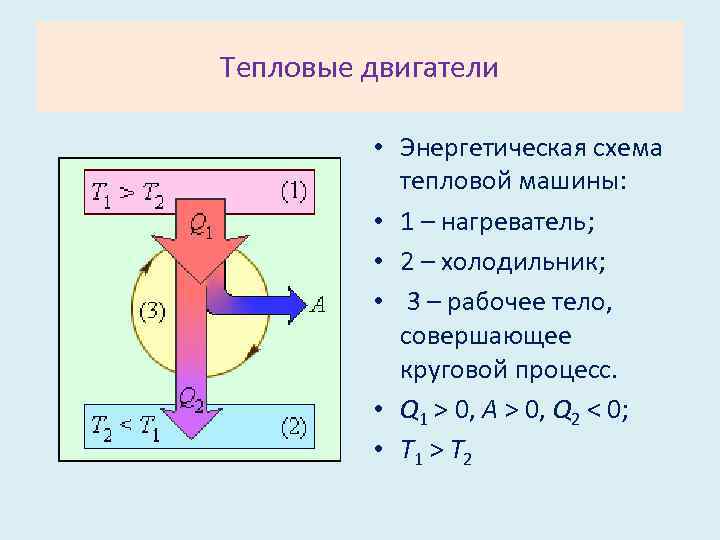 Тепловые двигатели • Энергетическая схема тепловой машины: • 1 – нагреватель; • 2 – холодильник; • 3 – рабочее тело, совершающее круговой процесс. • Q 1 > 0, A > 0, Q 2 < 0; • T 1 > T 2
Тепловые двигатели • Энергетическая схема тепловой машины: • 1 – нагреватель; • 2 – холодильник; • 3 – рабочее тело, совершающее круговой процесс. • Q 1 > 0, A > 0, Q 2 < 0; • T 1 > T 2
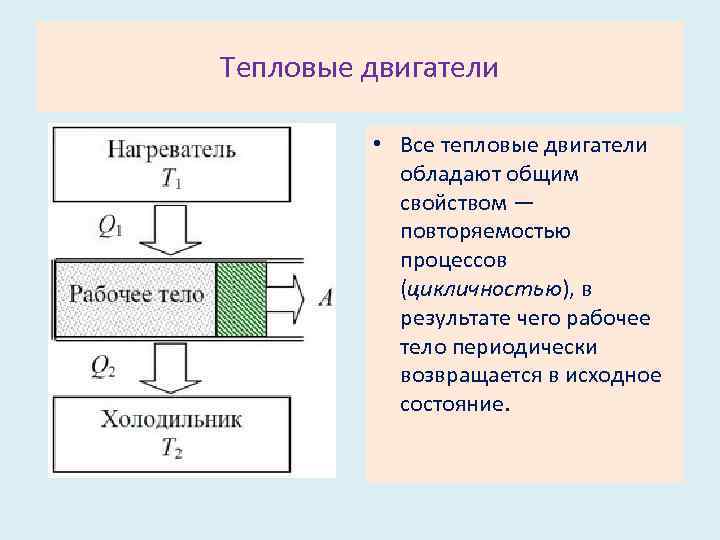 Тепловые двигатели • Все тепловые двигатели обладают общим свойством — повторяемостью процессов (цикличностью), в результате чего рабочее тело периодически возвращается в исходное состояние.
Тепловые двигатели • Все тепловые двигатели обладают общим свойством — повторяемостью процессов (цикличностью), в результате чего рабочее тело периодически возвращается в исходное состояние.
 Тепловые двигатели • Все тепловые двигатели обладают общим свойством — повторяемостью процессов (цикличностью), в результате чего рабочее тело периодически возвращается в исходное состояние. • Если система совершает положительную работу, то цикл называется прямым. Если работа отрицательная — обратный. На графике p(V) прямые циклы имеют направление обхода по часовой стрелке. • Каждый цикл включает в себя следующие процессы: • получение рабочим телом энергии; • совершение работы рабочим телом при расширении; • передача части энергии от рабочего тела; • совершение работы рабочим телом при сжатии.
Тепловые двигатели • Все тепловые двигатели обладают общим свойством — повторяемостью процессов (цикличностью), в результате чего рабочее тело периодически возвращается в исходное состояние. • Если система совершает положительную работу, то цикл называется прямым. Если работа отрицательная — обратный. На графике p(V) прямые циклы имеют направление обхода по часовой стрелке. • Каждый цикл включает в себя следующие процессы: • получение рабочим телом энергии; • совершение работы рабочим телом при расширении; • передача части энергии от рабочего тела; • совершение работы рабочим телом при сжатии.
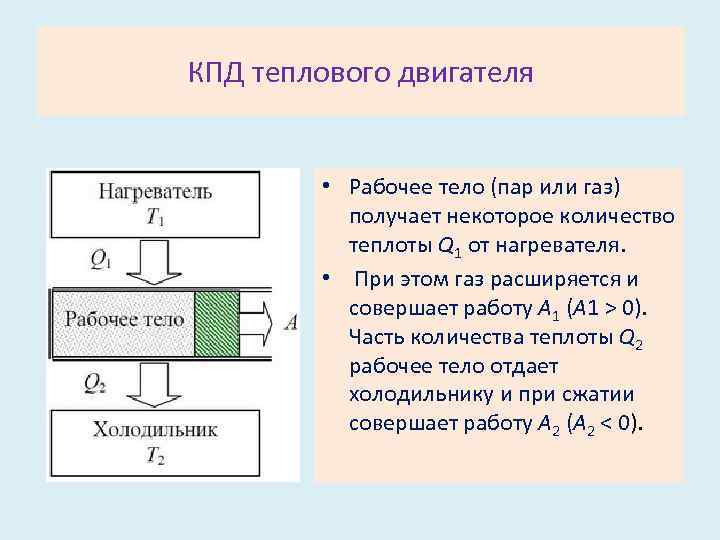 КПД теплового двигателя • Рабочее тело (пар или газ) получает некоторое количество теплоты Q 1 от нагревателя. • При этом газ расширяется и совершает работу A 1 (A 1 > 0). Часть количества теплоты Q 2 рабочее тело отдает холодильнику и при сжатии совершает работу A 2 (A 2 < 0).
КПД теплового двигателя • Рабочее тело (пар или газ) получает некоторое количество теплоты Q 1 от нагревателя. • При этом газ расширяется и совершает работу A 1 (A 1 > 0). Часть количества теплоты Q 2 рабочее тело отдает холодильнику и при сжатии совершает работу A 2 (A 2 < 0).
 КПД теплового двигателя • Полная работа A рабочего тела равна сумме работ при расширении A 1 и сжатии A 2, и равна разности полученного Q 1 и отданного Q 2 количества теплоты: • Отношение совершенной машиной работы A к количеству теплоты Q 1, полученному от нагревателя, называется коэффициентом полезного действия теплового двигателя (КПД):
КПД теплового двигателя • Полная работа A рабочего тела равна сумме работ при расширении A 1 и сжатии A 2, и равна разности полученного Q 1 и отданного Q 2 количества теплоты: • Отношение совершенной машиной работы A к количеству теплоты Q 1, полученному от нагревателя, называется коэффициентом полезного действия теплового двигателя (КПД):
 КПД теплового двигателя • КПД может измеряться и в процентах, тогда расчетная формула будет иметь вид • КПД характеризует эффективность работы тепловой машины, т. е. какая часть полученной энергии преобразуется в механическую. • Из формулы видно, что, так как у всех двигателей некоторое количество теплоты передается холодильнику (Q 2 ≠ 0), то КПД η < 1.
КПД теплового двигателя • КПД может измеряться и в процентах, тогда расчетная формула будет иметь вид • КПД характеризует эффективность работы тепловой машины, т. е. какая часть полученной энергии преобразуется в механическую. • Из формулы видно, что, так как у всех двигателей некоторое количество теплоты передается холодильнику (Q 2 ≠ 0), то КПД η < 1.
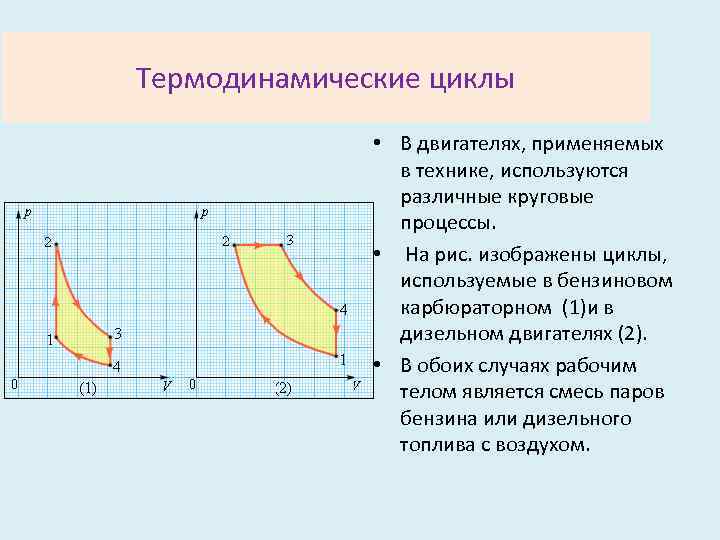 Термодинамические циклы • В двигателях, применяемых в технике, используются различные круговые процессы. • На рис. изображены циклы, используемые в бензиновом карбюраторном (1)и в дизельном двигателях (2). • В обоих случаях рабочим телом является смесь паров бензина или дизельного топлива с воздухом.
Термодинамические циклы • В двигателях, применяемых в технике, используются различные круговые процессы. • На рис. изображены циклы, используемые в бензиновом карбюраторном (1)и в дизельном двигателях (2). • В обоих случаях рабочим телом является смесь паров бензина или дизельного топлива с воздухом.
 Термодинамические циклы Цикл карбюраторного двигателя внутреннего сгорания состоит из двух изохор (1– 2, 3– 4) и двух адиабат (2– 3, 4– 1).
Термодинамические циклы Цикл карбюраторного двигателя внутреннего сгорания состоит из двух изохор (1– 2, 3– 4) и двух адиабат (2– 3, 4– 1).
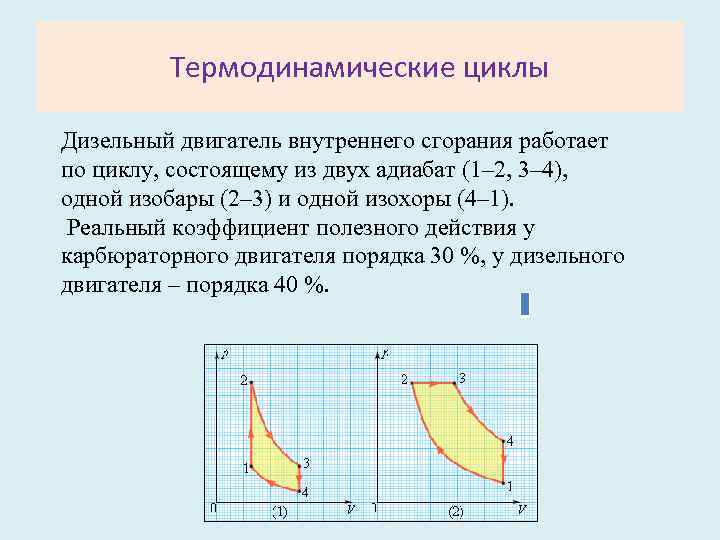 Термодинамические циклы Дизельный двигатель внутреннего сгорания работает по циклу, состоящему из двух адиабат (1– 2, 3– 4), одной изобары (2– 3) и одной изохоры (4– 1). Реальный коэффициент полезного действия у карбюраторного двигателя порядка 30 %, у дизельного двигателя – порядка 40 %.
Термодинамические циклы Дизельный двигатель внутреннего сгорания работает по циклу, состоящему из двух адиабат (1– 2, 3– 4), одной изобары (2– 3) и одной изохоры (4– 1). Реальный коэффициент полезного действия у карбюраторного двигателя порядка 30 %, у дизельного двигателя – порядка 40 %.
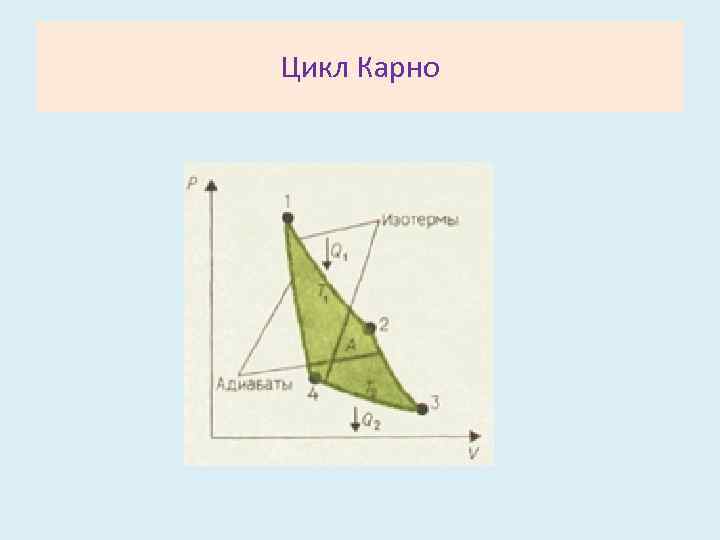
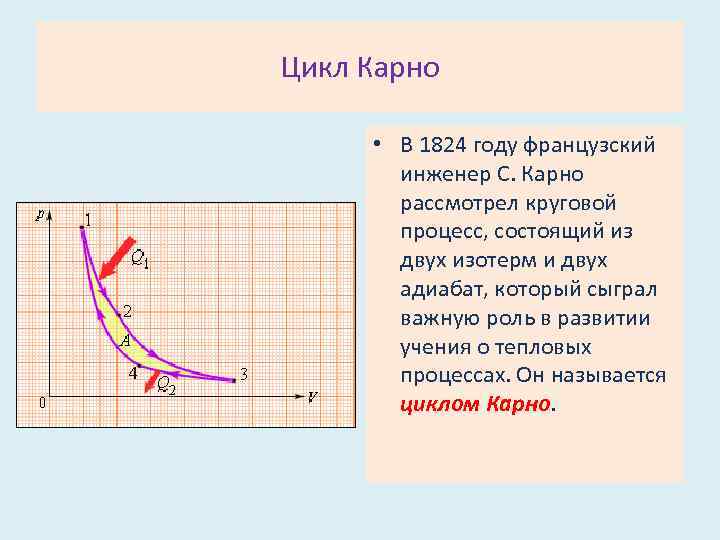 Цикл Карно • В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат, который сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно.
Цикл Карно • В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат, который сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно.
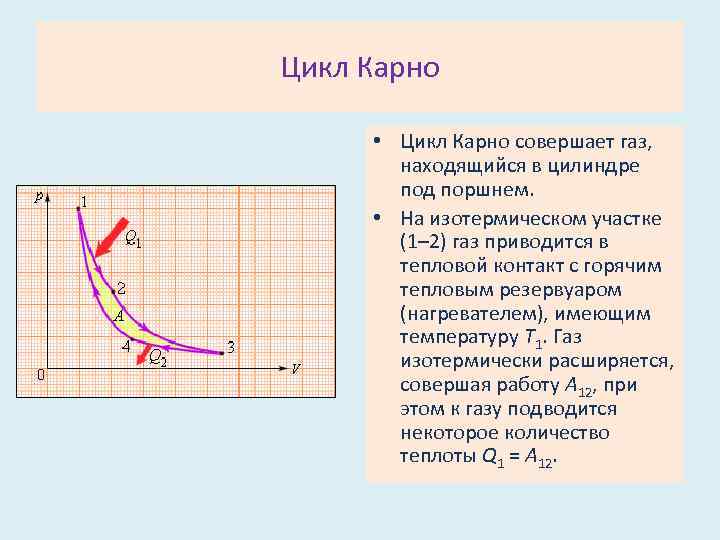 Цикл Карно • Цикл Карно совершает газ, находящийся в цилиндре под поршнем. • На изотермическом участке (1– 2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T 1. Газ изотермически расширяется, совершая работу A 12, при этом к газу подводится некоторое количество теплоты Q 1 = A 12.
Цикл Карно • Цикл Карно совершает газ, находящийся в цилиндре под поршнем. • На изотермическом участке (1– 2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T 1. Газ изотермически расширяется, совершая работу A 12, при этом к газу подводится некоторое количество теплоты Q 1 = A 12.
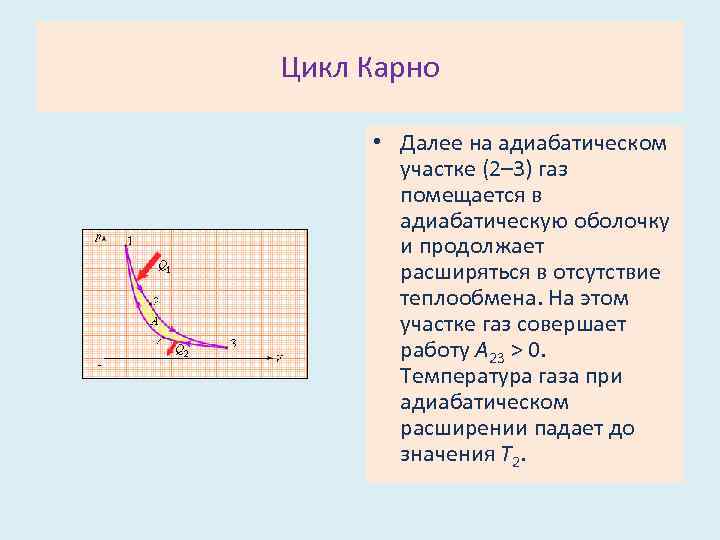 Цикл Карно • Далее на адиабатическом участке (2– 3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A 23 > 0. Температура газа при адиабатическом расширении падает до значения T 2.
Цикл Карно • Далее на адиабатическом участке (2– 3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A 23 > 0. Температура газа при адиабатическом расширении падает до значения T 2.
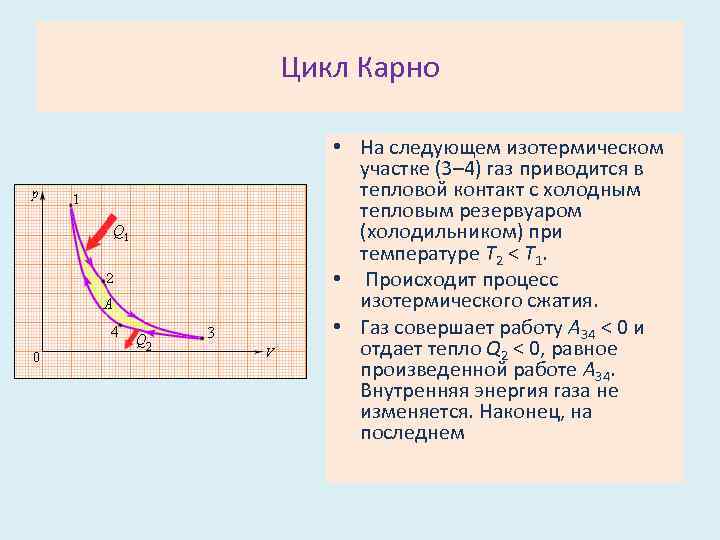 Цикл Карно • На следующем изотермическом участке (3– 4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T 2 < T 1. • Происходит процесс изотермического сжатия. • Газ совершает работу A 34 < 0 и отдает тепло Q 2 < 0, равное произведенной работе A 34. Внутренняя энергия газа не изменяется. Наконец, на последнем
Цикл Карно • На следующем изотермическом участке (3– 4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T 2 < T 1. • Происходит процесс изотермического сжатия. • Газ совершает работу A 34 < 0 и отдает тепло Q 2 < 0, равное произведенной работе A 34. Внутренняя энергия газа не изменяется. Наконец, на последнем
 Цикл Карно • Наконец, на последнем участке адиабатического сжатия газ вновь помещается в адиабатическую оболочку. При сжатии температура газа повышается до значения T 1, газ совершает работу A 41 < 0.
Цикл Карно • Наконец, на последнем участке адиабатического сжатия газ вновь помещается в адиабатическую оболочку. При сжатии температура газа повышается до значения T 1, газ совершает работу A 41 < 0.
 Цикл Карно
Цикл Карно
 Цикл Карно •
Цикл Карно •
 Цикл Карно •
Цикл Карно •
 Цикл Карно • По определению, коэффициент полезного действия η цикла Карно есть • С. Карно выразил коэффициент полезного действия цикла через температуры нагревателя T 1 и холодильника T 2:
Цикл Карно • По определению, коэффициент полезного действия η цикла Карно есть • С. Карно выразил коэффициент полезного действия цикла через температуры нагревателя T 1 и холодильника T 2:
 Цикл Карно • Цикл Карно замечателен тем, что на всех его участках отсутствует соприкосновение тел с различными температурами. • Любое состояние рабочего тела (газа) на цикле является квазиравновесным, т. е. бесконечно близким к состоянию теплового равновесия с окружающими телами (тепловыми резервуарами или термостатами). • Цикл Карно исключает теплообмен при конечной разности температур рабочего тела и окружающей среды (термостатов), когда тепло может передаваться без совершения работы. Поэтому цикл Карно – наиболее эффективный круговой процесс из всех возможных при заданных температурах нагревателя и холодильника: • ηКарно = ηmax.
Цикл Карно • Цикл Карно замечателен тем, что на всех его участках отсутствует соприкосновение тел с различными температурами. • Любое состояние рабочего тела (газа) на цикле является квазиравновесным, т. е. бесконечно близким к состоянию теплового равновесия с окружающими телами (тепловыми резервуарами или термостатами). • Цикл Карно исключает теплообмен при конечной разности температур рабочего тела и окружающей среды (термостатов), когда тепло может передаваться без совершения работы. Поэтому цикл Карно – наиболее эффективный круговой процесс из всех возможных при заданных температурах нагревателя и холодильника: • ηКарно = ηmax.
 Цикл Карно • Для цикла Карно к. п. д. действительно определяется только температурами нагревателя и холодильника. • Для его повышения необходимо увеличивать разность температур нагревателя и холодильника. • Например, при Т 1 = 400 К и Т 2 = ЗООК η = 0, 25. • Если же температуру нагревателя повысить на 100 К, а температуру холодильника понизить на 50 К, то η= 0, 5. • К. п. д. всякого реального теплового двигателя из-за трения и неизбежных тепловых потерь гораздо меньше вычисленного для цикла Карно.
Цикл Карно • Для цикла Карно к. п. д. действительно определяется только температурами нагревателя и холодильника. • Для его повышения необходимо увеличивать разность температур нагревателя и холодильника. • Например, при Т 1 = 400 К и Т 2 = ЗООК η = 0, 25. • Если же температуру нагревателя повысить на 100 К, а температуру холодильника понизить на 50 К, то η= 0, 5. • К. п. д. всякого реального теплового двигателя из-за трения и неизбежных тепловых потерь гораздо меньше вычисленного для цикла Карно.
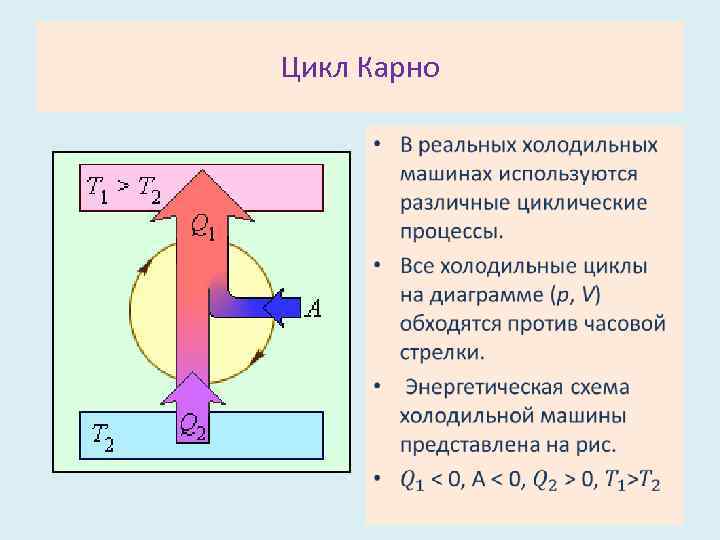
 Цикл Карно • Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. • Обход цикла по часовой стрелке соответствует тепловому двигателю, когда полученное рабочим телом тепло частично превращается в полезную работу. • Обход против часовой стрелки соответствует холодильной машине, когда некоторое количество теплоты отбирается от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. • Поэтому идеальное устройство, работающее по циклу Карно, называют обратимой тепловой машиной.
Цикл Карно • Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. • Обход цикла по часовой стрелке соответствует тепловому двигателю, когда полученное рабочим телом тепло частично превращается в полезную работу. • Обход против часовой стрелки соответствует холодильной машине, когда некоторое количество теплоты отбирается от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. • Поэтому идеальное устройство, работающее по циклу Карно, называют обратимой тепловой машиной.
 Цикл Карно •
Цикл Карно •
 Цикл Карно •
Цикл Карно •



