7116d7189693c3cf3ef90daab89af0cf.ppt
- Количество слайдов: 24
 ОСНОВЫ ТЕОРИИ СПЛАВОВ Лекция 1 Поток МС 41 Лектор доц. Лябук С. И. Использованы материалы электронного ресурса www. google. com. ua/search
ОСНОВЫ ТЕОРИИ СПЛАВОВ Лекция 1 Поток МС 41 Лектор доц. Лябук С. И. Использованы материалы электронного ресурса www. google. com. ua/search
 Вопросы 1. 2. 3. 4. 5. Понятие о кристаллизации металла Изменение свободной энергии при кристаллизации Механизм и закономерности кристаллизации Условия получения мелкозернистой структуры Строение слитка
Вопросы 1. 2. 3. 4. 5. Понятие о кристаллизации металла Изменение свободной энергии при кристаллизации Механизм и закономерности кристаллизации Условия получения мелкозернистой структуры Строение слитка
 Литература 1. С. С. Дяченко, І. В. Дощечкіна, А. О. Мовлян, Е. І. Плешаков Матеріалознавство, Харків, ХНАДУ, 2007 2. Материаловедение Б. Н. Арзамасов, В. И. Макарова, 2007 3. Металловедение. Н. Ф. Болховитинов 4. Перспективные материалы А. А. Викарчук, А. М. Глезер и др. , 2006
Литература 1. С. С. Дяченко, І. В. Дощечкіна, А. О. Мовлян, Е. І. Плешаков Матеріалознавство, Харків, ХНАДУ, 2007 2. Материаловедение Б. Н. Арзамасов, В. И. Макарова, 2007 3. Металловедение. Н. Ф. Болховитинов 4. Перспективные материалы А. А. Викарчук, А. М. Глезер и др. , 2006
 Основные понятия процесса кристаллизации Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры – первичная кристаллизация. Образование новых кристаллов в твердом кристаллическом веществе – вторичная кристаллизация. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рисунке Процесс кристаллизации чистого металла: До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии. Ттеор- теоретическая температура кристаллизации Ткр- реальная температура кристаллиpации
Основные понятия процесса кристаллизации Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры – первичная кристаллизация. Образование новых кристаллов в твердом кристаллическом веществе – вторичная кристаллизация. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рисунке Процесс кристаллизации чистого металла: До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии. Ттеор- теоретическая температура кристаллизации Ткр- реальная температура кристаллиpации
 Механизм и закономерности кристаллизации металлов. Зависимость энергии системы от размера зародыша твердой фазы При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рисунке. Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.
Механизм и закономерности кристаллизации металлов. Зависимость энергии системы от размера зародыша твердой фазы При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рисунке. Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.
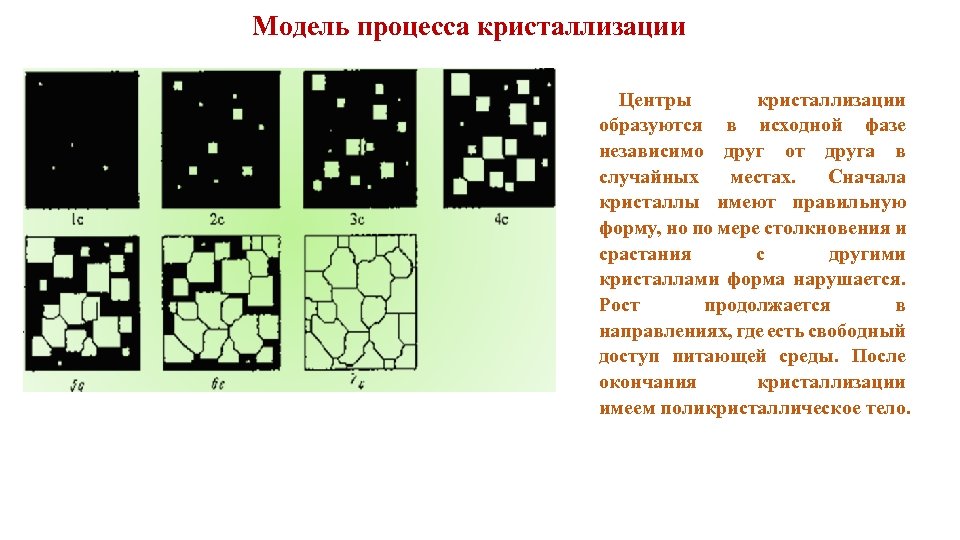 Модель процесса кристаллизации Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Модель процесса кристаллизации Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
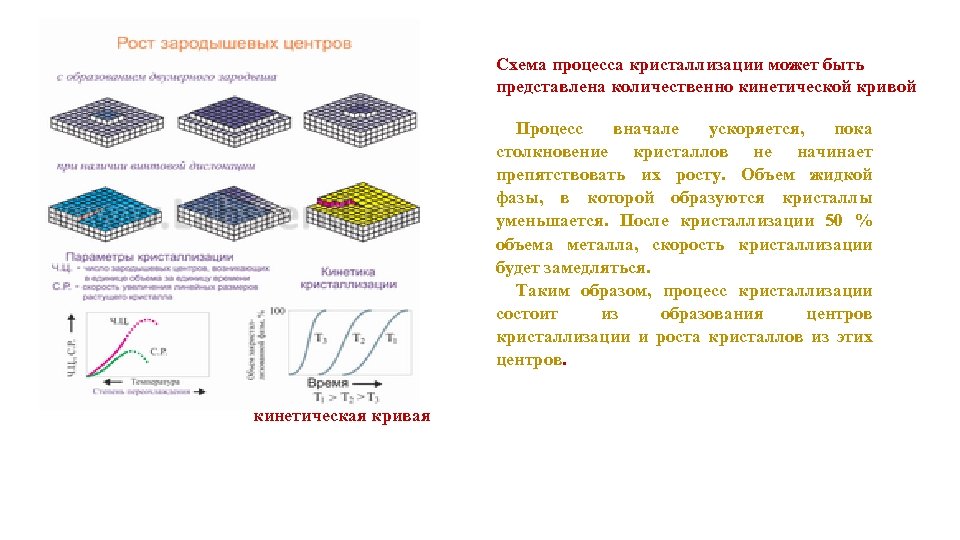 Схема процесса кристаллизации может быть представлена количественно кинетической кривой Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться. Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров. кинетическая кривая
Схема процесса кристаллизации может быть представлена количественно кинетической кривой Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться. Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров. кинетическая кривая
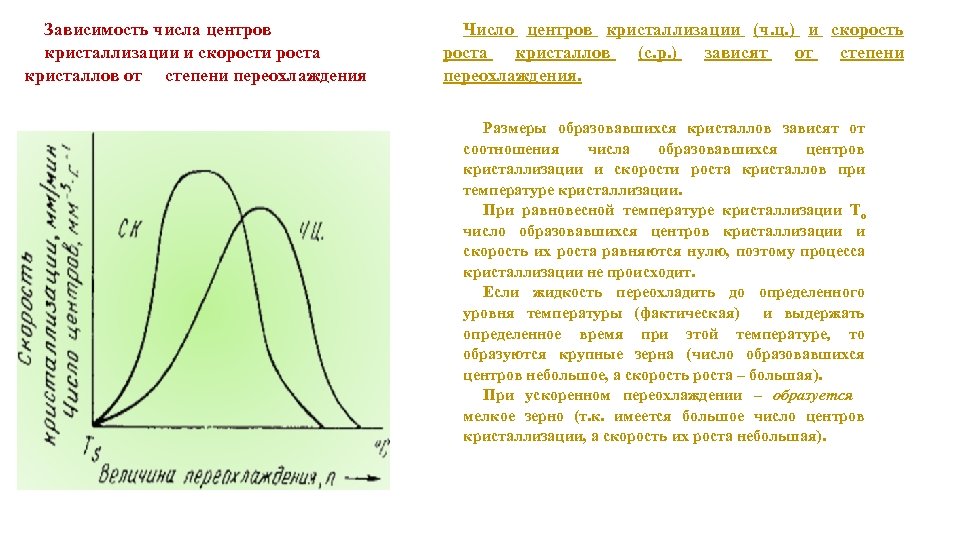 Зависимость числа центров кристаллизации и скорости роста кристаллов от степени переохлаждения Число центров кристаллизации (ч. ц. ) и скорость роста кристаллов (с. р. ) зависят от степени переохлаждения. Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации. При равновесной температуре кристаллизации То число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит. Если жидкость переохладить до определенного уровня температуры (фактическая) и выдержать определенное время при этой температуре, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая). При ускоренном переохлаждении – образуется мелкое зерно (т. к. имеется большое число центров кристаллизации, а скорость их роста небольшая).
Зависимость числа центров кристаллизации и скорости роста кристаллов от степени переохлаждения Число центров кристаллизации (ч. ц. ) и скорость роста кристаллов (с. р. ) зависят от степени переохлаждения. Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации. При равновесной температуре кристаллизации То число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит. Если жидкость переохладить до определенного уровня температуры (фактическая) и выдержать определенное время при этой температуре, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая). При ускоренном переохлаждении – образуется мелкое зерно (т. к. имеется большое число центров кристаллизации, а скорость их роста небольшая).
 Условия получения мелкозернистой структуры Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов. Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося металла. Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации. Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы. По механизму воздействия различают: 1. Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации. 2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту. Т. о. способствуют получению мелкозернистой структуры: • максимальное число центров кристаллизации и малая скорость роста кристаллов • модифицирование • Увеличение степени переохлаждения (увеличение скорости кристаллизации)
Условия получения мелкозернистой структуры Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов. Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося металла. Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации. Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы. По механизму воздействия различают: 1. Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации. 2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту. Т. о. способствуют получению мелкозернистой структуры: • максимальное число центров кристаллизации и малая скорость роста кристаллов • модифицирование • Увеличение степени переохлаждения (увеличение скорости кристаллизации)
 Строение металлического слитка Схема стального слитка, данная Черновым Д. К. Слиток состоит из трех зон: 1. мелкокристаллическая корковая зона; 2. зона столбчатых кристаллов; 3. внутренняя зона крупных равноосных кристаллов. Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура. Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера. Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты. Растут дендриты с направлением, близким к направлению теплоотвода.
Строение металлического слитка Схема стального слитка, данная Черновым Д. К. Слиток состоит из трех зон: 1. мелкокристаллическая корковая зона; 2. зона столбчатых кристаллов; 3. внутренняя зона крупных равноосных кристаллов. Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура. Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера. Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты. Растут дендриты с направлением, близким к направлению теплоотвода.
 Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией. Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией. Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка. В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15… 20 % от длины слитка).
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией. Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией. Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка. В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15… 20 % от длины слитка).
 Различают макроструктуру, микроструктуру и тонкую структуру. 1. Макроструктурный анализ – изучение строения металлов и сплавов невооруженным глазом или при небольшом увеличении, с помощью лупы. Осуществляется после предварительной подготовки исследуемой поверхности (шлифование и травление специальными реактивами). Позволяет выявить и определить дефекты, возникшие на различных этапах производства литых, кованных, штампованных и катанных заготовок, а также причины разрушения деталей. Устанавливают: вид излома (вязкий, хрупкий); величину, форму и расположение зерен и дендритов литого металла; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла, вызванную процессами кристаллизации или созданную термической и химико-термической обработкой; волокна в деформированном металле. 2. Микроструктурный анализ – изучение поверхности при помощи световых микроскопов. Увеличение – 50… 2000 раз. Позволяет обнаружить элементы структуры размером до 0, 2 мкм. Образцы – микрошлифы с блестящей полированной поверхностью, так как структура рассматривается в отраженном свете. Наблюдаются микротрещины и неметаллические включения. Для выявления микроструктуры поверхность травят реактивами, зависящими от состава сплава. Различные фазы протравливаются неодинаково и окрашиваются по разному. Можно выявить форму, размеры и ориентировку зерен, отдельные фазы и структурные составляющие. Кроме световых микроскопов используют электронные микроскопы с большой разрешающей способностью. Изображение формируется при помощи потока быстро летящих электронов. Электронные лучи с длиной волны (0, 04… 0, 12 ) · 10 -8 см дают возможность различать детали объекта, по своим размерам соответствующе межатомным расстояниям. Просвечивающие микроскопы. Поток электронов проходит через изучаемый объект. Изображение является результатом неодинакового рассеяния электронов на объекте. Различают косвенные и прямые методы исследования. При косвенном методе изучают не сам объект, а его отпечаток – кварцевый или угольный слепок (реплику), отображающую рельеф микрошлифа, для предупреждения вторичного излучения, искажающего картину. При прямом методе изучают тонкие металлические фольги, толщиной до 300 нм, на просвет. Фольги получают непосредственно из изучаемого металла. Растровые микроскопы. Изображение создается за счет вторичной эмиссии электронов, излучаемых поверхностью, на которую падает непрерывно перемещающийся по этой поверхности поток первичных электронов. Изучается непосредственно поверхность металла. Разрешающая способность несколько ниже, чем у просвечивающих микроскопов. 3. Для изучения атомно-кристаллического строения твердых тел (тонкое строение) используются рентгенографические методы, позволяющие устанавливать связь между химическим составом, структурой и свойствами тела, тип твердых растворов, микронапряжения, концентрацию дефектов, плотность дислокаций.
Различают макроструктуру, микроструктуру и тонкую структуру. 1. Макроструктурный анализ – изучение строения металлов и сплавов невооруженным глазом или при небольшом увеличении, с помощью лупы. Осуществляется после предварительной подготовки исследуемой поверхности (шлифование и травление специальными реактивами). Позволяет выявить и определить дефекты, возникшие на различных этапах производства литых, кованных, штампованных и катанных заготовок, а также причины разрушения деталей. Устанавливают: вид излома (вязкий, хрупкий); величину, форму и расположение зерен и дендритов литого металла; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла, вызванную процессами кристаллизации или созданную термической и химико-термической обработкой; волокна в деформированном металле. 2. Микроструктурный анализ – изучение поверхности при помощи световых микроскопов. Увеличение – 50… 2000 раз. Позволяет обнаружить элементы структуры размером до 0, 2 мкм. Образцы – микрошлифы с блестящей полированной поверхностью, так как структура рассматривается в отраженном свете. Наблюдаются микротрещины и неметаллические включения. Для выявления микроструктуры поверхность травят реактивами, зависящими от состава сплава. Различные фазы протравливаются неодинаково и окрашиваются по разному. Можно выявить форму, размеры и ориентировку зерен, отдельные фазы и структурные составляющие. Кроме световых микроскопов используют электронные микроскопы с большой разрешающей способностью. Изображение формируется при помощи потока быстро летящих электронов. Электронные лучи с длиной волны (0, 04… 0, 12 ) · 10 -8 см дают возможность различать детали объекта, по своим размерам соответствующе межатомным расстояниям. Просвечивающие микроскопы. Поток электронов проходит через изучаемый объект. Изображение является результатом неодинакового рассеяния электронов на объекте. Различают косвенные и прямые методы исследования. При косвенном методе изучают не сам объект, а его отпечаток – кварцевый или угольный слепок (реплику), отображающую рельеф микрошлифа, для предупреждения вторичного излучения, искажающего картину. При прямом методе изучают тонкие металлические фольги, толщиной до 300 нм, на просвет. Фольги получают непосредственно из изучаемого металла. Растровые микроскопы. Изображение создается за счет вторичной эмиссии электронов, излучаемых поверхностью, на которую падает непрерывно перемещающийся по этой поверхности поток первичных электронов. Изучается непосредственно поверхность металла. Разрешающая способность несколько ниже, чем у просвечивающих микроскопов. 3. Для изучения атомно-кристаллического строения твердых тел (тонкое строение) используются рентгенографические методы, позволяющие устанавливать связь между химическим составом, структурой и свойствами тела, тип твердых растворов, микронапряжения, концентрацию дефектов, плотность дислокаций.
 Основные понятия в теории сплавов Система – группа тел выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Фаза – однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую структура и свойства резко меняются. Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе. Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы ( С ). Это правило фаз или закон Гиббса Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
Основные понятия в теории сплавов Система – группа тел выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Фаза – однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую структура и свойства резко меняются. Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе. Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы ( С ). Это правило фаз или закон Гиббса Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
 Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы: 1. механические смеси; 2. химические соединения; 3. твердые растворы. Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов. В сплавах сохраняются кристаллические решетки компонентов. Схема микроструктуры механической смеси
Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы: 1. механические смеси; 2. химические соединения; 3. твердые растворы. Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов. В сплавах сохраняются кристаллические решетки компонентов. Схема микроструктуры механической смеси
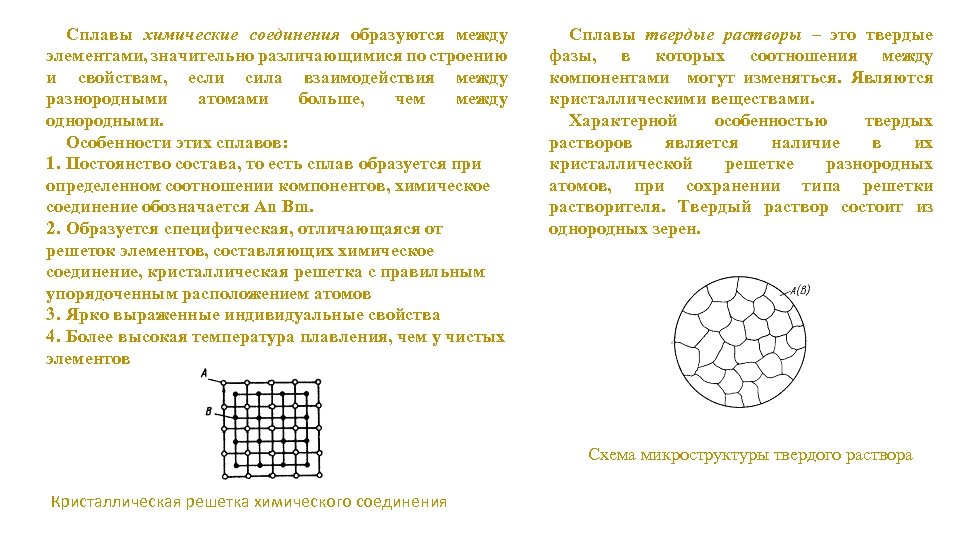 Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. Особенности этих сплавов: 1. Постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается Аn Вm. 2. Образуется специфическая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов 3. Ярко выраженные индивидуальные свойства 4. Более высокая температура плавления, чем у чистых элементов Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентами могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен. Схема микроструктуры твердого раствора Кристаллическая решетка химического соединения
Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. Особенности этих сплавов: 1. Постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается Аn Вm. 2. Образуется специфическая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов 3. Ярко выраженные индивидуальные свойства 4. Более высокая температура плавления, чем у чистых элементов Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентами могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен. Схема микроструктуры твердого раствора Кристаллическая решетка химического соединения
 Понятие о структуре металлов и сплавов. Примеры структур металлов Все металлы – тела кристаллические. Атомы располагаются закономерно в отличие от аморфных тел и жидкостей. Металлы состоят из различно ориентированных кристаллитов – зерен. Микроструктура материала – результат объединения отдельных кристаллов и фаз в единое целое. Изменение внутреннего строения отражается на свойствах материала Границы между кристаллитами Микроструктура стали с различным содержанием углерода Угол разориентации Микроструктура стали 09 Г 2 ФБ Граница между зернами - кристаллитами представляет собой тонкую в 5 – 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов. Различная ориентировка кристаллитов
Понятие о структуре металлов и сплавов. Примеры структур металлов Все металлы – тела кристаллические. Атомы располагаются закономерно в отличие от аморфных тел и жидкостей. Металлы состоят из различно ориентированных кристаллитов – зерен. Микроструктура материала – результат объединения отдельных кристаллов и фаз в единое целое. Изменение внутреннего строения отражается на свойствах материала Границы между кристаллитами Микроструктура стали с различным содержанием углерода Угол разориентации Микроструктура стали 09 Г 2 ФБ Граница между зернами - кристаллитами представляет собой тонкую в 5 – 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов. Различная ориентировка кристаллитов
 Атомно-кристаллическая структура металлов Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния Атом Н Электронный уровень Х 1500000 Х 5000 микроструктура Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующих в реальном кристалле. Между ионами и электронами возникают электростатические силы притяжения или отталкивания. Атомы располагаются на таком расстоянии друг от друга, которое соответствует минимальному расстоянию при котором энергия =min. Энергия связи двух рассматриваемых атомов Е 0 это величина потенциальной энергии, отвечающая затратам энергии, необходимым для разведения двух атомов на бесконечно большое расстояние друг от друга. Для двух изолированных атомов энергия притяжения как функция расстояния между ними выражается: ЕА = -А/r аналогично выражается энергия отталкивания: ЕR= B/rn А, В, n – константы, величина которых зависит от природы конкретной ионной связи, n~ 8
Атомно-кристаллическая структура металлов Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния Атом Н Электронный уровень Х 1500000 Х 5000 микроструктура Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующих в реальном кристалле. Между ионами и электронами возникают электростатические силы притяжения или отталкивания. Атомы располагаются на таком расстоянии друг от друга, которое соответствует минимальному расстоянию при котором энергия =min. Энергия связи двух рассматриваемых атомов Е 0 это величина потенциальной энергии, отвечающая затратам энергии, необходимым для разведения двух атомов на бесконечно большое расстояние друг от друга. Для двух изолированных атомов энергия притяжения как функция расстояния между ними выражается: ЕА = -А/r аналогично выражается энергия отталкивания: ЕR= B/rn А, В, n – константы, величина которых зависит от природы конкретной ионной связи, n~ 8
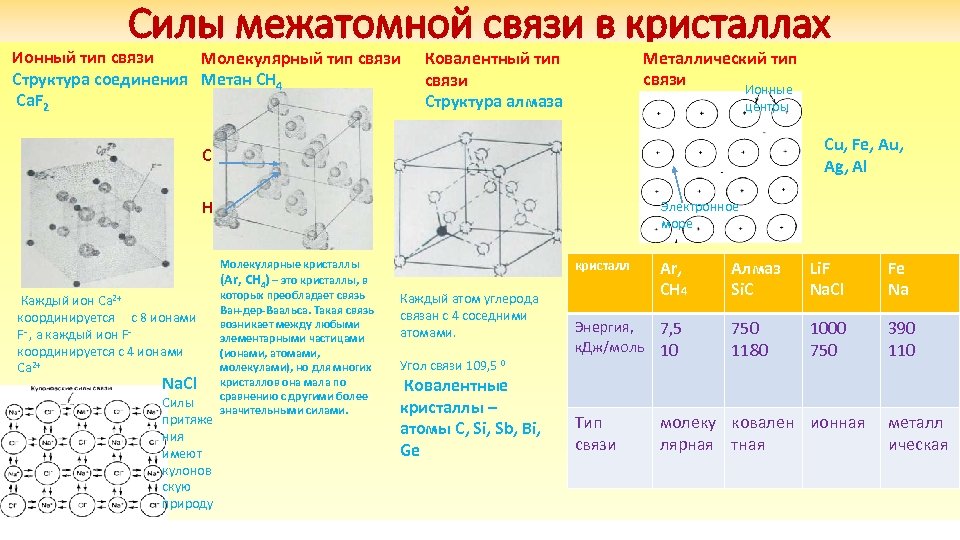 Силы межатомной связи в кристаллах Ионный тип связи Молекулярный тип связи Структура соединения Метан CH 4 Ca. F 2 Металлический тип связи Ионные Ковалентный тип связи Структура алмаза центры Cu, Fe, Au, Ag, Al C H Каждый ион Ca 2+ координируется с 8 ионами F- , а каждый ион Fкоординируется с 4 ионами Ca 2+ Na. Cl Силы притяже ния имеют кулонов скую природу Электронное море Молекулярные кристаллы (Ar, CH 4) – это кристаллы, в которых преобладает связь Ван-дер-Ваальса. Такая связь возникает между любыми элементарными частицами (ионами, атомами, молекулами), но для многих кристаллов она мала по сравнению с другими более значительными силами. кристалл Каждый атом углерода связан с 4 соседними атомами. Угол связи 109, 5 0 Ковалентные кристаллы – атомы С, Si, Sb, Bi, Ge Ar, CH 4 Энергия, 7, 5 к. Дж/моль 10 Тип связи Алмаз Si. C Li. F Na. Cl Fe Na 750 1180 1000 750 390 110 молеку ковален ионная лярная тная металл ическая
Силы межатомной связи в кристаллах Ионный тип связи Молекулярный тип связи Структура соединения Метан CH 4 Ca. F 2 Металлический тип связи Ионные Ковалентный тип связи Структура алмаза центры Cu, Fe, Au, Ag, Al C H Каждый ион Ca 2+ координируется с 8 ионами F- , а каждый ион Fкоординируется с 4 ионами Ca 2+ Na. Cl Силы притяже ния имеют кулонов скую природу Электронное море Молекулярные кристаллы (Ar, CH 4) – это кристаллы, в которых преобладает связь Ван-дер-Ваальса. Такая связь возникает между любыми элементарными частицами (ионами, атомами, молекулами), но для многих кристаллов она мала по сравнению с другими более значительными силами. кристалл Каждый атом углерода связан с 4 соседними атомами. Угол связи 109, 5 0 Ковалентные кристаллы – атомы С, Si, Sb, Bi, Ge Ar, CH 4 Энергия, 7, 5 к. Дж/моль 10 Тип связи Алмаз Si. C Li. F Na. Cl Fe Na 750 1180 1000 750 390 110 молеку ковален ионная лярная тная металл ическая
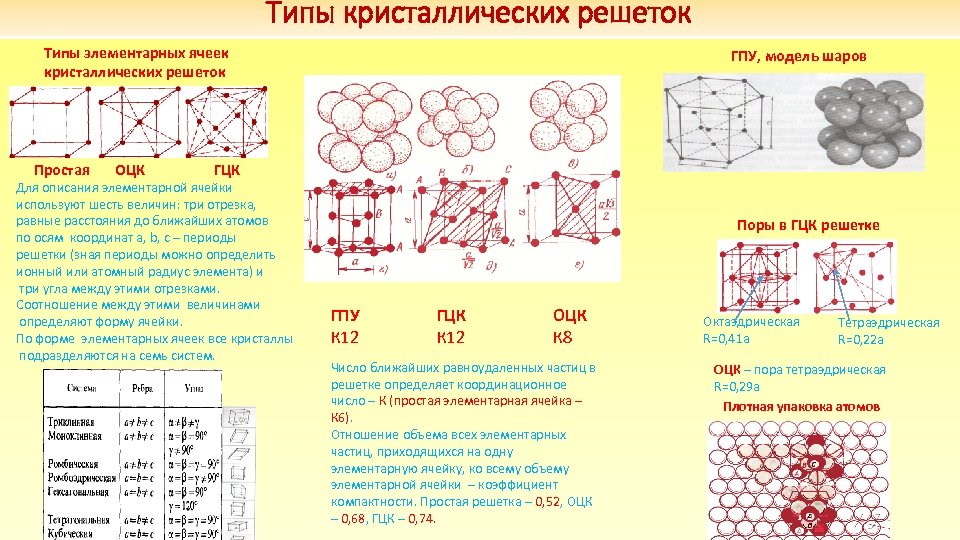 Типы кристаллических решеток Типы элементарных ячеек кристаллических решеток Простая ОЦК ГПУ, модель шаров ГЦК Для описания элементарной ячейки используют шесть величин: три отрезка, равные расстояния до ближайших атомов по осям координат a, b, с – периоды решетки (зная периоды можно определить ионный или атомный радиус элемента) и три угла между этими отрезками. Соотношение между этими величинами определяют форму ячейки. По форме элементарных ячеек все кристаллы подразделяются на семь систем. Поры в ГЦК решетке ГПУ К 12 ГЦК К 12 ОЦК К 8 Число ближайших равноудаленных частиц в решетке определяет координационное число – К (простая элементарная ячейка – К 6). Отношение объема всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки – коэффициент компактности. Простая решетка – 0, 52, ОЦК – 0, 68, ГЦК – 0, 74. Октаэдрическая R=0, 41 a Тетраэдрическая R=0, 22 a OЦК – пора тетраэдрическая R=0, 29 a Плотная упаковка атомов
Типы кристаллических решеток Типы элементарных ячеек кристаллических решеток Простая ОЦК ГПУ, модель шаров ГЦК Для описания элементарной ячейки используют шесть величин: три отрезка, равные расстояния до ближайших атомов по осям координат a, b, с – периоды решетки (зная периоды можно определить ионный или атомный радиус элемента) и три угла между этими отрезками. Соотношение между этими величинами определяют форму ячейки. По форме элементарных ячеек все кристаллы подразделяются на семь систем. Поры в ГЦК решетке ГПУ К 12 ГЦК К 12 ОЦК К 8 Число ближайших равноудаленных частиц в решетке определяет координационное число – К (простая элементарная ячейка – К 6). Отношение объема всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки – коэффициент компактности. Простая решетка – 0, 52, ОЦК – 0, 68, ГЦК – 0, 74. Октаэдрическая R=0, 41 a Тетраэдрическая R=0, 22 a OЦК – пора тетраэдрическая R=0, 29 a Плотная упаковка атомов
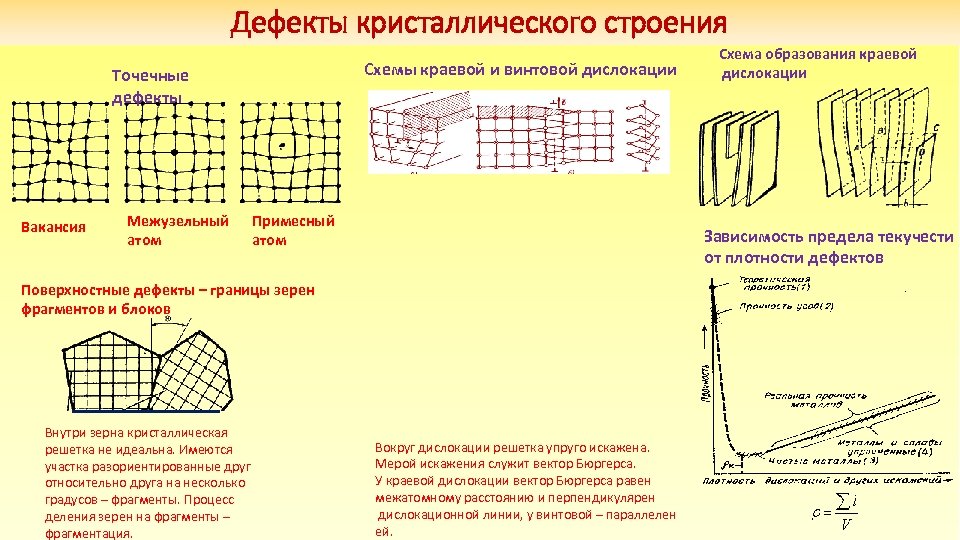 Дефекты кристаллического строения Схемы краевой и винтовой дислокации Точечные дефекты Вакансия Межузельный атом Примесный атом Зависимость предела текучести от плотности дефектов Поверхностные дефекты – границы зерен фрагментов и блоков Внутри зерна кристаллическая решетка не идеальна. Имеются участка разориентированные друг относительно друга на несколько градусов – фрагменты. Процесс деления зерен на фрагменты – фрагментация. Схема образования краевой дислокации Вокруг дислокации решетка упруго искажена. Мерой искажения служит вектор Бюргерса. У краевой дислокации вектор Бюргерса равен межатомному расстоянию и перпендикулярен дислокационной линии, у винтовой – параллелен ей.
Дефекты кристаллического строения Схемы краевой и винтовой дислокации Точечные дефекты Вакансия Межузельный атом Примесный атом Зависимость предела текучести от плотности дефектов Поверхностные дефекты – границы зерен фрагментов и блоков Внутри зерна кристаллическая решетка не идеальна. Имеются участка разориентированные друг относительно друга на несколько градусов – фрагменты. Процесс деления зерен на фрагменты – фрагментация. Схема образования краевой дислокации Вокруг дислокации решетка упруго искажена. Мерой искажения служит вектор Бюргерса. У краевой дислокации вектор Бюргерса равен межатомному расстоянию и перпендикулярен дислокационной линии, у винтовой – параллелен ей.
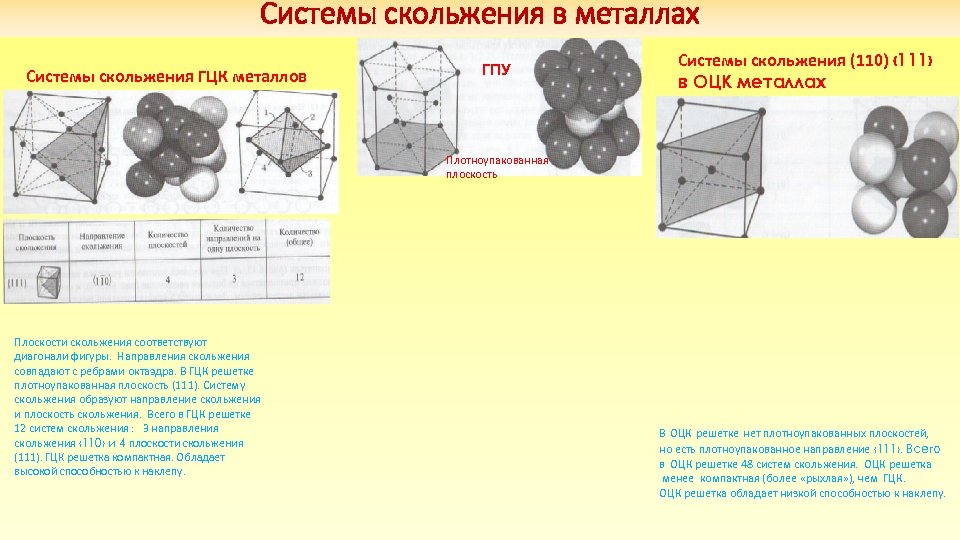 Системы скольжения в металлах Системы скольжения ГЦК металлов ГПУ Системы скольжения (110) ‹ 111› в ОЦК металлах Плотноупакованная плоскость Плоскости скольжения соответствуют диагонали фигуры. Направления скольжения совпадают с ребрами октаэдра. В ГЦК решетке плотноупакованная плоскость (111). Систему скольжения образуют направление скольжения и плоскость скольжения. Всего в ГЦК решетке 12 систем скольжения : 3 направления скольжения ‹ 110› и 4 плоскости скольжения (111). ГЦК решетка компактная. Обладает высокой способностью к наклепу. В ОЦК решетке нет плотноупакованных плоскостей, но есть плотноупакованное направление ‹ 111›. Всего в ОЦК решетке 48 систем скольжения. ОЦК решетка менее компактная (более «рыхлая» ), чем ГЦК. ОЦК решетка обладает низкой способностью к наклепу.
Системы скольжения в металлах Системы скольжения ГЦК металлов ГПУ Системы скольжения (110) ‹ 111› в ОЦК металлах Плотноупакованная плоскость Плоскости скольжения соответствуют диагонали фигуры. Направления скольжения совпадают с ребрами октаэдра. В ГЦК решетке плотноупакованная плоскость (111). Систему скольжения образуют направление скольжения и плоскость скольжения. Всего в ГЦК решетке 12 систем скольжения : 3 направления скольжения ‹ 110› и 4 плоскости скольжения (111). ГЦК решетка компактная. Обладает высокой способностью к наклепу. В ОЦК решетке нет плотноупакованных плоскостей, но есть плотноупакованное направление ‹ 111›. Всего в ОЦК решетке 48 систем скольжения. ОЦК решетка менее компактная (более «рыхлая» ), чем ГЦК. ОЦК решетка обладает низкой способностью к наклепу.
 Системы двойникования в металлах
Системы двойникования в металлах
 Представление о теоретической и реальной прочности
Представление о теоретической и реальной прочности
 Основные определения пластической деформации
Основные определения пластической деформации


