основы ПЦР и конструирование праймеров.pptx
- Количество слайдов: 11
 Основы полимеразной цепной реакции
Основы полимеразной цепной реакции
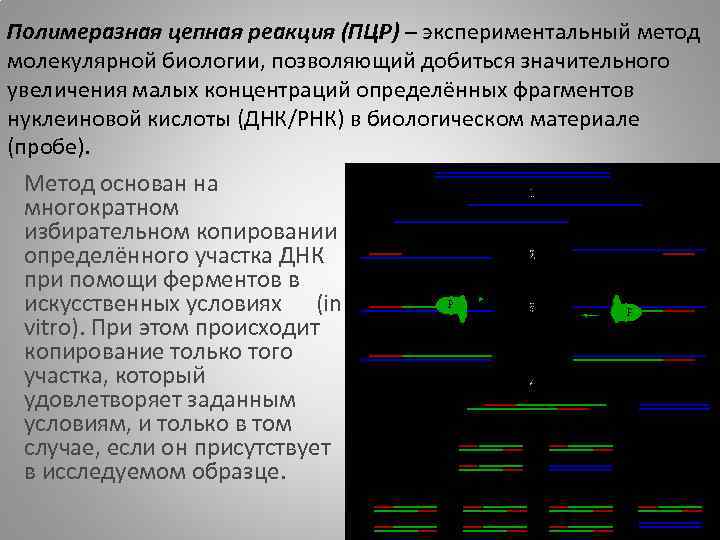 Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК/РНК) в биологическом материале (пробе). Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК/РНК) в биологическом материале (пробе). Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
 В состав реакционной смеси входят: -буфер, -Taq-полимераза, -ДНК-проба, -олигонулеотидные затравки (праймеры), -набор 4 -х типов дезоксинуклезидтрифосфатов. Буферная система – смесь катионов и анионов в определенной концентрации, обеспечивающая оптимальные условия для работы фермента, а также стабильное значение р. Н. Taq- полимераза – термостабильная ДНК-полимераза, которая обеспечивает достраивание второй цепи ДНК, начиная с 3`конца праймера согласно принципу комплементарности. ДНК-проба – специальным образом обработанный анализируемый образец, который может содержать искомую ДНК, служащую мишенью для амплификации. Праймеры – искусственно синтезированные олигонуклеотиды размером обычно от 18 до 25 нуклеотидов, идентичные соответствующим участкам ДНК-мишени. Смесь дезоксинуклеозидтрифосфатов (d. NTP) – раствор дезоксиаденозинтрифосфата (d. ATP), дезоксигуанозинтрифосфата (d. GTP), дезоксицитозинтрифосфата (d. CTP), дезокситимидинтрифосфата (d. TTP), которые служат строительным материалом для синтеза Taq-полимеразой второй цепи ДНК согласно принципу комплементарности.
В состав реакционной смеси входят: -буфер, -Taq-полимераза, -ДНК-проба, -олигонулеотидные затравки (праймеры), -набор 4 -х типов дезоксинуклезидтрифосфатов. Буферная система – смесь катионов и анионов в определенной концентрации, обеспечивающая оптимальные условия для работы фермента, а также стабильное значение р. Н. Taq- полимераза – термостабильная ДНК-полимераза, которая обеспечивает достраивание второй цепи ДНК, начиная с 3`конца праймера согласно принципу комплементарности. ДНК-проба – специальным образом обработанный анализируемый образец, который может содержать искомую ДНК, служащую мишенью для амплификации. Праймеры – искусственно синтезированные олигонуклеотиды размером обычно от 18 до 25 нуклеотидов, идентичные соответствующим участкам ДНК-мишени. Смесь дезоксинуклеозидтрифосфатов (d. NTP) – раствор дезоксиаденозинтрифосфата (d. ATP), дезоксигуанозинтрифосфата (d. GTP), дезоксицитозинтрифосфата (d. CTP), дезокситимидинтрифосфата (d. TTP), которые служат строительным материалом для синтеза Taq-полимеразой второй цепи ДНК согласно принципу комплементарности.
 Подбор праймеров выполняется разработчиками тест-систем (наборов для ПЦРреакций) путем анализа секвенированных последовательностей ДНК-мишени и является ключевым, так как именно праймеры определяют возможности амплификации и выявление необходимой нуклеотидной последовательности (ДНК-мишени). При конструировании праймеров для ПЦР следует принимать во внимание несколько параметров: Длина праймера. Поскольку специфичность, температура и время отжига частично зависят от длины праймера, этот параметр является критическим для успешного осуществления ПЦР. В идеале праймер должен иметь размер от 15 до 30 нуклеотидов. Температура плавления. Оба олигонуклеотидных праймера следует конструировать таким образом, что бы они имели одинаковую температуру плавления. Если праймеры не совпадают в отношении Tm, амплификация будет менее эффективной, или может вовсе не сработать(температура плавления в 55 -72 °С дает наилучшие результаты). Температура «отжига» праймера должна быть на 4 -5 о. С (а по мнению некоторых авторов, на 1 -2 о. С) ниже Тm праймера. Специфичность. В идеале праймер должен обладать 100 %-ной комплементарностью по отношению к сайту-мишени и не распознавать другие, даже очень близкие по нуклеотидному составу, последовательности. Однако практика показывает, что эффективными могут быть и праймеры, не обладающие 100 %-ной комплементарностью и имеющие достаточно высокую степень гомологии (но не более 70 %) по отношению к другим нуклеотидным последовательностям.
Подбор праймеров выполняется разработчиками тест-систем (наборов для ПЦРреакций) путем анализа секвенированных последовательностей ДНК-мишени и является ключевым, так как именно праймеры определяют возможности амплификации и выявление необходимой нуклеотидной последовательности (ДНК-мишени). При конструировании праймеров для ПЦР следует принимать во внимание несколько параметров: Длина праймера. Поскольку специфичность, температура и время отжига частично зависят от длины праймера, этот параметр является критическим для успешного осуществления ПЦР. В идеале праймер должен иметь размер от 15 до 30 нуклеотидов. Температура плавления. Оба олигонуклеотидных праймера следует конструировать таким образом, что бы они имели одинаковую температуру плавления. Если праймеры не совпадают в отношении Tm, амплификация будет менее эффективной, или может вовсе не сработать(температура плавления в 55 -72 °С дает наилучшие результаты). Температура «отжига» праймера должна быть на 4 -5 о. С (а по мнению некоторых авторов, на 1 -2 о. С) ниже Тm праймера. Специфичность. В идеале праймер должен обладать 100 %-ной комплементарностью по отношению к сайту-мишени и не распознавать другие, даже очень близкие по нуклеотидному составу, последовательности. Однако практика показывает, что эффективными могут быть и праймеры, не обладающие 100 %-ной комплементарностью и имеющие достаточно высокую степень гомологии (но не более 70 %) по отношению к другим нуклеотидным последовательностям.
 Комплементарная последовательность праймера. Праймер следует конструировать так, чтобы в нем абсолютно отсутствовала внутренняя гомология, превышающая 3 нуклеотидные пары. Если праймер имеет такой участок гомологии, могут создаваться частично двухцепочечные структуры, типа «обратного схлопывания» или «шпилек» , которые будут мешать отжигу с матрицей. G/C cодержание и полипиримидиновые (Т, С) или полипуриновые (А, G) протяженные участки. Последовательность праймера должна быть выбрана таким образом, чтобы не было поли-G или поли-С протяженных участков, которые могут способствовать неспецифическому отжигу. Поли-А и поли-Т протяженных участков тоже следует избегать, так как они будут раскрывать протяженные участки комплекса праймер-матрица. Это может снизить эффективность амплификации. Не следует допускать также образования полипиримидиновых (Т, С) или полипуриновых (А, G) протяженных участков. Идеально, праймер должен содержать почти случайную смесь нуклеотидов, иметь содержание GC 50 -55 % - это даст Tm в пределах 56 -62 °С. Вторичная структура праймера. Праймер не должен укладываться во вторичную структуру(так же как и сайт мишень). При наличии такой структуры эффективность связывания праймера с соответствующей нуклеотидной последовательностью сайтамишени будет низкой. Гомо- и гетеродимеризация праймеров. Возможность гомо- и гетеродимеризации праймеров при температуре, особенно с 3'-конца, так как это может привести к снижению выхода конечного продукта ПЦР (вплоть до его полного отсутствия).
Комплементарная последовательность праймера. Праймер следует конструировать так, чтобы в нем абсолютно отсутствовала внутренняя гомология, превышающая 3 нуклеотидные пары. Если праймер имеет такой участок гомологии, могут создаваться частично двухцепочечные структуры, типа «обратного схлопывания» или «шпилек» , которые будут мешать отжигу с матрицей. G/C cодержание и полипиримидиновые (Т, С) или полипуриновые (А, G) протяженные участки. Последовательность праймера должна быть выбрана таким образом, чтобы не было поли-G или поли-С протяженных участков, которые могут способствовать неспецифическому отжигу. Поли-А и поли-Т протяженных участков тоже следует избегать, так как они будут раскрывать протяженные участки комплекса праймер-матрица. Это может снизить эффективность амплификации. Не следует допускать также образования полипиримидиновых (Т, С) или полипуриновых (А, G) протяженных участков. Идеально, праймер должен содержать почти случайную смесь нуклеотидов, иметь содержание GC 50 -55 % - это даст Tm в пределах 56 -62 °С. Вторичная структура праймера. Праймер не должен укладываться во вторичную структуру(так же как и сайт мишень). При наличии такой структуры эффективность связывания праймера с соответствующей нуклеотидной последовательностью сайтамишени будет низкой. Гомо- и гетеродимеризация праймеров. Возможность гомо- и гетеродимеризации праймеров при температуре, особенно с 3'-конца, так как это может привести к снижению выхода конечного продукта ПЦР (вплоть до его полного отсутствия).
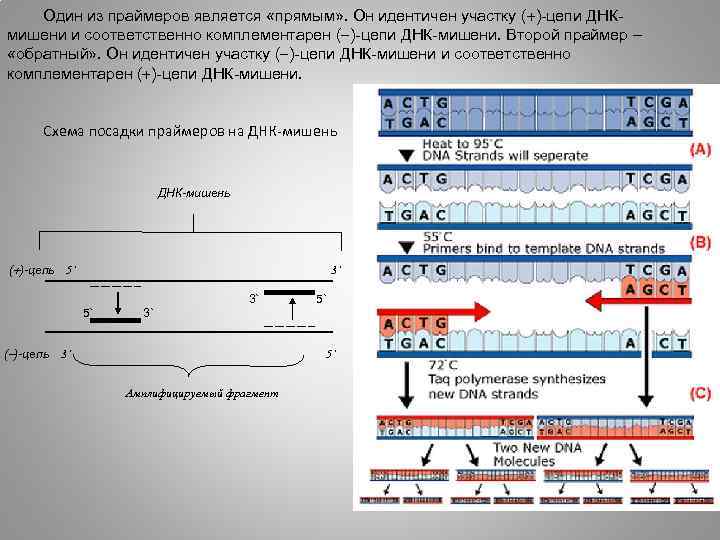 Один из праймеров является «прямым» . Он идентичен участку ( )-цепи ДНКмишени и соответственно комплементарен ( )-цепи ДНК-мишени. Второй праймер – «обратный» . Он идентичен участку ( )-цепи ДНК-мишени и соответственно комплементарен ( )-цепи ДНК-мишени. Схема посадки праймеров на ДНК-мишень ( )-цепь 5` 3` 3` 5` 5` 3` ( )-цепь 3` 5` Амплифицируемый фрагмент
Один из праймеров является «прямым» . Он идентичен участку ( )-цепи ДНКмишени и соответственно комплементарен ( )-цепи ДНК-мишени. Второй праймер – «обратный» . Он идентичен участку ( )-цепи ДНК-мишени и соответственно комплементарен ( )-цепи ДНК-мишени. Схема посадки праймеров на ДНК-мишень ( )-цепь 5` 3` 3` 5` 5` 3` ( )-цепь 3` 5` Амплифицируемый фрагмент
 BLAST (англ. Basic Local Alignment Search Tool) — семейство компьютерных программ, служащих для поиска гомологов белков или нуклеиновых кислот, для которых известна первичная структура (последовательность) или её фрагмент. Семейство программ серии BLAST делится на 5 основных групп: 1. Нуклеотидные - предназначены для сравнения изучаемой нуклеотидной последовательности с базой данных секвенированных нуклеиновых кислот и их участков: -megablast — быстрое сравнение с целью поиска высоко сходных последовательностей, -dmegablast — быстрое сравнение с целью поиска дивергировавших последовательностей, обладающих незначительным сходством, -blastn — медленное сравнение с целью поиска всех сходных последовательностей и др. . 2. Белковые - предназначены для сравнения изучаемой аминокислотной последовательности белка с имеющейся базой данных белков и их участков. -blastp — медленное сравнение с целью поиска всех сходных последовательностей, -cdart — сравнение с целью поиска гомологичных белков по доменной архитектуре, -rpsblast — сравнение с базой данных консервативных доменов, -psi-blast — сравнение с целью поиска последовательностей, обладающих незначительным сходством, -phi-blast — поиск белков, содержащих определённый пользователем паттерн и др.
BLAST (англ. Basic Local Alignment Search Tool) — семейство компьютерных программ, служащих для поиска гомологов белков или нуклеиновых кислот, для которых известна первичная структура (последовательность) или её фрагмент. Семейство программ серии BLAST делится на 5 основных групп: 1. Нуклеотидные - предназначены для сравнения изучаемой нуклеотидной последовательности с базой данных секвенированных нуклеиновых кислот и их участков: -megablast — быстрое сравнение с целью поиска высоко сходных последовательностей, -dmegablast — быстрое сравнение с целью поиска дивергировавших последовательностей, обладающих незначительным сходством, -blastn — медленное сравнение с целью поиска всех сходных последовательностей и др. . 2. Белковые - предназначены для сравнения изучаемой аминокислотной последовательности белка с имеющейся базой данных белков и их участков. -blastp — медленное сравнение с целью поиска всех сходных последовательностей, -cdart — сравнение с целью поиска гомологичных белков по доменной архитектуре, -rpsblast — сравнение с базой данных консервативных доменов, -psi-blast — сравнение с целью поиска последовательностей, обладающих незначительным сходством, -phi-blast — поиск белков, содержащих определённый пользователем паттерн и др.
 3. Транслирующие - способны транслировать нуклеотидные последовательности в аминокислотные: -blastx — переводит изучаемую нуклеотидную последовательность в кодируемые аминокислоты, а затем сравнивает её с имеющейся базой данных аминокислотных последовательностей белков, -tblastn — изучаемая аминокислотная последовательность сравнивается с транслированными последовательностями базы данных секвенированных нуклеиновых кислот, -tblastx — переводит изучаемую нуклеотидную последовательность в аминокислотную, а затем сравнивает её с транслированными последовательностями базы данных секвенированных нуклеиновых кислот. 4. Геномные - предназначены для сравнения изучаемой нуклеотидной последовательности с базой данных секвенированного генома какого-либо организма (человека, мыши и др. ) 5. Специальные - прикладные программы, использующие BLAST: -bl 2 seq — сопоставление двух последовательностей по принципу локальных выравниваний, -Vec. Screen — определение сегментов нуклеотидной последовательности нуклеиновой кислоты, которые могут иметь векторное происхождение и др.
3. Транслирующие - способны транслировать нуклеотидные последовательности в аминокислотные: -blastx — переводит изучаемую нуклеотидную последовательность в кодируемые аминокислоты, а затем сравнивает её с имеющейся базой данных аминокислотных последовательностей белков, -tblastn — изучаемая аминокислотная последовательность сравнивается с транслированными последовательностями базы данных секвенированных нуклеиновых кислот, -tblastx — переводит изучаемую нуклеотидную последовательность в аминокислотную, а затем сравнивает её с транслированными последовательностями базы данных секвенированных нуклеиновых кислот. 4. Геномные - предназначены для сравнения изучаемой нуклеотидной последовательности с базой данных секвенированного генома какого-либо организма (человека, мыши и др. ) 5. Специальные - прикладные программы, использующие BLAST: -bl 2 seq — сопоставление двух последовательностей по принципу локальных выравниваний, -Vec. Screen — определение сегментов нуклеотидной последовательности нуклеиновой кислоты, которые могут иметь векторное происхождение и др.
 три всемирные коллекции последовательностей нуклеотидов DDBJ (Япония) Gen. Bank (США) EMBL (Европа)
три всемирные коллекции последовательностей нуклеотидов DDBJ (Япония) Gen. Bank (США) EMBL (Европа)
 Основные типы баз данных: 1. Архивные: любой пользователь может добавить определенные им последовательности без какой-либо проверки их достоверности. Соответственно, такая база будет более полной, но менее достоверной. PDB, EMBL. 2. Курируемые: при подаче новой последовательности в данную базу происходит оценка достоверности как самой последовательности, так и найденных в ее составе генов и регуляторных последовательностей. Следовательно, такая база будет более надежной. KEGG, COG. 3. Интегрированные: предоставляют возможности поиска по многим как архивным, так и курируемым базам. NCBJ, EMBL-EBJ. 4. Производственные: эти базы получаются в результате обработки данных из архивных и курируемых баз данных. SCCP, PEAM, Pro. Dom. Кроме того, базы можно разделить на : -специализированные, в которых хранятся последовательности генома только одного вида, но по этому геному представлена более подробная информация (например, базы данных по геномам дрозофилы, дрожжей, кишечной палочки и других организмов); -общие – в таких базах можно получить информацию о геномах многих организмов.
Основные типы баз данных: 1. Архивные: любой пользователь может добавить определенные им последовательности без какой-либо проверки их достоверности. Соответственно, такая база будет более полной, но менее достоверной. PDB, EMBL. 2. Курируемые: при подаче новой последовательности в данную базу происходит оценка достоверности как самой последовательности, так и найденных в ее составе генов и регуляторных последовательностей. Следовательно, такая база будет более надежной. KEGG, COG. 3. Интегрированные: предоставляют возможности поиска по многим как архивным, так и курируемым базам. NCBJ, EMBL-EBJ. 4. Производственные: эти базы получаются в результате обработки данных из архивных и курируемых баз данных. SCCP, PEAM, Pro. Dom. Кроме того, базы можно разделить на : -специализированные, в которых хранятся последовательности генома только одного вида, но по этому геному представлена более подробная информация (например, базы данных по геномам дрозофилы, дрожжей, кишечной палочки и других организмов); -общие – в таких базах можно получить информацию о геномах многих организмов.



