2-Основы квантовой механики_Атом водорода.ppt
- Количество слайдов: 13
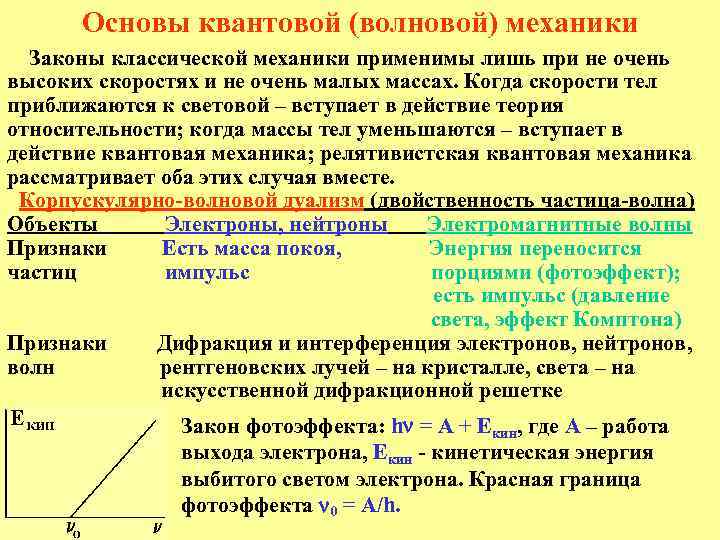 Основы квантовой (волновой) механики Законы классической механики применимы лишь при не очень высоких скоростях и не очень малых массах. Когда скорости тел приближаются к световой – вступает в действие теория относительности; когда массы тел уменьшаются – вступает в действие квантовая механика; релятивистская квантовая механика рассматривает оба этих случая вместе. Корпускулярно-волновой дуализм (двойственность частица-волна) Объекты Электроны, нейтроны Электромагнитные волны Признаки Есть масса покоя, Энергия переносится частиц импульс порциями (фотоэффект); есть импульс (давление света, эффект Комптона) Признаки Дифракция и интерференция электронов, нейтронов, волн рентгеновских лучей – на кристалле, света – на искусственной дифракционной решетке Закон фотоэффекта: h = A + Eкин, где А – работа выхода электрона, Eкин - кинетическая энергия выбитого светом электрона. Красная граница фотоэффекта 0 = А/h.
Основы квантовой (волновой) механики Законы классической механики применимы лишь при не очень высоких скоростях и не очень малых массах. Когда скорости тел приближаются к световой – вступает в действие теория относительности; когда массы тел уменьшаются – вступает в действие квантовая механика; релятивистская квантовая механика рассматривает оба этих случая вместе. Корпускулярно-волновой дуализм (двойственность частица-волна) Объекты Электроны, нейтроны Электромагнитные волны Признаки Есть масса покоя, Энергия переносится частиц импульс порциями (фотоэффект); есть импульс (давление света, эффект Комптона) Признаки Дифракция и интерференция электронов, нейтронов, волн рентгеновских лучей – на кристалле, света – на искусственной дифракционной решетке Закон фотоэффекта: h = A + Eкин, где А – работа выхода электрона, Eкин - кинетическая энергия выбитого светом электрона. Красная граница фотоэффекта 0 = А/h.
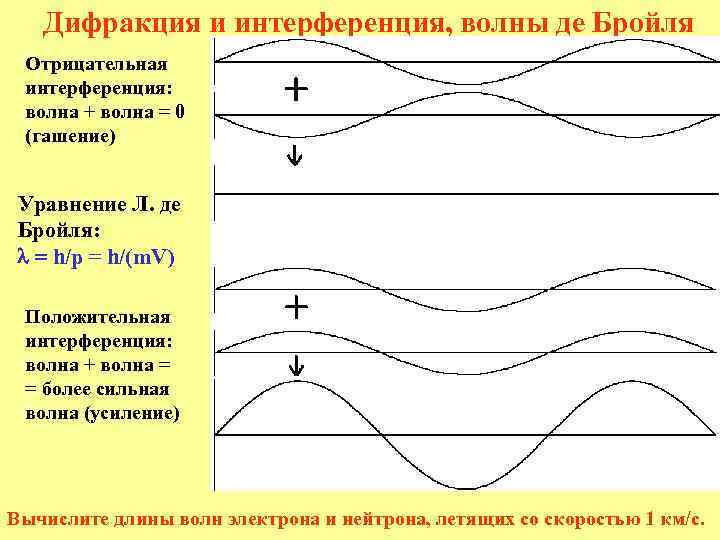 Дифракция и интерференция, волны де Бройля Отрицательная интерференция: волна + волна = 0 (гашение) Уравнение Л. де Бройля: l = h/p = h/(m. V) Положительная интерференция: волна + волна = = более сильная волна (усиление) Вычислите длины волн электрона и нейтрона, летящих со скоростью 1 км/c.
Дифракция и интерференция, волны де Бройля Отрицательная интерференция: волна + волна = 0 (гашение) Уравнение Л. де Бройля: l = h/p = h/(m. V) Положительная интерференция: волна + волна = = более сильная волна (усиление) Вычислите длины волн электрона и нейтрона, летящих со скоростью 1 км/c.
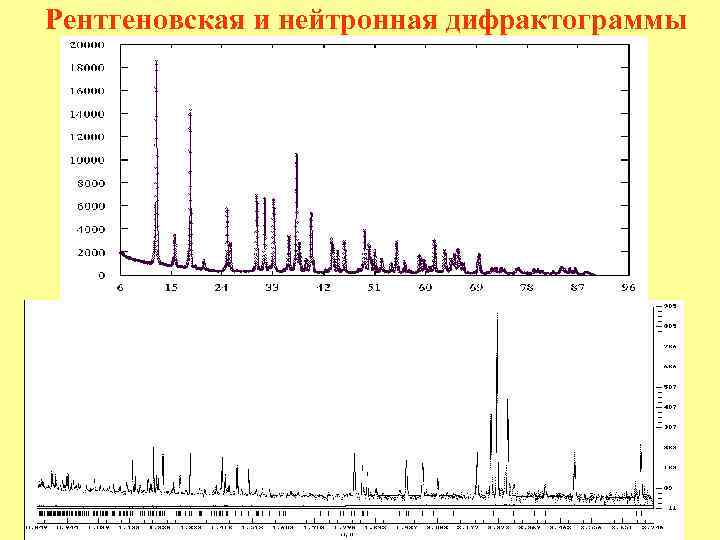 Рентгеновская и нейтронная дифрактограммы
Рентгеновская и нейтронная дифрактограммы
 Принцип неопределенности Гейзенберга и его философское значение Волновые свойства частиц приводят к тому, что становится невозможно определить одновременно положение и скорость (или импульс) частицы: чем точнее измеряем скорость, тем менее определенным является положение частицы и наоборот. Количественное выражение этого дает соотношение неопределенностей В. Гейзенберга: x* px h/2 p, где x – погрешность определения координаты х, px – погрешность определения проекции импульса на ось х (и то же для осей y и z). Импульс p=m. V. Постоянная Планка так мала, что для макроскопических тел указанные погрешности совершенно незаметны. Но для микрочастиц они очень существенны. Всякое измерение влияет на измеряемый объект !!!
Принцип неопределенности Гейзенберга и его философское значение Волновые свойства частиц приводят к тому, что становится невозможно определить одновременно положение и скорость (или импульс) частицы: чем точнее измеряем скорость, тем менее определенным является положение частицы и наоборот. Количественное выражение этого дает соотношение неопределенностей В. Гейзенберга: x* px h/2 p, где x – погрешность определения координаты х, px – погрешность определения проекции импульса на ось х (и то же для осей y и z). Импульс p=m. V. Постоянная Планка так мала, что для макроскопических тел указанные погрешности совершенно незаметны. Но для микрочастиц они очень существенны. Всякое измерение влияет на измеряемый объект !!!
 Волновая функция и волновое уравнение Если электрон – волна, то его поведение должно описываться волновой функцией Y, которую можно найти, решив соответствующее дифференциальное уравнение, подобно тому, как колебания струны описываются синусоидальной функцией, получающейся при решении дифференциального уравнения для гармонических колебаний. Y – функция координат и времени: x, y, z, t или r, q, f, t. Сама Y не имеет ясного физического смысла, но ее квадрат (точнее, квадрат ее модуля |Y|2, т. к. Y может быть комплексной величиной) пропорционален плотности вероятности пребывания электрона в данной точке пространства. Если V – объем, а w – вероятность пребывания электрона в этом объеме, то w/V – плотность вероятности. В точке - dw/d. V. |Y|2 = dw/d. V Мы не будем решать волновое уравнение (уравнение Шрёдингера) и даже записывать готовые волновые функции, а рассмотрим важные для химии результаты. У Карапетьянца решения записаны неверно! Правильно – у Коттона и Уилкинсона.
Волновая функция и волновое уравнение Если электрон – волна, то его поведение должно описываться волновой функцией Y, которую можно найти, решив соответствующее дифференциальное уравнение, подобно тому, как колебания струны описываются синусоидальной функцией, получающейся при решении дифференциального уравнения для гармонических колебаний. Y – функция координат и времени: x, y, z, t или r, q, f, t. Сама Y не имеет ясного физического смысла, но ее квадрат (точнее, квадрат ее модуля |Y|2, т. к. Y может быть комплексной величиной) пропорционален плотности вероятности пребывания электрона в данной точке пространства. Если V – объем, а w – вероятность пребывания электрона в этом объеме, то w/V – плотность вероятности. В точке - dw/d. V. |Y|2 = dw/d. V Мы не будем решать волновое уравнение (уравнение Шрёдингера) и даже записывать готовые волновые функции, а рассмотрим важные для химии результаты. У Карапетьянца решения записаны неверно! Правильно – у Коттона и Уилкинсона.
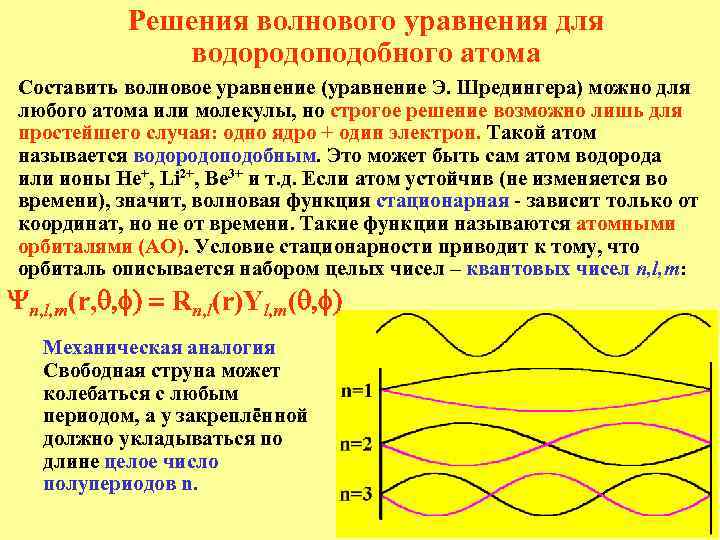 Решения волнового уравнения для водородоподобного атома Составить волновое уравнение (уравнение Э. Шредингера) можно для любого атома или молекулы, но строгое решение возможно лишь для простейшего случая: одно ядро + один электрон. Такой атом называется водородоподобным. Это может быть сам атом водорода или ионы He+, Li 2+, Be 3+ и т. д. Если атом устойчив (не изменяется во времени), значит, волновая функция стационарная - зависит только от координат, но не от времени. Такие функции называются атомными орбиталями (АО). Условие стационарности приводит к тому, что орбиталь описывается набором целых чисел – квантовых чисел n, l, m: Yn, l, m(r, q, f) = Rn, l(r)Yl, m(q, f) Механическая аналогия Свободная струна может колебаться с любым периодом, а у закреплённой должно укладываться по длине целое число полупериодов n.
Решения волнового уравнения для водородоподобного атома Составить волновое уравнение (уравнение Э. Шредингера) можно для любого атома или молекулы, но строгое решение возможно лишь для простейшего случая: одно ядро + один электрон. Такой атом называется водородоподобным. Это может быть сам атом водорода или ионы He+, Li 2+, Be 3+ и т. д. Если атом устойчив (не изменяется во времени), значит, волновая функция стационарная - зависит только от координат, но не от времени. Такие функции называются атомными орбиталями (АО). Условие стационарности приводит к тому, что орбиталь описывается набором целых чисел – квантовых чисел n, l, m: Yn, l, m(r, q, f) = Rn, l(r)Yl, m(q, f) Механическая аналогия Свободная струна может колебаться с любым периодом, а у закреплённой должно укладываться по длине целое число полупериодов n.
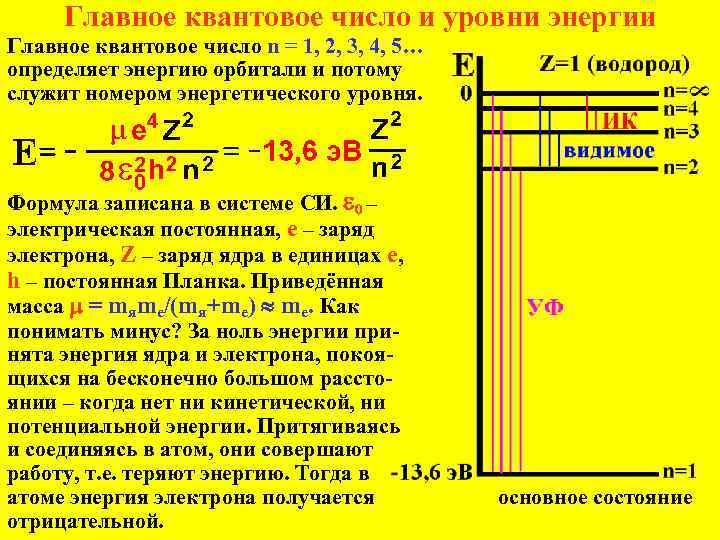 Главное квантовое число и уровни энергии Главное квантовое число n = 1, 2, 3, 4, 5… определяет энергию орбитали и потому служит номером энергетического уровня. Формула записана в системе СИ. e 0 – электрическая постоянная, е – заряд электрона, Z – заряд ядра в единицах е, h – постоянная Планка. Приведённая масса = mяme/(mя+me) mе. Как понимать минус? За ноль энергии принята энергия ядра и электрона, покоящихся на бесконечно большом расстоянии – когда нет ни кинетической, ни потенциальной энергии. Притягиваясь и соединяясь в атом, они совершают работу, т. е. теряют энергию. Тогда в атоме энергия электрона получается отрицательной. основное состояние
Главное квантовое число и уровни энергии Главное квантовое число n = 1, 2, 3, 4, 5… определяет энергию орбитали и потому служит номером энергетического уровня. Формула записана в системе СИ. e 0 – электрическая постоянная, е – заряд электрона, Z – заряд ядра в единицах е, h – постоянная Планка. Приведённая масса = mяme/(mя+me) mе. Как понимать минус? За ноль энергии принята энергия ядра и электрона, покоящихся на бесконечно большом расстоянии – когда нет ни кинетической, ни потенциальной энергии. Притягиваясь и соединяясь в атом, они совершают работу, т. е. теряют энергию. Тогда в атоме энергия электрона получается отрицательной. основное состояние
 Атомные спектры Если атомарный водород возбудить, т. е. перевести электрон с первого уровня на более высокий, сообщив ему энергию (например, соударениями атомов при высокой температуре в электрической дуге), то он довольно быстро переходит в состояние с более низкой энергией, теряя энергию в виде электромагнитного кванта. Поскольку уровни энергии строго определённые, то и разности их энергий – тоже, и испускаемое излучение имеет строго определённые частоты и длины волн, а промежуточных не может быть: Спектр испускания водорода У многоэлектронных атомов спектры сложнее, но тоже линейчатые: Спектр испускания натрия Непрерывный спектр Спектр поглощения содержит провалы (чёрные линии) там же, где были яркие линии испускания: поглощаются только кванты этих частот
Атомные спектры Если атомарный водород возбудить, т. е. перевести электрон с первого уровня на более высокий, сообщив ему энергию (например, соударениями атомов при высокой температуре в электрической дуге), то он довольно быстро переходит в состояние с более низкой энергией, теряя энергию в виде электромагнитного кванта. Поскольку уровни энергии строго определённые, то и разности их энергий – тоже, и испускаемое излучение имеет строго определённые частоты и длины волн, а промежуточных не может быть: Спектр испускания водорода У многоэлектронных атомов спектры сложнее, но тоже линейчатые: Спектр испускания натрия Непрерывный спектр Спектр поглощения содержит провалы (чёрные линии) там же, где были яркие линии испускания: поглощаются только кванты этих частот
 Другие квантовые числа и обозначения орбиталей Орбитальное квантовое число l = 0, 1, 2, 3 … n-1 Буквенные обозначения s, p, d, f … Число орбиталей на подуровне 1 3 5 7 l определяет симметрию орбитали, т. е. форму облака электронной плотности и величину орбитального момента импульса М= Vr=[l(l+1)]1/2 h/2 p. Магнитное квантовое число ml = -l… 0…+l определяет ориентацию облака в пространстве, т. е. величину проекции орбитального момента на некое выделенное направление (например, направление внешнего электрического поля). Без поля состояния с одинаковыми n и l, но разными ml эквивалентны и образуют один энергетический подуровень, а в поле их энергия становится разной – подуровень расщепляется. Например: 3 s : n = 3, l = 0, ml = 0; 3 px : n = 3, l = 1, ml = -1; 3 py : n = 3, l = 1, ml = 1; 3 pz : n = 3, l = 1, ml = 0; 3 d : n = 3, l = 2, ml = -2, -1, 0, 1, 2. Таким образом, энергия электрона, момент импульса и его ориентация квантованы, т. е. могут принимать значения только из строго определённого набора, а промежуточные значения невозможны.
Другие квантовые числа и обозначения орбиталей Орбитальное квантовое число l = 0, 1, 2, 3 … n-1 Буквенные обозначения s, p, d, f … Число орбиталей на подуровне 1 3 5 7 l определяет симметрию орбитали, т. е. форму облака электронной плотности и величину орбитального момента импульса М= Vr=[l(l+1)]1/2 h/2 p. Магнитное квантовое число ml = -l… 0…+l определяет ориентацию облака в пространстве, т. е. величину проекции орбитального момента на некое выделенное направление (например, направление внешнего электрического поля). Без поля состояния с одинаковыми n и l, но разными ml эквивалентны и образуют один энергетический подуровень, а в поле их энергия становится разной – подуровень расщепляется. Например: 3 s : n = 3, l = 0, ml = 0; 3 px : n = 3, l = 1, ml = -1; 3 py : n = 3, l = 1, ml = 1; 3 pz : n = 3, l = 1, ml = 0; 3 d : n = 3, l = 2, ml = -2, -1, 0, 1, 2. Таким образом, энергия электрона, момент импульса и его ориентация квантованы, т. е. могут принимать значения только из строго определённого набора, а промежуточные значения невозможны.
 Угловое распределение электронной плотности Разделение переменных позволяет рассматривать отдельно радиальную часть волновой функции Rn, l(r) и угловую Yl, m(q, f). Yn, l, m(r, q, f) = Rn, l(r)Yl, m(q, f) Угловая часть не зависит от n, поэтому все орбитали, обозначаемые одной буквой (s, p, d или f), имеют одинаковую форму. У s-орбиталей угловая часть – константа, т. е. не зависит от углов, поэтому они сферически симметричны – по всем направлениям электронная плотность одинакова. Три p-орбитали вытянуты вдоль трёх взаимно перпендикулярных осей. На рисунке – одна из них (px). График угловой p-функции – две сферы, касающиеся в центре атома – в ядре. Длина радиус-вектора r пропорциональна величине волновой функции в данном направлении. Она максимальна вдоль x и равна нулю в плоскости y 0 z. Поверхности, где электронная плотность равна нулю, называются узловыми. Плюс и минус – знаки волновой функции. Соответственно, у py -орбитали узловая поверхность x 0 z…
Угловое распределение электронной плотности Разделение переменных позволяет рассматривать отдельно радиальную часть волновой функции Rn, l(r) и угловую Yl, m(q, f). Yn, l, m(r, q, f) = Rn, l(r)Yl, m(q, f) Угловая часть не зависит от n, поэтому все орбитали, обозначаемые одной буквой (s, p, d или f), имеют одинаковую форму. У s-орбиталей угловая часть – константа, т. е. не зависит от углов, поэтому они сферически симметричны – по всем направлениям электронная плотность одинакова. Три p-орбитали вытянуты вдоль трёх взаимно перпендикулярных осей. На рисунке – одна из них (px). График угловой p-функции – две сферы, касающиеся в центре атома – в ядре. Длина радиус-вектора r пропорциональна величине волновой функции в данном направлении. Она максимальна вдоль x и равна нулю в плоскости y 0 z. Поверхности, где электронная плотность равна нулю, называются узловыми. Плюс и минус – знаки волновой функции. Соответственно, у py -орбитали узловая поверхность x 0 z…
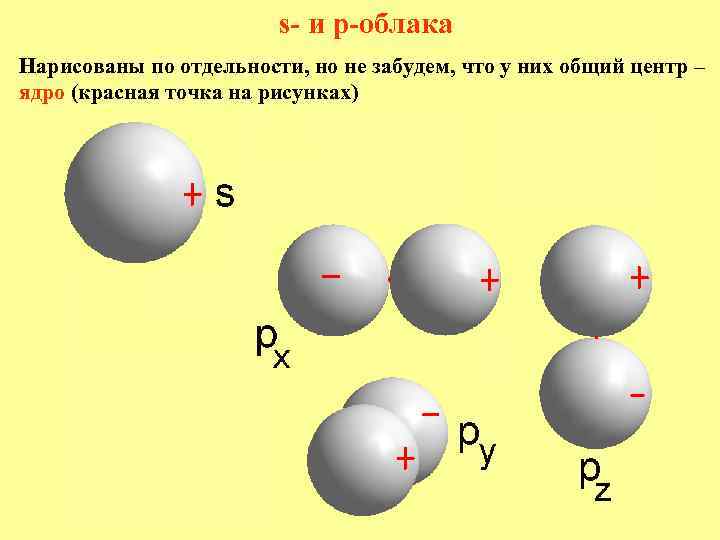 s- и p-облака Нарисованы по отдельности, но не забудем, что у них общий центр – ядро (красная точка на рисунках)
s- и p-облака Нарисованы по отдельности, но не забудем, что у них общий центр – ядро (красная точка на рисунках)
 Радиальное распределение электронной плотности Рассмотрим шаровой слой бесконечно малой толщины dr на расстоянии r от ядра. Его площадь 4 pr 2, а объём 4 pr 2 dr. Поскольку плотность вероятности равна Y 2, вероятность найти электрон в этом объёме dw = 4 pr 2 Y 2 dr, а плотность вероятности нахождения электрона на расстоянии r от ядра dw/dr = 4 pr 2 Y 2. Это – функция радиального распределения электронной плотности, без анализа которой трудно понять свойства атомов. Вместо Y достаточно подставить её радиальную часть. Графики на следующем слайде. Основные выводы: - у электрона нет определённой орбиты; при удалении от ядра электронная плотность асимптотически стремится к нулю, но строго в ноль не обращается, поэтому «размер атома» - понятие нестрогое; - число максимумов равно n-l; - если n-l = 1 (1 s, 2 p, 3 d, 4 f – орбитали), то единственный максимум находится на расстоянии rнаивер = n 2 a 0/Z, где «боровский радиус» 1 Å (ангстрем) = 10 -10 м
Радиальное распределение электронной плотности Рассмотрим шаровой слой бесконечно малой толщины dr на расстоянии r от ядра. Его площадь 4 pr 2, а объём 4 pr 2 dr. Поскольку плотность вероятности равна Y 2, вероятность найти электрон в этом объёме dw = 4 pr 2 Y 2 dr, а плотность вероятности нахождения электрона на расстоянии r от ядра dw/dr = 4 pr 2 Y 2. Это – функция радиального распределения электронной плотности, без анализа которой трудно понять свойства атомов. Вместо Y достаточно подставить её радиальную часть. Графики на следующем слайде. Основные выводы: - у электрона нет определённой орбиты; при удалении от ядра электронная плотность асимптотически стремится к нулю, но строго в ноль не обращается, поэтому «размер атома» - понятие нестрогое; - число максимумов равно n-l; - если n-l = 1 (1 s, 2 p, 3 d, 4 f – орбитали), то единственный максимум находится на расстоянии rнаивер = n 2 a 0/Z, где «боровский радиус» 1 Å (ангстрем) = 10 -10 м
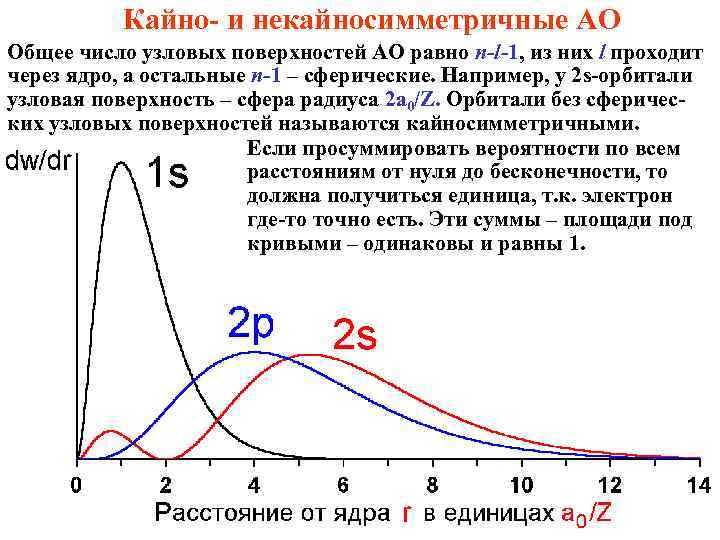 Кайно- и некайносимметричные АО Общее число узловых поверхностей АО равно n-l-1, из них l проходит через ядро, а остальные n-1 – сферические. Например, у 2 s-орбитали узловая поверхность – сфера радиуса 2 a 0/Z. Орбитали без сферических узловых поверхностей называются кайносимметричными. Если просуммировать вероятности по всем расстояниям от нуля до бесконечности, то должна получиться единица, т. к. электрон где-то точно есть. Эти суммы – площади под кривыми – одинаковы и равны 1.
Кайно- и некайносимметричные АО Общее число узловых поверхностей АО равно n-l-1, из них l проходит через ядро, а остальные n-1 – сферические. Например, у 2 s-орбитали узловая поверхность – сфера радиуса 2 a 0/Z. Орбитали без сферических узловых поверхностей называются кайносимметричными. Если просуммировать вероятности по всем расстояниям от нуля до бесконечности, то должна получиться единица, т. к. электрон где-то точно есть. Эти суммы – площади под кривыми – одинаковы и равны 1.


