c5e342c0fe7ed9cff921f6a103f61513.ppt
- Количество слайдов: 27
 Основы клинических испытаний / исследований Клиническая онкология в Хорватии, май 2007 года Barry Anderson, MD, Ph. D Отделение клинических испытаний Оценка программ лечения онкологических заболеваний Национальный институт рака (США)
Основы клинических испытаний / исследований Клиническая онкология в Хорватии, май 2007 года Barry Anderson, MD, Ph. D Отделение клинических испытаний Оценка программ лечения онкологических заболеваний Национальный институт рака (США)
 Гипотеза исследования • Клинические испытания проверяют верность гипотезы исследования • Гипотеза исследования – это предположение, основанное на данных лабораторных исследований или других формах уже имеющейся информации • Гипотезы служат для того, чтобы определить логическую последовательность Пример: Может ли новое лекарство, уже продемонстрировавшее противоопухолевую активность на мышах и собаках (и имеющее приемлемую токсичность при использовании у мышей и собак) применяться для лечения рака у людей?
Гипотеза исследования • Клинические испытания проверяют верность гипотезы исследования • Гипотеза исследования – это предположение, основанное на данных лабораторных исследований или других формах уже имеющейся информации • Гипотезы служат для того, чтобы определить логическую последовательность Пример: Может ли новое лекарство, уже продемонстрировавшее противоопухолевую активность на мышах и собаках (и имеющее приемлемую токсичность при использовании у мышей и собак) применяться для лечения рака у людей?
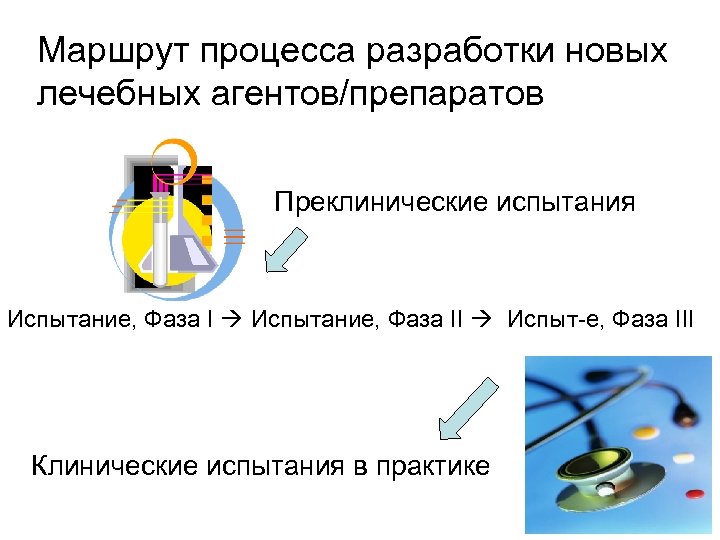 Маршрут процесса разработки новых лечебных агентов/препаратов Преклинические испытания Испытание, Фаза II Испыт-е, Фаза III Клинические испытания в практике
Маршрут процесса разработки новых лечебных агентов/препаратов Преклинические испытания Испытание, Фаза II Испыт-е, Фаза III Клинические испытания в практике
 Испытание, Фаза I • Основные/первичные цели: - Определить оптимальную дозу для каждого курса и способа применения нового лекарства - Определить максимальную допустимую доза (MTD; maximum tolerated dose) - Рекомендуемая доза для Фазы II • Вторичные цели: - Оценка фармакокинетических параметров - Изучение противоопухолевой активности
Испытание, Фаза I • Основные/первичные цели: - Определить оптимальную дозу для каждого курса и способа применения нового лекарства - Определить максимальную допустимую доза (MTD; maximum tolerated dose) - Рекомендуемая доза для Фазы II • Вторичные цели: - Оценка фармакокинетических параметров - Изучение противоопухолевой активности
 Испытание, Фаза II • Основные цели - Изучить предварительные доказательства эффективности - Получить дополнительные данные о безопасности и токсичности (острый и хронический) - Принять решение “идет/не идет” в отношении последовательного тестирования, часто на стадии Фазы III испытания • Изучать группу населения настолько гомогенную, насколько это возможно; иметь подробное описание ее характеристик до начала лечения • Подробное описание функционирования органов • Проводится или по определенному заболеванию, или в определенной популяции пациентов
Испытание, Фаза II • Основные цели - Изучить предварительные доказательства эффективности - Получить дополнительные данные о безопасности и токсичности (острый и хронический) - Принять решение “идет/не идет” в отношении последовательного тестирования, часто на стадии Фазы III испытания • Изучать группу населения настолько гомогенную, насколько это возможно; иметь подробное описание ее характеристик до начала лечения • Подробное описание функционирования органов • Проводится или по определенному заболеванию, или в определенной популяции пациентов
 Испытание, Фаза III • Окончательные результаты изучения преимуществ использования для лечения больных • Рандомизированные, часто сравниваемые со “стандартным способом лечения” • Предлагает дополнительные данные/ сведения и формулирование параметров риска/преимуществ • Может быть лечебной, диагностической или профилактической
Испытание, Фаза III • Окончательные результаты изучения преимуществ использования для лечения больных • Рандомизированные, часто сравниваемые со “стандартным способом лечения” • Предлагает дополнительные данные/ сведения и формулирование параметров риска/преимуществ • Может быть лечебной, диагностической или профилактической
 Испытание, Фаза III • Основные цели: • Предоставить рекомендации для принятия решений по использованию для лечения • Предоставить достоверную информацию пациентам о предполагаемых результатах • Направлять показатели о статусе благополучия пациентов
Испытание, Фаза III • Основные цели: • Предоставить рекомендации для принятия решений по использованию для лечения • Предоставить достоверную информацию пациентам о предполагаемых результатах • Направлять показатели о статусе благополучия пациентов
 Испытание, Фаза III: • Design 4 Дизайн Проведение • Conduct Анализ • Analysis Интерпретация • Interpretation Отчетный доклад 5 • Reporting 1 2 3
Испытание, Фаза III: • Design 4 Дизайн Проведение • Conduct Анализ • Analysis Интерпретация • Interpretation Отчетный доклад 5 • Reporting 1 2 3
 Фаза III - Дизайн испытания Дизайн: • Обусловлен вопросом, на который предполагается получить ответ • Должен отражать соответствующий конечный результат • Должен минимизировать необъективность (предвзятость) и ошибки • Должен быть этичным • Должен быть осуществимым (в ресурсном отношении)
Фаза III - Дизайн испытания Дизайн: • Обусловлен вопросом, на который предполагается получить ответ • Должен отражать соответствующий конечный результат • Должен минимизировать необъективность (предвзятость) и ошибки • Должен быть этичным • Должен быть осуществимым (в ресурсном отношении)
 Фаза III - Дизайн испытания • Дизайн 1. Результаты должны быть применимы в местном сообществе 2. Должен обеспечивать правомочность и не быть слишком «запрещающим / ограничивающим» : • Допускает более общую приемлемость/применяемость • Повышает количество участников испытания • Социально значимые проблемы Цена
Фаза III - Дизайн испытания • Дизайн 1. Результаты должны быть применимы в местном сообществе 2. Должен обеспечивать правомочность и не быть слишком «запрещающим / ограничивающим» : • Допускает более общую приемлемость/применяемость • Повышает количество участников испытания • Социально значимые проблемы Цена
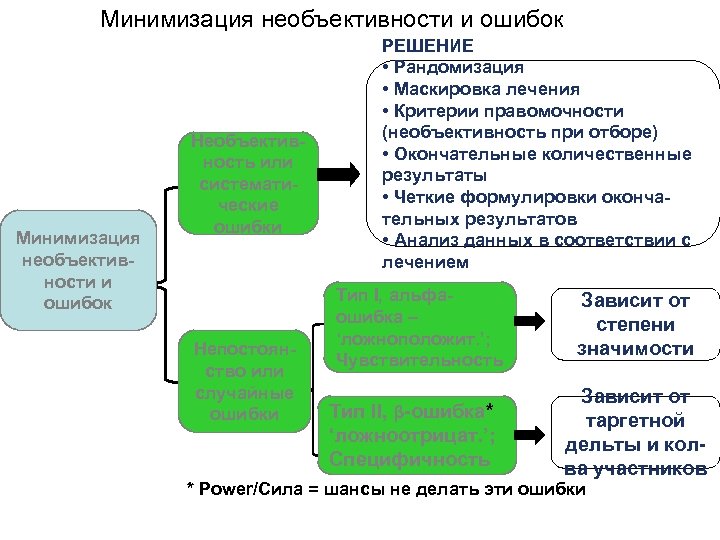 Минимизация необъективности и ошибок Необъективность или систематические ошибки Непостоянство или случайные ошибки РЕШЕНИЕ • Рандомизация • Маскировка лечения • Критерии правомочности (необъективность при отборе) • Окончательные количественные результаты • Четкие формулировки окончательных результатов • Анализ данных в соответствии с лечением Тип I, альфаошибка – ‘ложноположит. ’; Чувствительность Тип II, β-ошибка* ‘ложноотрицат. ’; Специфичность Зависит от степени значимости Зависит от таргетной дельты и колва участников * Power/Сила = шансы не делать эти ошибки
Минимизация необъективности и ошибок Необъективность или систематические ошибки Непостоянство или случайные ошибки РЕШЕНИЕ • Рандомизация • Маскировка лечения • Критерии правомочности (необъективность при отборе) • Окончательные количественные результаты • Четкие формулировки окончательных результатов • Анализ данных в соответствии с лечением Тип I, альфаошибка – ‘ложноположит. ’; Чувствительность Тип II, β-ошибка* ‘ложноотрицат. ’; Специфичность Зависит от степени значимости Зависит от таргетной дельты и колва участников * Power/Сила = шансы не делать эти ошибки
 Фаза III - Рандомизация исследования • Рандомизация обеспечивает: • Контроль за известными прогностическими факторами • Контроль за неизвестными прогностическими факторами • Основу для обеспечения достоверности статистических тестов
Фаза III - Рандомизация исследования • Рандомизация обеспечивает: • Контроль за известными прогностическими факторами • Контроль за неизвестными прогностическими факторами • Основу для обеспечения достоверности статистических тестов
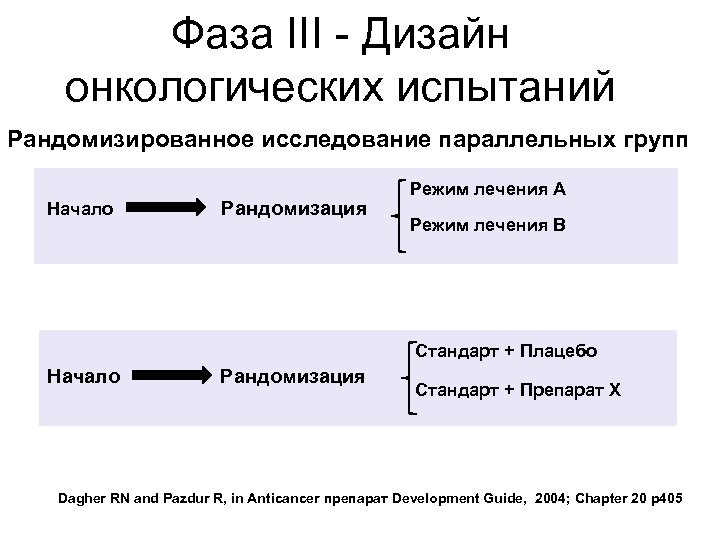 Фаза III - Дизайн онкологических испытаний Рандомизированное исследование параллельных групп Начало Рандомизация Режим лечения A Режим лечения B Стандарт + Плацебо Начало Рандомизация Стандарт + Препарат X Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
Фаза III - Дизайн онкологических испытаний Рандомизированное исследование параллельных групп Начало Рандомизация Режим лечения A Режим лечения B Стандарт + Плацебо Начало Рандомизация Стандарт + Препарат X Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
 Фаза III - Дизайн онкологических испытаний Перекрестное испытание Режим лечения A с последующим режимом лечения B Исходная точка Рандомизация Режим лечения В с последующим режимом лечения А • Сравнение внутри групп: Пациенты служат в качестве своей собственной контрольной группы • Подходят для хронических, медленно прогрессирующих заболеваний Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
Фаза III - Дизайн онкологических испытаний Перекрестное испытание Режим лечения A с последующим режимом лечения B Исходная точка Рандомизация Режим лечения В с последующим режимом лечения А • Сравнение внутри групп: Пациенты служат в качестве своей собственной контрольной группы • Подходят для хронических, медленно прогрессирующих заболеваний Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
 Фаза III Дизайн онкологических испытаний Факториальный/факторный дизайн Пример факториального дизайна 2 x 2 Фактор 1 Лучевая терапия Фактор 2 Без лучевой терапии Препарат A / Лучевая терапия n Препарат A n Прапарат A+B Препарат A+B / Лучевая терапия n Препарат A+B n Делаются тогда, когда два (или более) различных метода лечения тестируются одновременно Общее количество больных, принимавших участие в испытании = 4 n Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
Фаза III Дизайн онкологических испытаний Факториальный/факторный дизайн Пример факториального дизайна 2 x 2 Фактор 1 Лучевая терапия Фактор 2 Без лучевой терапии Препарат A / Лучевая терапия n Препарат A n Прапарат A+B Препарат A+B / Лучевая терапия n Препарат A+B n Делаются тогда, когда два (или более) различных метода лечения тестируются одновременно Общее количество больных, принимавших участие в испытании = 4 n Dagher RN and Pazdur R, in Anticancer препарат Development Guide, 2004; Chapter 20 p 405
 Мониторинг данных испытания • Комитет мониторирования данных (DMC) Независимого совета по мониторингу данных и безопасности субъектов исследования [Data Monitoring Safety Board (DMSB)] • Для того, чтобы на постоянной основе оценивать безопасность и эффективность данных, полученных во время Фазы III Задача: • Рекомендации для «координационного совета» испытания • Завершение испытания в случае явного лечебного преимущества • Завершение испытания в случае его бесполезности • Изменение дизайна при рассмотрении правомочности участия в испытании • Ранняя публикация данных • Закрытие исследований в случае сложности сбора необходимых данных Dagher RN and Pazdur R, in Anticancer Drug Development Guide, 2004; Chapter 20 p 408
Мониторинг данных испытания • Комитет мониторирования данных (DMC) Независимого совета по мониторингу данных и безопасности субъектов исследования [Data Monitoring Safety Board (DMSB)] • Для того, чтобы на постоянной основе оценивать безопасность и эффективность данных, полученных во время Фазы III Задача: • Рекомендации для «координационного совета» испытания • Завершение испытания в случае явного лечебного преимущества • Завершение испытания в случае его бесполезности • Изменение дизайна при рассмотрении правомочности участия в испытании • Ранняя публикация данных • Закрытие исследований в случае сложности сбора необходимых данных Dagher RN and Pazdur R, in Anticancer Drug Development Guide, 2004; Chapter 20 p 408
 Важные элементы 1. Участие квалифицированных исследователей, которые имеют важные научные/лечебные гипотезы И имеют опыт проведения клинических испытаний 2. Наличие инфраструктуры для разработки протокола и проведения клинических испытаний в мультиинституциональной среде 3. Наличие инфраструктуры для сбора данных и проверки их качества 4. Биологические ткани / коррелятивные исследования 5. Финансовая поддержка 6. Пациенты
Важные элементы 1. Участие квалифицированных исследователей, которые имеют важные научные/лечебные гипотезы И имеют опыт проведения клинических испытаний 2. Наличие инфраструктуры для разработки протокола и проведения клинических испытаний в мультиинституциональной среде 3. Наличие инфраструктуры для сбора данных и проверки их качества 4. Биологические ткани / коррелятивные исследования 5. Финансовая поддержка 6. Пациенты
 • Знания различных дизайнов клинических испытаний и методологии их проведения очень важны для планирования и проведения клинических испытаний. • Для исследователя важно участвовать в полиинституциональных клинических испытаниях. Это позволяет лучше следить за протоколом, лучше проводить отбор и оценку больных, лучше выполнять требования исследования и заполнять необходимые формы. • В процессе чтения литературы, важно анализировать ценность (научную и практическую) испытаний, которые уже были опубликованы.
• Знания различных дизайнов клинических испытаний и методологии их проведения очень важны для планирования и проведения клинических испытаний. • Для исследователя важно участвовать в полиинституциональных клинических испытаниях. Это позволяет лучше следить за протоколом, лучше проводить отбор и оценку больных, лучше выполнять требования исследования и заполнять необходимые формы. • В процессе чтения литературы, важно анализировать ценность (научную и практическую) испытаний, которые уже были опубликованы.
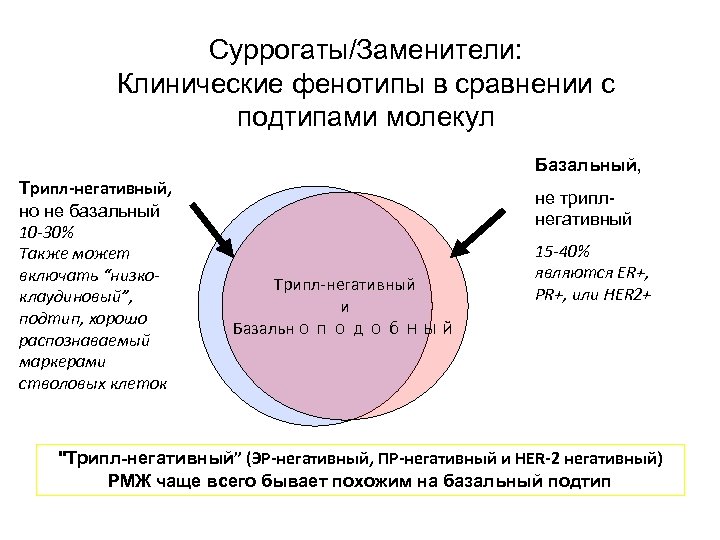 Суррогаты/Заменители: Клинические фенотипы в сравнении с подтипами молекул Базальный, Трипл-негативный, но не базальный 10 -30% Также может включать “низкоклаудиновый”, подтип, хорошо распознаваемый маркерами стволовых клеток не триплнегативный Трипл-негативный и Базальноподобный 15 -40% являются ER+, PR+, или HER 2+ "Трипл-негативный” (ЭР-негативный, ПР-негативный и HER-2 негативный) РМЖ чаще всего бывает похожим на базальный подтип
Суррогаты/Заменители: Клинические фенотипы в сравнении с подтипами молекул Базальный, Трипл-негативный, но не базальный 10 -30% Также может включать “низкоклаудиновый”, подтип, хорошо распознаваемый маркерами стволовых клеток не триплнегативный Трипл-негативный и Базальноподобный 15 -40% являются ER+, PR+, или HER 2+ "Трипл-негативный” (ЭР-негативный, ПР-негативный и HER-2 негативный) РМЖ чаще всего бывает похожим на базальный подтип
 Определение биологии ER- РМЖ • Аберрантная (отличающаяся от нормальной) экспрессия транскрипционных факторов и рост факторных рецепторов была связана с похожим на базальный (трипл -негативный) подтип РМЖ • Механизмы утери ER могут различаться: – Метилирование стимулятора ER при ER- РМЖ (25%) – Деградация ER, активированная Src • ER- опухоли имеют некоторые общие признаки с BRCA-1 РМЖ – Клинические и гистологические признаки – Данные о профиле гена
Определение биологии ER- РМЖ • Аберрантная (отличающаяся от нормальной) экспрессия транскрипционных факторов и рост факторных рецепторов была связана с похожим на базальный (трипл -негативный) подтип РМЖ • Механизмы утери ER могут различаться: – Метилирование стимулятора ER при ER- РМЖ (25%) – Деградация ER, активированная Src • ER- опухоли имеют некоторые общие признаки с BRCA-1 РМЖ – Клинические и гистологические признаки – Данные о профиле гена
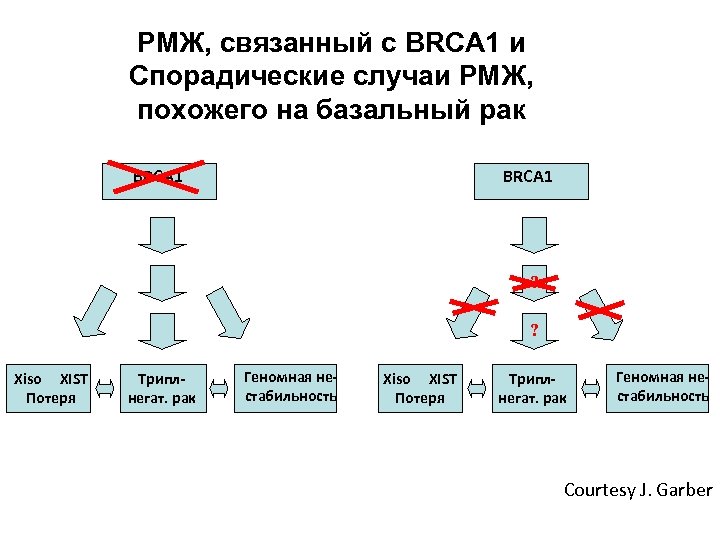 РМЖ, связанный с BRCA 1 и Спорадические случаи РМЖ, похожего на базальный рак Basal-like Hereditary Basal-like Sporadic BRCA 1 ? ? Xiso XIST Потеря Триплнегат. рак Геномная нестабильность Courtesy J. Garber
РМЖ, связанный с BRCA 1 и Спорадические случаи РМЖ, похожего на базальный рак Basal-like Hereditary Basal-like Sporadic BRCA 1 ? ? Xiso XIST Потеря Триплнегат. рак Геномная нестабильность Courtesy J. Garber
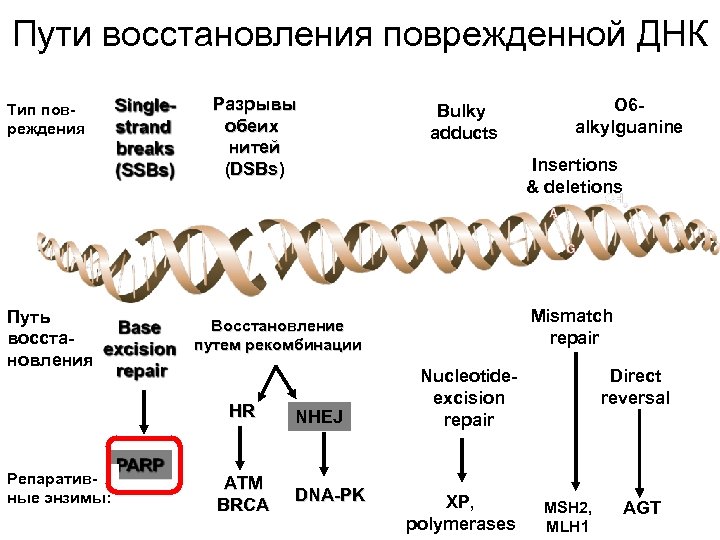 Пути восстановления поврежденной ДНК Тип повреждения Путь восстановления Разрывы обеих нитей (DSBs) ATM BRCA NHEJ DNA-PK O 6 alkylguanine Insertions & deletions Mismatch repair Восстановление путем рекомбинации HR Репаративные энзимы: Bulky adducts Nucleotideexcision repair XP, polymerases Direct reversal MSH 2, MLH 1 AGT
Пути восстановления поврежденной ДНК Тип повреждения Путь восстановления Разрывы обеих нитей (DSBs) ATM BRCA NHEJ DNA-PK O 6 alkylguanine Insertions & deletions Mismatch repair Восстановление путем рекомбинации HR Репаративные энзимы: Bulky adducts Nucleotideexcision repair XP, polymerases Direct reversal MSH 2, MLH 1 AGT
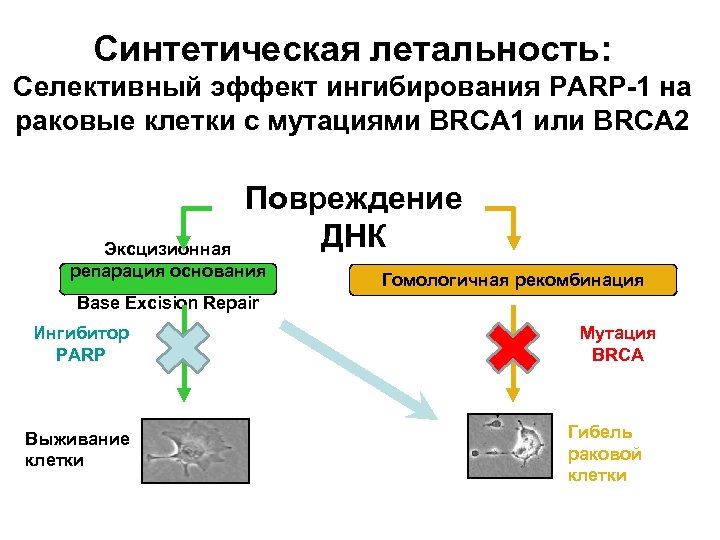 Синтетическая летальность: Селективный эффект ингибирования PARP-1 на раковые клетки с мутациями BRCA 1 или BRCA 2 Повреждение ДНК Эксцизионная репарация основания Гомологичная рекомбинация Base Excision Repair Ингибитор PARP Выживание клетки Мутация BRCA Гибель раковой клетки
Синтетическая летальность: Селективный эффект ингибирования PARP-1 на раковые клетки с мутациями BRCA 1 или BRCA 2 Повреждение ДНК Эксцизионная репарация основания Гомологичная рекомбинация Base Excision Repair Ингибитор PARP Выживание клетки Мутация BRCA Гибель раковой клетки
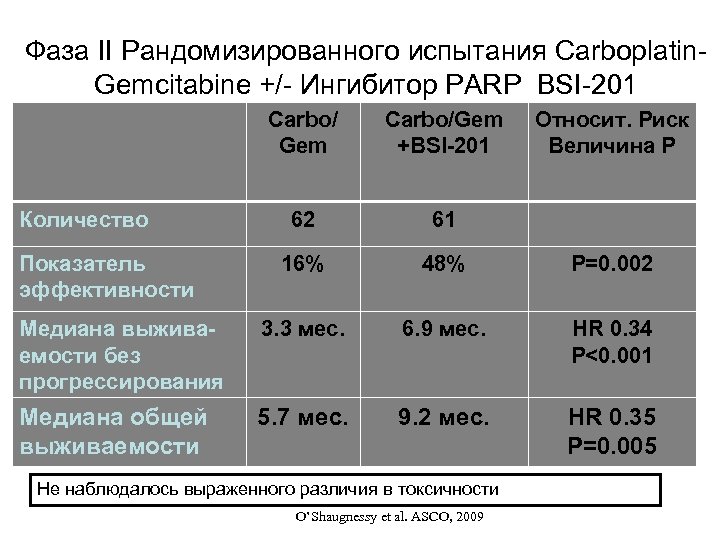 Фаза II Рандомизированного испытания Carboplatin. Gemcitabine +/- Ингибитор PARP BSI-201 Carbo/ Gem Carbo/Gem +BSI-201 62 61 16% 48% P=0. 002 Медиана выживаемости без прогрессирования 3. 3 мес. 6. 9 мес. HR 0. 34 P<0. 001 Медиана общей выживаемости 5. 7 мес. 9. 2 мес. HR 0. 35 P=0. 005 Количество Показатель эффективности Не наблюдалось выраженного различия в токсичности O’Shaugnessy et al. ASCO, 2009 Относит. Риск Величина P
Фаза II Рандомизированного испытания Carboplatin. Gemcitabine +/- Ингибитор PARP BSI-201 Carbo/ Gem Carbo/Gem +BSI-201 62 61 16% 48% P=0. 002 Медиана выживаемости без прогрессирования 3. 3 мес. 6. 9 мес. HR 0. 34 P<0. 001 Медиана общей выживаемости 5. 7 мес. 9. 2 мес. HR 0. 35 P=0. 005 Количество Показатель эффективности Не наблюдалось выраженного различия в токсичности O’Shaugnessy et al. ASCO, 2009 Относит. Риск Величина P
 Эффективность препарата должна быть установлена на Фазе III клин. испытания 27 января 2011 г. Sanofi-aventis и ее дочерняя компания Bi. Par Sciences объявили, что Фаза III рандомизированного исследования по оценке эффективности iniparib* (BSI-201) у пациентов с трипл-негативным метастатическим РМЖ не соответствовала заранее определенным критериям оценки результатов общей выживаемости и выживаемости без прогрессирования заболевания.
Эффективность препарата должна быть установлена на Фазе III клин. испытания 27 января 2011 г. Sanofi-aventis и ее дочерняя компания Bi. Par Sciences объявили, что Фаза III рандомизированного исследования по оценке эффективности iniparib* (BSI-201) у пациентов с трипл-негативным метастатическим РМЖ не соответствовала заранее определенным критериям оценки результатов общей выживаемости и выживаемости без прогрессирования заболевания.
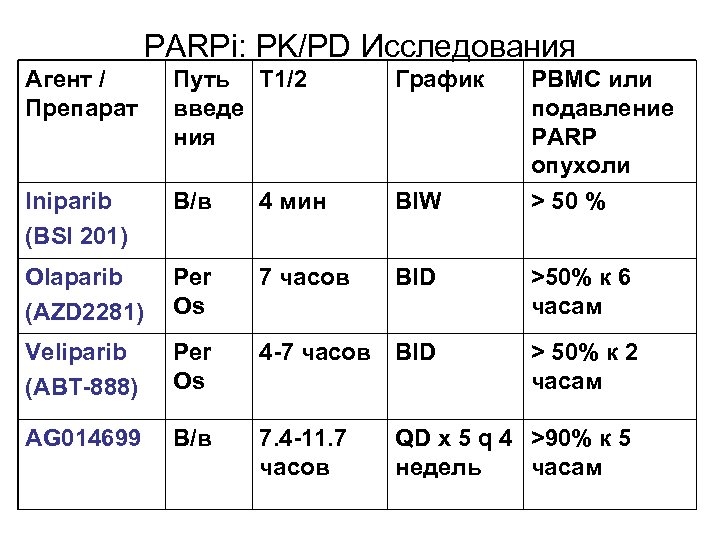 PARPi: PK/PD Исследования Агент / Препарат Путь T 1/2 введе ния График PBMC или подавление PARP опухоли > 50 % Iniparib (BSI 201) В/в 4 мин BIW Olaparib (AZD 2281) Per Os 7 часов BID >50% к 6 часам Veliparib (ABT-888) Per Os 4 -7 часов BID > 50% к 2 часам AG 014699 В/в 7. 4 -11. 7 часов QD x 5 q 4 >90% к 5 недель часам
PARPi: PK/PD Исследования Агент / Препарат Путь T 1/2 введе ния График PBMC или подавление PARP опухоли > 50 % Iniparib (BSI 201) В/в 4 мин BIW Olaparib (AZD 2281) Per Os 7 часов BID >50% к 6 часам Veliparib (ABT-888) Per Os 4 -7 часов BID > 50% к 2 часам AG 014699 В/в 7. 4 -11. 7 часов QD x 5 q 4 >90% к 5 недель часам
 Клинические испытания: ресурсы и информация Сайт Национального института рака США Ссылки на группы сотрудничества Программа оценки эффективности лечения онкологических заболеваний www. cancer. gov www. ctsu. org ctep. info. nih. gov Вопросы врачу [Physician’s Desk Query (PDQ)] www. cancer. gov/cancerinfo/pdq Регистр клинических испытаний, проведенных в США и других странах мира www. clinicaltrials. gov
Клинические испытания: ресурсы и информация Сайт Национального института рака США Ссылки на группы сотрудничества Программа оценки эффективности лечения онкологических заболеваний www. cancer. gov www. ctsu. org ctep. info. nih. gov Вопросы врачу [Physician’s Desk Query (PDQ)] www. cancer. gov/cancerinfo/pdq Регистр клинических испытаний, проведенных в США и других странах мира www. clinicaltrials. gov


