лекции по гидрогеологии 8.pptx
- Количество слайдов: 26
 Основы гидрогеохимии Гидрогеохимия – отрасль геохимии, рассматривающая строение и поведение воды в тесном взаимодействии ее с горными породами, растворенными в ней газами, взаимодействие ее с органическим веществом, изучающая миграцию и историю всех химических элементов в подземных водах, а так же формирование химического состава вод в целом, с учетом особенностей динамики подземных вод.
Основы гидрогеохимии Гидрогеохимия – отрасль геохимии, рассматривающая строение и поведение воды в тесном взаимодействии ее с горными породами, растворенными в ней газами, взаимодействие ее с органическим веществом, изучающая миграцию и историю всех химических элементов в подземных водах, а так же формирование химического состава вод в целом, с учетом особенностей динамики подземных вод.
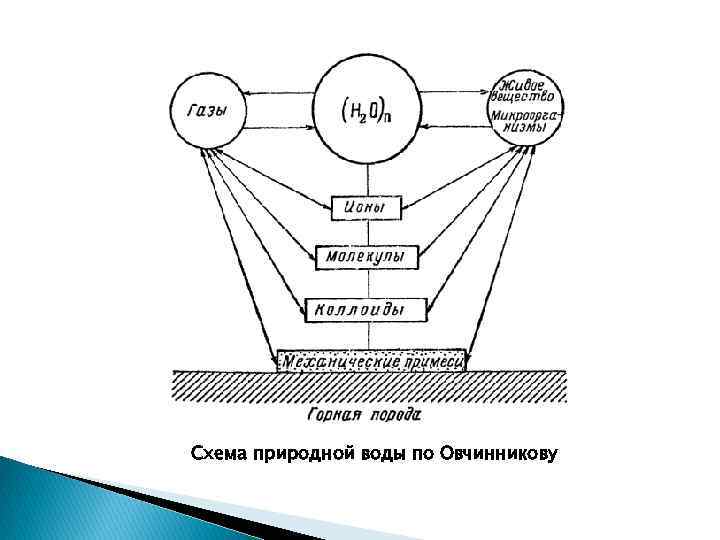 Схема природной воды по Овчинникову
Схема природной воды по Овчинникову
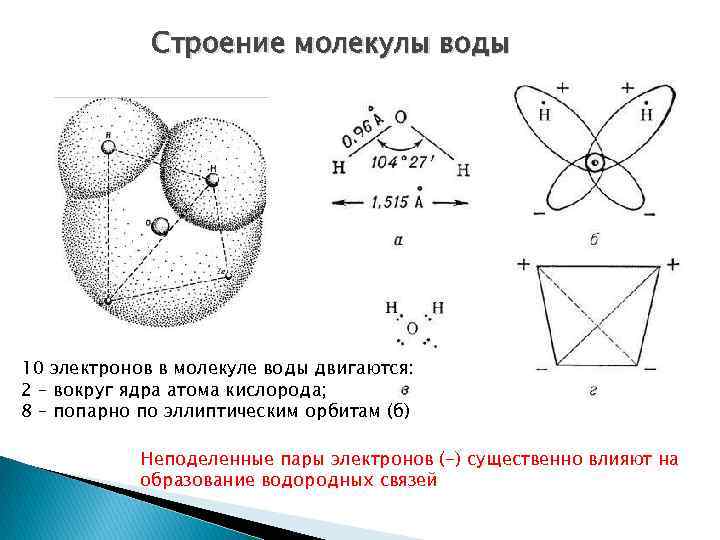 Строение молекулы воды 10 электронов в молекуле воды двигаются: 2 – вокруг ядра атома кислорода; 8 – попарно по эллиптическим орбитам (б) Неподеленные пары электронов (-) существенно влияют на образование водородных связей
Строение молекулы воды 10 электронов в молекуле воды двигаются: 2 – вокруг ядра атома кислорода; 8 – попарно по эллиптическим орбитам (б) Неподеленные пары электронов (-) существенно влияют на образование водородных связей
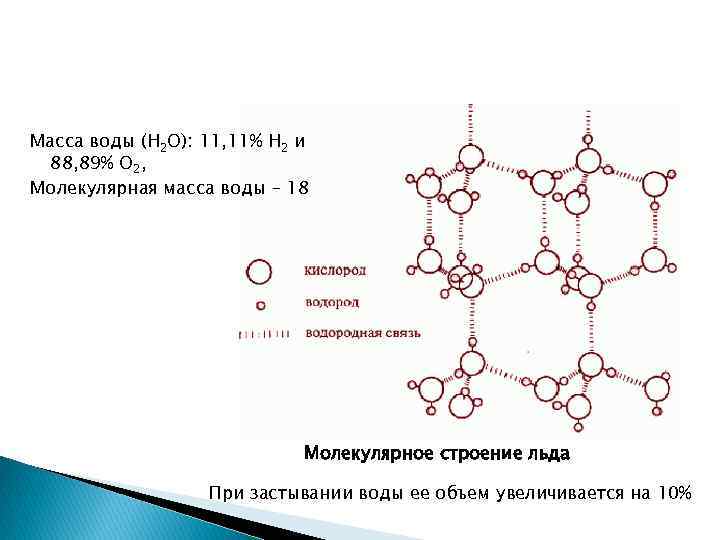 Масса воды (H 2 O): 11, 11% H 2 и 88, 89% O 2, Молекулярная масса воды – 18 Молекулярное строение льда При застывании воды ее объем увеличивается на 10%
Масса воды (H 2 O): 11, 11% H 2 и 88, 89% O 2, Молекулярная масса воды – 18 Молекулярное строение льда При застывании воды ее объем увеличивается на 10%
 Физические свойства воды -температура, -плотность (от 1 – 1, 4 г/см 3) - сжимаемость β - (2, 7 -5)*10 -5 Па β = ΔV/ ΔP (c увеличением T и растворенных газов – объем воды растет, с ростом давления - уменьшается - вязкость динамическая (при НУ µдист. в = 1 м. Па*с) - электропроводность (УЭС от 0, 02 -1, 00 Ом*м) -прозрачность - радиоактивность (U, Ra, Rn) Органолептические свойства: -цвет, -вкус, -запах
Физические свойства воды -температура, -плотность (от 1 – 1, 4 г/см 3) - сжимаемость β - (2, 7 -5)*10 -5 Па β = ΔV/ ΔP (c увеличением T и растворенных газов – объем воды растет, с ростом давления - уменьшается - вязкость динамическая (при НУ µдист. в = 1 м. Па*с) - электропроводность (УЭС от 0, 02 -1, 00 Ом*м) -прозрачность - радиоактивность (U, Ra, Rn) Органолептические свойства: -цвет, -вкус, -запах
 Аномалии физических свойств воды: 1. Плавление воды (таяние льда) – это не расширение, а сжатие; 2. Плотность воды при повышении Т от 0 до 4 о. С возрастает, после 4 о. С – уменьшается; 3. Аномальные температуры кипения и плавления; 4. Способность растворять соли;
Аномалии физических свойств воды: 1. Плавление воды (таяние льда) – это не расширение, а сжатие; 2. Плотность воды при повышении Т от 0 до 4 о. С возрастает, после 4 о. С – уменьшается; 3. Аномальные температуры кипения и плавления; 4. Способность растворять соли;
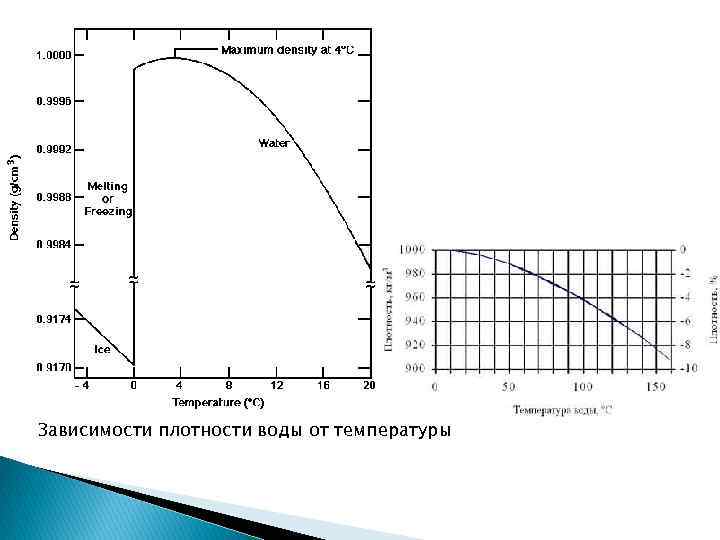 Зависимости плотности воды от температуры
Зависимости плотности воды от температуры
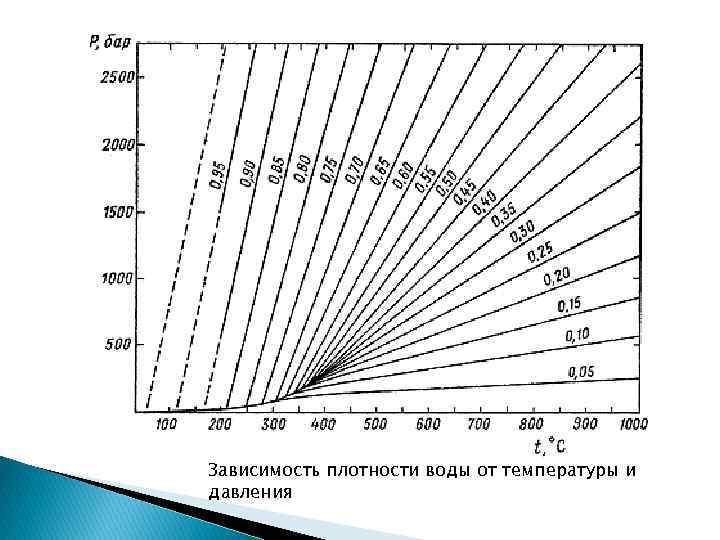 Зависимость плотности воды от температуры и давления
Зависимость плотности воды от температуры и давления
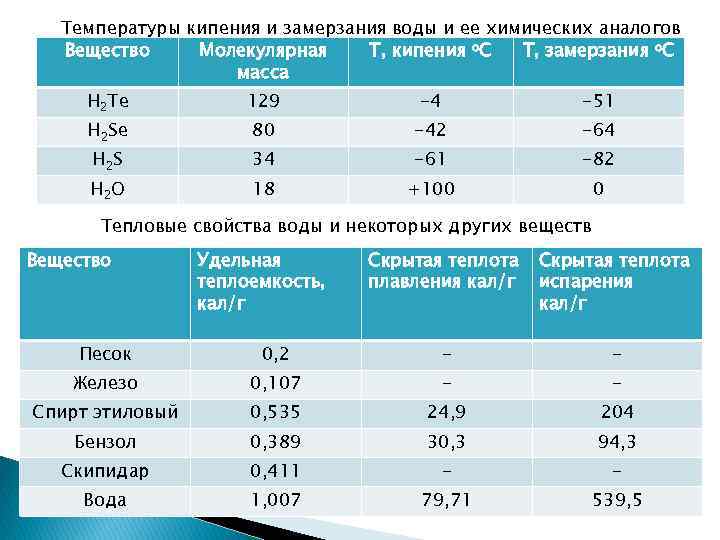 Температуры кипения и замерзания воды и ее химических аналогов Вещество Молекулярная Т, кипения о. С Т, замерзания о. С масса H 2 Te 129 -4 -51 H 2 Se 80 -42 -64 H 2 S 34 -61 -82 H 2 O 18 +100 0 Тепловые свойства воды и некоторых других веществ Вещество Удельная теплоемкость, кал/г Скрытая теплота плавления кал/г Скрытая теплота испарения кал/г Песок 0, 2 - - Железо 0, 107 - - Спирт этиловый 0, 535 24, 9 204 Бензол 0, 389 30, 3 94, 3 Скипидар 0, 411 - - Вода 1, 007 79, 71 539, 5
Температуры кипения и замерзания воды и ее химических аналогов Вещество Молекулярная Т, кипения о. С Т, замерзания о. С масса H 2 Te 129 -4 -51 H 2 Se 80 -42 -64 H 2 S 34 -61 -82 H 2 O 18 +100 0 Тепловые свойства воды и некоторых других веществ Вещество Удельная теплоемкость, кал/г Скрытая теплота плавления кал/г Скрытая теплота испарения кал/г Песок 0, 2 - - Железо 0, 107 - - Спирт этиловый 0, 535 24, 9 204 Бензол 0, 389 30, 3 94, 3 Скипидар 0, 411 - - Вода 1, 007 79, 71 539, 5
 Химические свойства воды На вкусовые качества пива влияет содержание в воде гипса Ca. SO 4 • 2 H 2 O, а так же жесткость, чем больще (Са+Mg) , тем вкуснее
Химические свойства воды На вкусовые качества пива влияет содержание в воде гипса Ca. SO 4 • 2 H 2 O, а так же жесткость, чем больще (Са+Mg) , тем вкуснее
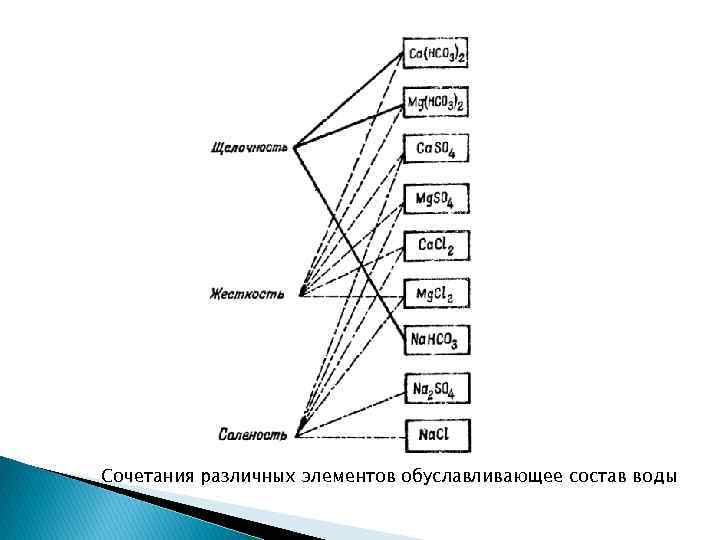 Сочетания различных элементов обуславливающее состав воды
Сочетания различных элементов обуславливающее состав воды

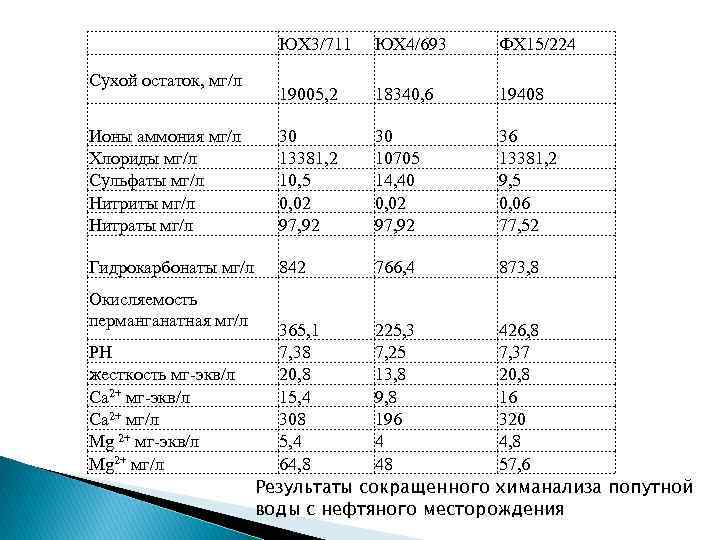 ЮХ 3/711 ЮХ 4/693 ФХ 15/224 19005, 2 18340, 6 19408 Ионы аммония мг/л Хлориды мг/л Сульфаты мг/л Нитриты мг/л Нитраты мг/л 30 13381, 2 10, 5 0, 02 97, 92 30 10705 14, 40 0, 02 97, 92 36 13381, 2 9, 5 0, 06 77, 52 Гидрокарбонаты мг/л 842 766, 4 873, 8 Сухой остаток, мг/л Окисляемость перманганатная мг/л PH жесткость мг-экв/л Са 2+ мг/л Mg 2+ мг-экв/л Mg 2+ мг/л 365, 1 225, 3 426, 8 7, 38 7, 25 7, 37 20, 8 13, 8 20, 8 15, 4 9, 8 16 308 196 320 5, 4 4 4, 8 64, 8 48 57, 6 Результаты сокращенного химанализа попутной воды с нефтяного месторождения
ЮХ 3/711 ЮХ 4/693 ФХ 15/224 19005, 2 18340, 6 19408 Ионы аммония мг/л Хлориды мг/л Сульфаты мг/л Нитриты мг/л Нитраты мг/л 30 13381, 2 10, 5 0, 02 97, 92 30 10705 14, 40 0, 02 97, 92 36 13381, 2 9, 5 0, 06 77, 52 Гидрокарбонаты мг/л 842 766, 4 873, 8 Сухой остаток, мг/л Окисляемость перманганатная мг/л PH жесткость мг-экв/л Са 2+ мг/л Mg 2+ мг-экв/л Mg 2+ мг/л 365, 1 225, 3 426, 8 7, 38 7, 25 7, 37 20, 8 13, 8 20, 8 15, 4 9, 8 16 308 196 320 5, 4 4 4, 8 64, 8 48 57, 6 Результаты сокращенного химанализа попутной воды с нефтяного месторождения
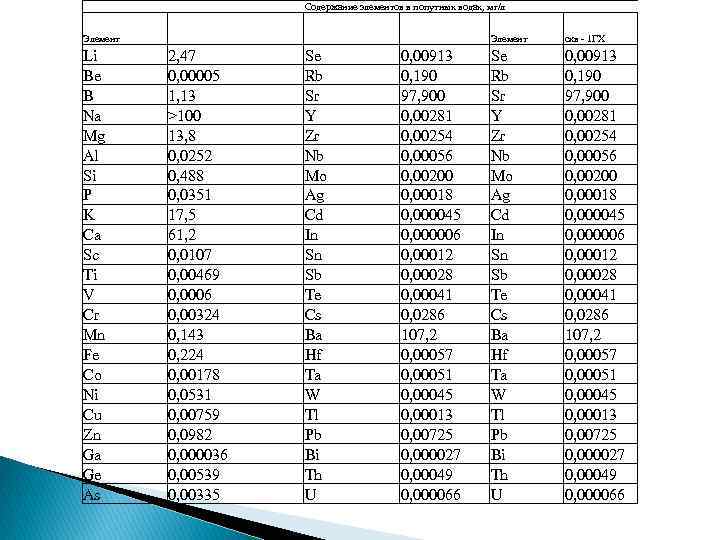 Содержание элементов в попутных водах, мг/л Элемент скв - 1 ГХ Li Be B Na Mg Al Si P K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 2, 47 0, 00005 1, 13 >100 13, 8 0, 0252 0, 488 0, 0351 17, 5 61, 2 0, 0107 0, 00469 0, 0006 0, 00324 0, 143 0, 224 0, 00178 0, 0531 0, 00759 0, 0982 0, 000036 0, 00539 0, 00335 Se Rb Sr Y Zr Nb Mo Ag Cd In Sn Sb Te Cs Ba Hf Ta W Tl Pb Bi Th U 0, 00913 0, 190 97, 900 0, 00281 0, 00254 0, 00056 0, 00200 0, 00018 0, 000045 0, 000006 0, 00012 0, 00028 0, 00041 0, 0286 107, 2 0, 00057 0, 00051 0, 00045 0, 00013 0, 00725 0, 000027 0, 00049 0, 000066
Содержание элементов в попутных водах, мг/л Элемент скв - 1 ГХ Li Be B Na Mg Al Si P K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 2, 47 0, 00005 1, 13 >100 13, 8 0, 0252 0, 488 0, 0351 17, 5 61, 2 0, 0107 0, 00469 0, 0006 0, 00324 0, 143 0, 224 0, 00178 0, 0531 0, 00759 0, 0982 0, 000036 0, 00539 0, 00335 Se Rb Sr Y Zr Nb Mo Ag Cd In Sn Sb Te Cs Ba Hf Ta W Tl Pb Bi Th U 0, 00913 0, 190 97, 900 0, 00281 0, 00254 0, 00056 0, 00200 0, 00018 0, 000045 0, 000006 0, 00012 0, 00028 0, 00041 0, 0286 107, 2 0, 00057 0, 00051 0, 00045 0, 00013 0, 00725 0, 000027 0, 00049 0, 000066
 Растворенные соли Содержание растворенных солей в водах от доли % - 40% от веса воды; Соли хлористоводородной кислоты: Na. Cl, KCl, Mg. Cl 2, Ca. Cl 2, Fe. Cl 3; Соли серной кислоты: Сa. SO 4, Mg. SO 4, Na 2 SO 4, реже K 2 SO 4, (NH 4)2 SO 4; Сульфаты тяжелых металлов: Fe-, Zn- , Cu. SO 4 Соли угольной кислоты: Na. CO 3, Na. HCO 3, K 2 CO 3, Ca. CO 3, Mg. HCO 3; Соли сероводорода: Na 2 S, Ca. S, Fe. S; Бораты: Na 2 B 4 O 7, (NH 4)2 B 2 O 7
Растворенные соли Содержание растворенных солей в водах от доли % - 40% от веса воды; Соли хлористоводородной кислоты: Na. Cl, KCl, Mg. Cl 2, Ca. Cl 2, Fe. Cl 3; Соли серной кислоты: Сa. SO 4, Mg. SO 4, Na 2 SO 4, реже K 2 SO 4, (NH 4)2 SO 4; Сульфаты тяжелых металлов: Fe-, Zn- , Cu. SO 4 Соли угольной кислоты: Na. CO 3, Na. HCO 3, K 2 CO 3, Ca. CO 3, Mg. HCO 3; Соли сероводорода: Na 2 S, Ca. S, Fe. S; Бораты: Na 2 B 4 O 7, (NH 4)2 B 2 O 7
 Минерализация (сухой остаток) - сумма всех найденных при химическом анализе воды минеральных веществ. Величина сухого остатка состоит из общего содержания в воде нелетучих минеральных соединений и частично органических соединений (г/л, мг/л, г/кг) Группа Сухой остаток, г/л Ультрапресные До 0, 2 Пресные 0, 2 -1 Слабосолоноватые 1 -3 Сильносолоноватые 3 -10 Соленые 10 -35 Рассолы Более 35
Минерализация (сухой остаток) - сумма всех найденных при химическом анализе воды минеральных веществ. Величина сухого остатка состоит из общего содержания в воде нелетучих минеральных соединений и частично органических соединений (г/л, мг/л, г/кг) Группа Сухой остаток, г/л Ультрапресные До 0, 2 Пресные 0, 2 -1 Слабосолоноватые 1 -3 Сильносолоноватые 3 -10 Соленые 10 -35 Рассолы Более 35
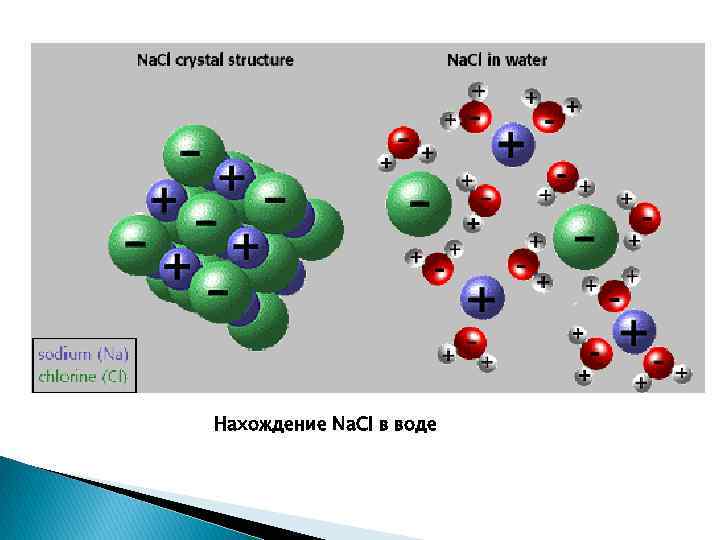 Нахождение Na. Cl в воде
Нахождение Na. Cl в воде
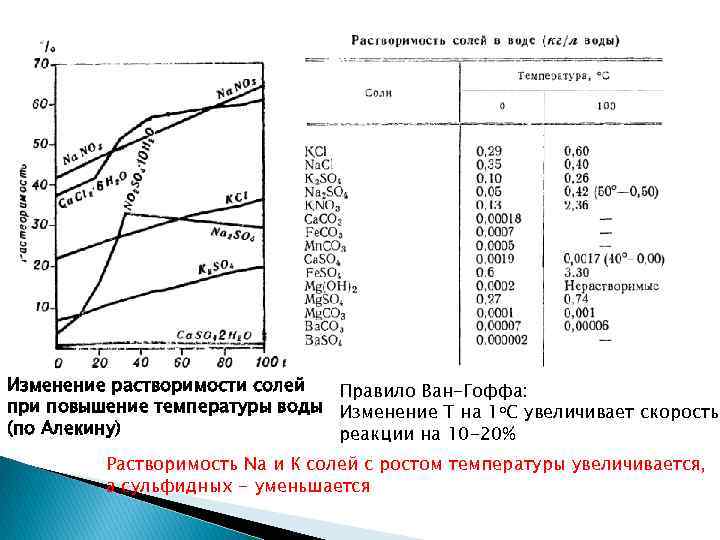 Изменение растворимости солей Правило Ван-Гоффа: при повышение температуры воды Изменение Т на 1 о. С увеличивает скорость (по Алекину) реакции на 10 -20% Растворимость Na и К солей с ростом температуры увеличивается, а сульфидных - уменьшается
Изменение растворимости солей Правило Ван-Гоффа: при повышение температуры воды Изменение Т на 1 о. С увеличивает скорость (по Алекину) реакции на 10 -20% Растворимость Na и К солей с ростом температуры увеличивается, а сульфидных - уменьшается
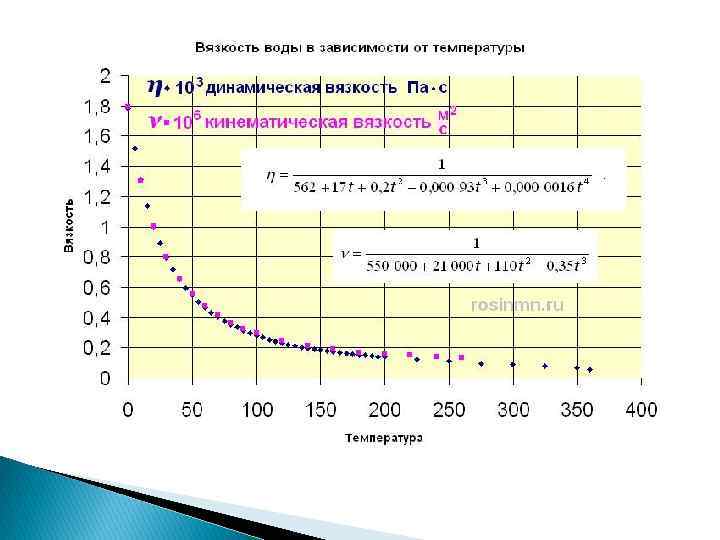
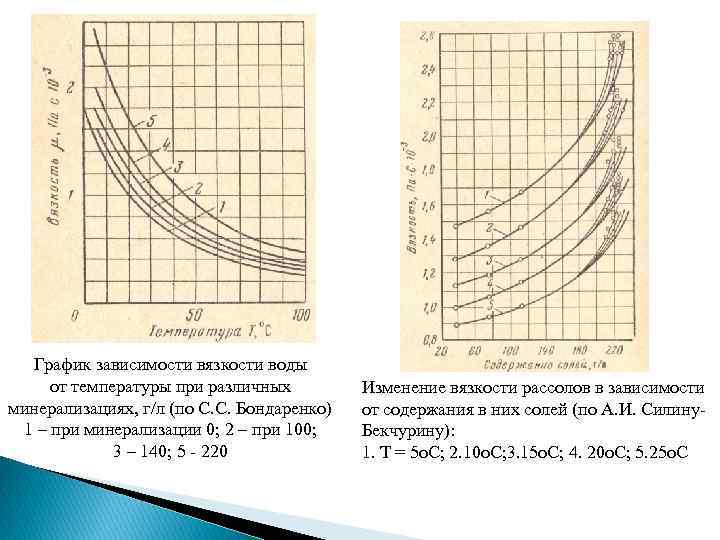 График зависимости вязкости воды от температуры при различных минерализациях, г/л (по С. С. Бондаренко) 1 – при минерализации 0; 2 – при 100; 3 – 140; 5 - 220 Изменение вязкости рассолов в зависимости от содержания в них солей (по А. И. Силину. Бекчурину): 1. Т = 5 о. С; 2. 10 о. С; 3. 15 о. С; 4. 20 о. С; 5. 25 о. С
График зависимости вязкости воды от температуры при различных минерализациях, г/л (по С. С. Бондаренко) 1 – при минерализации 0; 2 – при 100; 3 – 140; 5 - 220 Изменение вязкости рассолов в зависимости от содержания в них солей (по А. И. Силину. Бекчурину): 1. Т = 5 о. С; 2. 10 о. С; 3. 15 о. С; 4. 20 о. С; 5. 25 о. С
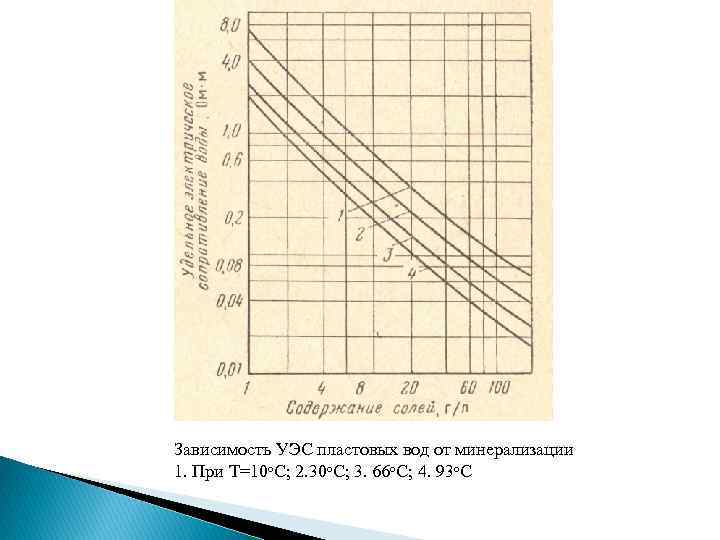 Зависимость УЭС пластовых вод от минерализации 1. При Т=10 о. С; 2. 30 о. С; 3. 66 о. С; 4. 93 о. С
Зависимость УЭС пластовых вод от минерализации 1. При Т=10 о. С; 2. 30 о. С; 3. 66 о. С; 4. 93 о. С
 Коллоиды – тонкодисперсные частицы от 0, 7 – 0, 001 мкм (10 -6 м). В виде коллоидов в водах распространены: - кремнекислота; -окислы железа и алюминия; -соединения марганца, магния, никеля и др; - тончайшие пленки нефти.
Коллоиды – тонкодисперсные частицы от 0, 7 – 0, 001 мкм (10 -6 м). В виде коллоидов в водах распространены: - кремнекислота; -окислы железа и алюминия; -соединения марганца, магния, никеля и др; - тончайшие пленки нефти.
 Газовые компоненты и ОВ Количество находящихся в природных водах газов по Вернадскому: 10 -4 – 10 -1%. Среди растворенных газов распространены: O 2, N 2, CO 2, H 2 S, H 2, CH 4, ТУВ; Органические вещества: Гуминовые кислоты и их соли, нафтеновые кислоты, жирные кислоты, аммиак, азотистая кислота.
Газовые компоненты и ОВ Количество находящихся в природных водах газов по Вернадскому: 10 -4 – 10 -1%. Среди растворенных газов распространены: O 2, N 2, CO 2, H 2 S, H 2, CH 4, ТУВ; Органические вещества: Гуминовые кислоты и их соли, нафтеновые кислоты, жирные кислоты, аммиак, азотистая кислота.
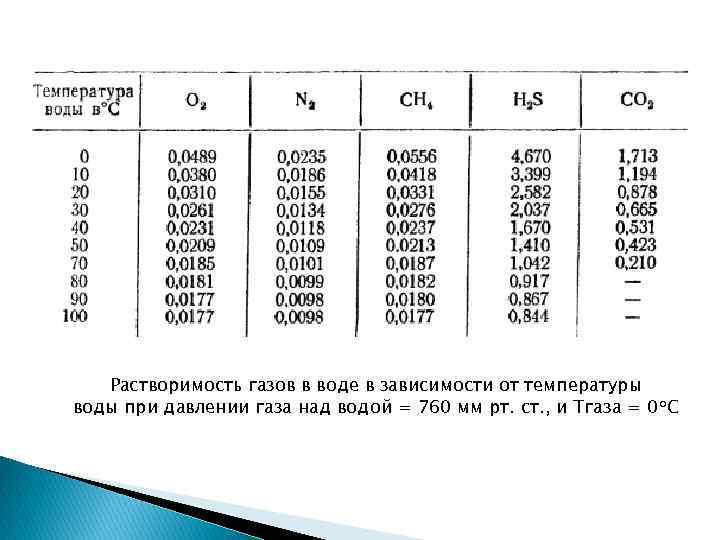 Растворимость газов в воде в зависимости от температуры воды при давлении газа над водой = 760 мм рт. ст. , и Тгаза = 0 о. С
Растворимость газов в воде в зависимости от температуры воды при давлении газа над водой = 760 мм рт. ст. , и Тгаза = 0 о. С
 Водородный показатель Характеризует активностью или концентрацией ионов водорода в воде Вода диссоциирует на ионы по уравнению: H 2 O ⇄ H+-OHКонцентрация ионов водорода определяется ионным произведением воды Кв Кв = [H+]*[OH-] При То =22 о. С, Кв = 10 -14 В нейтральной среде концентрации Н+ и ОН- одинаковы тогда, [Н+] = 10 -7
Водородный показатель Характеризует активностью или концентрацией ионов водорода в воде Вода диссоциирует на ионы по уравнению: H 2 O ⇄ H+-OHКонцентрация ионов водорода определяется ионным произведением воды Кв Кв = [H+]*[OH-] При То =22 о. С, Кв = 10 -14 В нейтральной среде концентрации Н+ и ОН- одинаковы тогда, [Н+] = 10 -7
 Концентрацию водородных ионов принято выражать через показатель p. H H+: p. H = - lg [H+] = - lg[10 -7] = 7 Класс Ph Сильнокислые Менее 1, 9 Кислые 1, 9 -4, 1 Слабокислые 4, 7 -7 Нейтральные 7 Слабощелочные 7 -8, 3 Щелочные 8, 3 -10, 3 Сильнощелочные Более 10, 3
Концентрацию водородных ионов принято выражать через показатель p. H H+: p. H = - lg [H+] = - lg[10 -7] = 7 Класс Ph Сильнокислые Менее 1, 9 Кислые 1, 9 -4, 1 Слабокислые 4, 7 -7 Нейтральные 7 Слабощелочные 7 -8, 3 Щелочные 8, 3 -10, 3 Сильнощелочные Более 10, 3


