Лекция 5 Белковая инженерия 2015.pptx
- Количество слайдов: 48
Основы генной инженерии и биотехнологии Лекция 5 Генная инженерия в исследовании белков

Задачи белковой инженерии Создание белков с новыми свойствами на основе новых аминокислотных последовательностей, а также путем модификации остатков аминокислот в природных полипептидных цепях

Свойства ферментов, важные для биотехнологии v. Реакции происходят в мягких условиях (температура, p. H) v. Высокая эффективность (kкат/kнекат) до 1017 v. Высокая специфичность. Кажущаяся константа (kкат/k. М) до 108 v. Недостаток: осуществляют реакции, происходящие только в организме

Две стратегии современной белковой инженерии Рациональный дизайн белков Конструирование белков de novo Конструирование полипептидов с элементами известной вторичной структуры: α-спирали, β-слои, различные функциональные домены (цинковые пальцы, спираль-поворот-спираль, центры связывания ионов металлов) Рациональный редизайн белков Гибридные белки и ферменты. Изменение субстратной специфичности ферментов. Повышение стабильности белков – поперечные сшивки Направленная эволюция белковых молекул Отбор белков с нужными свойствами из библиотек мутантных молекул
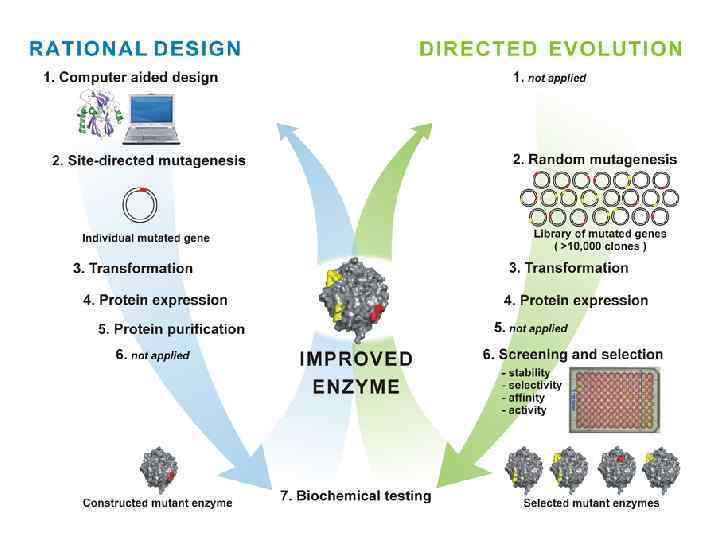

При рациональном редизайне необходимо изменять конкретные аминокислотные остатки в белке: 1. Направленным мутагенезом и/или 2. С помощью химических модификаций боковых цепей
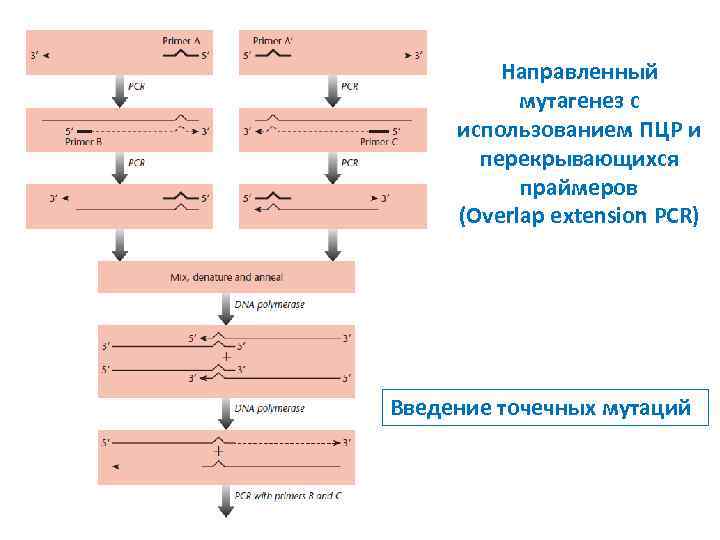
Направленный мутагенез с использованием ПЦР и перекрывающихся праймеров (Overlap extension PCR) Введение точечных мутаций
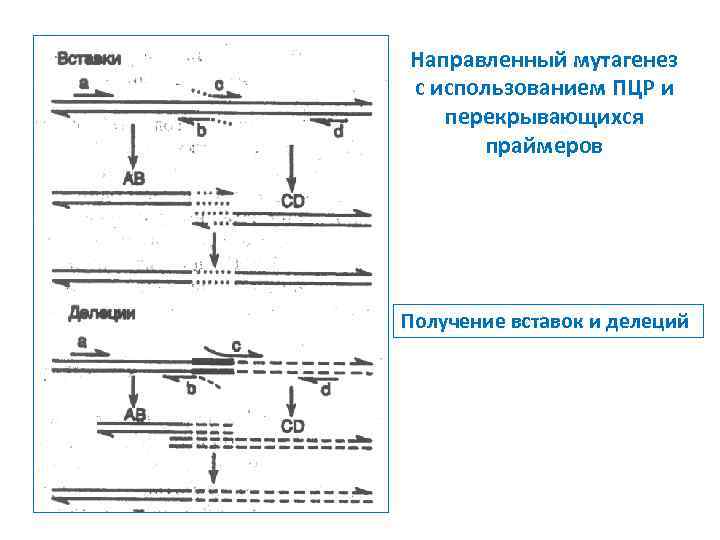
Направленный мутагенез с использованием ПЦР и перекрывающихся праймеров Получение вставок и делеций
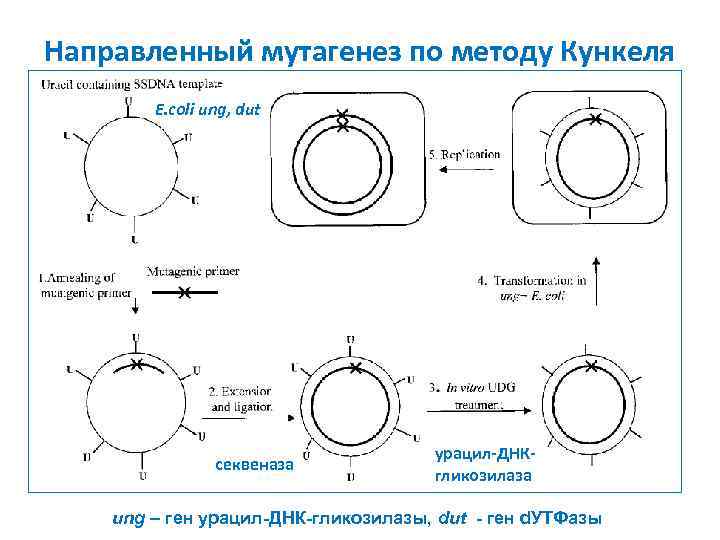
Направленный мутагенез по методу Кункеля E. coli ung, dut секвеназа урацил-ДНКгликозилаза ung – ген урацил-ДНК-гликозилазы, dut - ген d. УТФазы
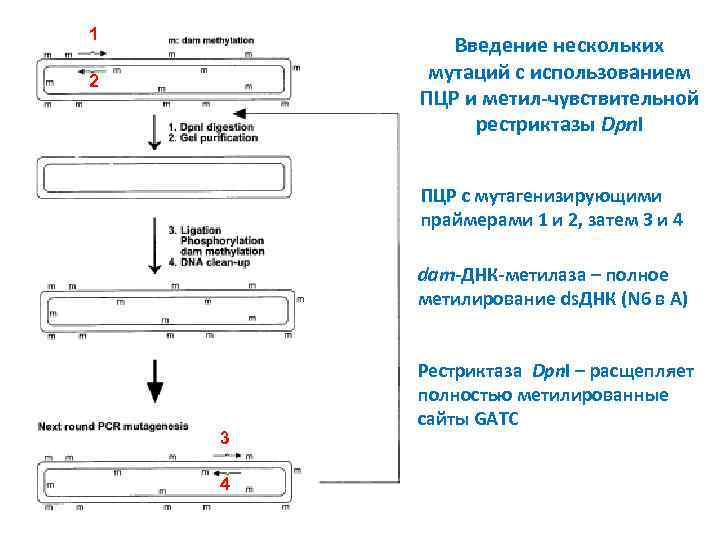
1 Введение нескольких мутаций с использованием ПЦР и метил-чувствительной рестриктазы Dpn. I 2 ПЦР с мутагенизирующими праймерами 1 и 2, затем 3 и 4 dam-ДНК-метилаза – полное метилирование ds. ДНК (N 6 в A) 3 4 Рестриктаза Dpn. I – расщепляет полностью метилированные сайты GATC
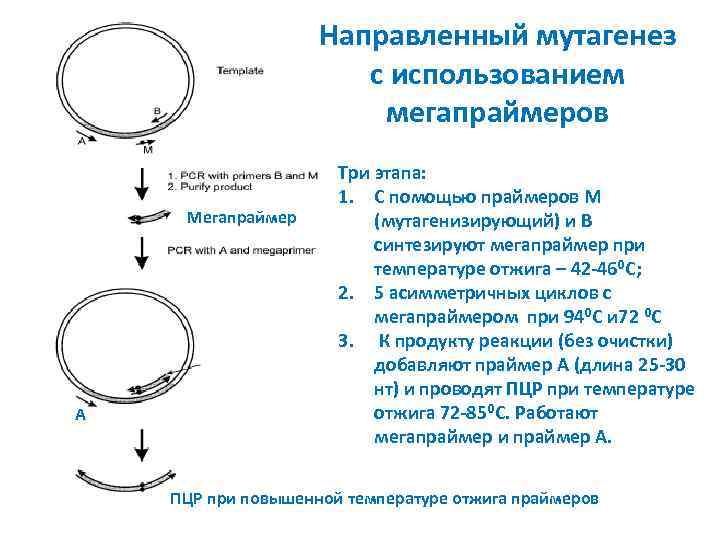
Направленный мутагенез с использованием мегапраймеров Мегапраймер A Три этапа: 1. С помощью праймеров М (мутагенизирующий) и B синтезируют мегапраймер при температуре отжига – 42 -46⁰С; 2. 5 асимметричных циклов с мегапраймером при 94⁰С и 72 ⁰С 3. К продукту реакции (без очистки) добавляют праймер A (длина 25 -30 нт) и проводят ПЦР при температуре отжига 72 -85⁰С. Работают мегапраймер и праймер A. ПЦР при повышенной температуре отжига праймеров
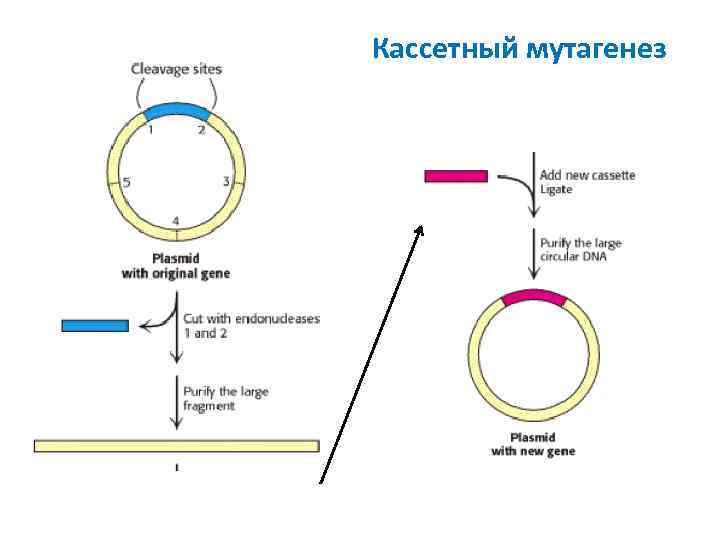
Кассетный мутагенез
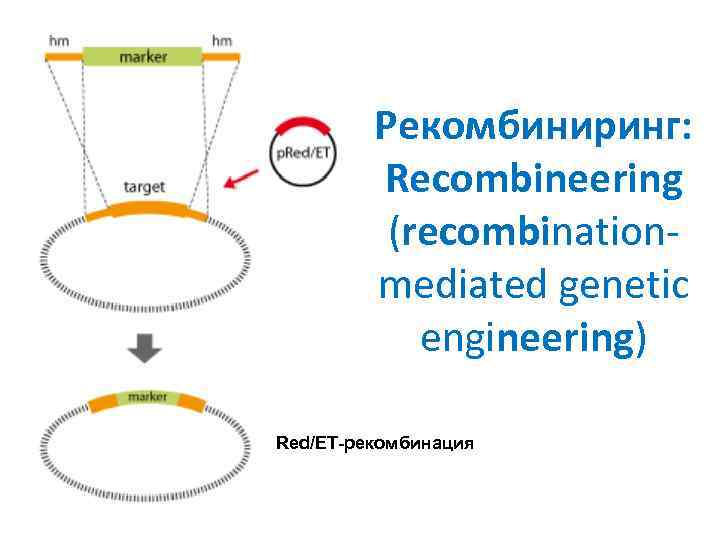
Рекомбиниринг: Recombineering (recombinationmediated genetic engineering) Red/ET-рекомбинация
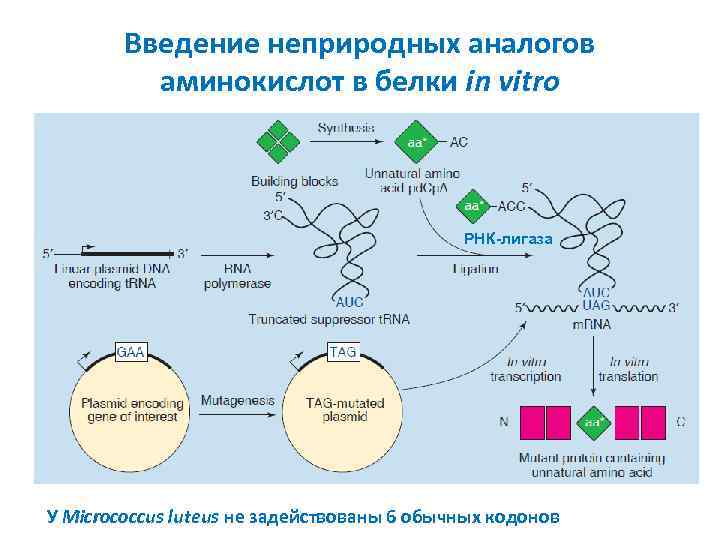
Введение неприродных аналогов аминокислот в белки in vitro РНК-лигаза У Micrococcus luteus не задействованы 6 обычных кодонов
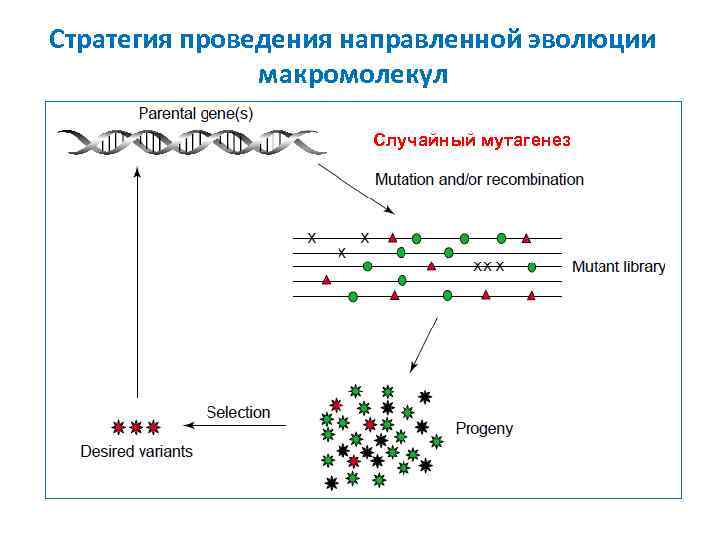
Стратегия проведения направленной эволюции макромолекул Случайный мутагенез
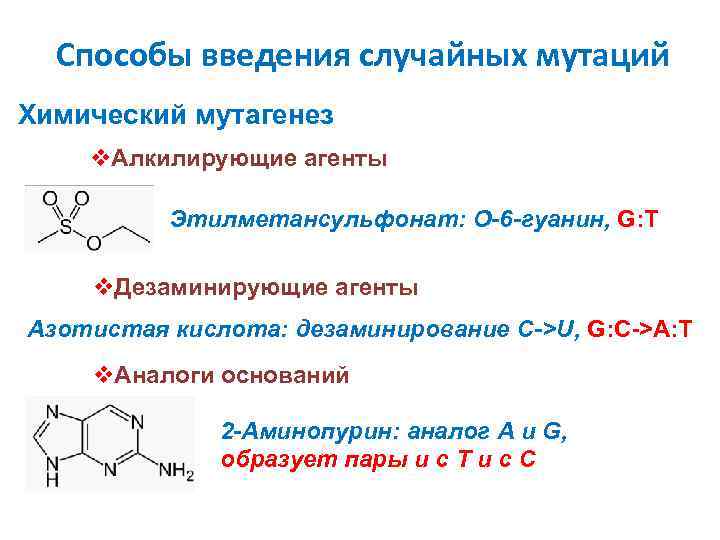
Способы введения случайных мутаций Химический мутагенез v. Алкилирующие агенты Этилметансульфонат: O-6 -гуанин, G: T v. Дезаминирующие агенты Азотистая кислота: дезаминирование С->U, G: C->A: T v. Аналоги оснований 2 -Аминопурин: аналог A и G, образует пары и с T и с С

Способы введения случайных мутаций v. Синтез ДНК с ошибками In vivo (E. coli) инактивация генов системы репарации mut. S, mut. T и/или mut. D: возрастание частоты мутаций на четыре порядка – с 10 -10 до 10 -6 нуклеотид/генерация In vitro (error-prone PCR): d. ITP, ионы Mn 2+ вместе с Mg 2+ Повышение частоты мутаций с 8, 0 x 10− 6 до 10− 4~10− 2 /нуклеотид 10 µl Число мутаций в ПЦР-продукте возрастает с увеличением числа циклов ПЦР
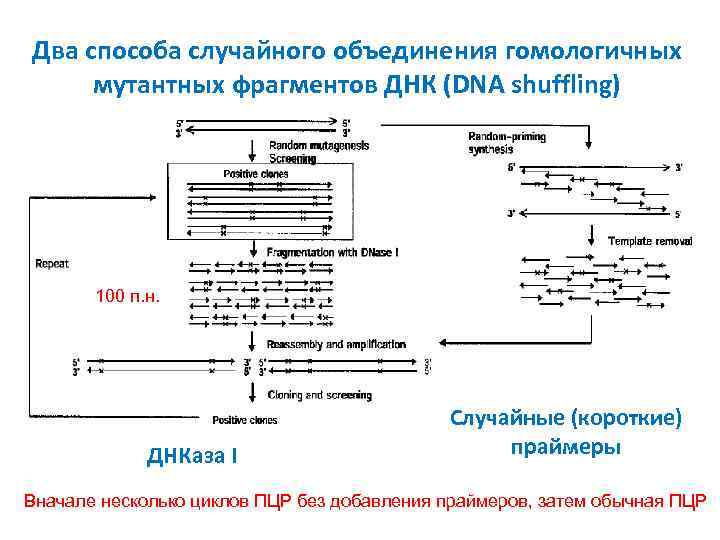
Два способа случайного объединения гомологичных мутантных фрагментов ДНК (DNA shuffling) 100 п. н. ДНКаза I Случайные (короткие) праймеры Вначале несколько циклов ПЦР без добавления праймеров, затем обычная ПЦР
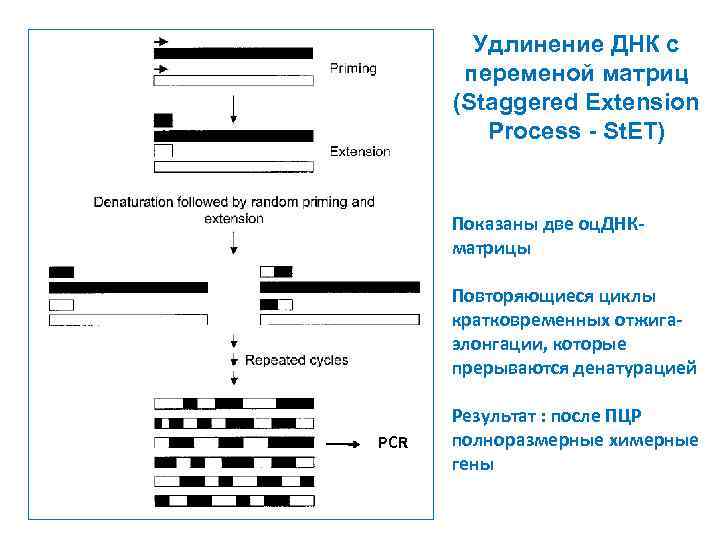
Удлинение ДНК с переменой матриц (Staggered Extension Process - St. ET) Показаны две оц. ДНКматрицы Повторяющиеся циклы кратковременных отжигаэлонгации, которые прерываются денатурацией PCR Результат : после ПЦР полноразмерные химерные гены
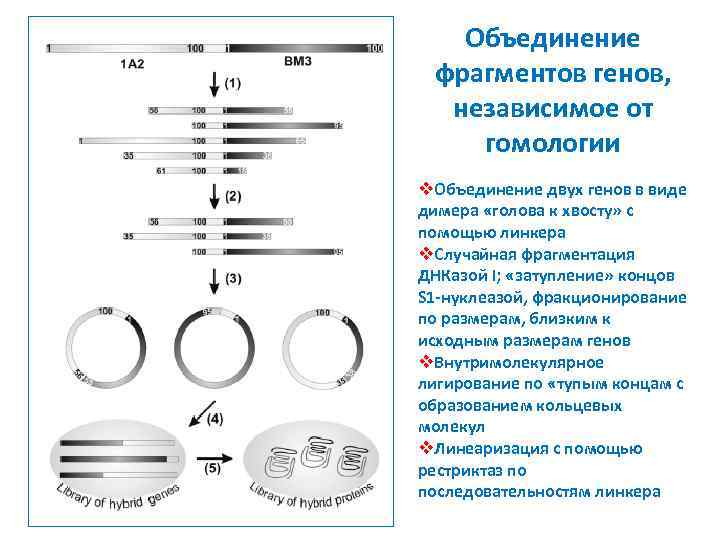
Объединение фрагментов генов, независимое от гомологии v. Объединение двух генов в виде димера «голова к хвосту» с помощью линкера v. Случайная фрагментация ДНКазой I; «затупление» концов S 1 -нуклеазой, фракционирование по размерам, близким к исходным размерам генов v. Внутримолекулярное лигирование по «тупым концам с образованием кольцевых молекул v. Линеаризация с помощью рестриктаз по последовательностям линкера
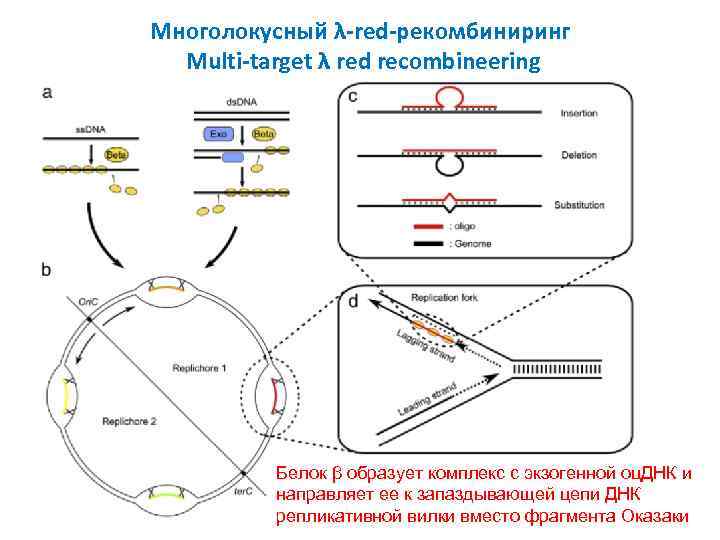
Многолокусный λ-red-рекомбиниринг Multi-target λ red recombineering Белок β образует комплекс с экзогенной оц. ДНК и направляет ее к запаздывающей цепи ДНК репликативной вилки вместо фрагмента Оказаки
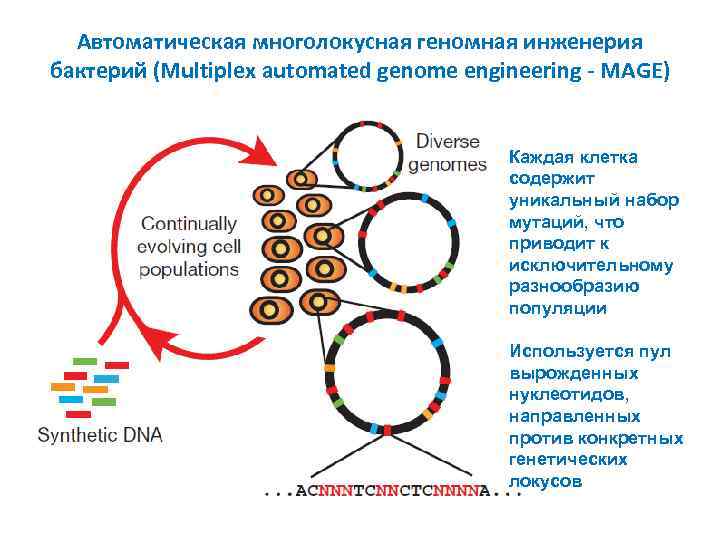
Автоматическая многолокусная геномная инженерия бактерий (Multiplex automated genome engineering - MAGE) Каждая клетка содержит уникальный набор мутаций, что приводит к исключительному разнообразию популяции Используется пул вырожденных нуклеотидов, направленных против конкретных генетических локусов

Способы введения и диверсификации случайных мутаций v. Химический мутагенез v. Синтез ДНК с ошибками v. Случайное объединение гомологичных участков генов (DNA shuffling) v. Удлиннение ДНК с переменой матриц (Staggered Extension Process) v. Рекомбинирование фрагментов генов, независимое от гомологии v. Многолокусный λ-red-рекомбиниринг
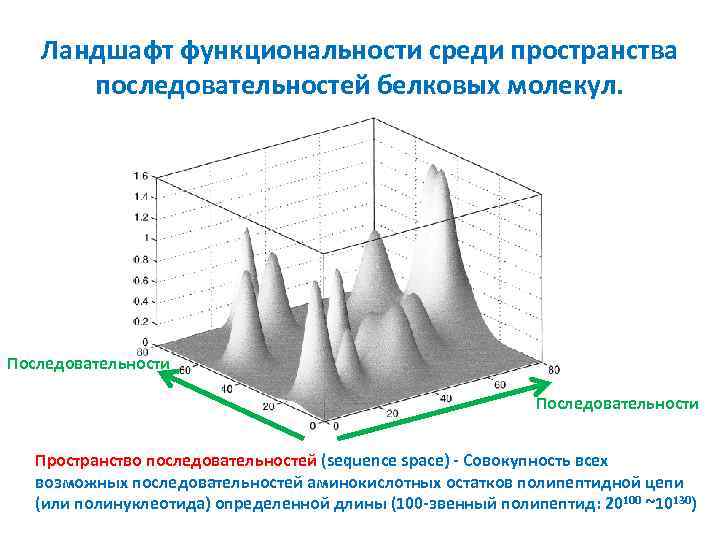
Ландшафт функциональности среди пространства последовательностей белковых молекул. Последовательности Пространство последовательностей (sequence space) - Совокупность всех возможных последовательностей аминокислотных остатков полипептидной цепи (или полинуклеотида) определенной длины (100 -звенный полипептид: 20 100 ~10130)
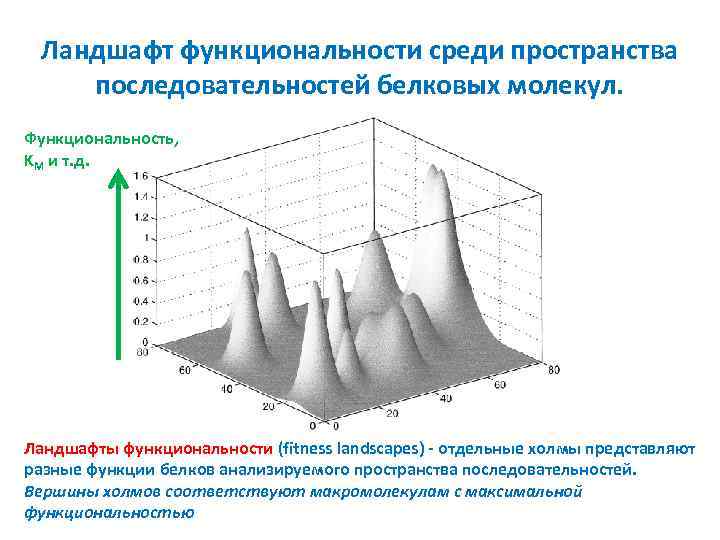
Ландшафт функциональности среди пространства последовательностей белковых молекул. Функциональность, KМ и т. д. Ландшафты функциональности (fitness landscapes) - отдельные холмы представляют разные функции белков анализируемого пространства последовательностей. Вершины холмов соответствуют макромолекулам с максимальной функциональностью
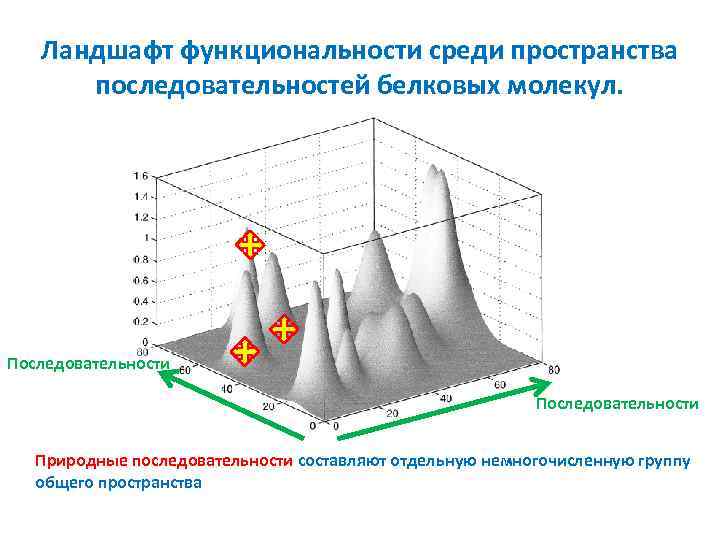
Ландшафт функциональности среди пространства последовательностей белковых молекул. Последовательности Природные последовательности составляют отдельную немногочисленную группу общего пространства
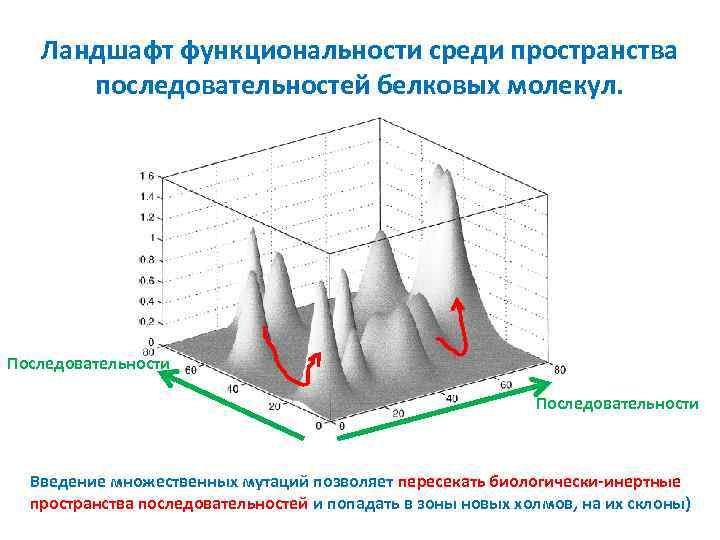
Ландшафт функциональности среди пространства последовательностей белковых молекул. Последовательности Введение множественных мутаций позволяет пересекать биологически-инертные пространства последовательностей и попадать в зоны новых холмов, на их склоны)
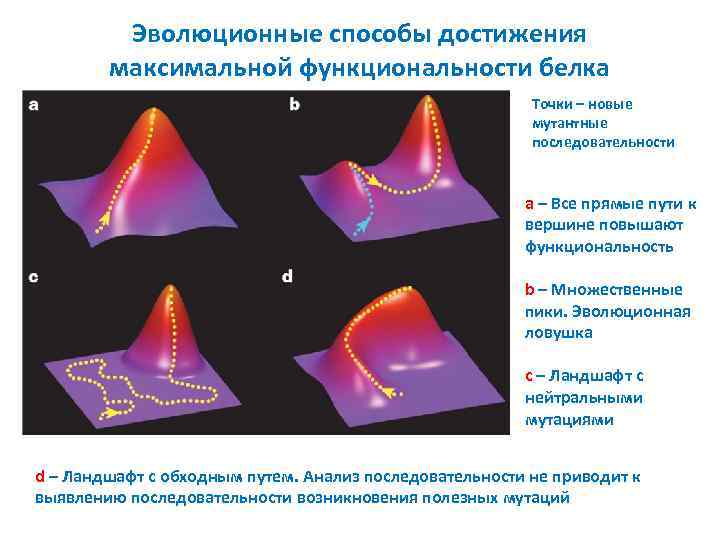
Эволюционные способы достижения максимальной функциональности белка Точки – новые мутантные последовательности a – Все прямые пути к вершине повышают функциональность b – Множественные пики. Эволюционная ловушка c – Ландшафт с нейтральными мутациями d – Ландшафт с обходным путем. Анализ последовательности не приводит к выявлению последовательности возникновения полезных мутаций
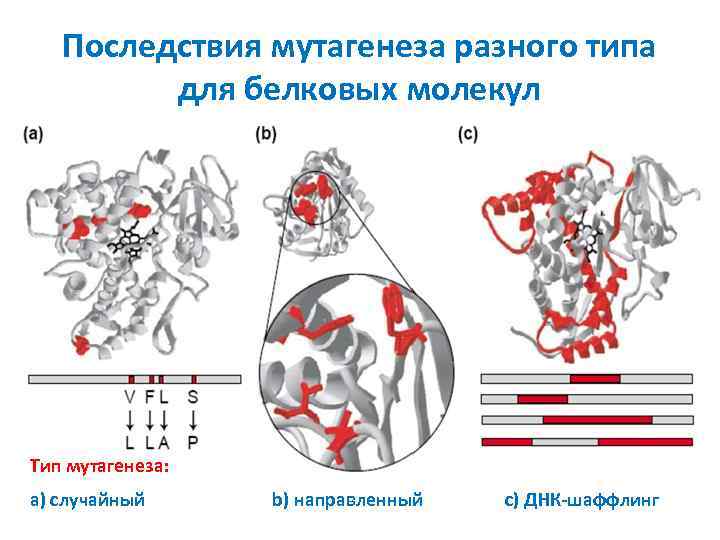
Последствия мутагенеза разного типа для белковых молекул Тип мутагенеза: a) случайный b) направленный c) ДНК-шаффлинг
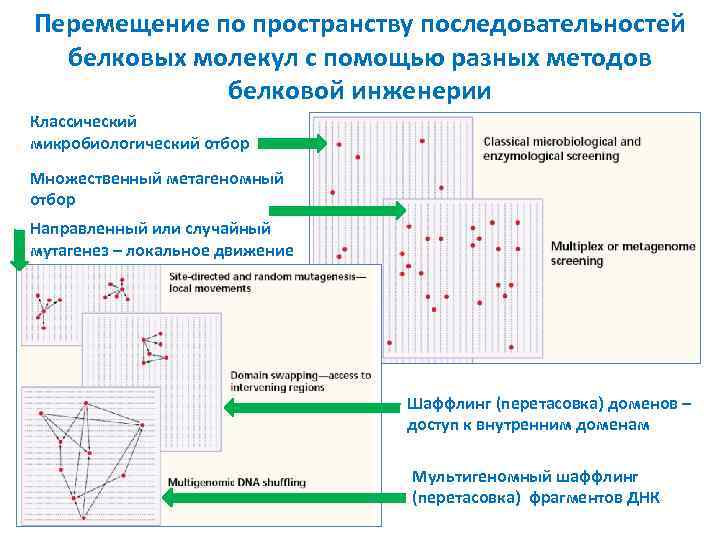
Перемещение по пространству последовательностей белковых молекул с помощью разных методов белковой инженерии Классический микробиологический отбор Множественный метагеномный отбор Направленный или случайный мутагенез – локальное движение Шаффлинг (перетасовка) доменов – доступ к внутренним доменам Мультигеномный шаффлинг (перетасовка) фрагментов ДНК

Локализация мутаций в полипептидных цепях ферментов при разной направленности отбора (эмпирические правила) Мутации локализуются вблизи активного центра при отборе: Энантиоселективности Субстратной специфичности Альтернативной каталитической активности Мутации локализуются как вблизи активного центра, так и вдали от него при отборе: Удельной активности Термостабильности

Методы отбора белков при их направленной эволюции: фаговый дисплей и непрерывная направленная эволюция
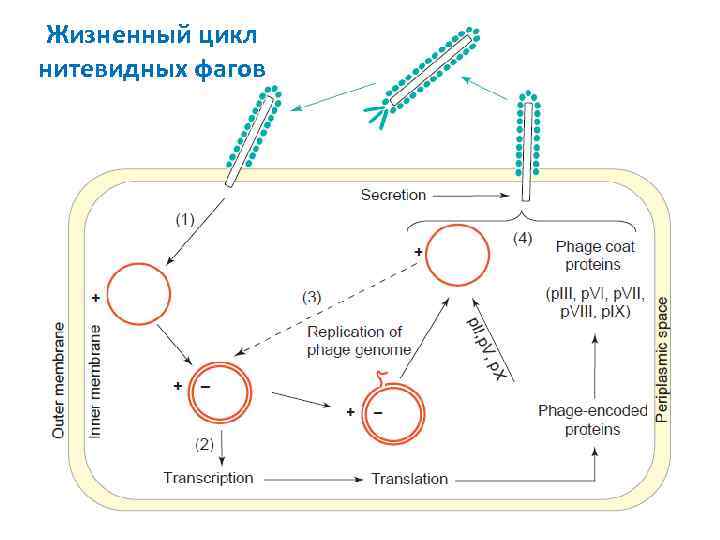
Жизненный цикл нитевидных фагов
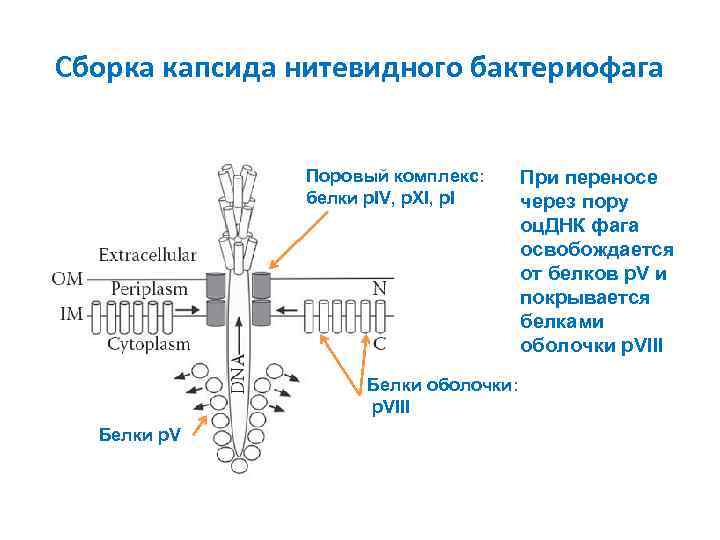
Сборка капсида нитевидного бактериофага Поровый комплекс: белки p. IV, p. XI, p. I Белки оболочки: p. VIII Белки p. V При переносе через пору оц. ДНК фага освобождается от белков p. V и покрывается белками оболочки p. VIII
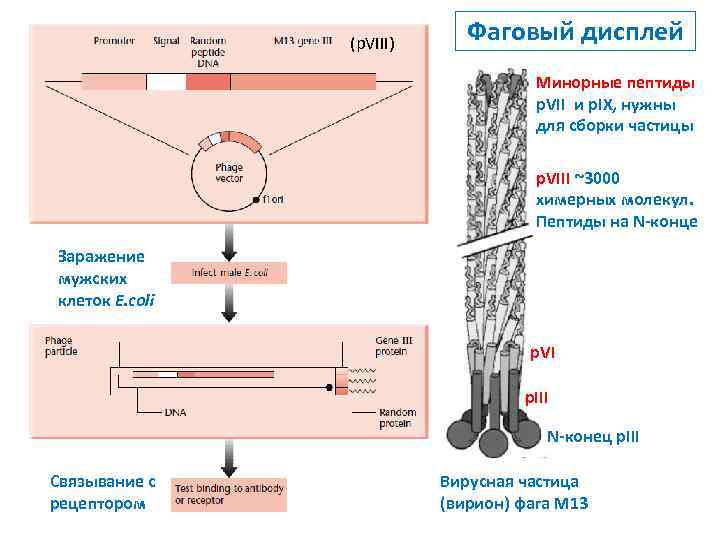
(p. VIII) Фаговый дисплей Минорные пептиды p. VII и p. IX, нужны для сборки частицы p. VIII ~3000 химерных молекул. Пептиды на N-конце Заражение мужских клеток E. coli p. VI p. III N-конец p. III Связывание с рецептором Вирусная частица (вирион) фага М 13
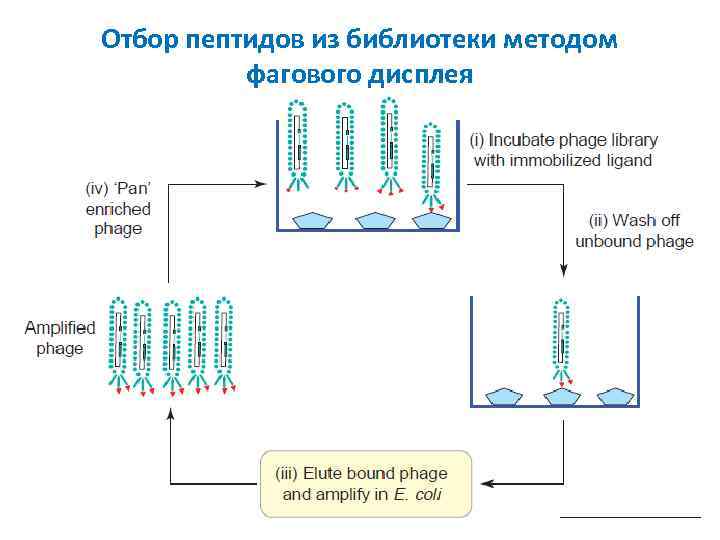
Отбор пептидов из библиотеки методом фагового дисплея
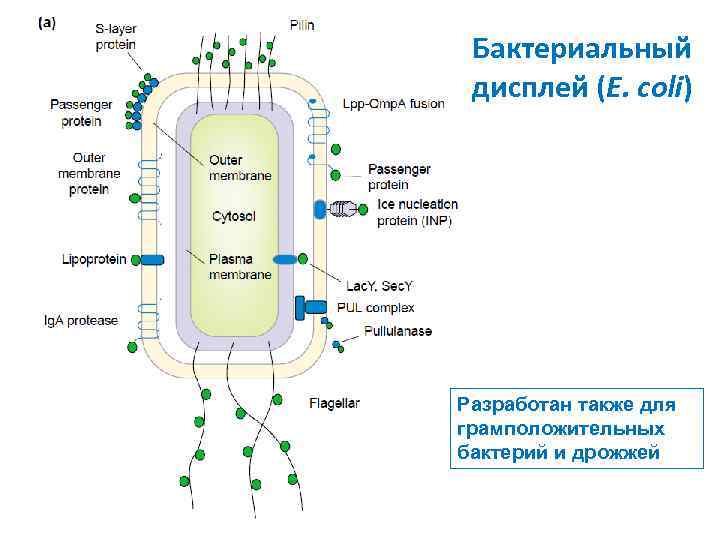
Бактериальный дисплей (E. coli) Разработан также для грамположительных бактерий и дрожжей
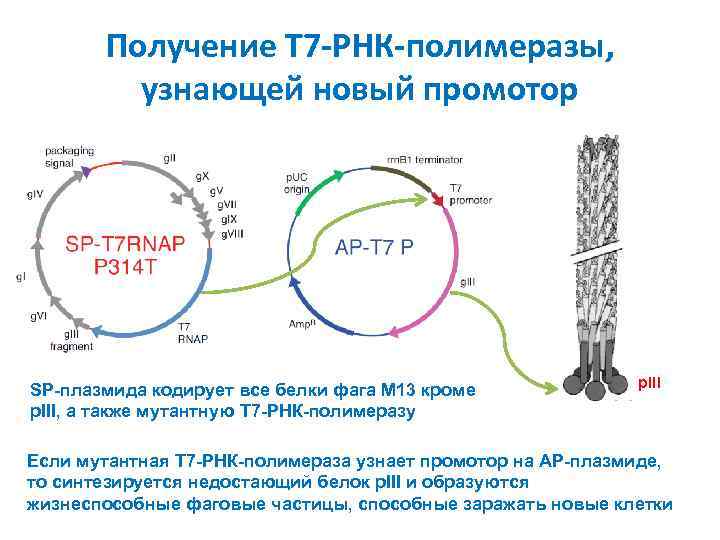
Получение T 7 -РНК-полимеразы, узнающей новый промотор SP-плазмида кодирует все белки фага M 13 кроме p. III, а также мутантную T 7 -РНК-полимеразу p. III Если мутантная T 7 -РНК-полимераза узнает промотор на AP-плазмиде, то синтезируется недостающий белок p. III и образуются жизнеспособные фаговые частицы, способные заражать новые клетки
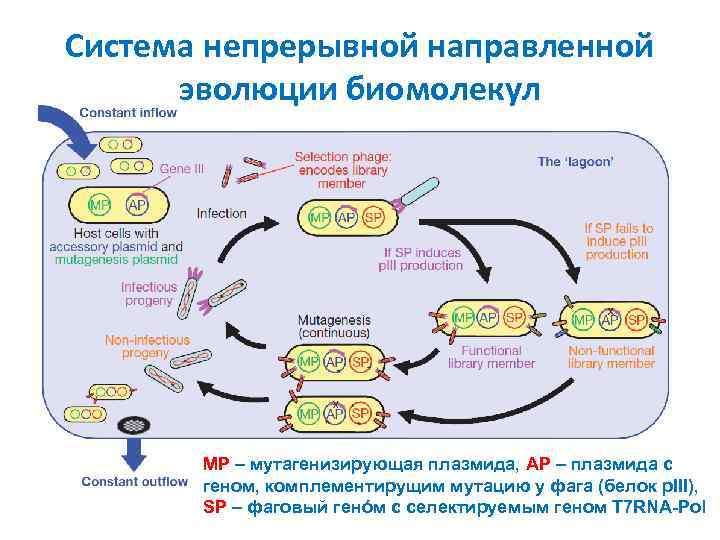
Система непрерывной направленной эволюции биомолекул MP – мутагенизирующая плазмида, AP – плазмида с геном, комплементирущим мутацию у фага (белок p. III), SP – фаговый генóм с селектируемым геном T 7 RNA-Pol
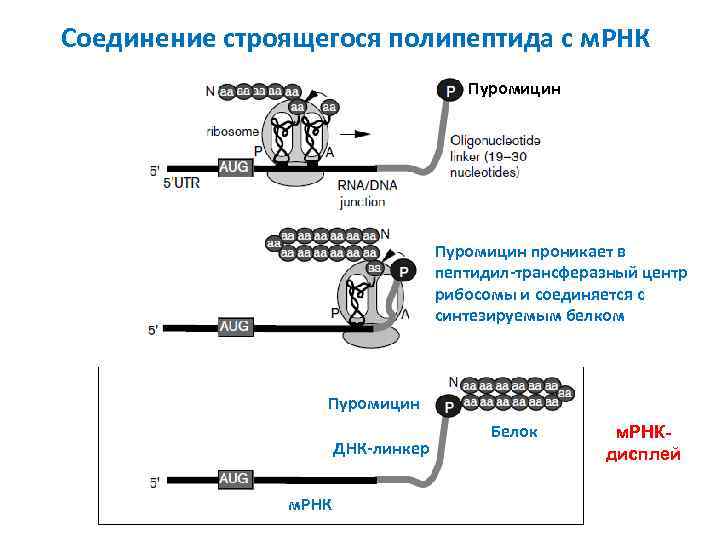
Соединение строящегося полипептида с м. РНК Пуромицин проникает в пептидил-трансферазный центр рибосомы и соединяется с синтезируемым белком Пуромицин ДНК-линкер м. РНК Белок м. РНКдисплей
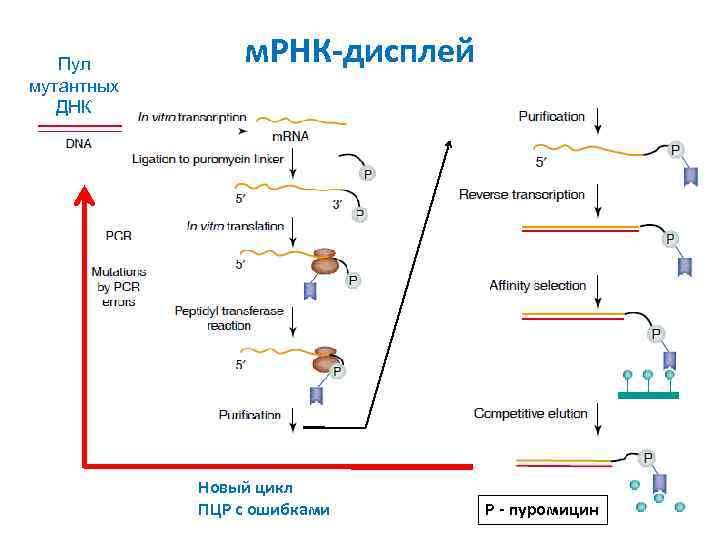
Пул мутантных ДНК м. РНК-дисплей Новый цикл ПЦР с ошибками Р - пуромицин
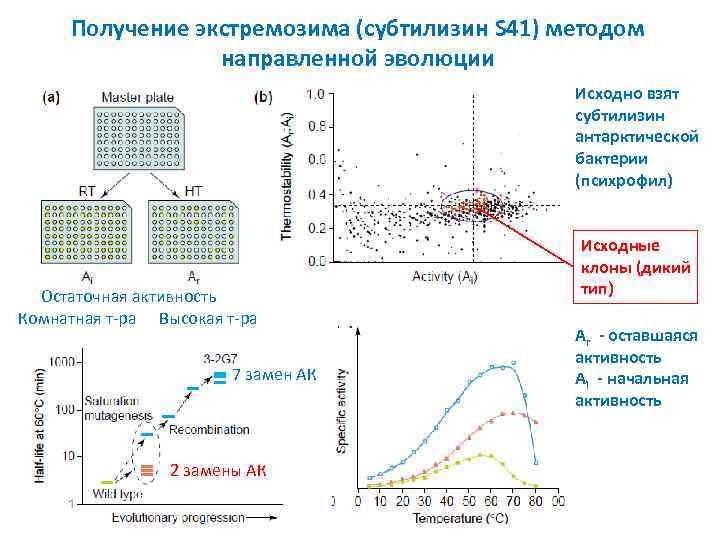
Получение экстремозима (субтилизин S 41) методом направленной эволюции Исходно взят субтилизин антарктической бактерии (психрофил) Остаточная активность Комнатная т-ра Высокая т-ра 7 замен АК 2 замены АК Исходные клоны (дикий тип) Ar - оставшаяся активность Ai - начальная активность

Разработаны индустриальные ферменты, стабильные при 60⁰С в присутствии органических растворителей с измененной субстратной специфичностью, катализирующих реакции, не происходящие в природе Раньше разрабатывали производственный процесс под имеющиеся ферменты Теперь создают (конструируют) ферменты, удовлетворяющие требованиям производственного процесса
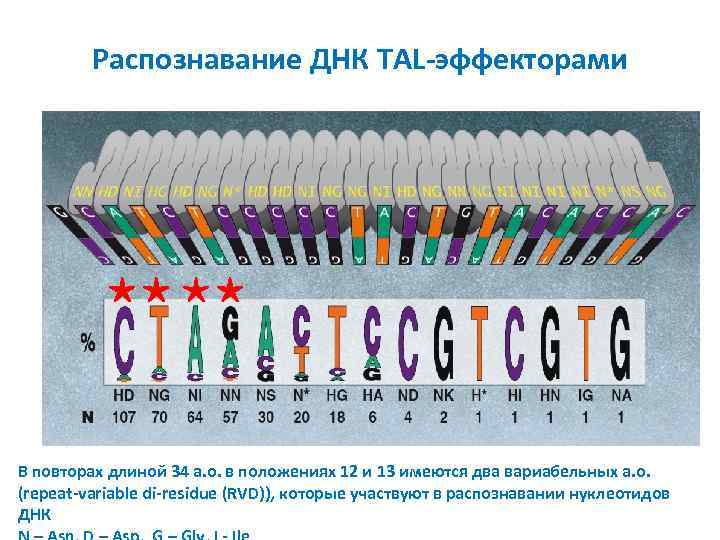
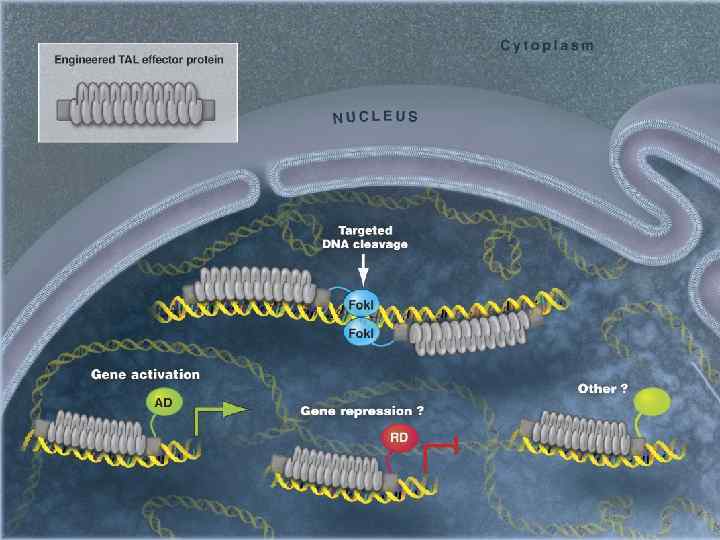
Распознавание ДНК TAL-эффекторами В повторах длиной 34 а. о. в положениях 12 и 13 имеются два вариабельных а. о. (repeat-variable di-residue (RVD)), которые участвуют в распознавании нуклеотидов ДНК
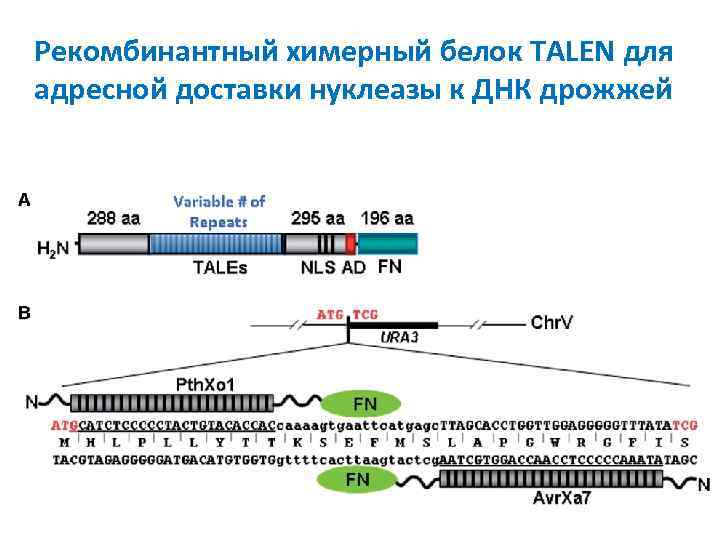
Рекомбинантный химерный белок TALEN для адресной доставки нуклеазы к ДНК дрожжей

Биоинформатика становится интегральной частью белковой инженерии v Анализ больших массивов данных о последовательностях белков, полученных новыми методами секвенирования ДНК. Метагеномика. v Выравнивание множественных последовательностей позволяет выявлять ключевые аминокислотные остатки у белков одного класса v Использование баз данных о пространственной структуре известных белков (RCSB Protein Data Bank, http: //www. pdb. org – 77 000 структур)

В направленной эволюции должно быть и зерно рационального дизайна Интеллект исследователя незаменим
Лекция 5 Белковая инженерия 2015.pptx