 Основы электрохимии Эл. х-я – раздел химии, изучающий процессы на границе раздела 2 -х фаз (Ме – р-р) с участием заряженных частиц(ионов, ē)
Основы электрохимии Эл. х-я – раздел химии, изучающий процессы на границе раздела 2 -х фаз (Ме – р-р) с участием заряженных частиц(ионов, ē)
 Электрохимические процессы делят на две группы: • Процессы превращения химической энергии в электрическую (гальванический элемент). • Процессы превращения электрической энергии в химическую (электролиз).
Электрохимические процессы делят на две группы: • Процессы превращения химической энергии в электрическую (гальванический элемент). • Процессы превращения электрической энергии в химическую (электролиз).
 Электрод – система, состоящая из токопроводящего в-ва и р-ра или р-ва электролита Zn + Zn. SO 4 Водородный электрод – Pt (пластина), опущенная в р-р кислоты(1 моль/л), ч/з который пропускается газ. H 2
Электрод – система, состоящая из токопроводящего в-ва и р-ра или р-ва электролита Zn + Zn. SO 4 Водородный электрод – Pt (пластина), опущенная в р-р кислоты(1 моль/л), ч/з который пропускается газ. H 2
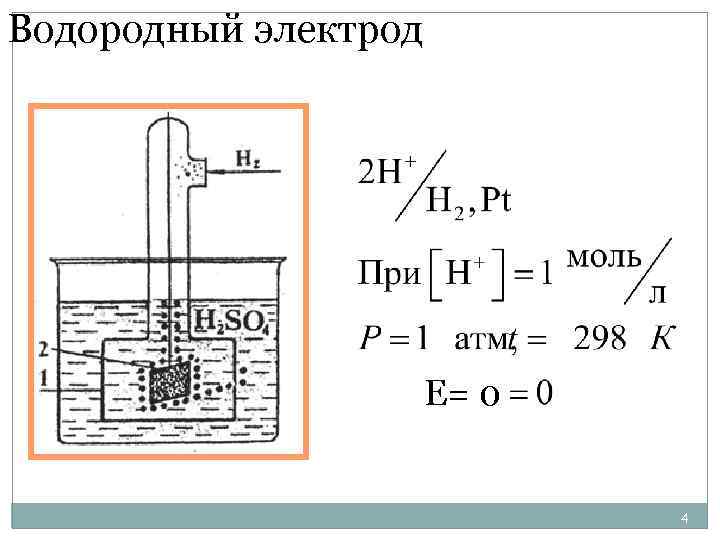 Водородный электрод Е= 0 4
Водородный электрод Е= 0 4
 Электродный потенциал – эдс цепи, составленной из исследуемого электрода и ст. водородного электрода Zn/Zn 2+||2 H+/H 2, Pt Ряд ст. электр. потенциалов (ряд напряжений Me) Характеризует хим. св-ва Ме
Электродный потенциал – эдс цепи, составленной из исследуемого электрода и ст. водородного электрода Zn/Zn 2+||2 H+/H 2, Pt Ряд ст. электр. потенциалов (ряд напряжений Me) Характеризует хим. св-ва Ме
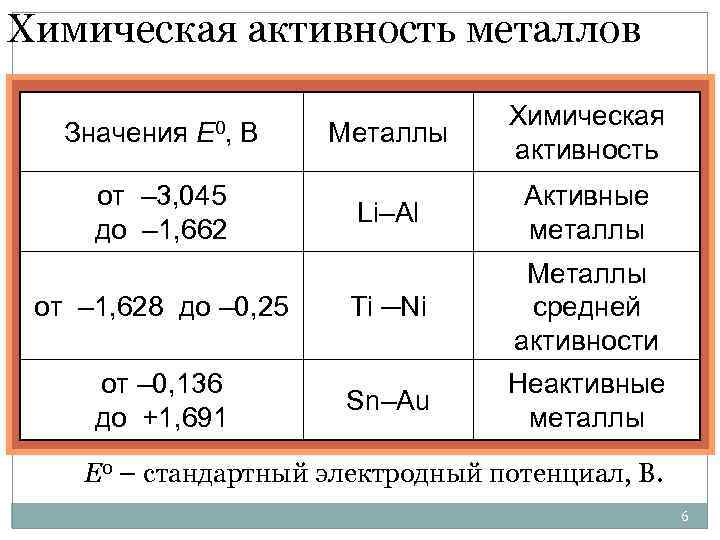 Химическая активность металлов Значения E 0, В от – 3, 045 до – 1, 662 от – 1, 628 до – 0, 25 от – 0, 136 до +1, 691 Металлы Химическая активность Li–Al Активные металлы Ti ─Ni Металлы средней активности Sn–Au Неактивные металлы E 0 – стандартный электродный потенциал, В. 6
Химическая активность металлов Значения E 0, В от – 3, 045 до – 1, 662 от – 1, 628 до – 0, 25 от – 0, 136 до +1, 691 Металлы Химическая активность Li–Al Активные металлы Ti ─Ni Металлы средней активности Sn–Au Неактивные металлы E 0 – стандартный электродный потенциал, В. 6
 1. Чем левее(выше) расположен Ме, т. е. имеет меньший потенциал, тем сильнее восстановительная способность 2. Каждый Ме способен вытеснять из р-ров солей те Ме, которые стоят в ряду напряжений правее(ниже) 3. Только Ме, стоящие левее(выше) водорода способны вытеснять его из р-ров кислот
1. Чем левее(выше) расположен Ме, т. е. имеет меньший потенциал, тем сильнее восстановительная способность 2. Каждый Ме способен вытеснять из р-ров солей те Ме, которые стоят в ряду напряжений правее(ниже) 3. Только Ме, стоящие левее(выше) водорода способны вытеснять его из р-ров кислот
 Гальванический элемент состоит из двух электродов: 1. анод (отрицательный электрод), обозначается: А (–); протекает процесс окисления; 2. катод (положительный электрод), обозначается К (+) ; протекает процесс восстановления;
Гальванический элемент состоит из двух электродов: 1. анод (отрицательный электрод), обозначается: А (–); протекает процесс окисления; 2. катод (положительный электрод), обозначается К (+) ; протекает процесс восстановления;
 А(-): Ме 0 – nē = Men+ K(+): Men+ + nē = Ме 0 Анодом является более активный Ме (с меньшим потенциалом) Катод – электрод, на котором протекает восстановление менее активного Ме(с большим потен. ) Екатод>Еанод
А(-): Ме 0 – nē = Men+ K(+): Men+ + nē = Ме 0 Анодом является более активный Ме (с меньшим потенциалом) Катод – электрод, на котором протекает восстановление менее активного Ме(с большим потен. ) Екатод>Еанод
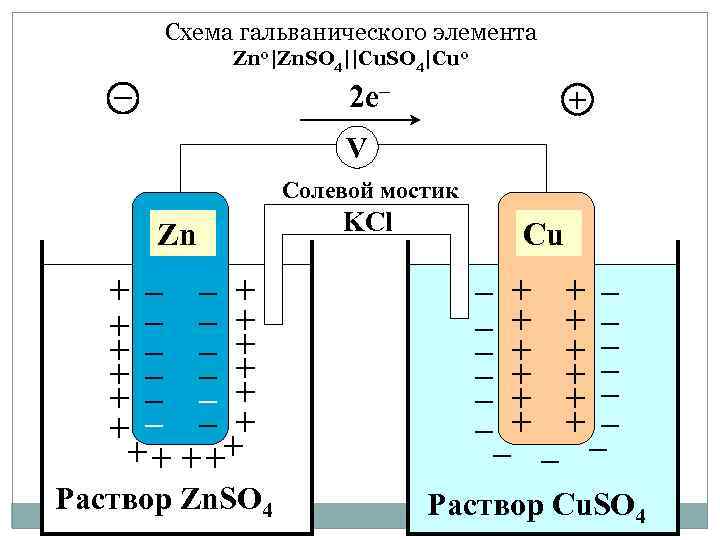 Схема гальванического элемента Zn 0|Zn. SO 4||Cu. SO 4|Cu 0 – 2 e– + V Солевой мостик Zn + – – + + – – + + + – –+ + + ++ Раствор Zn. SO 4 KCl Cu – – – + + + – – – – – Раствор Cu. SO 4
Схема гальванического элемента Zn 0|Zn. SO 4||Cu. SO 4|Cu 0 – 2 e– + V Солевой мостик Zn + – – + + – – + + + – –+ + + ++ Раствор Zn. SO 4 KCl Cu – – – + + + – – – – – Раствор Cu. SO 4
 Процессы на аноде и катоде Анод Катод - Zn 0|Zn. SO 4||Cu. SO 4|Cu 0 + -А: Zn 0 – 2 e Zn 2+ Е 0= 0, 76 окисление +K: Cu 2+ + 2 e Cu 0 0 = +0, 34 восстановле Zn 0 + Cu 2+ Zn 2+ + Cu 0 Е 0= 0 К - 0 А Е 0 Cu/Zn= 0, 34 – (-0, 76)=1, 1 В ние
Процессы на аноде и катоде Анод Катод - Zn 0|Zn. SO 4||Cu. SO 4|Cu 0 + -А: Zn 0 – 2 e Zn 2+ Е 0= 0, 76 окисление +K: Cu 2+ + 2 e Cu 0 0 = +0, 34 восстановле Zn 0 + Cu 2+ Zn 2+ + Cu 0 Е 0= 0 К - 0 А Е 0 Cu/Zn= 0, 34 – (-0, 76)=1, 1 В ние
![Уравнение Нернста для расчета о-в потенциала Ме-го электрода, если [ионы]≠ 1 моль/л E = Уравнение Нернста для расчета о-в потенциала Ме-го электрода, если [ионы]≠ 1 моль/л E =](https://present5.com/presentation/-30187883_30748281/image-12.jpg) Уравнение Нернста для расчета о-в потенциала Ме-го электрода, если [ионы]≠ 1 моль/л E = E 0 + (0, 059 / n) • lg. C где E - потенциал металла (в вольтах) E 0 – стандарт. электрод. потенциал n - заряд ионов металла С - концентрация ионов в растворе (г-ион/л)
Уравнение Нернста для расчета о-в потенциала Ме-го электрода, если [ионы]≠ 1 моль/л E = E 0 + (0, 059 / n) • lg. C где E - потенциал металла (в вольтах) E 0 – стандарт. электрод. потенциал n - заряд ионов металла С - концентрация ионов в растворе (г-ион/л)
 Уравнение Нернста Концентрационный гальванический элемент 14
Уравнение Нернста Концентрационный гальванический элемент 14
![Уравнение Нернста для расчета о-в потенциала водородного электрода, если [ H+]≠ 1 моль/л Уравнение Нернста для расчета о-в потенциала водородного электрода, если [ H+]≠ 1 моль/л](https://present5.com/presentation/-30187883_30748281/image-15.jpg) Уравнение Нернста для расчета о-в потенциала водородного электрода, если [ H+]≠ 1 моль/л
Уравнение Нернста для расчета о-в потенциала водородного электрода, если [ H+]≠ 1 моль/л