Основы биосигнализации: Са. Са 2+2+ / /









7_-_sa2+_-_fosfoinozitolovaya_sistema_l_7.ppt
- Размер: 1.5 Мб
- Автор:
- Количество слайдов: 22
Описание презентации Основы биосигнализации: Са. Са 2+2+ / / по слайдам
 Основы биосигнализации: Са. Са 2+2+ / / ФОСФОИНОЗИТО-ЛОВА Я СИСТЕМА МЕССЕНДЖЕРОВ ЛЕКЦИЯ
Основы биосигнализации: Са. Са 2+2+ / / ФОСФОИНОЗИТО-ЛОВА Я СИСТЕМА МЕССЕНДЖЕРОВ ЛЕКЦИЯ
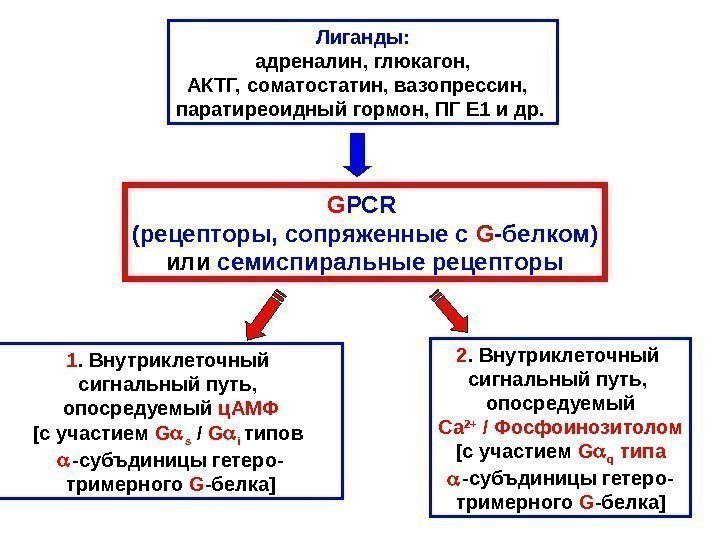
 Лиганды: адреналин, глюкагон, АКТГ, соматостатин, вазопрессин, паратиреоидный гормон, ПГ Е 1 и др. G PCR (рецепторы, сопряженные с G — белком) или c емиспиральные рецепторы 1. Внутриклеточный сигнальный путь, опосредуемый ц. АМФ [c участием G s / G i типов — субъдиницы гетеро- тримерного G — белка ] 2. Внутриклеточный сигнальный путь, опосредуемый Са 2+ / Фосфоинозитолом [c участием G q типа — субъдиницы гетеро- тримерного G — белка ]
Лиганды: адреналин, глюкагон, АКТГ, соматостатин, вазопрессин, паратиреоидный гормон, ПГ Е 1 и др. G PCR (рецепторы, сопряженные с G — белком) или c емиспиральные рецепторы 1. Внутриклеточный сигнальный путь, опосредуемый ц. АМФ [c участием G s / G i типов — субъдиницы гетеро- тримерного G — белка ] 2. Внутриклеточный сигнальный путь, опосредуемый Са 2+ / Фосфоинозитолом [c участием G q типа — субъдиницы гетеро- тримерного G — белка ]

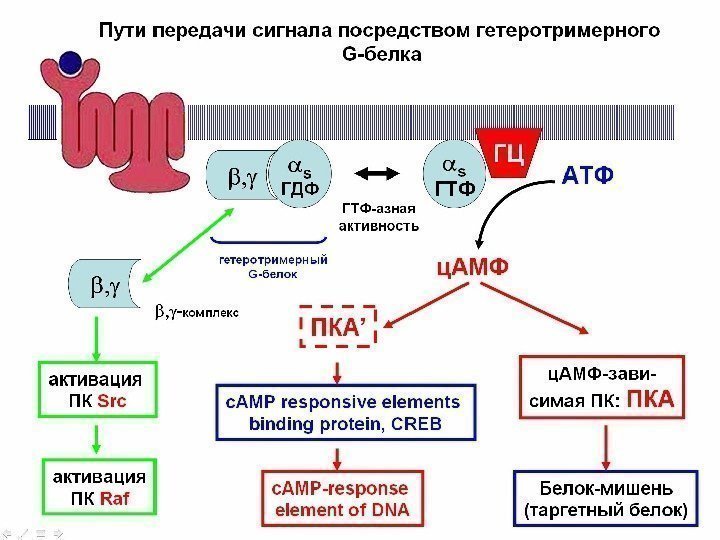
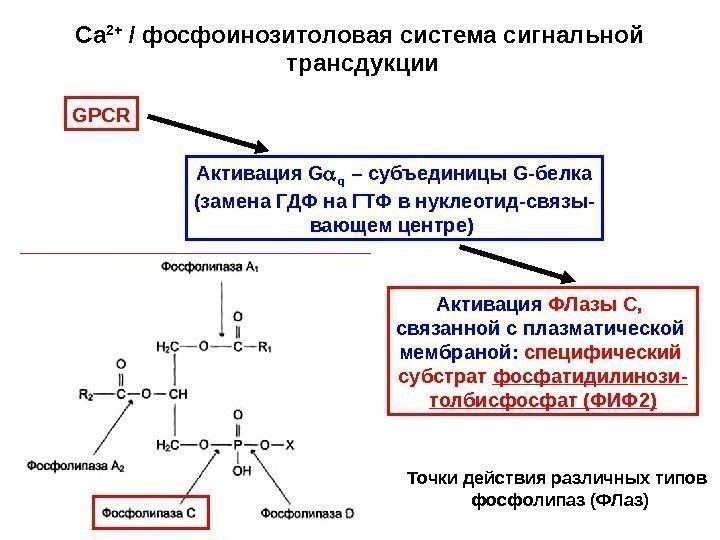
 Са 2+ / фосфоинозитоловая система сигнальной трансдукции GPCR Активация ФЛазы С связанной с плазматической мембраной: специфический субстрат фосфатидилинози- толбисфосфат (ФИФ 2) Точки действия различных типов фосфолипаз (ФЛаз)Активация G q – субъединицы G- белка (замена ГДФ на ГТФ в нуклеотид-связы- вающем центре)
Са 2+ / фосфоинозитоловая система сигнальной трансдукции GPCR Активация ФЛазы С связанной с плазматической мембраной: специфический субстрат фосфатидилинози- толбисфосфат (ФИФ 2) Точки действия различных типов фосфолипаз (ФЛаз)Активация G q – субъединицы G- белка (замена ГДФ на ГТФ в нуклеотид-связы- вающем центре)
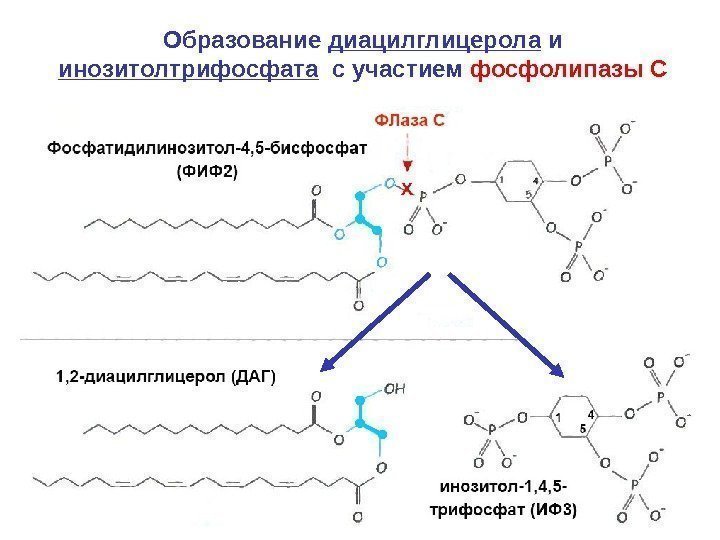
 Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С Х
Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С Х
 Липид-модифицирующие ферменты Внутренний слой цитоплазматической мембраны – компартмент, где с участием липид модифицирующих ферментов (связаных с мембраной) из инозитолфосфата (ИФ) образуются: 1. Вторичные мессенджеры липидной природы ( ДАГ и ИФ 3 ): образуются с участием ФЛазы С . 2. Другие биоактивные производные, фосфорилированные в позиции-3 по инозитолу, не являются вторичными мессенджерами. Образуются с участием фосфатидилинозитол-3 -киназы ( PI-3 K , ФИ-3 К ). Эти ферменты активируются в результате стимуляции соответ- ствующих мембранных рецепторов: ФЛазы С посредством GPCR ; ФИ-3 К – посредством рецепторов с тирозинкиназной активностью. Инозитолфосфат (ИФ) – «прародитель» всех этих производных и вторичных мессенджеров ( ДАГ и ИФ 3 ).
Липид-модифицирующие ферменты Внутренний слой цитоплазматической мембраны – компартмент, где с участием липид модифицирующих ферментов (связаных с мембраной) из инозитолфосфата (ИФ) образуются: 1. Вторичные мессенджеры липидной природы ( ДАГ и ИФ 3 ): образуются с участием ФЛазы С . 2. Другие биоактивные производные, фосфорилированные в позиции-3 по инозитолу, не являются вторичными мессенджерами. Образуются с участием фосфатидилинозитол-3 -киназы ( PI-3 K , ФИ-3 К ). Эти ферменты активируются в результате стимуляции соответ- ствующих мембранных рецепторов: ФЛазы С посредством GPCR ; ФИ-3 К – посредством рецепторов с тирозинкиназной активностью. Инозитолфосфат (ИФ) – «прародитель» всех этих производных и вторичных мессенджеров ( ДАГ и ИФ 3 ).
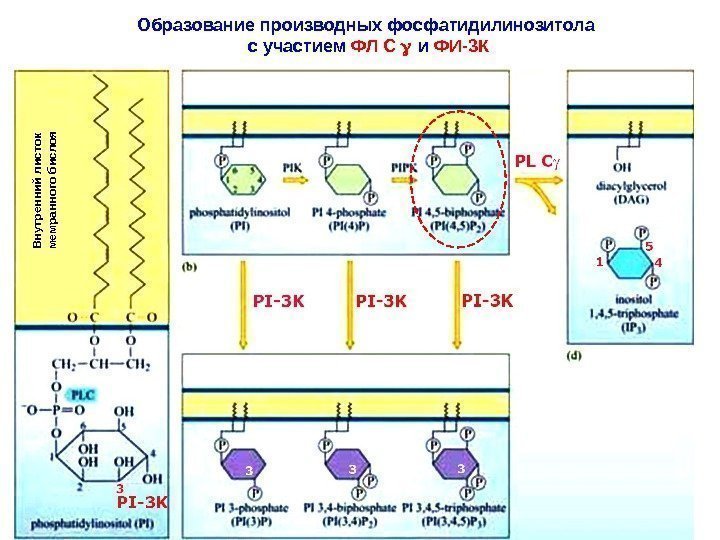
 Образование производных фосфатидилинозитола с участием ФЛ С и ФИ-3 КВнутренний листок мемранного бислоя
Образование производных фосфатидилинозитола с участием ФЛ С и ФИ-3 КВнутренний листок мемранного бислоя
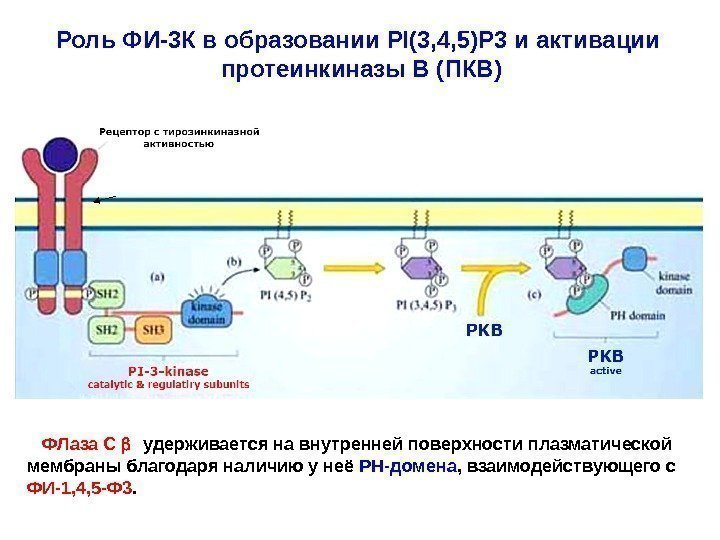
 Жирнокислотные цепи молекулы ИФ внедрены в цитозольный слой плазматической мембраны. Его инозитольное кольцо проеци-ровано в сторону цитозоля. С 3, С 4 и С 5 -атомы инозитольного кольца могут быть фосфорилированы липидными киназами (на-пример, ФИ-3 К). ФИ-3 -киназа активируется в мембране посредством рецептора с тирозинкиназной активностью ( РТК ). В результате, один из SH 2 -доменов регуляторной субъединицы киназы связывается с фос-фотирозином на цитозольном домене рецептора. Каталитическая субъединица ФИ-3 К фосфорилирует PI (4, 5) P 2 с образованием продукта — PI (3, 4, 5) P 3. Так создаются временные докинг-участки для различных белков, содержащих РН-домены. PI (3, 4, 5) P 3 приобретают способность связывать белки, содер-жащие РН-домен. Один из таких белков – серин-треониновая кина-за – ПКВ или Akt. Активное состояние ПКВ/ Akt – принципиально важно для обеспечение проведения сигналов, необходимых для выживания клетки (для противодействя апоптозу ).
Жирнокислотные цепи молекулы ИФ внедрены в цитозольный слой плазматической мембраны. Его инозитольное кольцо проеци-ровано в сторону цитозоля. С 3, С 4 и С 5 -атомы инозитольного кольца могут быть фосфорилированы липидными киназами (на-пример, ФИ-3 К). ФИ-3 -киназа активируется в мембране посредством рецептора с тирозинкиназной активностью ( РТК ). В результате, один из SH 2 -доменов регуляторной субъединицы киназы связывается с фос-фотирозином на цитозольном домене рецептора. Каталитическая субъединица ФИ-3 К фосфорилирует PI (4, 5) P 2 с образованием продукта — PI (3, 4, 5) P 3. Так создаются временные докинг-участки для различных белков, содержащих РН-домены. PI (3, 4, 5) P 3 приобретают способность связывать белки, содер-жащие РН-домен. Один из таких белков – серин-треониновая кина-за – ПКВ или Akt. Активное состояние ПКВ/ Akt – принципиально важно для обеспечение проведения сигналов, необходимых для выживания клетки (для противодействя апоптозу ).
 Роль ФИ-3 К в образовании PI(3, 4, 5)P 3 и активации протеинкиназы В (ПКВ) ФЛаза С удерживается на внутренней поверхности плазматической мембраны благодаря наличию у неё РН-домена , взаимодействующего с ФИ-1, 4, 5 -Ф 3.
Роль ФИ-3 К в образовании PI(3, 4, 5)P 3 и активации протеинкиназы В (ПКВ) ФЛаза С удерживается на внутренней поверхности плазматической мембраны благодаря наличию у неё РН-домена , взаимодействующего с ФИ-1, 4, 5 -Ф 3.
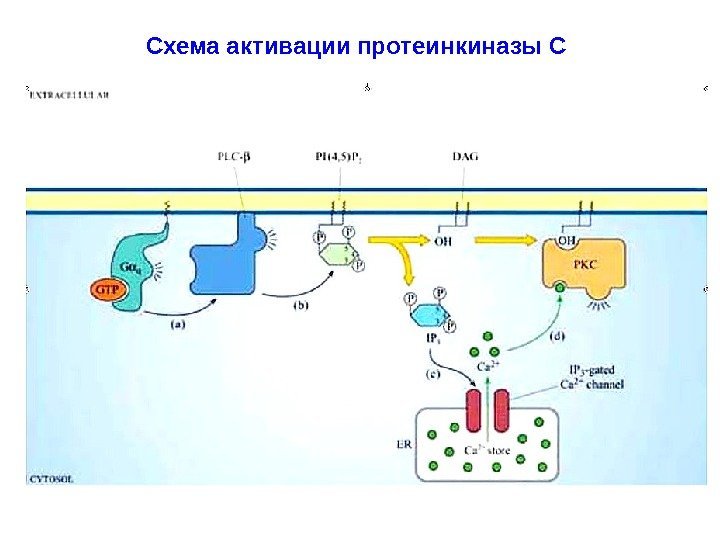
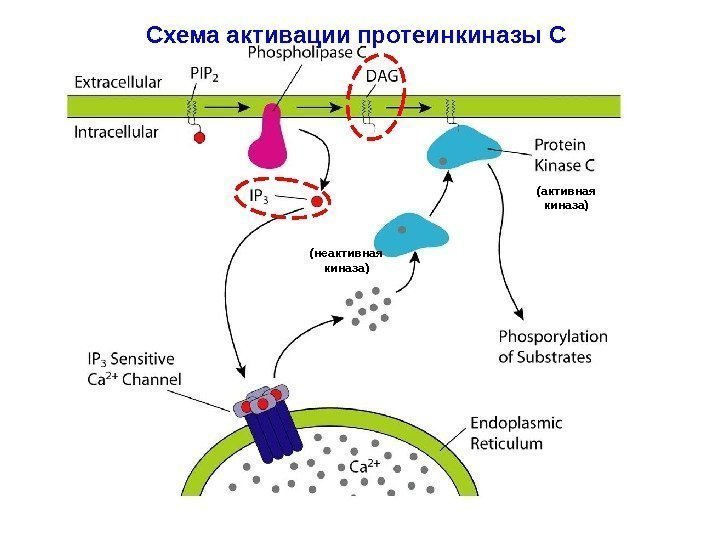
 Вторичные мессенджеры липидного происхождения: ДАГ и ИФ 3 Вторичный мессенджер: инозитол-1, 4, 5 -трифосфат (ИФ 3). Гидрофилен благодаря –q , которые сообщают ему три фосфо-рильные группы. Переходит в цитоплазму клетки и взаимодейст-вует с Са 2+ -каналами в мембране ЭР ( ИФ 3 -рецептор, ассоцииро-ванный с Са 2+ -каналом ), стимулируя выброс Са 2+ в цитоплазму. Увеличение концентрации Са 2+ способствует активации серин-треониновой протеинкиназы С (ПКС). Для поддержания кальциевого гомеостаза избыток Са 2+ уда-ляется. ИФ 3 дефосфорилируется цитозольными специфически-ми фосфатазами и отделяется от Са 2+ -каналов. Каналы закрыва-ются.
Вторичные мессенджеры липидного происхождения: ДАГ и ИФ 3 Вторичный мессенджер: инозитол-1, 4, 5 -трифосфат (ИФ 3). Гидрофилен благодаря –q , которые сообщают ему три фосфо-рильные группы. Переходит в цитоплазму клетки и взаимодейст-вует с Са 2+ -каналами в мембране ЭР ( ИФ 3 -рецептор, ассоцииро-ванный с Са 2+ -каналом ), стимулируя выброс Са 2+ в цитоплазму. Увеличение концентрации Са 2+ способствует активации серин-треониновой протеинкиназы С (ПКС). Для поддержания кальциевого гомеостаза избыток Са 2+ уда-ляется. ИФ 3 дефосфорилируется цитозольными специфически-ми фосфатазами и отделяется от Са 2+ -каналов. Каналы закрыва-ются.
 Вторичный мессенджер: 1, 2 -диацилглицерол (ДАГ). Молекула гидрофобна, в силу чего остается во внутреннем слое клеточной мембраны. Благодаря латеральной диффузии, ДАГ встречается с неактивной серин-треониновой ПКС , которая рекрутируется во внутренний слой мембраны из цитолазмы. ДАГ — единственный естественный активатор ПКС. Повышенная концентрация Са 2+ в цитоплазме приводит к свя-зыванию ионов с регуляторными субъединицами ПКС. Это сооб-щает молекуле фермента + q , что позволяет ПКС связываться с несущими –q головками ФС, выступающими над внутренней поверхностью плазматической мембраны. Т. о. , активация ПКС происходит на внутренней поверхности плазматической мембраны только под воздействием ДАГ в присутствии Са 2+ ( кооперативность эффектов ). Действие ИФ 3 и ДАГ являются синергичными – итог : активация ПКС.
Вторичный мессенджер: 1, 2 -диацилглицерол (ДАГ). Молекула гидрофобна, в силу чего остается во внутреннем слое клеточной мембраны. Благодаря латеральной диффузии, ДАГ встречается с неактивной серин-треониновой ПКС , которая рекрутируется во внутренний слой мембраны из цитолазмы. ДАГ — единственный естественный активатор ПКС. Повышенная концентрация Са 2+ в цитоплазме приводит к свя-зыванию ионов с регуляторными субъединицами ПКС. Это сооб-щает молекуле фермента + q , что позволяет ПКС связываться с несущими –q головками ФС, выступающими над внутренней поверхностью плазматической мембраны. Т. о. , активация ПКС происходит на внутренней поверхности плазматической мембраны только под воздействием ДАГ в присутствии Са 2+ ( кооперативность эффектов ). Действие ИФ 3 и ДАГ являются синергичными – итог : активация ПКС.
 Схема активации протеинкиназы С
Схема активации протеинкиназы С
 Схема активации протеинкиназы С (неактивная киназа) (активная киназа)
Схема активации протеинкиназы С (неактивная киназа) (активная киназа)
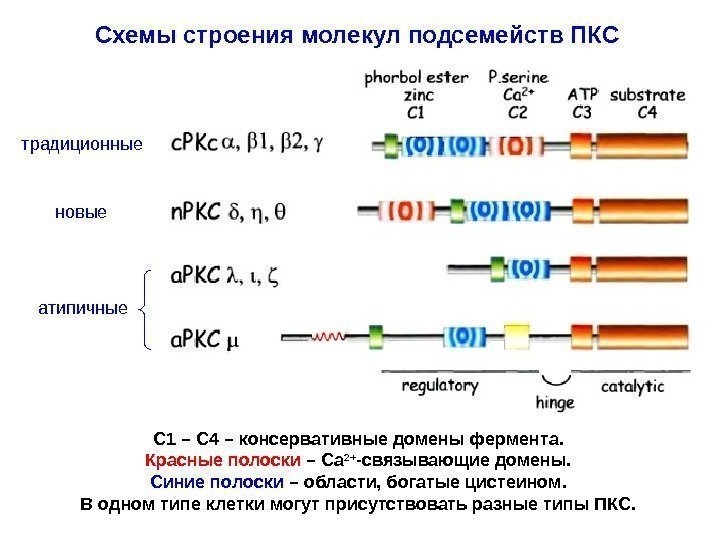
 Структура и свойства ПКС Фермент является мономером с массой 77 к. Да. Полипептидная цепь включает 670 -690 аминокислотных остатков. Состоит из 2 -х компактных доменов: 1. Регуляторный домен – гидрофобен, располагается ближе к N-концу цепи. Тут имеются сайты для связывания Са 2+ и ДАГ. 2. Каталитический (киназный) домен — более гидрофилен, находится на С-конце полипептидной цепи. Для ПКС характерен длительный период активности , кото-рая сохраняется, даже если первоначальный сигнал пропал или снизилась [ Ca 2+ ]. Причина – постоянное образование дополни — тельного ДАГ из ФХ с участием ФЛазы С. ПКС делят на три подсемейства в зависимости от сходства первичной структуры (доменов) и способу активации : а). Классические формы ПКС (активируются ДАГ и Са 2+ , нуждается в ФС , активируются форболовыми эфирами ). Изоформы : . б). Новые формы ПКС ( активируются ДАГ , нуждается в ФС , но независимы от Са 2+ ). Изоформы : в). Атипичные формы ПКС ( нуждается в ФС, но не чувствитель-ны к ДАГ и Са 2+ ). Изоформы :
Структура и свойства ПКС Фермент является мономером с массой 77 к. Да. Полипептидная цепь включает 670 -690 аминокислотных остатков. Состоит из 2 -х компактных доменов: 1. Регуляторный домен – гидрофобен, располагается ближе к N-концу цепи. Тут имеются сайты для связывания Са 2+ и ДАГ. 2. Каталитический (киназный) домен — более гидрофилен, находится на С-конце полипептидной цепи. Для ПКС характерен длительный период активности , кото-рая сохраняется, даже если первоначальный сигнал пропал или снизилась [ Ca 2+ ]. Причина – постоянное образование дополни — тельного ДАГ из ФХ с участием ФЛазы С. ПКС делят на три подсемейства в зависимости от сходства первичной структуры (доменов) и способу активации : а). Классические формы ПКС (активируются ДАГ и Са 2+ , нуждается в ФС , активируются форболовыми эфирами ). Изоформы : . б). Новые формы ПКС ( активируются ДАГ , нуждается в ФС , но независимы от Са 2+ ). Изоформы : в). Атипичные формы ПКС ( нуждается в ФС, но не чувствитель-ны к ДАГ и Са 2+ ). Изоформы :
 Схемы строения молекул подсемейств ПКС C 1 – C 4 – консервативные домены фермента. Красные полоски – Са 2+ -связывающие домены. Синие полоски – области, богатые цистеином. В одном типе клетки могут присутствовать разные типы ПКС. традиционные новые атипичные
Схемы строения молекул подсемейств ПКС C 1 – C 4 – консервативные домены фермента. Красные полоски – Са 2+ -связывающие домены. Синие полоски – области, богатые цистеином. В одном типе клетки могут присутствовать разные типы ПКС. традиционные новые атипичные
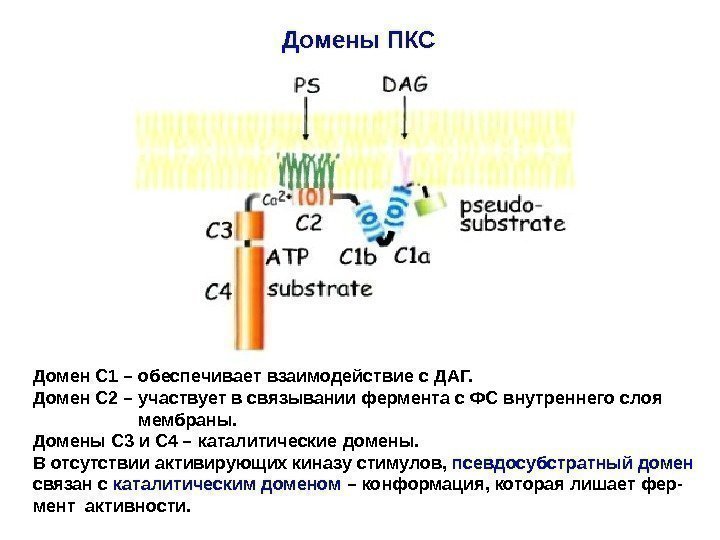
 Домены ПКС Домен С 1 – обеспечивает взаимодействие с ДАГ. Домен С 2 – участвует в связывании фермента с ФС внутреннего слоя мембраны. Домены С 3 и С 4 – каталитические домены. В отсутствии активирующих киназу стимулов, псевдосубстратный домен связан с каталитическим доменом – конформация, которая лишает фер- мент активности.
Домены ПКС Домен С 1 – обеспечивает взаимодействие с ДАГ. Домен С 2 – участвует в связывании фермента с ФС внутреннего слоя мембраны. Домены С 3 и С 4 – каталитические домены. В отсутствии активирующих киназу стимулов, псевдосубстратный домен связан с каталитическим доменом – конформация, которая лишает фер- мент активности.
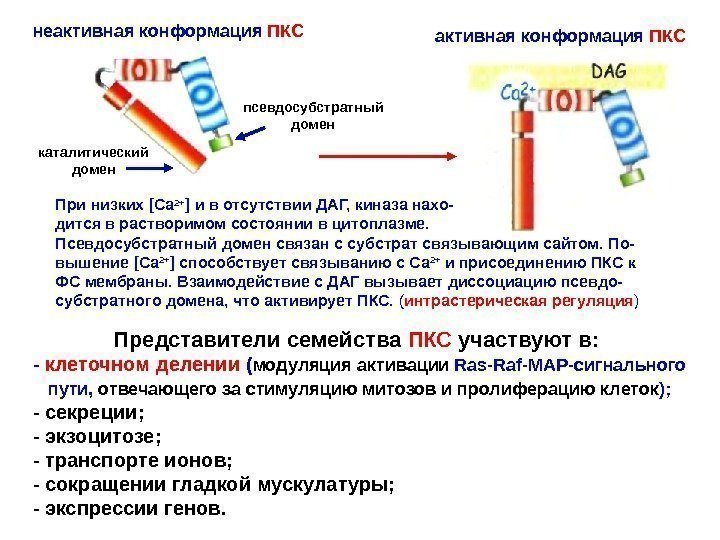
 Представители семейства ПКС участвуют в: — клеточном делении ( модуляция активации Ras-Raf-MAP- сигнального пути, отвечающего за стимуляцию митозов и пролиферацию клеток ); — секреции; — экзоцитозе; — транспорте ионов; — сокращении гладкой мускулатуры; — экспрессии генов. неактивная конформация ПКС псевдосубстратный домен каталитический домен При низких [Ca 2+ ] и в отсутствии ДАГ, киназа нахо- дится в растворимом состоянии в цитоплазме. Псевдосубстратный домен связан с субстрат связывающим сайтом. По- вышение [Ca 2+ ] способствует связыванию с Са 2+ и присоединению ПКС к ФС мембраны. Взаимодействие с ДАГ вызывает диссоциацию псевдо- субстратного домена, что активирует ПКС. ( интрастерическая регуляция )
Представители семейства ПКС участвуют в: — клеточном делении ( модуляция активации Ras-Raf-MAP- сигнального пути, отвечающего за стимуляцию митозов и пролиферацию клеток ); — секреции; — экзоцитозе; — транспорте ионов; — сокращении гладкой мускулатуры; — экспрессии генов. неактивная конформация ПКС псевдосубстратный домен каталитический домен При низких [Ca 2+ ] и в отсутствии ДАГ, киназа нахо- дится в растворимом состоянии в цитоплазме. Псевдосубстратный домен связан с субстрат связывающим сайтом. По- вышение [Ca 2+ ] способствует связыванию с Са 2+ и присоединению ПКС к ФС мембраны. Взаимодействие с ДАГ вызывает диссоциацию псевдо- субстратного домена, что активирует ПКС. ( интрастерическая регуляция )
 Одна из изоформ атипичной ПКС ( ПКС- спосо бна запускать сигнальный путь, опосредуемый ядерным транскрипционным фактором k B ( NFk. B ). NFk. B присутствет во всех клетках организма человека и животных. NF k B – активирует экспрессию 100 – 300 генов, кодирующих белки, участвующие в регуляции клеточной пролиферации, апо- птоза, воспалительной и аутоиммунной реакций и др. NF k B – гетеродимер (белки р50 и р65 ). В покоящейся клетке NF k B находится в цитоплазме в неактивной форме: комплекс р50 / р65 / I k B ( I k B – ингибирующий белок). Под действием ПКС- а а а а а IKK ( IκB kinase ). IKK фосфорилирует ингибитор Ik. B , который сразу же покидает гетеродимер и NF k B становится активным транскрипционным фактором. Сигнальный путь, опосредуемый NF k B , срабатывает в течение считанных минут , поскольку не требует синтеза белка de novo : транскрипционный фактор всегда присутствует в цитоплазме (в неактивной форме). Такой срочный ответ необходим для своевре- менной реакции клетки на воздейстиве патогенного или повре- ждающего фактора.
Одна из изоформ атипичной ПКС ( ПКС- спосо бна запускать сигнальный путь, опосредуемый ядерным транскрипционным фактором k B ( NFk. B ). NFk. B присутствет во всех клетках организма человека и животных. NF k B – активирует экспрессию 100 – 300 генов, кодирующих белки, участвующие в регуляции клеточной пролиферации, апо- птоза, воспалительной и аутоиммунной реакций и др. NF k B – гетеродимер (белки р50 и р65 ). В покоящейся клетке NF k B находится в цитоплазме в неактивной форме: комплекс р50 / р65 / I k B ( I k B – ингибирующий белок). Под действием ПКС- а а а а а IKK ( IκB kinase ). IKK фосфорилирует ингибитор Ik. B , который сразу же покидает гетеродимер и NF k B становится активным транскрипционным фактором. Сигнальный путь, опосредуемый NF k B , срабатывает в течение считанных минут , поскольку не требует синтеза белка de novo : транскрипционный фактор всегда присутствует в цитоплазме (в неактивной форме). Такой срочный ответ необходим для своевре- менной реакции клетки на воздейстиве патогенного или повре- ждающего фактора.
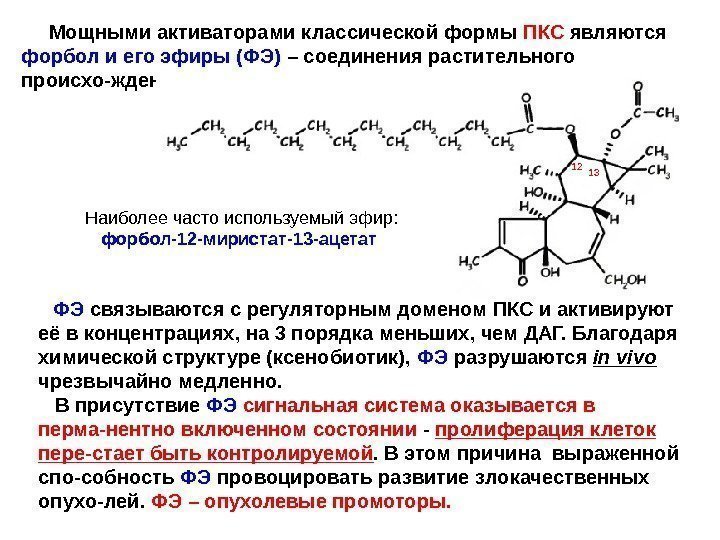
 Мощными активаторами классической формы ПКС являются форбол и его эфиры (ФЭ) – соединения растительного происхо-ждения. Наиболее часто используемый эфир: форбол-12 -миристат-13 -ацетат ФЭ связываются с регуляторным доменом ПКС и активируют её в концентрациях, на 3 порядка меньших, чем ДАГ. Благодаря химической структуре (ксенобиотик), ФЭ разрушаются in vivo чрезвычайно медленно. В присутствие ФЭ сигнальная система оказывается в перма-нентно включенном состоянии — пролиферация клеток пере-стает быть контролируемой. В этом причина выраженной спо-собность ФЭ провоцировать развитие злокачественных опухо-лей. ФЭ – опухолевые промоторы.
Мощными активаторами классической формы ПКС являются форбол и его эфиры (ФЭ) – соединения растительного происхо-ждения. Наиболее часто используемый эфир: форбол-12 -миристат-13 -ацетат ФЭ связываются с регуляторным доменом ПКС и активируют её в концентрациях, на 3 порядка меньших, чем ДАГ. Благодаря химической структуре (ксенобиотик), ФЭ разрушаются in vivo чрезвычайно медленно. В присутствие ФЭ сигнальная система оказывается в перма-нентно включенном состоянии — пролиферация клеток пере-стает быть контролируемой. В этом причина выраженной спо-собность ФЭ провоцировать развитие злокачественных опухо-лей. ФЭ – опухолевые промоторы.
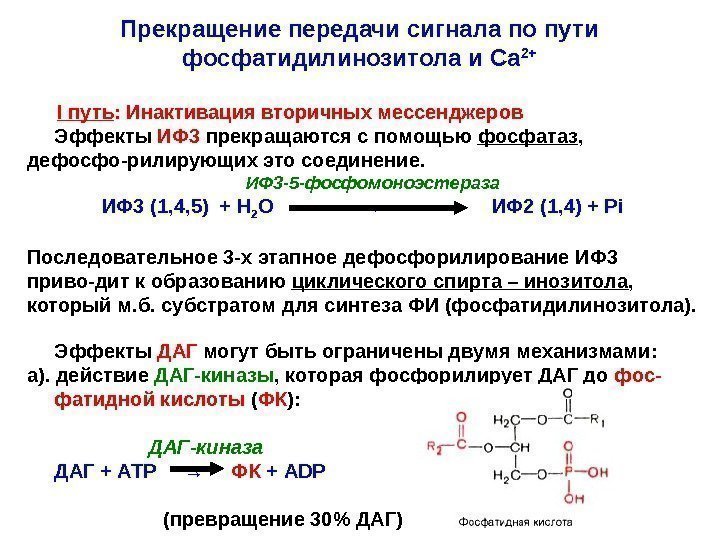
 Прекращение передачи сигнала по пути фосфатидилинозитола и Са 2+ I путь : Инактивация вторичных мессенджеров Эффекты ИФ 3 прекращаются с помощью фосфатаз , дефосфо-рилирующих это соединение. ИФ 3 -5 -фосфомоноэстераза ИФ 3 (1, 4, 5) + Н 2 О → ИФ 2 (1, 4) + Рi Последовательное 3 -х этапное дефосфорилирование ИФ 3 приво-дит к образованию циклического спирта – инозитола , который м. б. субстратом для синтеза ФИ (фосфатидилинозитола). Эффекты ДАГ могут быть ограничены двумя механизмами: а). действие ДАГ-киназы , которая фосфорилирует ДАГ до фос- фатидной кислоты ( ФК ): ДАГ-киназа ДАГ + АТР → ФК + ADP (превращение 30% ДАГ)
Прекращение передачи сигнала по пути фосфатидилинозитола и Са 2+ I путь : Инактивация вторичных мессенджеров Эффекты ИФ 3 прекращаются с помощью фосфатаз , дефосфо-рилирующих это соединение. ИФ 3 -5 -фосфомоноэстераза ИФ 3 (1, 4, 5) + Н 2 О → ИФ 2 (1, 4) + Рi Последовательное 3 -х этапное дефосфорилирование ИФ 3 приво-дит к образованию циклического спирта – инозитола , который м. б. субстратом для синтеза ФИ (фосфатидилинозитола). Эффекты ДАГ могут быть ограничены двумя механизмами: а). действие ДАГ-киназы , которая фосфорилирует ДАГ до фос- фатидной кислоты ( ФК ): ДАГ-киназа ДАГ + АТР → ФК + ADP (превращение 30% ДАГ)
 б). Действие ДАГ-липазы — гидролиз мессенджера с отщеплением арахидоновой кислоты: ДАГ-липаза ДАГ + Н 2 О 2 -арахидоноил-глицерол + R 1 -СООН (жирная к-та) На следующем этапе происходит расщепление 2 -арахидоноил-глицерола на арахидоновую кислоту и глицерол. ФК участвует во многих процессах: * предшественник синтеза многих липидов; * локально усиливает кривизну мембраны – участие в эндо- и экзоцитозе ; * участвует во внутриклеточной сигнализации , рекрутируя из цитоплазмы некоторые белки (сфингозинкиназу). Арахидоновая кислота и ее производные формируют отдель-ную группу сигнальных молекул : простагландинов , лейкотриенов и тромбоксанов. II путь : Дефосфорилирование эффекторного белка протеинки- назы С. С участием специфических фосфатаз (протеинфосфатаз).
б). Действие ДАГ-липазы — гидролиз мессенджера с отщеплением арахидоновой кислоты: ДАГ-липаза ДАГ + Н 2 О 2 -арахидоноил-глицерол + R 1 -СООН (жирная к-та) На следующем этапе происходит расщепление 2 -арахидоноил-глицерола на арахидоновую кислоту и глицерол. ФК участвует во многих процессах: * предшественник синтеза многих липидов; * локально усиливает кривизну мембраны – участие в эндо- и экзоцитозе ; * участвует во внутриклеточной сигнализации , рекрутируя из цитоплазмы некоторые белки (сфингозинкиназу). Арахидоновая кислота и ее производные формируют отдель-ную группу сигнальных молекул : простагландинов , лейкотриенов и тромбоксанов. II путь : Дефосфорилирование эффекторного белка протеинки- назы С. С участием специфических фосфатаз (протеинфосфатаз).
 Благодарю за внимание
Благодарю за внимание

