общ. хим. 2_Osnovnye_khimicheskie_zakony.ppt
- Количество слайдов: 14
 Основные законы и количественные закономерности химии Лекция 2 по курсу «Общая химия»
Основные законы и количественные закономерности химии Лекция 2 по курсу «Общая химия»
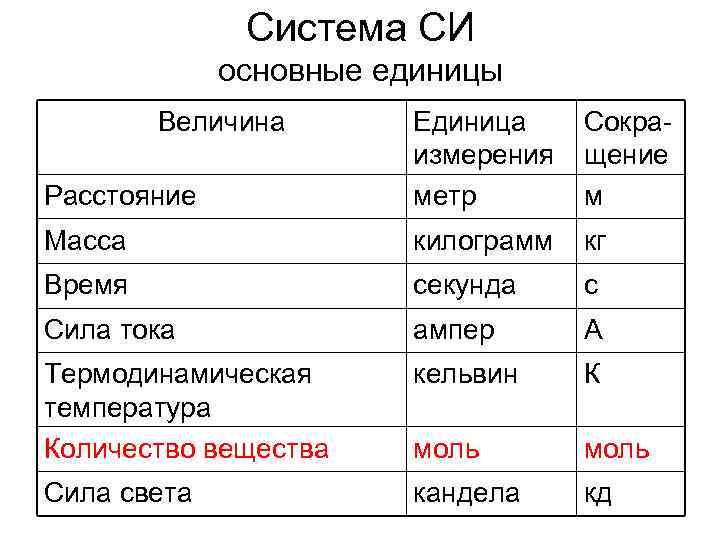 Система СИ основные единицы Величина Расстояние Единица измерения метр Сокращение м Масса килограмм кг Время секунда с Сила тока ампер А Термодинамическая температура Количество вещества кельвин К моль Сила света кандела кд
Система СИ основные единицы Величина Расстояние Единица измерения метр Сокращение м Масса килограмм кг Время секунда с Сила тока ампер А Термодинамическая температура Количество вещества кельвин К моль Сила света кандела кд
 Система СИ некоторые производные единицы Величина Выражение Давление Единица измерения Паскаль (Па) Сила Ньютон (Н) кг·м/с2 Частота Герц (Гц) 1/с Электрический Кулон (кл) заряд Электродвижущая Вольт (В) сила Энергия Джоуль (Дж) кг/(м·с2) А·с кг·м 2/(с3·А) кг·м 2/с2
Система СИ некоторые производные единицы Величина Выражение Давление Единица измерения Паскаль (Па) Сила Ньютон (Н) кг·м/с2 Частота Герц (Гц) 1/с Электрический Кулон (кл) заряд Электродвижущая Вольт (В) сила Энергия Джоуль (Дж) кг/(м·с2) А·с кг·м 2/(с3·А) кг·м 2/с2
 Моль Количество вещества, содержащее столько структурных единиц, сколько атомов содержится в 12 г чистого нуклида 126 С (6. 02· 1023 – число Авогадро) В химии главная единица измерения для вещества – не килограмм, а моль! Атомная единица массы (а. е. м. ): 1/12 массы атома нуклида 126 С Mr = M
Моль Количество вещества, содержащее столько структурных единиц, сколько атомов содержится в 12 г чистого нуклида 126 С (6. 02· 1023 – число Авогадро) В химии главная единица измерения для вещества – не килограмм, а моль! Атомная единица массы (а. е. м. ): 1/12 массы атома нуклида 126 С Mr = M
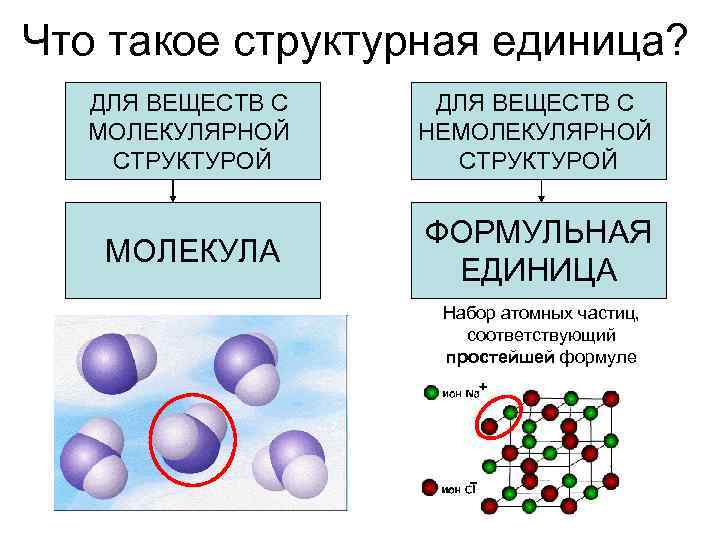 Что такое структурная единица? ДЛЯ ВЕЩЕСТВ С МОЛЕКУЛЯРНОЙ СТРУКТУРОЙ ДЛЯ ВЕЩЕСТВ С НЕМОЛЕКУЛЯРНОЙ СТРУКТУРОЙ МОЛЕКУЛА ФОРМУЛЬНАЯ ЕДИНИЦА Набор атомных частиц, соответствующий простейшей формуле
Что такое структурная единица? ДЛЯ ВЕЩЕСТВ С МОЛЕКУЛЯРНОЙ СТРУКТУРОЙ ДЛЯ ВЕЩЕСТВ С НЕМОЛЕКУЛЯРНОЙ СТРУКТУРОЙ МОЛЕКУЛА ФОРМУЛЬНАЯ ЕДИНИЦА Набор атомных частиц, соответствующий простейшей формуле
 Закон сохранения массы М. В. Ломоносов 1756 г А. -Л. Лавуазье 1773 г Масса веществ, вступивших в химическую реакцию, равна массе ее продуктов Не только для вещества в целом, но и для отдельных видов атомов!
Закон сохранения массы М. В. Ломоносов 1756 г А. -Л. Лавуазье 1773 г Масса веществ, вступивших в химическую реакцию, равна массе ее продуктов Не только для вещества в целом, но и для отдельных видов атомов!
 Взаимосвязь массы и энергии E = mc 2, где c – скорость света c = 2, 99792458· 108 м/с Химические реакции: E = 100 – 3000 к. Дж/моль m не более 10– 7 г А. Эйнштейн ДЕФЕКТ МАССЫ + + 1. 007825 = 1. 008665 2. 01649 + 2. 014102 m = 0. 002388 а. е. м. E = 2. 15· 1012 к. Дж/моль
Взаимосвязь массы и энергии E = mc 2, где c – скорость света c = 2, 99792458· 108 м/с Химические реакции: E = 100 – 3000 к. Дж/моль m не более 10– 7 г А. Эйнштейн ДЕФЕКТ МАССЫ + + 1. 007825 = 1. 008665 2. 01649 + 2. 014102 m = 0. 002388 а. е. м. E = 2. 15· 1012 к. Дж/моль
 Закон постоянства состава Ж. Л. Пруст Д. Дальтон К. Л. Бертолле Состав данного вещества всегда один и тот же, он не зависит от способа получения МОЛЕКУЛЯРНАЯ СТРУКТУРА НЕМОЛЕКУЛЯРНАЯ СТРУКТУРА Верно для любых веществ ДАЛЬТОНИДЫ В общем случае неверно БЕРТОЛЛИДЫ
Закон постоянства состава Ж. Л. Пруст Д. Дальтон К. Л. Бертолле Состав данного вещества всегда один и тот же, он не зависит от способа получения МОЛЕКУЛЯРНАЯ СТРУКТУРА НЕМОЛЕКУЛЯРНАЯ СТРУКТУРА Верно для любых веществ ДАЛЬТОНИДЫ В общем случае неверно БЕРТОЛЛИДЫ
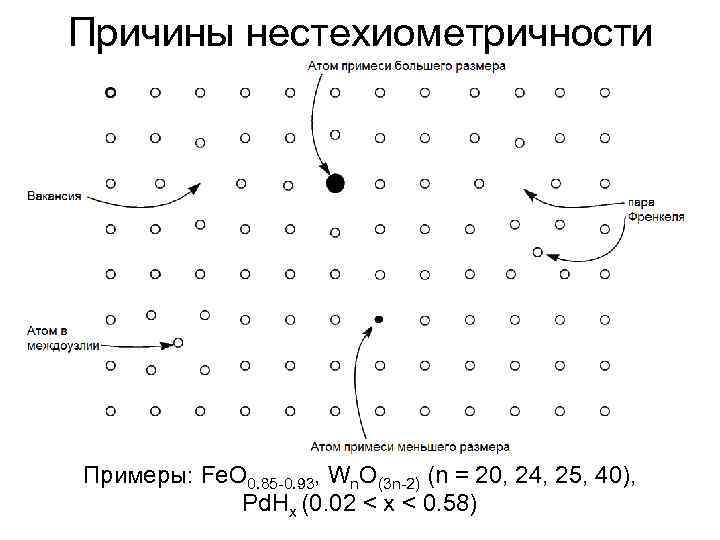 Причины нестехиометричности Примеры: Fe. O 0. 85 -0. 93, Wn. O(3 n-2) (n = 20, 24, 25, 40), Pd. Hx (0. 02 < x < 0. 58)
Причины нестехиометричности Примеры: Fe. O 0. 85 -0. 93, Wn. O(3 n-2) (n = 20, 24, 25, 40), Pd. Hx (0. 02 < x < 0. 58)
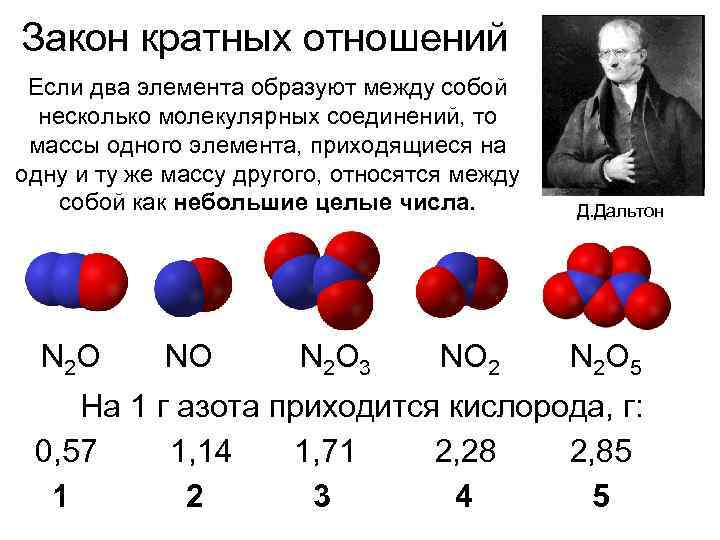 Закон кратных отношений Если два элемента образуют между собой несколько молекулярных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа. N 2 O NO N 2 O 3 NO 2 Д. Дальтон N 2 O 5 На 1 г азота приходится кислорода, г: 0, 57 1, 14 1, 71 2, 28 2, 85 1 2 3 4 5
Закон кратных отношений Если два элемента образуют между собой несколько молекулярных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа. N 2 O NO N 2 O 3 NO 2 Д. Дальтон N 2 O 5 На 1 г азота приходится кислорода, г: 0, 57 1, 14 1, 71 2, 28 2, 85 1 2 3 4 5
 Закон эквивалентов Эквивалент – химическое количество вещества, которое взаимодействует с 1 моль атомов H или замещает его в ходе реакции. Ca + 2 HCl = Ca. Cl 2 + H 2 1 моль Ca замещает 2 моль атомов H х моль Ca замещает 1 моль атомов H х = 0. 5 моль Вещества взаимодействуют в количествах, пропорциональных их эквивалентам Эквивалент может быть переменным!
Закон эквивалентов Эквивалент – химическое количество вещества, которое взаимодействует с 1 моль атомов H или замещает его в ходе реакции. Ca + 2 HCl = Ca. Cl 2 + H 2 1 моль Ca замещает 2 моль атомов H х моль Ca замещает 1 моль атомов H х = 0. 5 моль Вещества взаимодействуют в количествах, пропорциональных их эквивалентам Эквивалент может быть переменным!
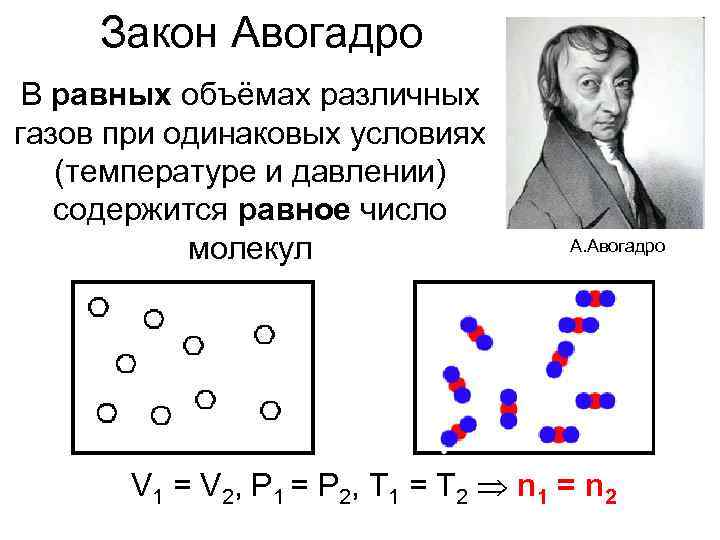 Закон Авогадро В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится равное число молекул А. Авогадро V 1 = V 2, P 1 = P 2, T 1 = T 2 n 1 = n 2
Закон Авогадро В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится равное число молекул А. Авогадро V 1 = V 2, P 1 = P 2, T 1 = T 2 n 1 = n 2
 Идеальный газ • Молекулы – материальные точки • Движутся хаотически • Отсутствует межмолекулярное взаимодействие • Только упругие столкновения Подчиняется газовым законам Для данной массы газа: Закон Бойля-Мариотта: PV = const при T = const Закон Гей-Люссака: V пропорционален T при Р = const Закон Шарля: P пропорционально T при V = const Закон Дальтона: P = Pi, где Pi – парциальные давления индивидуальных газов, входящих в состав смеси
Идеальный газ • Молекулы – материальные точки • Движутся хаотически • Отсутствует межмолекулярное взаимодействие • Только упругие столкновения Подчиняется газовым законам Для данной массы газа: Закон Бойля-Мариотта: PV = const при T = const Закон Гей-Люссака: V пропорционален T при Р = const Закон Шарля: P пропорционально T при V = const Закон Дальтона: P = Pi, где Pi – парциальные давления индивидуальных газов, входящих в состав смеси
 Объединенный газовый закон P 1 V 1/T 1 = P 2 V 2/T 2 или PV = n. RT (R = 8, 314 Дж/моль·К) Уравнение Клапейрона. Менделеева Б. П. Э. Клапейрон Д. И. Менделеев Нормальные условия: P = 1, 013· 105 Па, T = 273 K Для n = 1 моль V = 22, 4 дм 3 При других условиях молярный объем другой!
Объединенный газовый закон P 1 V 1/T 1 = P 2 V 2/T 2 или PV = n. RT (R = 8, 314 Дж/моль·К) Уравнение Клапейрона. Менделеева Б. П. Э. Клапейрон Д. И. Менделеев Нормальные условия: P = 1, 013· 105 Па, T = 273 K Для n = 1 моль V = 22, 4 дм 3 При других условиях молярный объем другой!


