 Основные термодинамические процессы
Основные термодинамические процессы
 Классификация термодинамических процессов n n Изохорный – при постоянном объеме; Изобарный – при постоянном давлении; Изотермический – при постоянной температуре; Адиабатный – при отсутствии теплообмена между рабочим телом и окружающей средой.
Классификация термодинамических процессов n n Изохорный – при постоянном объеме; Изобарный – при постоянном давлении; Изотермический – при постоянной температуре; Адиабатный – при отсутствии теплообмена между рабочим телом и окружающей средой.
 Изохорный процесс v=const n n Все тепло, подводимое к системе идет на изменение внутренней энергии системы. Уравнение процесса: Работа: Lv = 0 Теплота: Qv = ∆Uv =Mcv(T 2 – T 1)
Изохорный процесс v=const n n Все тепло, подводимое к системе идет на изменение внутренней энергии системы. Уравнение процесса: Работа: Lv = 0 Теплота: Qv = ∆Uv =Mcv(T 2 – T 1)
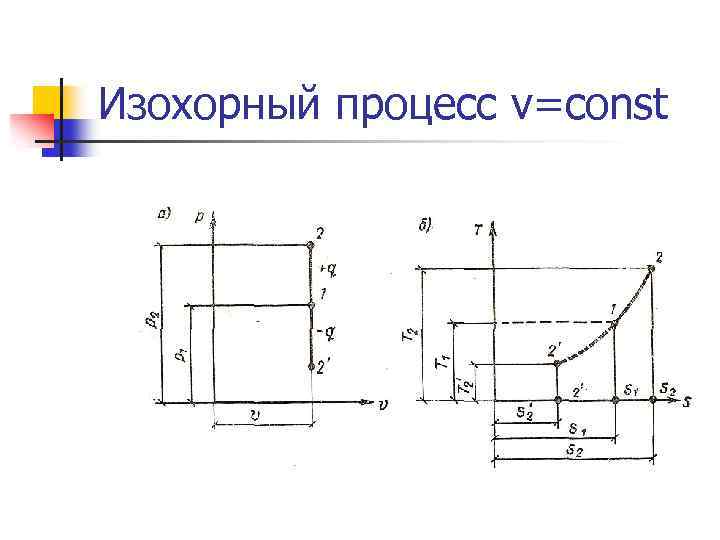 Изохорный процесс v=const
Изохорный процесс v=const
 Изобарный процесс p=const n Теплота, сообщаемая системе, увеличивает её энтальпию. n Уравнение процесса: n Работа: Lp = p(V 2 – V 1) n Теплота: Qp =Mcp(T 2 – T 1) n Изменение внутренней энергии: ∆Up = Qp - Lp
Изобарный процесс p=const n Теплота, сообщаемая системе, увеличивает её энтальпию. n Уравнение процесса: n Работа: Lp = p(V 2 – V 1) n Теплота: Qp =Mcp(T 2 – T 1) n Изменение внутренней энергии: ∆Up = Qp - Lp
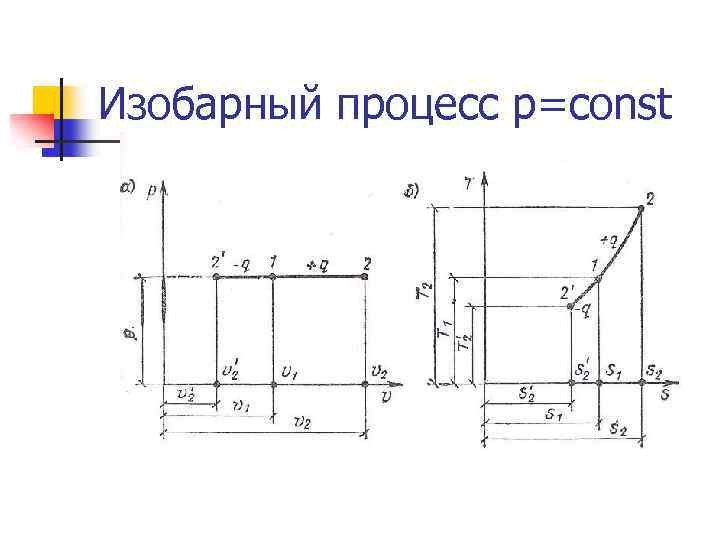 Изобарный процесс p=const
Изобарный процесс p=const
 Изотермический процесс T=const n Теплота, сообщаемая системе, тратится на совершение внешней работы. n Уравнение процесса: n Теплота: Qp = LT = RT ln(V 2/V 1) n Изменение внутренней энергии: ∆UT = 0
Изотермический процесс T=const n Теплота, сообщаемая системе, тратится на совершение внешней работы. n Уравнение процесса: n Теплота: Qp = LT = RT ln(V 2/V 1) n Изменение внутренней энергии: ∆UT = 0
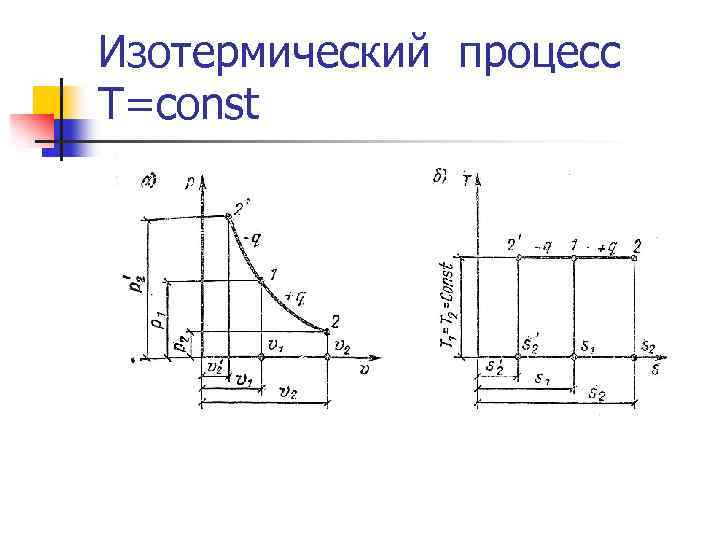 Изотермический процесс T=const
Изотермический процесс T=const
 Адиабатный процесс n Внешняя работа совершается рабочим телом за счет изменения его внутренней энергии. n Уравнение процесса: n Работа: LS = - ∆US n Теплота: QS = 0
Адиабатный процесс n Внешняя работа совершается рабочим телом за счет изменения его внутренней энергии. n Уравнение процесса: n Работа: LS = - ∆US n Теплота: QS = 0
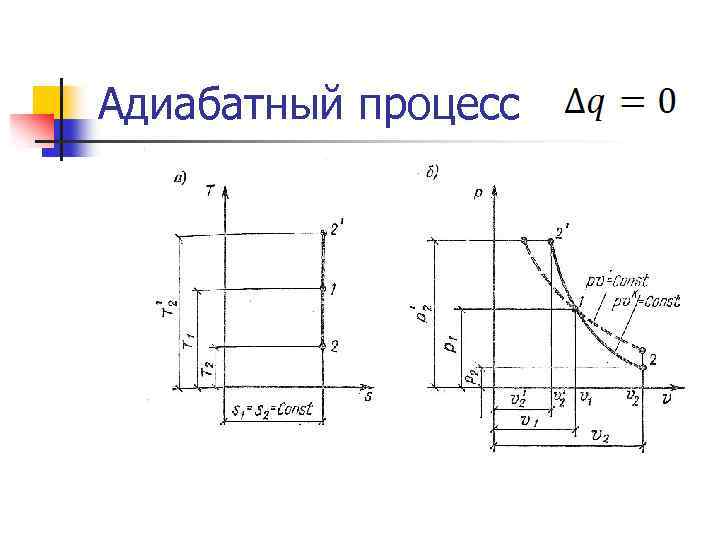 Адиабатный процесс
Адиабатный процесс
 Политропный процесс n n n Все процессы – частный случай политропного. Изохорный – Изобарный – Изотермический – Адиабатный -
Политропный процесс n n n Все процессы – частный случай политропного. Изохорный – Изобарный – Изотермический – Адиабатный -
 Политропный процесс n Уравнение процесса: Первый закон термодинамики: Теплоемкость: Изменение внутренней энергии: Работа: n Энтропия: n Энтальпия: n n
Политропный процесс n Уравнение процесса: Первый закон термодинамики: Теплоемкость: Изменение внутренней энергии: Работа: n Энтропия: n Энтальпия: n n
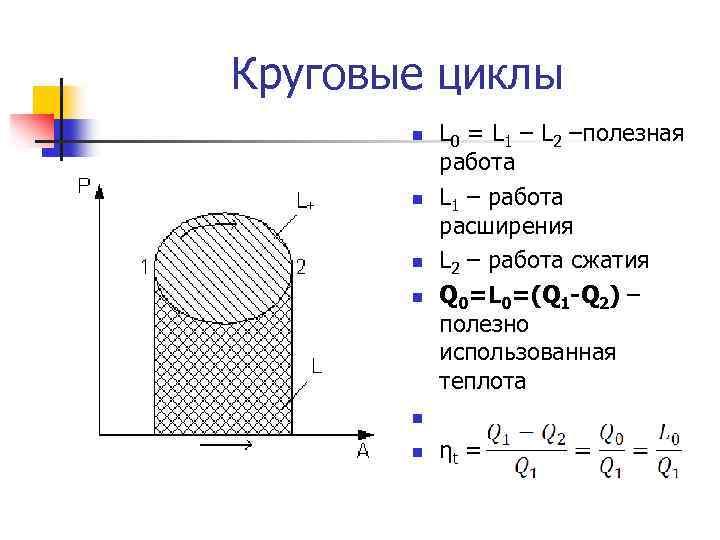 Круговые циклы n n n L 0 = L 1 – L 2 –полезная работа L 1 – работа расширения L 2 – работа сжатия Q 0=L 0=(Q 1 -Q 2) – полезно использованная теплота ηt =
Круговые циклы n n n L 0 = L 1 – L 2 –полезная работа L 1 – работа расширения L 2 – работа сжатия Q 0=L 0=(Q 1 -Q 2) – полезно использованная теплота ηt =
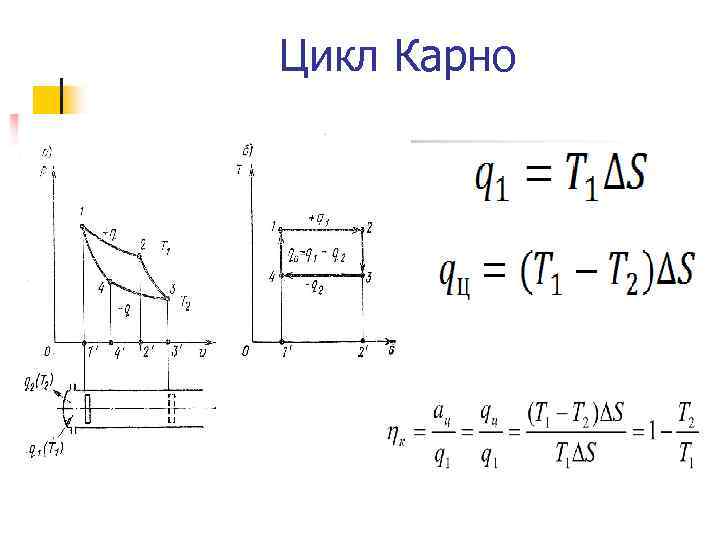 Цикл Карно
Цикл Карно