Catalysis by metals-1c.ppt
- Количество слайдов: 27
 Основные реакции, катализируемые металлами Катализ металлами ä H – D обмен (W, Pt, Rh) ä Гидрирование - дегидрирование (Ru, Pd, Pt, Ni) ä Ароматизация углеводородов (Pt) ä Изомеризация двойной связи (Pd) ä Скелетная изомеризация (Pt) ä Гидрогенолиз C-C, C-O, C-S, C-N связей (Pt, Pd, Re, Mo, Ru, Os, Rh) ä Гидрирование СО 3 до углеводородов (Fe, Co, Ru) 3 до метана (Ni, Co) 3 до метанола (Pd, Rh) ä Синтез аммиака (Fe, Ru) ä Окисление (Pt, Pd, Rh, Ag) Catalysis by metals. ppt 1
Основные реакции, катализируемые металлами Катализ металлами ä H – D обмен (W, Pt, Rh) ä Гидрирование - дегидрирование (Ru, Pd, Pt, Ni) ä Ароматизация углеводородов (Pt) ä Изомеризация двойной связи (Pd) ä Скелетная изомеризация (Pt) ä Гидрогенолиз C-C, C-O, C-S, C-N связей (Pt, Pd, Re, Mo, Ru, Os, Rh) ä Гидрирование СО 3 до углеводородов (Fe, Co, Ru) 3 до метана (Ni, Co) 3 до метанола (Pd, Rh) ä Синтез аммиака (Fe, Ru) ä Окисление (Pt, Pd, Rh, Ag) Catalysis by metals. ppt 1
 Примеры промышленных процессов на металлических катализаторах Катализ металлами 1. Гидрирование жиров (триглицеридов олеиновой, линоленовой кислот) Ni/диатомит; Ni Ренея, 150 -200 о. С 2. Гидрирование ацетиленов: – в этилене – во фракции С 4 0. 04%Pd/Al 2 O 3 (20 м 2/г); 60 -70 о. С 5000 млн. долей ® 5 млн. долей 3. Гидрирование бензола в циклогексан Ni/Al 2 O 3; 150 -200 o. C; 30 -50 атм Catalysis by metals. ppt 2
Примеры промышленных процессов на металлических катализаторах Катализ металлами 1. Гидрирование жиров (триглицеридов олеиновой, линоленовой кислот) Ni/диатомит; Ni Ренея, 150 -200 о. С 2. Гидрирование ацетиленов: – в этилене – во фракции С 4 0. 04%Pd/Al 2 O 3 (20 м 2/г); 60 -70 о. С 5000 млн. долей ® 5 млн. долей 3. Гидрирование бензола в циклогексан Ni/Al 2 O 3; 150 -200 o. C; 30 -50 атм Catalysis by metals. ppt 2
 Примеры промышленных процессов на металлических катализаторах Катализ металлами 4. Окисление этилена в этиленоксид Ag/корунд; 260 -280 o. C 5. Окисление аммиака Pt металл; 920 -940 о. С; 8 атм 6. Получение цианистого водорода сплав 90%Pt+10%Rh; 1100 -1500 o. C; 2 атм 7. Очистка выхлопных газов Pt (Rh, Ru)/сотовый носитель Catalysis by metals. ppt 3
Примеры промышленных процессов на металлических катализаторах Катализ металлами 4. Окисление этилена в этиленоксид Ag/корунд; 260 -280 o. C 5. Окисление аммиака Pt металл; 920 -940 о. С; 8 атм 6. Получение цианистого водорода сплав 90%Pt+10%Rh; 1100 -1500 o. C; 2 атм 7. Очистка выхлопных газов Pt (Rh, Ru)/сотовый носитель Catalysis by metals. ppt 3
 Примеры промышленных процессов на металлических катализаторах Катализ металлами 8. Риформинг Pt/g-Al 2 O 3 9. Процессы изомеризации – парафинов (Pd/цеолит) – ксилолов (Pt/алюмосиликат) 10. Синтез Фишера-Тропша – Fe с добавками – Co/(Si. O 2, Ti. O 2) 11. Синтез NH 3 Fe с добавками Catalysis by metals. ppt 4
Примеры промышленных процессов на металлических катализаторах Катализ металлами 8. Риформинг Pt/g-Al 2 O 3 9. Процессы изомеризации – парафинов (Pd/цеолит) – ксилолов (Pt/алюмосиликат) 10. Синтез Фишера-Тропша – Fe с добавками – Co/(Si. O 2, Ti. O 2) 11. Синтез NH 3 Fe с добавками Catalysis by metals. ppt 4
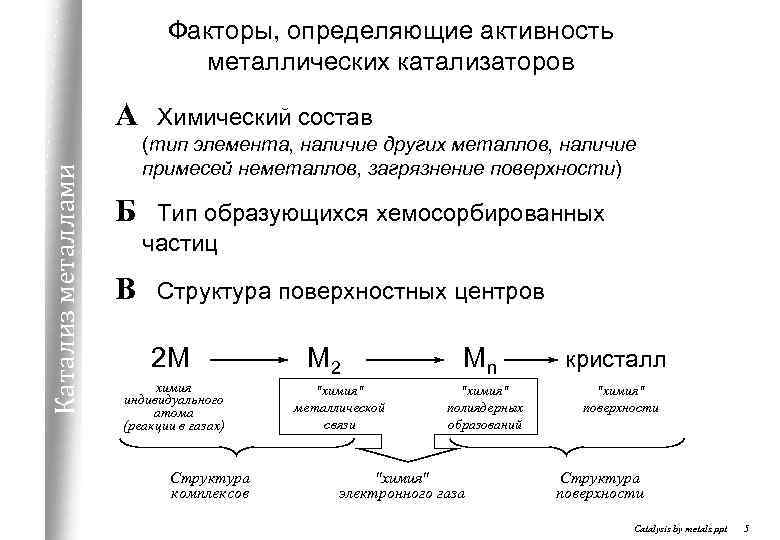 Факторы, определяющие активность металлических катализаторов Катализ металлами А Химический состав (тип элемента, наличие других металлов, наличие примесей неметаллов, загрязнение поверхности) Б В Тип образующихся хемосорбированных частиц Структура поверхностных центров 2 М химия индивидуального атома (реакции в газах) Структура комплексов М 2 "химия" металлической связи Мn "химия" полиядерных образований "химия" электронного газа кристалл "химия" поверхности Структура поверхности Catalysis by metals. ppt 5
Факторы, определяющие активность металлических катализаторов Катализ металлами А Химический состав (тип элемента, наличие других металлов, наличие примесей неметаллов, загрязнение поверхности) Б В Тип образующихся хемосорбированных частиц Структура поверхностных центров 2 М химия индивидуального атома (реакции в газах) Структура комплексов М 2 "химия" металлической связи Мn "химия" полиядерных образований "химия" электронного газа кристалл "химия" поверхности Структура поверхности Catalysis by metals. ppt 5
 Катализ металлами Теория валентных связей Полинга в применении к металлической связи 1. Каждый атом образует гибридные dsp-орбитали, перекрывание которых приводит к металлической связи 2. Реальная электронная конфигурация металла возникает в результате резонанса между всеми возможными структурами. 3. Рассматриваются 2 типа d-орбиталей: – участвующие в образовании dsp-орбиталей – свободные Магнитные свойства металлов объясняются присутствием неспаренных электронов на свободных d-орбиталях. Catalysis by metals. ppt 6
Катализ металлами Теория валентных связей Полинга в применении к металлической связи 1. Каждый атом образует гибридные dsp-орбитали, перекрывание которых приводит к металлической связи 2. Реальная электронная конфигурация металла возникает в результате резонанса между всеми возможными структурами. 3. Рассматриваются 2 типа d-орбиталей: – участвующие в образовании dsp-орбиталей – свободные Магнитные свойства металлов объясняются присутствием неспаренных электронов на свободных d-орбиталях. Catalysis by metals. ppt 6
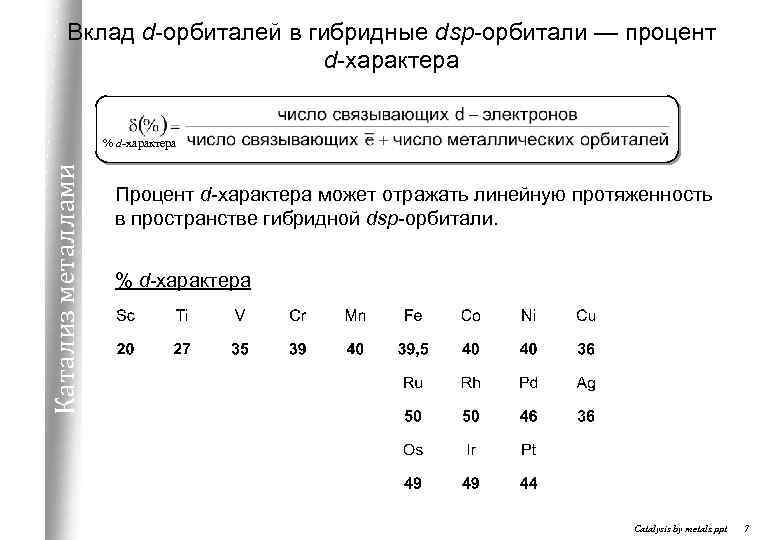 Вклад d-орбиталей в гибридные dsp-орбитали — процент d-характера Катализ металлами % d-характера Процент d-характера может отражать линейную протяженность в пространстве гибридной dsp-орбитали. % d-характера Catalysis by metals. ppt 7
Вклад d-орбиталей в гибридные dsp-орбитали — процент d-характера Катализ металлами % d-характера Процент d-характера может отражать линейную протяженность в пространстве гибридной dsp-орбитали. % d-характера Catalysis by metals. ppt 7
 Корреляция между активностью в реакции гидрогенолиза этана и % d-характера Катализ металлами С 2 H 6 + H 2 ® 2 CH 4 % d-характера 108 Ru Tc Os 1 Re Mo, W W Mo 52 Rh Ir Pd Pt Ag, Au 44 Ag Catalysis by metals. ppt 8
Корреляция между активностью в реакции гидрогенолиза этана и % d-характера Катализ металлами С 2 H 6 + H 2 ® 2 CH 4 % d-характера 108 Ru Tc Os 1 Re Mo, W W Mo 52 Rh Ir Pd Pt Ag, Au 44 Ag Catalysis by metals. ppt 8
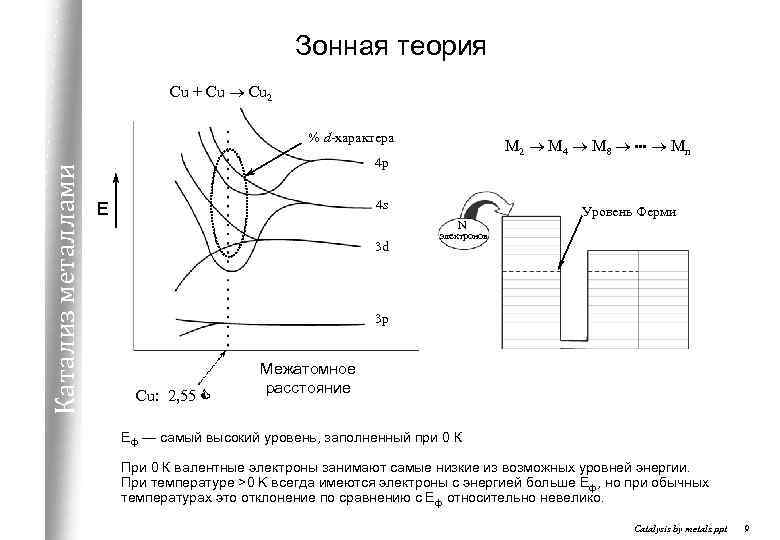 Зонная теория Cu + Cu ® Cu 2 Катализ металлами % d-характера M 2 ® M 4 ® M 8 ®. . . ® Mn 4 p 4 s E N 3 d Уровень Ферми электронов 3 p Cu: 2, 55 C Межатомное расстояние Eф — самый высокий уровень, заполненный при 0 К При 0 К валентные электроны занимают самые низкие из возможных уровней энергии. При температуре >0 K всегда имеются электроны с энергией больше Еф, но при обычных температурах это отклонение по сравнению с Еф относительно невелико. Catalysis by metals. ppt 9
Зонная теория Cu + Cu ® Cu 2 Катализ металлами % d-характера M 2 ® M 4 ® M 8 ®. . . ® Mn 4 p 4 s E N 3 d Уровень Ферми электронов 3 p Cu: 2, 55 C Межатомное расстояние Eф — самый высокий уровень, заполненный при 0 К При 0 К валентные электроны занимают самые низкие из возможных уровней энергии. При температуре >0 K всегда имеются электроны с энергией больше Еф, но при обычных температурах это отклонение по сравнению с Еф относительно невелико. Catalysis by metals. ppt 9
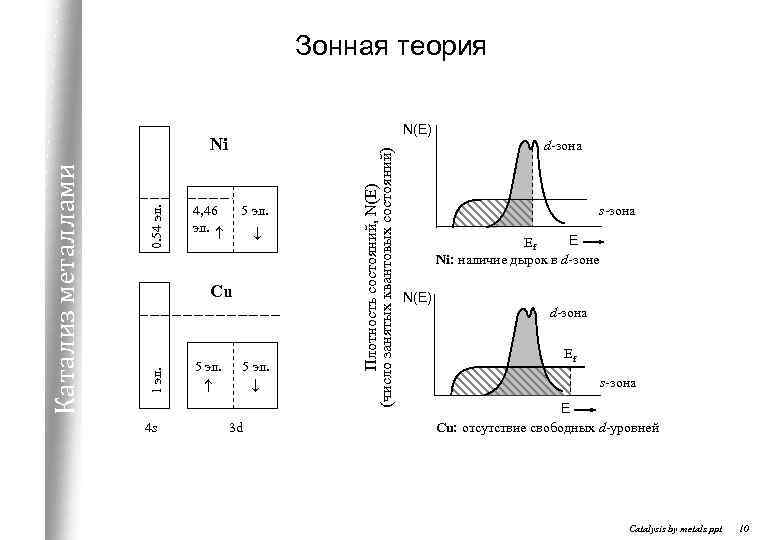 Зонная теория 0. 54 эл. 4, 46 эл. 5 эл. Cu 1 эл. Катализ металлами Ni 4 s 5 эл. 3 d Плотность состояний, N(E) (число занятых квантовых состояний) N(E) d-зона s-зона E Ef Ni: наличие дырок в d-зоне N(E) d-зона Ef s-зона E Cu: отсутствие свободных d-уровней Catalysis by metals. ppt 10
Зонная теория 0. 54 эл. 4, 46 эл. 5 эл. Cu 1 эл. Катализ металлами Ni 4 s 5 эл. 3 d Плотность состояний, N(E) (число занятых квантовых состояний) N(E) d-зона s-зона E Ef Ni: наличие дырок в d-зоне N(E) d-зона Ef s-зона E Cu: отсутствие свободных d-уровней Catalysis by metals. ppt 10
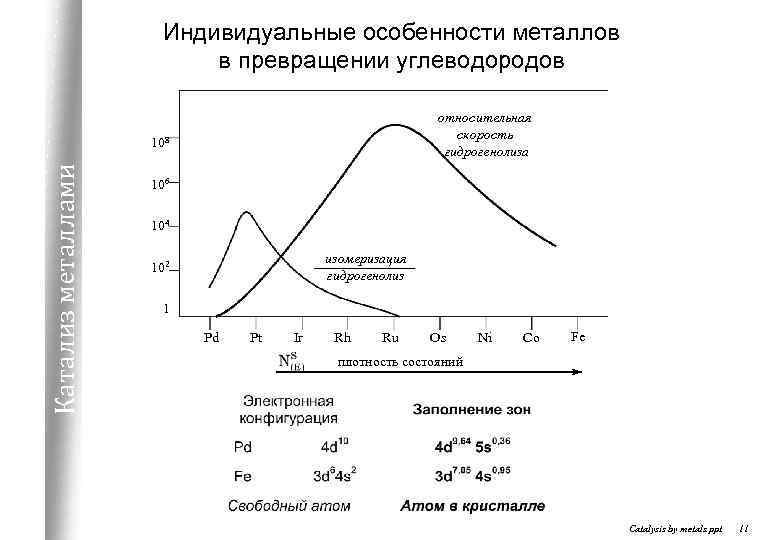 Индивидуальные особенности металлов в превращении углеводородов относительная скорость гидрогенолиза Катализ металлами 108 106 104 изомеризация гидрогенолиз 102 1 Pd Pt Ir Rh Ru Os Ni Co Fe плотность состояний Catalysis by metals. ppt 11
Индивидуальные особенности металлов в превращении углеводородов относительная скорость гидрогенолиза Катализ металлами 108 106 104 изомеризация гидрогенолиз 102 1 Pd Pt Ir Rh Ru Os Ni Co Fe плотность состояний Catalysis by metals. ppt 11
 Катализ металлами Атомные диаметры некоторых элементов Catalysis by metals. ppt 12
Катализ металлами Атомные диаметры некоторых элементов Catalysis by metals. ppt 12
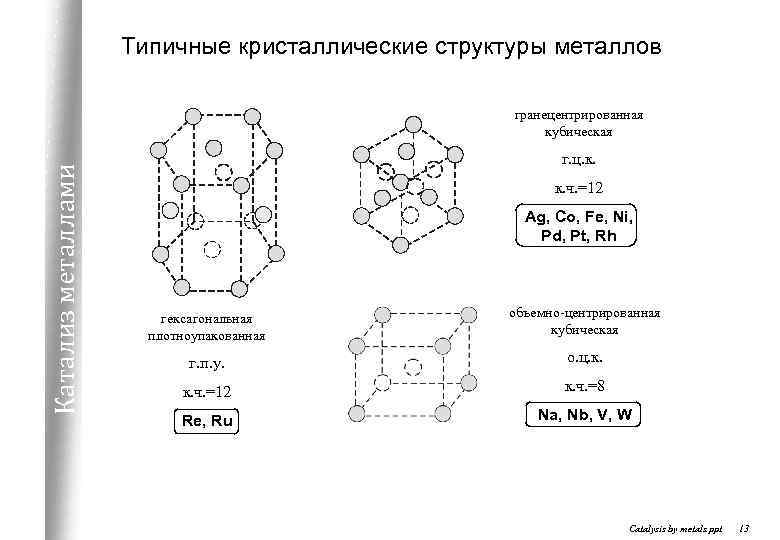 Типичные кристаллические структуры металлов Катализ металлами гранецентрированная кубическая г. ц. к. к. ч. =12 Ag, Co, Fe, Ni, Pd, Pt, Rh гексагональная плотноупакованная объемно-центрированная кубическая г. п. у. о. ц. к. ч. =12 к. ч. =8 Re, Ru Na, Nb, V, W Catalysis by metals. ppt 13
Типичные кристаллические структуры металлов Катализ металлами гранецентрированная кубическая г. ц. к. к. ч. =12 Ag, Co, Fe, Ni, Pd, Pt, Rh гексагональная плотноупакованная объемно-центрированная кубическая г. п. у. о. ц. к. ч. =12 к. ч. =8 Re, Ru Na, Nb, V, W Catalysis by metals. ppt 13
 Катализ металлами Примеры кристаллографических плоскостей в кубической структуре a 2 a (100) (010) (111) (112) Catalysis by metals. ppt 14
Катализ металлами Примеры кристаллографических плоскостей в кубической структуре a 2 a (100) (010) (111) (112) Catalysis by metals. ppt 14
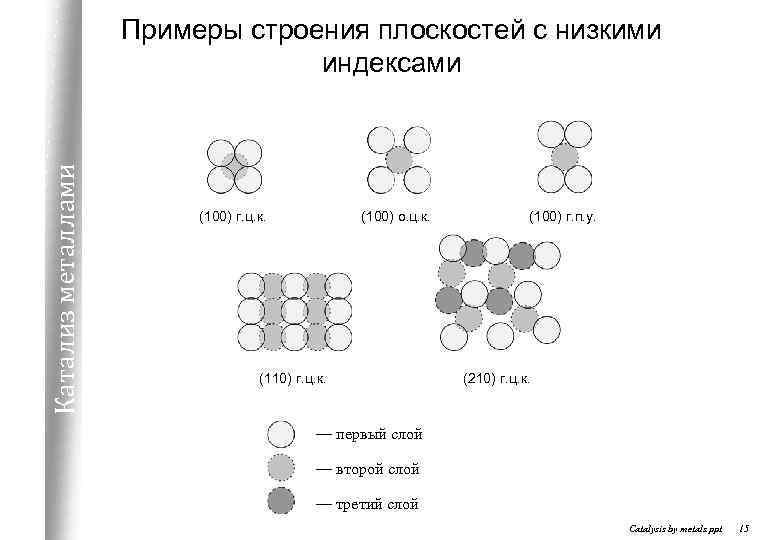 Катализ металлами Примеры строения плоскостей с низкими индексами (100) г. ц. к. (100) о. ц. к. (110) г. ц. к. (100) г. п. у. (210) г. ц. к. — первый слой — второй слой — третий слой Catalysis by metals. ppt 15
Катализ металлами Примеры строения плоскостей с низкими индексами (100) г. ц. к. (100) о. ц. к. (110) г. ц. к. (100) г. п. у. (210) г. ц. к. — первый слой — второй слой — третий слой Catalysis by metals. ppt 15
![Катализ металлами Структура краев слоев симметрии (100) о. ц. к. [001] г. ц. к. Катализ металлами Структура краев слоев симметрии (100) о. ц. к. [001] г. ц. к.](https://present5.com/presentation/92275910_223141928/image-16.jpg) Катализ металлами Структура краев слоев симметрии (100) о. ц. к. [001] г. ц. к. [011] о. ц. к. [011] г. ц. к. [001] о. ц. к. [012] г. ц. к. [013] о. ц. к. [013] г. ц. к. [012] Catalysis by metals. ppt 16
Катализ металлами Структура краев слоев симметрии (100) о. ц. к. [001] г. ц. к. [011] о. ц. к. [011] г. ц. к. [001] о. ц. к. [012] г. ц. к. [013] о. ц. к. [013] г. ц. к. [012] Catalysis by metals. ppt 16
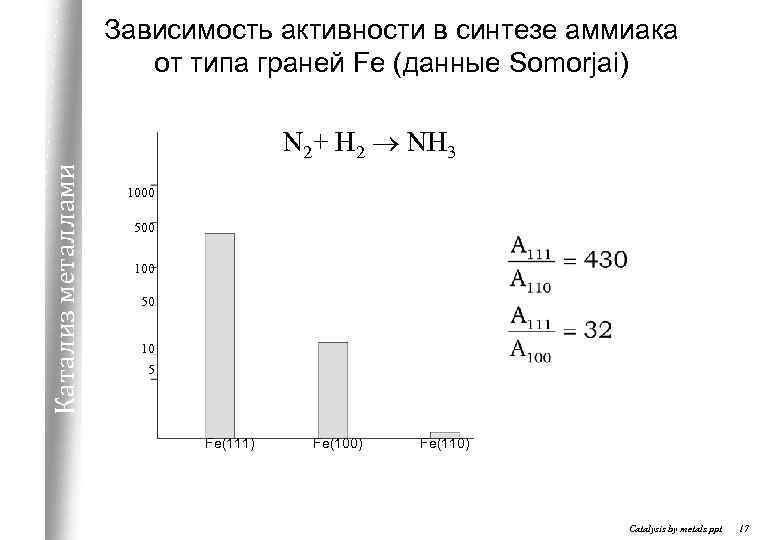 Зависимость активности в синтезе аммиака от типа граней Fe (данные Somorjai) Катализ металлами N 2+ H 2 ® NH 3 1000 500 100 50 10 5 Fe(111) Fe(100) Fe(110) Catalysis by metals. ppt 17
Зависимость активности в синтезе аммиака от типа граней Fe (данные Somorjai) Катализ металлами N 2+ H 2 ® NH 3 1000 500 100 50 10 5 Fe(111) Fe(100) Fe(110) Catalysis by metals. ppt 17
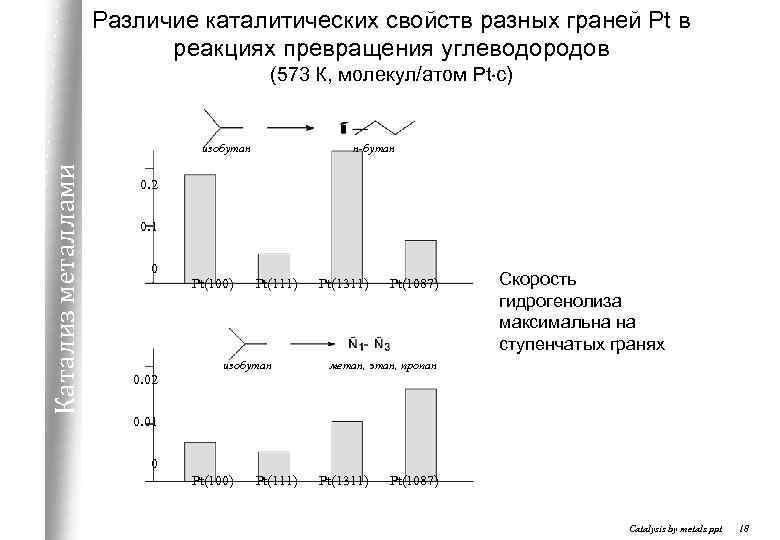 Различие каталитических свойств разных граней Pt в реакциях превращения углеводородов (573 К, молекул/атом Pt c) Катализ металлами изобутан н-бутан 0. 2 0. 1 0 0. 02 Pt(100) Pt(111) изобутан Pt(1311) Pt(1087) Скорость гидрогенолиза максимальна на ступенчатых гранях метан, этан, пропан 0. 01 0 Pt(100) Pt(111) Pt(1311) Pt(1087) Catalysis by metals. ppt 18
Различие каталитических свойств разных граней Pt в реакциях превращения углеводородов (573 К, молекул/атом Pt c) Катализ металлами изобутан н-бутан 0. 2 0. 1 0 0. 02 Pt(100) Pt(111) изобутан Pt(1311) Pt(1087) Скорость гидрогенолиза максимальна на ступенчатых гранях метан, этан, пропан 0. 01 0 Pt(100) Pt(111) Pt(1311) Pt(1087) Catalysis by metals. ppt 18
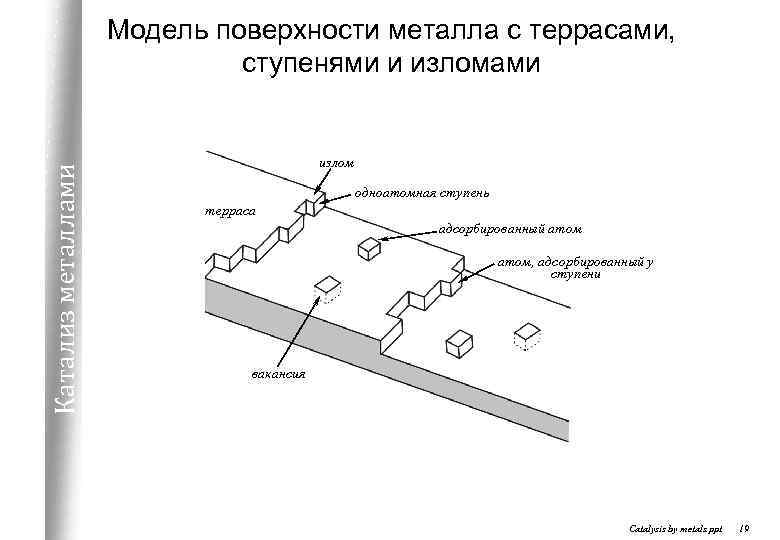 Катализ металлами Модель поверхности металла с террасами, ступенями и изломами излом одноатомная ступень терраса адсорбированный атом, адсорбированный у ступени вакансия Catalysis by metals. ppt 19
Катализ металлами Модель поверхности металла с террасами, ступенями и изломами излом одноатомная ступень терраса адсорбированный атом, адсорбированный у ступени вакансия Catalysis by metals. ppt 19
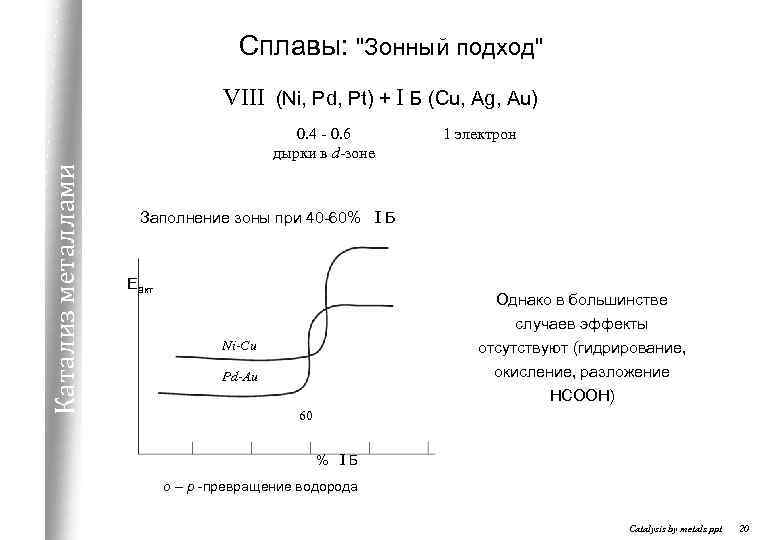 Сплавы: "Зонный подход" VIII (Ni, Pd, Pt) + I Б (Cu, Ag, Au) Катализ металлами 0. 4 - 0. 6 дырки в d-зоне 1 электрон Заполнение зоны при 40 -60% I Б Eакт Однако в большинстве случаев эффекты Ni-Cu отсутствуют (гидрирование, окисление, разложение HCOOH) Pd-Au 60 % IБ o – p -превращение водорода Catalysis by metals. ppt 20
Сплавы: "Зонный подход" VIII (Ni, Pd, Pt) + I Б (Cu, Ag, Au) Катализ металлами 0. 4 - 0. 6 дырки в d-зоне 1 электрон Заполнение зоны при 40 -60% I Б Eакт Однако в большинстве случаев эффекты Ni-Cu отсутствуют (гидрирование, окисление, разложение HCOOH) Pd-Au 60 % IБ o – p -превращение водорода Catalysis by metals. ppt 20
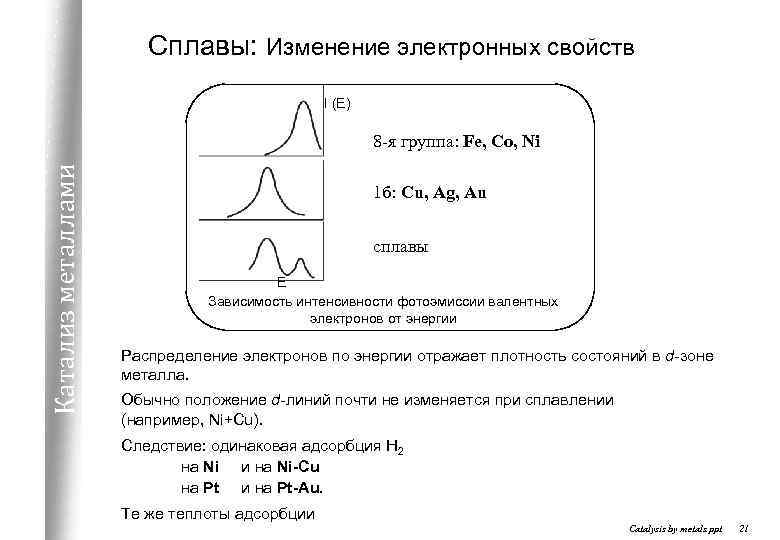 Сплавы: Изменение электронных свойств I (E) Катализ металлами 8 -я группа: Fe, Co, Ni 1 б: Cu, Ag, Au сплавы E Зависимость интенсивности фотоэмиссии валентных электронов от энергии Распределение электронов по энергии отражает плотность состояний в d-зоне металла. Обычно положение d-линий почти не изменяется при сплавлении (например, Ni+Cu). Следствие: одинаковая адсорбция Н 2 на Ni и на Ni-Cu на Pt и на Pt-Au. Те же теплоты адсорбции Catalysis by metals. ppt 21
Сплавы: Изменение электронных свойств I (E) Катализ металлами 8 -я группа: Fe, Co, Ni 1 б: Cu, Ag, Au сплавы E Зависимость интенсивности фотоэмиссии валентных электронов от энергии Распределение электронов по энергии отражает плотность состояний в d-зоне металла. Обычно положение d-линий почти не изменяется при сплавлении (например, Ni+Cu). Следствие: одинаковая адсорбция Н 2 на Ni и на Ni-Cu на Pt и на Pt-Au. Те же теплоты адсорбции Catalysis by metals. ppt 21
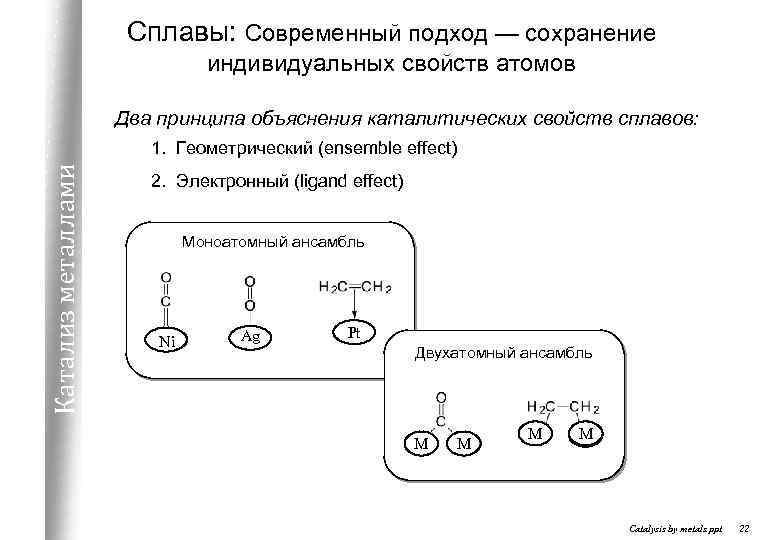 Сплавы: Современный подход — сохранение индивидуальных свойств атомов Два принципа объяснения каталитических свойств сплавов: Катализ металлами 1. Геометрический (ensemble effect) 2. Электронный (ligand effect) Моноатомный ансамбль Ni Ag Pt Двухатомный ансамбль М М Catalysis by metals. ppt 22
Сплавы: Современный подход — сохранение индивидуальных свойств атомов Два принципа объяснения каталитических свойств сплавов: Катализ металлами 1. Геометрический (ensemble effect) 2. Электронный (ligand effect) Моноатомный ансамбль Ni Ag Pt Двухатомный ансамбль М М Catalysis by metals. ppt 22
 Сплавы Ni-Cu: Данные Понеца Катализ металлами При широкой вариации содержания меди, поверхностный состав почти постоянен и содержит 5 15% Ni. Исследованные реакции делятся на две группы: 1. Скорость на 1 атом Ni одинакова или выше на сплаве (моноатомные центры); 2. Скорость на 1 атом Ni существенно ниже (полиатомные центры). 1: H 2–D 2 обмен, (де)гидрирование 2: риформинг, гидрирование СО Catalysis by metals. ppt 23
Сплавы Ni-Cu: Данные Понеца Катализ металлами При широкой вариации содержания меди, поверхностный состав почти постоянен и содержит 5 15% Ni. Исследованные реакции делятся на две группы: 1. Скорость на 1 атом Ni одинакова или выше на сплаве (моноатомные центры); 2. Скорость на 1 атом Ni существенно ниже (полиатомные центры). 1: H 2–D 2 обмен, (де)гидрирование 2: риформинг, гидрирование СО Catalysis by metals. ppt 23
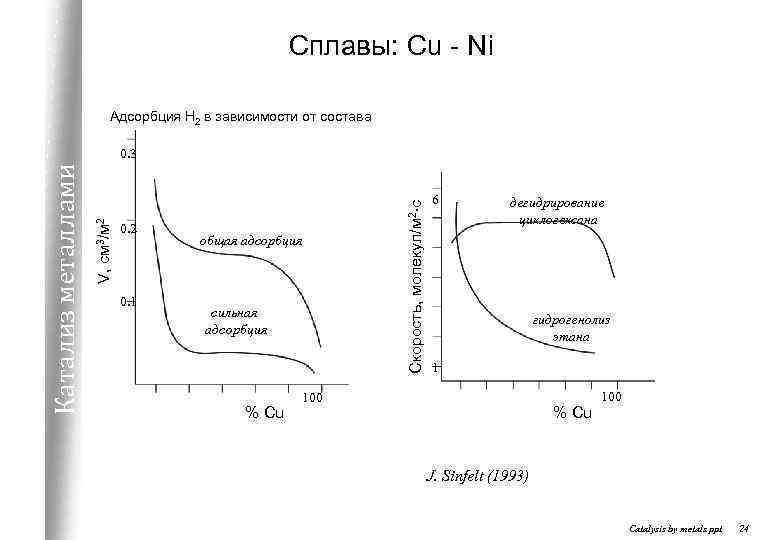 Сплавы: Cu - Ni Адсорбция Н 2 в зависимости от состава 0. 2 0. 1 общая адсорбция сильная адсорбция % Cu Скорость, молекул/м 2. с V, см 3/м 2 Катализ металлами 0. 3 6 дегидрирование циклогексана гидрогенолиз этана 1 100 % Cu 100 J. Sinfelt (1993) Catalysis by metals. ppt 24
Сплавы: Cu - Ni Адсорбция Н 2 в зависимости от состава 0. 2 0. 1 общая адсорбция сильная адсорбция % Cu Скорость, молекул/м 2. с V, см 3/м 2 Катализ металлами 0. 3 6 дегидрирование циклогексана гидрогенолиз этана 1 100 % Cu 100 J. Sinfelt (1993) Catalysis by metals. ppt 24
 Сплавы: Вывод Понеца Катализ металлами В сплавах сохраняется способность компонентов к образованию структур: М–С М=С с той же реакционной способностью Однако, разбавление активного металла приводит к резкому падению активности в реакциях дегидроциклизации, гидрогенолиза. Основная причина: изменение числа активных многоцентровых мест. Требования к размеру а. ц. гидрогенолиз > дегидроциклизация >> изомеризация Catalysis by metals. ppt 25
Сплавы: Вывод Понеца Катализ металлами В сплавах сохраняется способность компонентов к образованию структур: М–С М=С с той же реакционной способностью Однако, разбавление активного металла приводит к резкому падению активности в реакциях дегидроциклизации, гидрогенолиза. Основная причина: изменение числа активных многоцентровых мест. Требования к размеру а. ц. гидрогенолиз > дегидроциклизация >> изомеризация Catalysis by metals. ppt 25
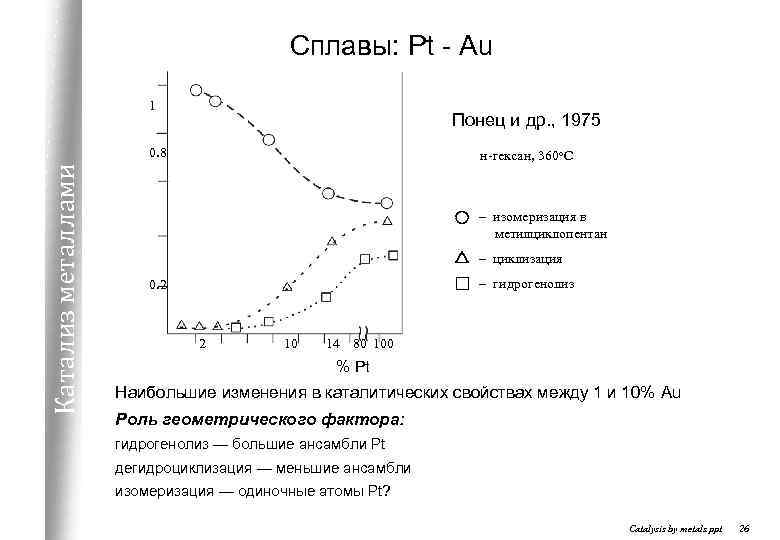 Сплавы: Pt - Au 1 Понец и др. , 1975 Катализ металлами 0. 8 н-гексан, 360 о. С – изомеризация в метилциклопентан – циклизация – гидрогенолиз 0. 2 2 10 14 80 100 % Pt Наибольшие изменения в каталитических свойствах между 1 и 10% Au Роль геометрического фактора: гидрогенолиз — большие ансамбли Pt дегидроциклизация — меньшие ансамбли изомеризация — одиночные атомы Pt? Catalysis by metals. ppt 26
Сплавы: Pt - Au 1 Понец и др. , 1975 Катализ металлами 0. 8 н-гексан, 360 о. С – изомеризация в метилциклопентан – циклизация – гидрогенолиз 0. 2 2 10 14 80 100 % Pt Наибольшие изменения в каталитических свойствах между 1 и 10% Au Роль геометрического фактора: гидрогенолиз — большие ансамбли Pt дегидроциклизация — меньшие ансамбли изомеризация — одиночные атомы Pt? Catalysis by metals. ppt 26
 Сплавы: Ni - Cu Катализ металлами Влияние состава станд. Ni Реакции типа 1 Реакции типа 2 10 -3 10 -5 Ni Cu Catalysis by metals. ppt 27
Сплавы: Ni - Cu Катализ металлами Влияние состава станд. Ni Реакции типа 1 Реакции типа 2 10 -3 10 -5 Ni Cu Catalysis by metals. ppt 27


