Рак- Лекция МГУ-2012.ppt
- Количество слайдов: 48


 Основные постулаты вирусо-генетической теории происхождения опухолей (Л. А. Зильбер, 1968) • Естественно возникающие опухоли вызываются вирусами • Опухолевая конверсия клеток вызывается не вирусом, а его нуклеиновой кислотой. . • Новая генетическая информация, приносимая нуклеиновой кислотой вируса в клетку, инкорпорируется частично или полностью в геном клетки. • В результате наследственных изменений возникает нерегулируемое размножение клеток, приводящее к образованию опухоли. • Вирус, вызвавший опухолевую конверсию, не принимает участия в размножении уже образовавшихся опухолевых клеток. • «Рак – это заболевание генома клетки. » (стр. 228)
Основные постулаты вирусо-генетической теории происхождения опухолей (Л. А. Зильбер, 1968) • Естественно возникающие опухоли вызываются вирусами • Опухолевая конверсия клеток вызывается не вирусом, а его нуклеиновой кислотой. . • Новая генетическая информация, приносимая нуклеиновой кислотой вируса в клетку, инкорпорируется частично или полностью в геном клетки. • В результате наследственных изменений возникает нерегулируемое размножение клеток, приводящее к образованию опухоли. • Вирус, вызвавший опухолевую конверсию, не принимает участия в размножении уже образовавшихся опухолевых клеток. • «Рак – это заболевание генома клетки. » (стр. 228)
 Первые этапы молекулярной онкологии (1970 – 1980 гг) • Обнаружение онкогена в РНК вируса саркомы Рауса. • Доказательства необходимости ДНК для репликации вируса (инфекционность ДНК из зараженных клеток). • Обнаружение обратной транскриптазы в вирионах • Продукт онкогена – белок, обладающий фосфотирозин-киназной активностью • Идентификация онкогенов во всех РНК-содержащих вирусах с трансформирующим потенциалом. • Создание экспериментальных моделей – клетки млекопитающих, трансформированных вирусом саркомы Рауса • Выявление гомологов онкогенов (протоонкогенов) в нормальных клетках.
Первые этапы молекулярной онкологии (1970 – 1980 гг) • Обнаружение онкогена в РНК вируса саркомы Рауса. • Доказательства необходимости ДНК для репликации вируса (инфекционность ДНК из зараженных клеток). • Обнаружение обратной транскриптазы в вирионах • Продукт онкогена – белок, обладающий фосфотирозин-киназной активностью • Идентификация онкогенов во всех РНК-содержащих вирусах с трансформирующим потенциалом. • Создание экспериментальных моделей – клетки млекопитающих, трансформированных вирусом саркомы Рауса • Выявление гомологов онкогенов (протоонкогенов) в нормальных клетках.

 Онкогены – клеточные или вирусные гены, экспрессия которых ведет к развитию новообразований.
Онкогены – клеточные или вирусные гены, экспрессия которых ведет к развитию новообразований.
 CLASSIFICATION of PROTOONCOGENES • GROWTH FACTORS family pdgf, fgf • Membrane TYROSINE KINASES GROWTH FACTOR RECEPTORS (erb B, fms, et al) OTHER TYROSINE KINASES (src, abl, ret, et al) • G-PROTEINS ras family • Cytoplasmic SERINE KINASES raf, mos, et al • fos, jun, myc et al NUCLEAR PROTEINS
CLASSIFICATION of PROTOONCOGENES • GROWTH FACTORS family pdgf, fgf • Membrane TYROSINE KINASES GROWTH FACTOR RECEPTORS (erb B, fms, et al) OTHER TYROSINE KINASES (src, abl, ret, et al) • G-PROTEINS ras family • Cytoplasmic SERINE KINASES raf, mos, et al • fos, jun, myc et al NUCLEAR PROTEINS
 PROTOONCOGENE ACTIVATION • • POINT MUTATIONS CHROMOSOMAL TRANSLOCATIONS GENE AMPLIFICATION PARTIAL GENE DELETION
PROTOONCOGENE ACTIVATION • • POINT MUTATIONS CHROMOSOMAL TRANSLOCATIONS GENE AMPLIFICATION PARTIAL GENE DELETION
 Мутации в онкогене RAS характерны для многих опухолей человека Мутации в кодонах 12, 13, 61 генов K-RAS, N-RAS, H-RAS обнаруживаются в: 90 -95% случаев рака поджелудочной железы; 25 -40% случаев многих других новообразований рака легкого, толстого кишечника, щитовидной железы и др.
Мутации в онкогене RAS характерны для многих опухолей человека Мутации в кодонах 12, 13, 61 генов K-RAS, N-RAS, H-RAS обнаруживаются в: 90 -95% случаев рака поджелудочной железы; 25 -40% случаев многих других новообразований рака легкого, толстого кишечника, щитовидной железы и др.
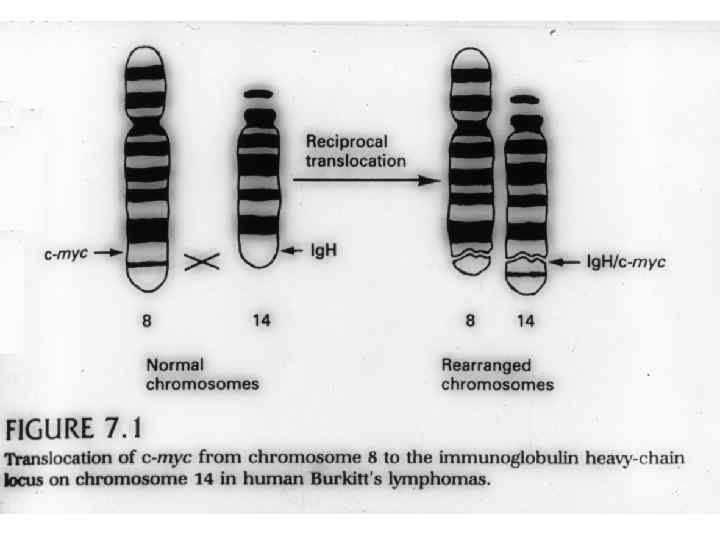
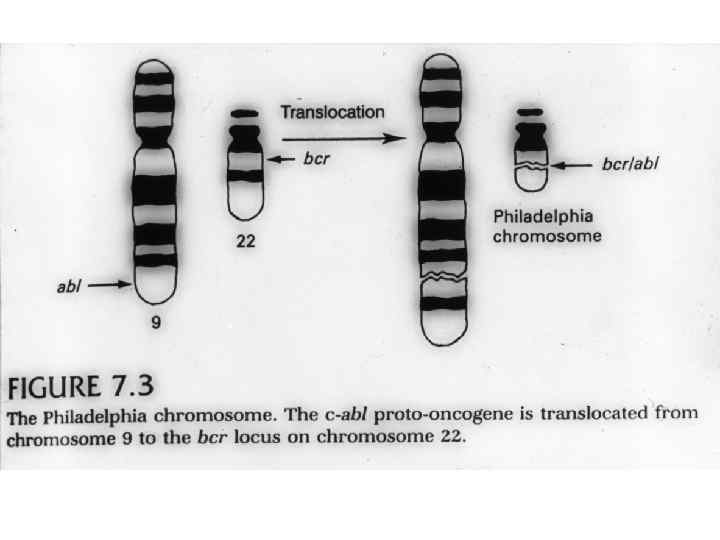
 Опухолевые супрессоры (антионкогены, рецессивные опухолевые гены) – клеточные гены, инактивация которых резко увеличивает вероятность развития новообразований, а восстановление функции, наоборот, может подавить рост опухолевых клеток.
Опухолевые супрессоры (антионкогены, рецессивные опухолевые гены) – клеточные гены, инактивация которых резко увеличивает вероятность развития новообразований, а восстановление функции, наоборот, может подавить рост опухолевых клеток.
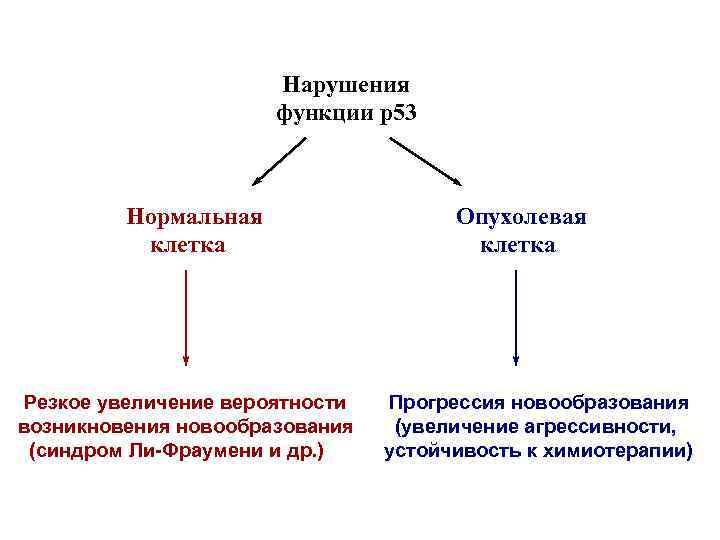 Нарушения функции р53 Нормальная клетка Резкое увеличение вероятности возникновения новообразования (синдром Ли-Фраумени и др. ) Опухолевая клетка Прогрессия новообразования (увеличение агрессивности, устойчивость к химиотерапии)
Нарушения функции р53 Нормальная клетка Резкое увеличение вероятности возникновения новообразования (синдром Ли-Фраумени и др. ) Опухолевая клетка Прогрессия новообразования (увеличение агрессивности, устойчивость к химиотерапии)
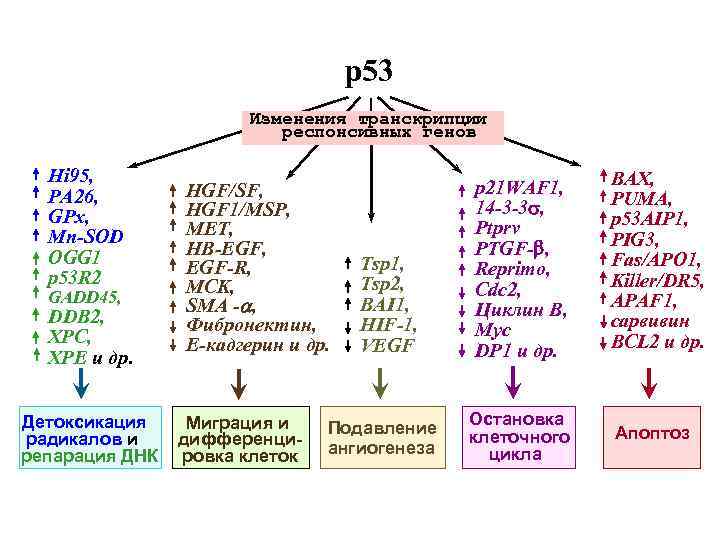 р53 Изменения транскрипции респонсивных генов Hi 95, PA 26, GPx, Mn-SOD OGG 1 p 53 R 2 GADD 45, DDB 2, XPC, XPE и др. Детоксикация радикалов и репарация ДНК HGF/SF, HGF 1/MSP, MET, HB-EGF, EGF-R, MCK, SMA -a, Фибронектин, E-кадгерин и др. Миграция и дифференцировка клеток Tsp 1, Tsp 2, BAI 1, HIF-1, VEGF Подавление ангиогенеза p 21 WAF 1, 14 -3 -3 s, Ptprv PTGF-b, Reprimo, Cdc 2, Циклин B, Myc DP 1 и др. BAX, PUMA, p 53 AIP 1, PIG 3, Fas/APO 1, Killer/DR 5, APAF 1, сарвивин BCL 2 и др. Остановка клеточного цикла Апоптоз
р53 Изменения транскрипции респонсивных генов Hi 95, PA 26, GPx, Mn-SOD OGG 1 p 53 R 2 GADD 45, DDB 2, XPC, XPE и др. Детоксикация радикалов и репарация ДНК HGF/SF, HGF 1/MSP, MET, HB-EGF, EGF-R, MCK, SMA -a, Фибронектин, E-кадгерин и др. Миграция и дифференцировка клеток Tsp 1, Tsp 2, BAI 1, HIF-1, VEGF Подавление ангиогенеза p 21 WAF 1, 14 -3 -3 s, Ptprv PTGF-b, Reprimo, Cdc 2, Циклин B, Myc DP 1 и др. BAX, PUMA, p 53 AIP 1, PIG 3, Fas/APO 1, Killer/DR 5, APAF 1, сарвивин BCL 2 и др. Остановка клеточного цикла Апоптоз
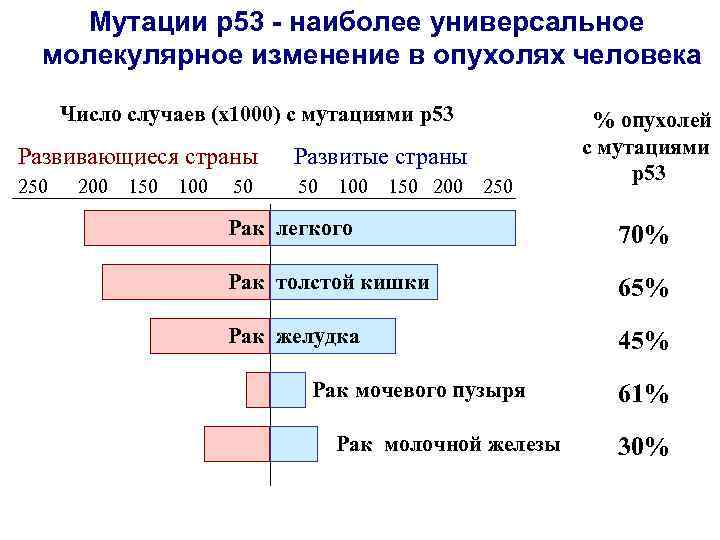 Мутации р53 - наиболее универсальное молекулярное изменение в опухолях человека Число случаев (х1000) с мутациями р53 Развивающиеся страны Развитые страны 250 50 200 150 100 150 200 250 % опухолей с мутациями р53 Рак легкого 70% Рак толстой кишки 65% Рак желудка 45% Рак мочевого пузыря Рак молочной железы 61% 30%
Мутации р53 - наиболее универсальное молекулярное изменение в опухолях человека Число случаев (х1000) с мутациями р53 Развивающиеся страны Развитые страны 250 50 200 150 100 150 200 250 % опухолей с мутациями р53 Рак легкого 70% Рак толстой кишки 65% Рак желудка 45% Рак мочевого пузыря Рак молочной железы 61% 30%
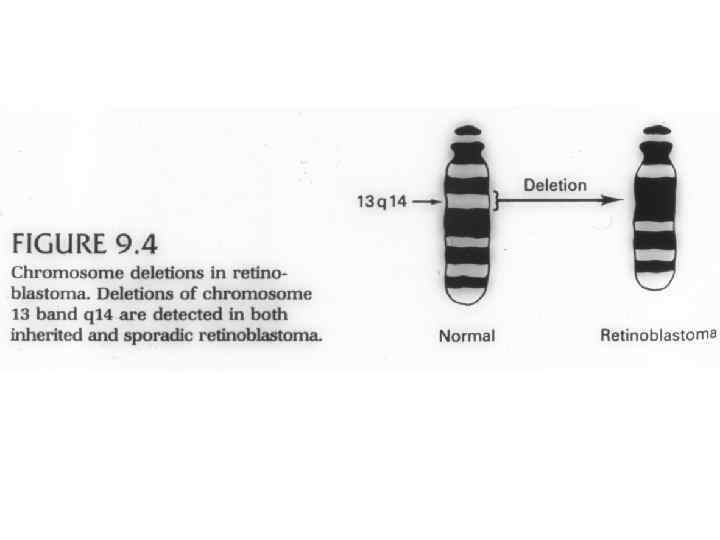
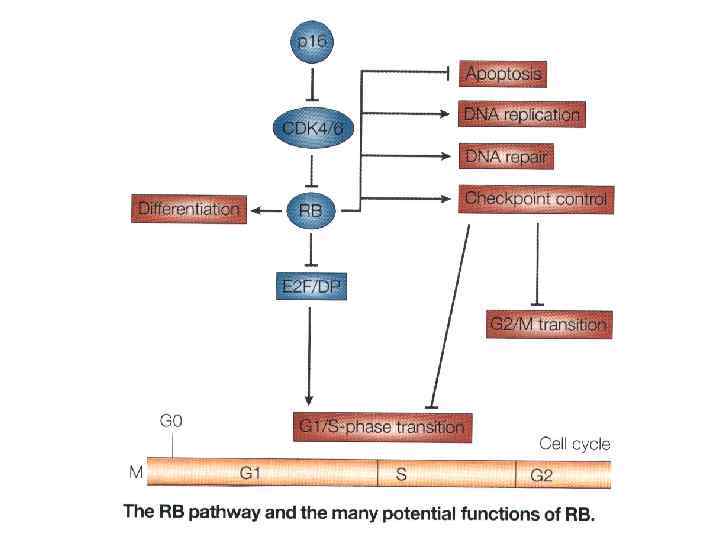

 Расшифровка структуры генома человека. Два типа генетических нарушений: а) мутации в геноме; б) эпигенетические нарушения:
Расшифровка структуры генома человека. Два типа генетических нарушений: а) мутации в геноме; б) эпигенетические нарушения:
 Мутаторный фенотип опухолевых клеток (последнее десятилетие) • Замена оснований, инсерции, делеции, реаранжировки, изменение копийности • • Соматические мутации (driver and passenger) Driver mutations обеспечивают преимущественный и неконтролируемый рост От 1 000 до 10 000 замещений (рак молочных желез, яичники, колоректальный рак, поджелудочная железа, глиома) Существенно меньше мутаций –медулобластома, острые лейкозы, тестикулярные опухоли Более 10 000 мутаций – опухоли легких, меланома • • Driver mutations – потенциальные мишени для противоопухолевой терапии • ~ 400 соматических мутироваших генов участвуют в превращении нормальной клетки в опухолевую (2% белок-кодирующих генов)
Мутаторный фенотип опухолевых клеток (последнее десятилетие) • Замена оснований, инсерции, делеции, реаранжировки, изменение копийности • • Соматические мутации (driver and passenger) Driver mutations обеспечивают преимущественный и неконтролируемый рост От 1 000 до 10 000 замещений (рак молочных желез, яичники, колоректальный рак, поджелудочная железа, глиома) Существенно меньше мутаций –медулобластома, острые лейкозы, тестикулярные опухоли Более 10 000 мутаций – опухоли легких, меланома • • Driver mutations – потенциальные мишени для противоопухолевой терапии • ~ 400 соматических мутироваших генов участвуют в превращении нормальной клетки в опухолевую (2% белок-кодирующих генов)
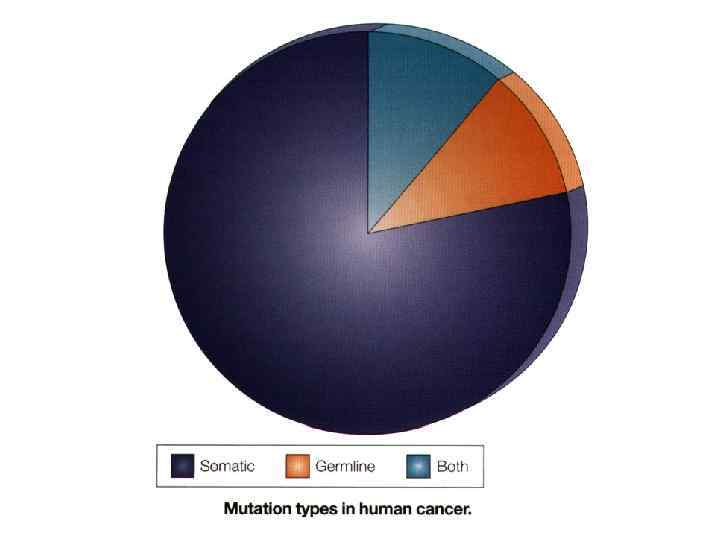
 Mутаторный фенотип опухолевых клеток (последнее десятилетие) • Доминантные опухолевые гены – мутации в одном из двух аллелей (80% опухолей) • Рецессивные опухолевые гены – мутации в обеих аллелях • Клональная экспансия для возникновения доминантного субклона, размножение которого приводит к возникновению опухоли • Метастазы – это, как правило субклоны первичной опухоли
Mутаторный фенотип опухолевых клеток (последнее десятилетие) • Доминантные опухолевые гены – мутации в одном из двух аллелей (80% опухолей) • Рецессивные опухолевые гены – мутации в обеих аллелях • Клональная экспансия для возникновения доминантного субклона, размножение которого приводит к возникновению опухоли • Метастазы – это, как правило субклоны первичной опухоли
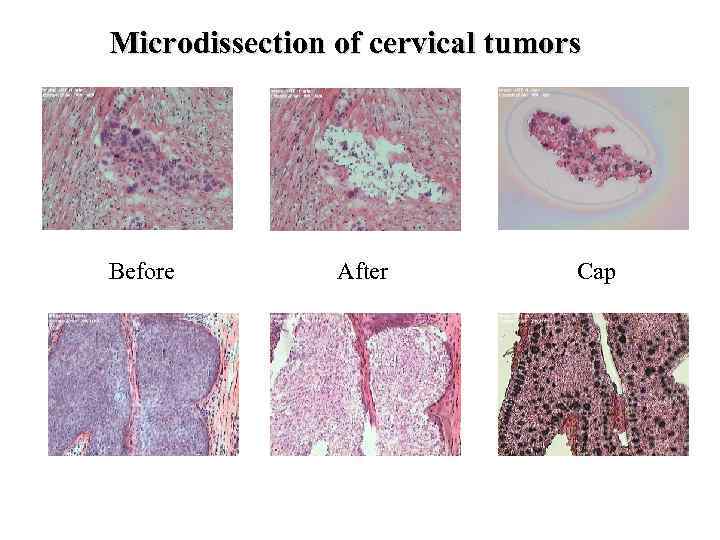 Microdissection of cervical tumors Before After Cap
Microdissection of cervical tumors Before After Cap
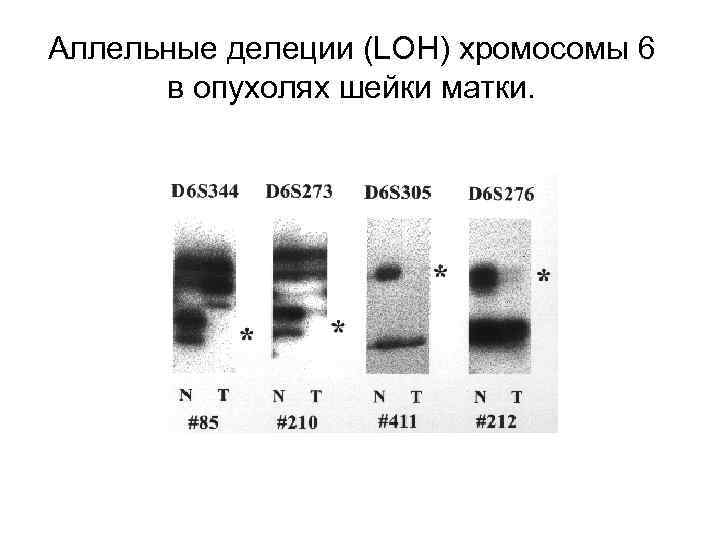 Аллельные делеции (LOH) хромосомы 6 в опухолях шейки матки.
Аллельные делеции (LOH) хромосомы 6 в опухолях шейки матки.
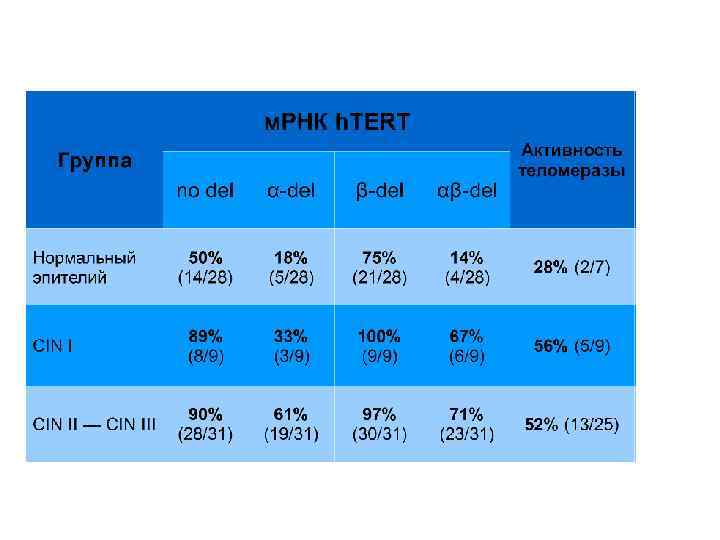
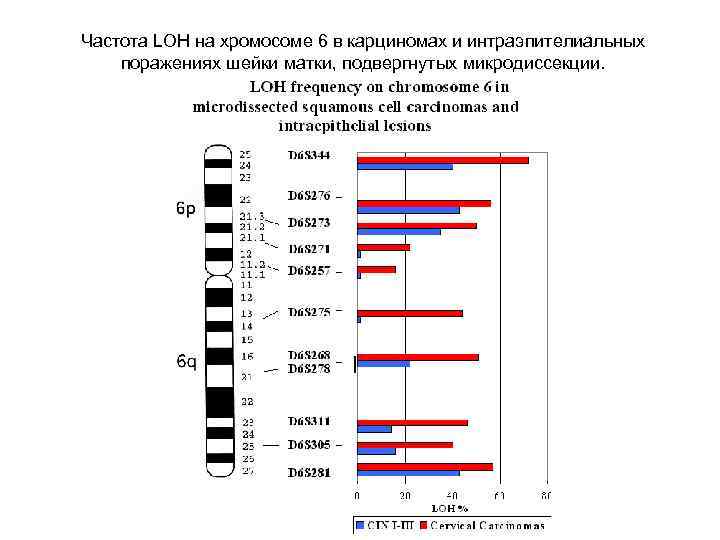 Частота LOH на хромосоме 6 в карциномах и интраэпителиальных поражениях шейки матки, подвергнутых микродиссекции.
Частота LOH на хромосоме 6 в карциномах и интраэпителиальных поражениях шейки матки, подвергнутых микродиссекции.
 Эпигеномные нарушения в опухолях • Нарушения в уровнях экспрессии генов • Метилирование Cp. G островков в промоторах и первых экзонах генов • Ацетилирование гистонов и реаранжировки хроматина • Сплайсинг • Микро-РНК (mir-RNA)
Эпигеномные нарушения в опухолях • Нарушения в уровнях экспрессии генов • Метилирование Cp. G островков в промоторах и первых экзонах генов • Ацетилирование гистонов и реаранжировки хроматина • Сплайсинг • Микро-РНК (mir-RNA)
 ЭПИГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ (ЭКСПРЕССИЯ ГЕНОВ). - Контроль уровня экспрессии генов и использование метода экспрессионных микрочипов. Преимущества: одновременный анализ экспрессии всех генов клетки; вычленение кластеров специфических генов для опухолей различных локализаций и для каждой индивидуальной опухоли; создание упрощенных “диагностических” вариантов микрочипов, содержащих не более 100 -1000 генов. Значение для клиники: паттерн экспрессии генов может определять чувствительность к различным химиопрепаратам и определять тактику лечения; проводить целенаправленный поиск новых геннаправленных противоопухолевых препаратов; верифицировать диагноз в сложных случаях; прогноз заболевания.
ЭПИГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ (ЭКСПРЕССИЯ ГЕНОВ). - Контроль уровня экспрессии генов и использование метода экспрессионных микрочипов. Преимущества: одновременный анализ экспрессии всех генов клетки; вычленение кластеров специфических генов для опухолей различных локализаций и для каждой индивидуальной опухоли; создание упрощенных “диагностических” вариантов микрочипов, содержащих не более 100 -1000 генов. Значение для клиники: паттерн экспрессии генов может определять чувствительность к различным химиопрепаратам и определять тактику лечения; проводить целенаправленный поиск новых геннаправленных противоопухолевых препаратов; верифицировать диагноз в сложных случаях; прогноз заболевания.
 Математическая обработка данных. Круговая диаграмма.
Математическая обработка данных. Круговая диаграмма.
 ГЕНЫ, ДИФФЕРЕНЦИАЛЬНО ЭКСПРЕССИРУЮЩИЕСЯ В РАЗЛИЧНЫХ ТИПАХ ОПУХОЛЕЙ МОЛОЧНЫХ ЖЕЛЕЗ. (предварительные данные совместного исследования с Университетом Дж. Мейсона, США) 1. Опухолевый супрессор р27/KIP 1 2. IGBP 1 (IGF связующий белок 1) 3. PSG 1 ( бета 1 -гликопротеид, специфичный для беременности) 4. FGG (фибриноген) 5. DKK 2 6. TNFRSF 14 (ген семейства TNF, участвующий в индукции металлопротеиназ) 7. CAV 1 (кавеолин) 8. PL 2 G 2 A – ген фосфолипазы А 2, ассоциированный с хорошим прогнозом. 9. PSA – ген простат-специфического антигена. 10. Транскрипционные факторы YY 1 и HESX 1. 11. RANBP 2 – белок ядерных пор. 12. SUMO E 3 лигаза 13. Rho-Gef p 114.
ГЕНЫ, ДИФФЕРЕНЦИАЛЬНО ЭКСПРЕССИРУЮЩИЕСЯ В РАЗЛИЧНЫХ ТИПАХ ОПУХОЛЕЙ МОЛОЧНЫХ ЖЕЛЕЗ. (предварительные данные совместного исследования с Университетом Дж. Мейсона, США) 1. Опухолевый супрессор р27/KIP 1 2. IGBP 1 (IGF связующий белок 1) 3. PSG 1 ( бета 1 -гликопротеид, специфичный для беременности) 4. FGG (фибриноген) 5. DKK 2 6. TNFRSF 14 (ген семейства TNF, участвующий в индукции металлопротеиназ) 7. CAV 1 (кавеолин) 8. PL 2 G 2 A – ген фосфолипазы А 2, ассоциированный с хорошим прогнозом. 9. PSA – ген простат-специфического антигена. 10. Транскрипционные факторы YY 1 и HESX 1. 11. RANBP 2 – белок ядерных пор. 12. SUMO E 3 лигаза 13. Rho-Gef p 114.
 ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИИ ХРОМАТИНА. Гипоацетилирование гистоновыми деацетилазами (HDAC) Метилирование лизина 9 в гистоне H 3 – направлено против транскрипционных репрессоров хроматина Метилирование ДНК в Сp. G островков – за счет взаимодействия с HDAC индуцирует ингибиторную конфигурацию хроматина.
ЭПИГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИИ ХРОМАТИНА. Гипоацетилирование гистоновыми деацетилазами (HDAC) Метилирование лизина 9 в гистоне H 3 – направлено против транскрипционных репрессоров хроматина Метилирование ДНК в Сp. G островков – за счет взаимодействия с HDAC индуцирует ингибиторную конфигурацию хроматина.
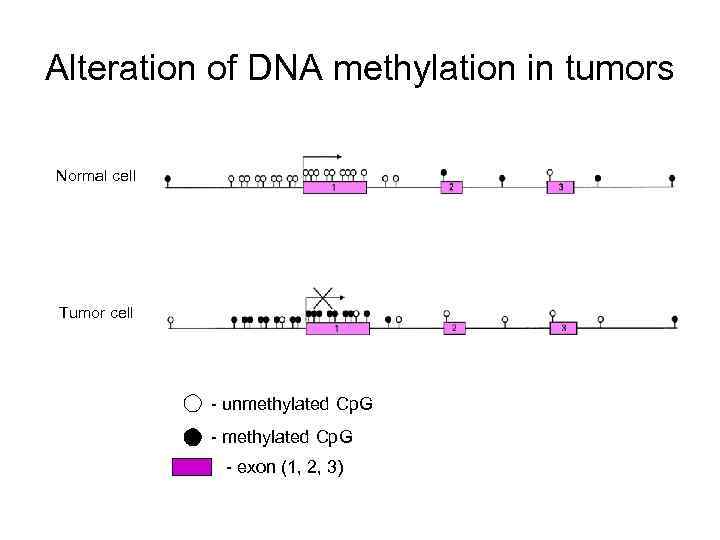 Alteration of DNA methylation in tumors Normal cell Tumor cell - unmethylated Cp. G - exon (1, 2, 3)
Alteration of DNA methylation in tumors Normal cell Tumor cell - unmethylated Cp. G - exon (1, 2, 3)
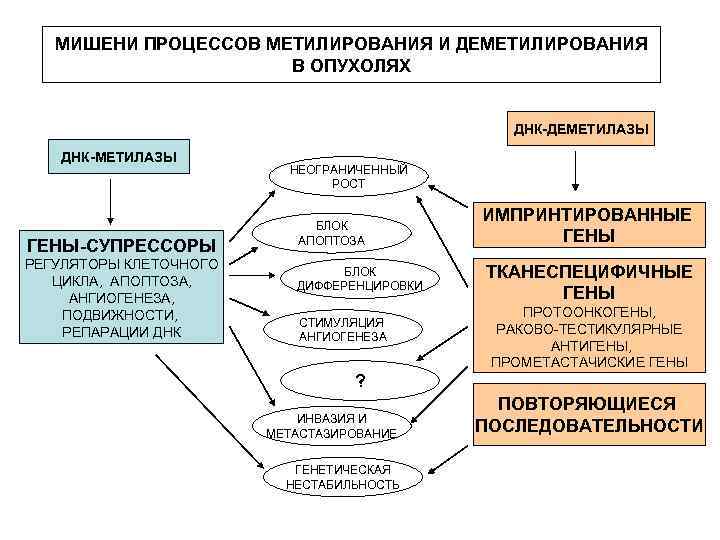 МИШЕНИ ПРОЦЕССОВ МЕТИЛИРОВАНИЯ И ДЕМЕТИЛИРОВАНИЯ В ОПУХОЛЯХ ДНК-ДЕМЕТИЛАЗЫ ДНК-МЕТИЛАЗЫ ГЕНЫ-СУПРЕССОРЫ РЕГУЛЯТОРЫ КЛЕТОЧНОГО ЦИКЛА, АПОПТОЗА, АНГИОГЕНЕЗА, ПОДВИЖНОСТИ, РЕПАРАЦИИ ДНК НЕОГРАНИЧЕННЫЙ РОСТ БЛОК АПОПТОЗА БЛОК ДИФФЕРЕНЦИРОВКИ СТИМУЛЯЦИЯ АНГИОГЕНЕЗА ИМПРИНТИРОВАННЫЕ ГЕНЫ ТКАНЕСПЕЦИФИЧНЫЕ ГЕНЫ ПРОТООНКОГЕНЫ, РАКОВО-ТЕСТИКУЛЯРНЫЕ АНТИГЕНЫ, ПРОМЕТАСТАЧИСКИЕ ГЕНЫ ? ИНВАЗИЯ И МЕТАСТАЗИРОВАНИЕ ГЕНЕТИЧЕСКАЯ НЕСТАБИЛЬНОСТЬ ПОВТОРЯЮЩИЕСЯ ПОСЛЕДОВАТЕЛЬНОСТИ
МИШЕНИ ПРОЦЕССОВ МЕТИЛИРОВАНИЯ И ДЕМЕТИЛИРОВАНИЯ В ОПУХОЛЯХ ДНК-ДЕМЕТИЛАЗЫ ДНК-МЕТИЛАЗЫ ГЕНЫ-СУПРЕССОРЫ РЕГУЛЯТОРЫ КЛЕТОЧНОГО ЦИКЛА, АПОПТОЗА, АНГИОГЕНЕЗА, ПОДВИЖНОСТИ, РЕПАРАЦИИ ДНК НЕОГРАНИЧЕННЫЙ РОСТ БЛОК АПОПТОЗА БЛОК ДИФФЕРЕНЦИРОВКИ СТИМУЛЯЦИЯ АНГИОГЕНЕЗА ИМПРИНТИРОВАННЫЕ ГЕНЫ ТКАНЕСПЕЦИФИЧНЫЕ ГЕНЫ ПРОТООНКОГЕНЫ, РАКОВО-ТЕСТИКУЛЯРНЫЕ АНТИГЕНЫ, ПРОМЕТАСТАЧИСКИЕ ГЕНЫ ? ИНВАЗИЯ И МЕТАСТАЗИРОВАНИЕ ГЕНЕТИЧЕСКАЯ НЕСТАБИЛЬНОСТЬ ПОВТОРЯЮЩИЕСЯ ПОСЛЕДОВАТЕЛЬНОСТИ
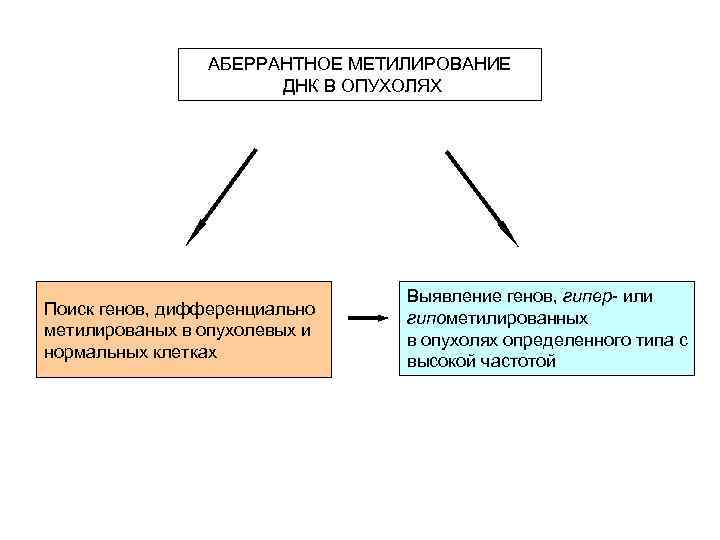 АБЕРРАНТНОЕ МЕТИЛИРОВАНИЕ ДНК В ОПУХОЛЯХ Поиск генов, дифференциально метилированых в опухолевых и нормальных клетках Выявление генов, гипер- или гипометилированных в опухолях определенного типа с высокой частотой
АБЕРРАНТНОЕ МЕТИЛИРОВАНИЕ ДНК В ОПУХОЛЯХ Поиск генов, дифференциально метилированых в опухолевых и нормальных клетках Выявление генов, гипер- или гипометилированных в опухолях определенного типа с высокой частотой
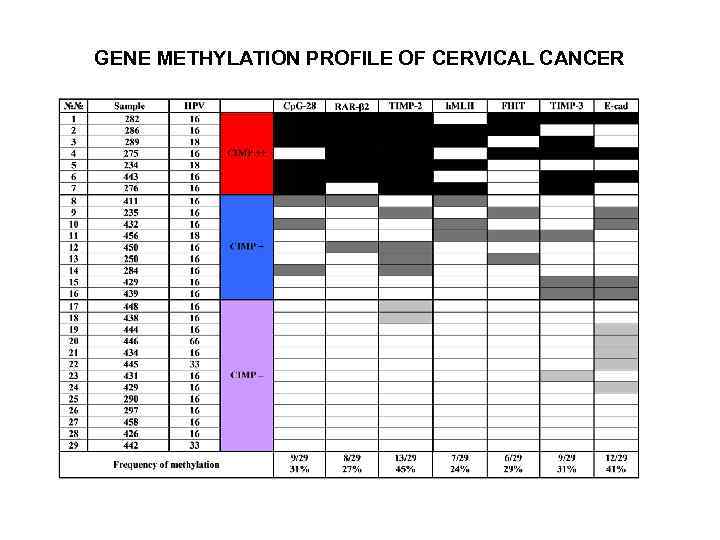 GENE METHYLATION PROFILE OF CERVICAL CANCER
GENE METHYLATION PROFILE OF CERVICAL CANCER
 SPLICING • Мутации в сайтах сплайсинга вызывают аберрантный сплайсинг, который часто выявляется в опухолях. • Сплайсинг в опухолях включает в себя следующие варианты: использование альтернативных индивидуальных сайтов сплайсинга, вовлечение альтернативных экзонов и альтернативных интронов • Альтернативный сплайсинг транскрипционных факторов (NRSF, андрогенный рецептор, ядерный коактиватор гормонов AIBI, хроматин ремоделирующий белок) • Альтернативный сплайсинг трансмембранных белков - два варианта Gбелков, FGFR 1, РНК-связующий белок PTB, белки, участвующие в клеточной адгезии - интегрины, CD 44 • Альтернативный сплайсинг секретируемых внеклеточных белков (активатор плазминогена, тенасцин С, фибронектин)
SPLICING • Мутации в сайтах сплайсинга вызывают аберрантный сплайсинг, который часто выявляется в опухолях. • Сплайсинг в опухолях включает в себя следующие варианты: использование альтернативных индивидуальных сайтов сплайсинга, вовлечение альтернативных экзонов и альтернативных интронов • Альтернативный сплайсинг транскрипционных факторов (NRSF, андрогенный рецептор, ядерный коактиватор гормонов AIBI, хроматин ремоделирующий белок) • Альтернативный сплайсинг трансмембранных белков - два варианта Gбелков, FGFR 1, РНК-связующий белок PTB, белки, участвующие в клеточной адгезии - интегрины, CD 44 • Альтернативный сплайсинг секретируемых внеклеточных белков (активатор плазминогена, тенасцин С, фибронектин)
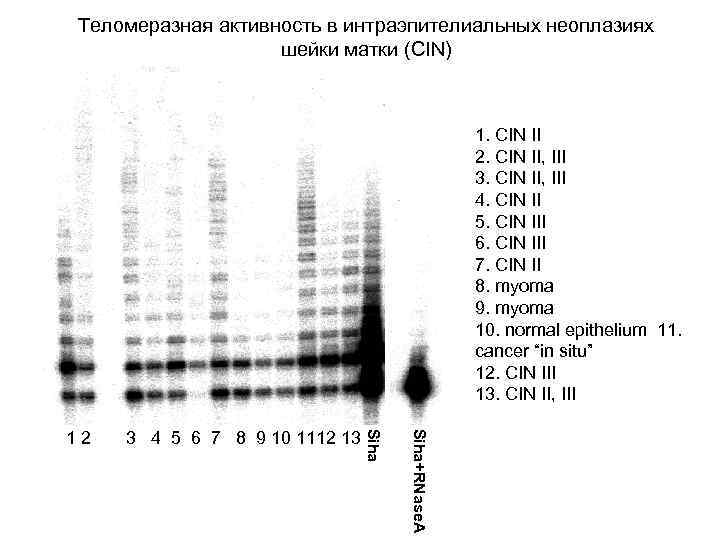 Теломеразная активность в интраэпителиальных неоплазиях шейки матки (CIN) 1. CIN II 2. CIN II, III 3. CIN II, III 4. CIN II 5. CIN III 6. CIN III 7. CIN II 8. myoma 9. myoma 10. normal epithelium 11. cancer “in situ” 12. CIN III 13. CIN II, III Siha+RNase. A 3 4 5 6 7 8 9 10 1112 13 Siha 12
Теломеразная активность в интраэпителиальных неоплазиях шейки матки (CIN) 1. CIN II 2. CIN II, III 3. CIN II, III 4. CIN II 5. CIN III 6. CIN III 7. CIN II 8. myoma 9. myoma 10. normal epithelium 11. cancer “in situ” 12. CIN III 13. CIN II, III Siha+RNase. A 3 4 5 6 7 8 9 10 1112 13 Siha 12
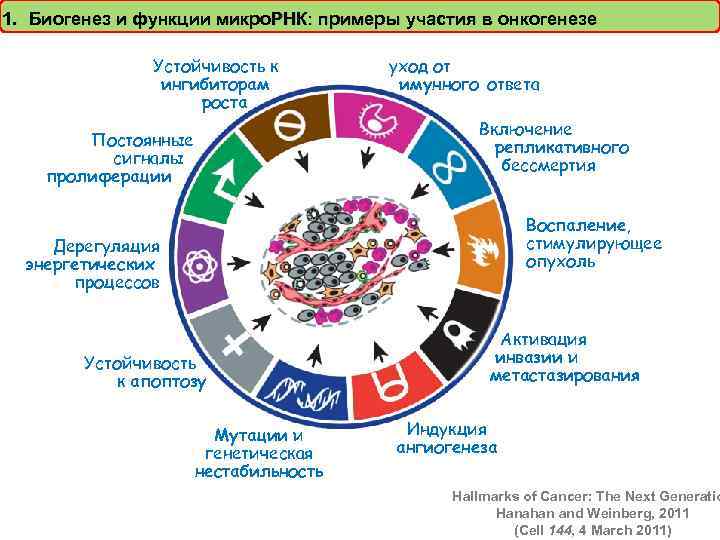 1. Биогенез и функции микро. РНК: примеры участия в онкогенезе Устойчивость к ингибиторам роста уход от имунного ответа Включение репликативного бессмертия Постоянные сигналы пролиферации Воспаление, стимулирующее опухоль Дерегуляция энергетических процессов Устойчивость к апоптозу Мутации и генетическая нестабильность Активация инвазии и метастазирования Индукция ангиогенеза Hallmarks of Cancer: The Next Generatio Hanahan and Weinberg, 2011 (Cell 144, 4 March 2011)
1. Биогенез и функции микро. РНК: примеры участия в онкогенезе Устойчивость к ингибиторам роста уход от имунного ответа Включение репликативного бессмертия Постоянные сигналы пролиферации Воспаление, стимулирующее опухоль Дерегуляция энергетических процессов Устойчивость к апоптозу Мутации и генетическая нестабильность Активация инвазии и метастазирования Индукция ангиогенеза Hallmarks of Cancer: The Next Generatio Hanahan and Weinberg, 2011 (Cell 144, 4 March 2011)
 Микро РНК (mir-RNA) • • • Mir-RNA, локализованные в участках генома, амплифицированных в опухолях, функционируют как онкогены, в то время как mir-RNA, локализованные в участках хроматина, делецированных в опухолях, функционируют как опухолевые супрессоры. Изменение в уровнях экспрессии mir-RNA обнаружено как в солидных опухолях, так и при лейкозах. Анормально экспрессирующиеся mir-RNA в опухолевых клетках в качестве мишеней используют транскрипты с генов, кодирующих бедки, играющие ключевую роль в канцерогенезе (онкоген Ras, анти-апоптотическиe гены BCL-2 и BCL-6, транскрипционный фактор E 2 F 1). Паттерн экспрессии mir-RNA коррелирует с клиническими и биологическими характеристиками опухолей (тип опухоли, уровень дифференцировки, агрессивность и ответ на терапию) Выявлены аномалии в mir-RNA и в генах, кодирующих эти mir-RNA, в герминальных клетках. Соответственно эти аномалии выявлены и в информационных РНК, являющихся мишенями для этих РНК. Поскольку каждая mir-RNA имеет множество мишеней, то наследуемые вариации в изменения транскрипции могут иметь серьезные последствия, в том числе и для синтеза белков, играющих ключевую роль в канцерогенезе. Можно предполагать, что этот феномен может иметь важное значение в фамильной предрасположенности к возникновению опухолей.
Микро РНК (mir-RNA) • • • Mir-RNA, локализованные в участках генома, амплифицированных в опухолях, функционируют как онкогены, в то время как mir-RNA, локализованные в участках хроматина, делецированных в опухолях, функционируют как опухолевые супрессоры. Изменение в уровнях экспрессии mir-RNA обнаружено как в солидных опухолях, так и при лейкозах. Анормально экспрессирующиеся mir-RNA в опухолевых клетках в качестве мишеней используют транскрипты с генов, кодирующих бедки, играющие ключевую роль в канцерогенезе (онкоген Ras, анти-апоптотическиe гены BCL-2 и BCL-6, транскрипционный фактор E 2 F 1). Паттерн экспрессии mir-RNA коррелирует с клиническими и биологическими характеристиками опухолей (тип опухоли, уровень дифференцировки, агрессивность и ответ на терапию) Выявлены аномалии в mir-RNA и в генах, кодирующих эти mir-RNA, в герминальных клетках. Соответственно эти аномалии выявлены и в информационных РНК, являющихся мишенями для этих РНК. Поскольку каждая mir-RNA имеет множество мишеней, то наследуемые вариации в изменения транскрипции могут иметь серьезные последствия, в том числе и для синтеза белков, играющих ключевую роль в канцерогенезе. Можно предполагать, что этот феномен может иметь важное значение в фамильной предрасположенности к возникновению опухолей.
 Микро РНК (mir-RNA) • • • Mir-RNA – распространенный класс негативных регуляторов активности генов, который контролирует такие клеточные функции как пролиферация, дифференцировка и апоптоз. Около половины mir-RNA картируется внутри “ломких” участков хромосом, которые ассоциированы с различными опухолями человека Mir-RNA могут функционировать и как онкогены, и как супрессоры и могут быть обозначены как “oncomirs” Экспрессионные профили mir-RNA являются более адекватным методом для классификации субтипов опухоли, чем экспрессионные профили для белоккодирующих генов. Дифференциальная экспрессия различных mir-RNA в различных опухолях может быть с успехом использована в диагностике и терапии опухолей. Генная терапия с использованием mir-RNA может быть эффективным подходом для подавления опухолевой прогрессии.
Микро РНК (mir-RNA) • • • Mir-RNA – распространенный класс негативных регуляторов активности генов, который контролирует такие клеточные функции как пролиферация, дифференцировка и апоптоз. Около половины mir-RNA картируется внутри “ломких” участков хромосом, которые ассоциированы с различными опухолями человека Mir-RNA могут функционировать и как онкогены, и как супрессоры и могут быть обозначены как “oncomirs” Экспрессионные профили mir-RNA являются более адекватным методом для классификации субтипов опухоли, чем экспрессионные профили для белоккодирующих генов. Дифференциальная экспрессия различных mir-RNA в различных опухолях может быть с успехом использована в диагностике и терапии опухолей. Генная терапия с использованием mir-RNA может быть эффективным подходом для подавления опухолевой прогрессии.
 В основе неопластической трансформации клеток лежат наследуемые изменения сигнальных путей, контролирующих размножение, жизнеспособность и миграцию клеток. Такие изменения могут возникать в результате а) мутаций или эпигенетических изменений генов, кодирующих компоненты таких сигнальных систем (изменения онкогенов, опухолевых супрессоров и др. ) б) экспрессии вирусных генов, продукты которых либо имитируют функцию клеточных онкогенов, либо активируют клеточные протоонкогены, либо связывают и инактивируют клеточные опухолевые супрессоры
В основе неопластической трансформации клеток лежат наследуемые изменения сигнальных путей, контролирующих размножение, жизнеспособность и миграцию клеток. Такие изменения могут возникать в результате а) мутаций или эпигенетических изменений генов, кодирующих компоненты таких сигнальных систем (изменения онкогенов, опухолевых супрессоров и др. ) б) экспрессии вирусных генов, продукты которых либо имитируют функцию клеточных онкогенов, либо активируют клеточные протоонкогены, либо связывают и инактивируют клеточные опухолевые супрессоры
 Каждая опухоль имеет индивидуальную генетическую программу
Каждая опухоль имеет индивидуальную генетическую программу
 Новые прапараты, созданные на основе знаний о мишенях • Ингибиторы металлопротеиназ (инвазия, метастазирование, ангиогенез) • Ингибиторы фарнезилтрансфераз (белки RAS) • Ингибиторы нерецепторных киназ (m. TOR, PKC, CDKs) • Генотерапевтические подходы)
Новые прапараты, созданные на основе знаний о мишенях • Ингибиторы металлопротеиназ (инвазия, метастазирование, ангиогенез) • Ингибиторы фарнезилтрансфераз (белки RAS) • Ингибиторы нерецепторных киназ (m. TOR, PKC, CDKs) • Генотерапевтические подходы)
 Новые прапараты: созданы на основании данных о мишенях • • HERCEPTIN (ERB 2/HER 2) IRESSA (EGFR/HER 1) ERLOTINIB (EGFR/HER 1) GLEEVEC(BCR/ABL) MABTERA (CD 20) AVASTIN (VEGF) VELCADE (Proteasome inhibitor) CELECOXIB (COX 2)
Новые прапараты: созданы на основании данных о мишенях • • HERCEPTIN (ERB 2/HER 2) IRESSA (EGFR/HER 1) ERLOTINIB (EGFR/HER 1) GLEEVEC(BCR/ABL) MABTERA (CD 20) AVASTIN (VEGF) VELCADE (Proteasome inhibitor) CELECOXIB (COX 2)
 Программа ЕNCODE (Genome Atlas, DNA encyclopedia) -проанализировано 84% генома -Картированы участки транскрипции, взаимодействия с транскрипционными факторами, влияющие на структур хроматина и модификацию гистонов -AML – все нормальные клетки содержат фоновый уровень мутаци, количество которых возрастает с возрастом; AML-геномы содержат сотни мутаций, но только малое количество связаны с обострением болезни -Рак легких – у курильщиков в 10 раз больше точечных мутаций, выявлены 54 гена, -Плоскоклеточный рак легких – 360 мутаций в экзонах, 165 геномных перестроек, 323 сегмента в реаранжировками в копийности; статистически часто повторяютмя мутации в 11 генах, из них р53 пркатически во всех образцах, мутации с потерец фунции в 5 генах с различной частотой -Рак молочной железы – молекулярные портреты по количеству копий ДНК, секвенированию ДНК, типах экспрессируемых РНК, типу экспрессируемых РНК, типам синтезируемых белков; выделено 4 основных класса, каждый из которыхъ обладает значительной гетерогенностью
Программа ЕNCODE (Genome Atlas, DNA encyclopedia) -проанализировано 84% генома -Картированы участки транскрипции, взаимодействия с транскрипционными факторами, влияющие на структур хроматина и модификацию гистонов -AML – все нормальные клетки содержат фоновый уровень мутаци, количество которых возрастает с возрастом; AML-геномы содержат сотни мутаций, но только малое количество связаны с обострением болезни -Рак легких – у курильщиков в 10 раз больше точечных мутаций, выявлены 54 гена, -Плоскоклеточный рак легких – 360 мутаций в экзонах, 165 геномных перестроек, 323 сегмента в реаранжировками в копийности; статистически часто повторяютмя мутации в 11 генах, из них р53 пркатически во всех образцах, мутации с потерец фунции в 5 генах с различной частотой -Рак молочной железы – молекулярные портреты по количеству копий ДНК, секвенированию ДНК, типах экспрессируемых РНК, типу экспрессируемых РНК, типам синтезируемых белков; выделено 4 основных класса, каждый из которыхъ обладает значительной гетерогенностью
 Микро. РНК (mir-RNA) 600 - 700 видов, не кодируют белков, выполняют только регуляторные функции, взаимодействуя в определенными участками ДНК, с которых осуществляется синтез РНК, кодирующих функционально важные клеточные белки Эти mir. RNA (различные типы)могут выполнять следующие функции: рак молочной железы –(mir 520/373 -RNA) опухолевый репрессор, (mir 200 b-RNA) – метастазирование и статус гормональных рецепторов колоректальный рак – (mir 103/107 -RNA)участвует в развитии метатстазов, (mir 135 b) – увеличение экспрессии и возможная терапевтическая мишень аденокарцинома легких (mir 29 b-RNA) и рак шейки матки (mir-133 b. RNA) – регуляция различных сигнальных путей, опухоли поджелудочной железы (mir 135 b)- новый биомаркер злокачественная глиома (mir 135)– селективный киллер опухолевых клеток нейробластома – (mir-204 -RNA) обеспечивает чувствительность к цисплатину рак простаты –(mir-let 7 -RNA)опухоль-супрессорные функции, (mir-708 RNA) - диагностический и прогностический маркер герминальные опухоли яичек – (mir-3471 -3) диагностика
Микро. РНК (mir-RNA) 600 - 700 видов, не кодируют белков, выполняют только регуляторные функции, взаимодействуя в определенными участками ДНК, с которых осуществляется синтез РНК, кодирующих функционально важные клеточные белки Эти mir. RNA (различные типы)могут выполнять следующие функции: рак молочной железы –(mir 520/373 -RNA) опухолевый репрессор, (mir 200 b-RNA) – метастазирование и статус гормональных рецепторов колоректальный рак – (mir 103/107 -RNA)участвует в развитии метатстазов, (mir 135 b) – увеличение экспрессии и возможная терапевтическая мишень аденокарцинома легких (mir 29 b-RNA) и рак шейки матки (mir-133 b. RNA) – регуляция различных сигнальных путей, опухоли поджелудочной железы (mir 135 b)- новый биомаркер злокачественная глиома (mir 135)– селективный киллер опухолевых клеток нейробластома – (mir-204 -RNA) обеспечивает чувствительность к цисплатину рак простаты –(mir-let 7 -RNA)опухоль-супрессорные функции, (mir-708 RNA) - диагностический и прогностический маркер герминальные опухоли яичек – (mir-3471 -3) диагностика
 БУДУЩЕЕ Последовательное использование различных схем лечения, направленных на группы генов, активирующихся на разных этапах опухолевого процесса, позволит продлевать жизнь больных раком на 15 -20 лет, превратив рак из летального в хроническое заболевание.
БУДУЩЕЕ Последовательное использование различных схем лечения, направленных на группы генов, активирующихся на разных этапах опухолевого процесса, позволит продлевать жизнь больных раком на 15 -20 лет, превратив рак из летального в хроническое заболевание.


