Основные понятия_1_лекция.ppt
- Количество слайдов: 15
 Основные понятия химии
Основные понятия химии
 Химия - наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи. Вещество - материальное образование, состоящее из элементарных частиц, имеющих собственную массу или массу покоя
Химия - наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава и структуры, а также взаимные переходы между этими процессами и другими формами движения материи. Вещество - материальное образование, состоящее из элементарных частиц, имеющих собственную массу или массу покоя
 Вещества простые сложные Молекулы простых веществ состоят из атомов одного элемента, в состав молекул сложных веществ входят атомы двух или более разных элементов.
Вещества простые сложные Молекулы простых веществ состоят из атомов одного элемента, в состав молекул сложных веществ входят атомы двух или более разных элементов.
 Химический элемент - определенный сорт атомов, имеющих определенное одинаковое количество протонов в ядре. Массовое число Заряд ядра
Химический элемент - определенный сорт атомов, имеющих определенное одинаковое количество протонов в ядре. Массовое число Заряд ядра
 Изотопы - атомы, содержащие одинаковое количество протонов, но отличающиеся содержанием нейтронов. Химическое соединение - однородное вещество постоянного или переменного состава с качественно своеобразным химическим или кристаллохимическим строением.
Изотопы - атомы, содержащие одинаковое количество протонов, но отличающиеся содержанием нейтронов. Химическое соединение - однородное вещество постоянного или переменного состава с качественно своеобразным химическим или кристаллохимическим строением.
 Химическим строением называется количественный и качественный состав молекул вещества, а также последовательность и порядок связи атомов. Изомерия: NH 3 OH*HOSO 2 и NH 4*HOSO 3; C 2 H 5 OH и CH 3 OCH 3; бутен-1, бутен-2, метилпропен, циклобутан и метилциклопропан).
Химическим строением называется количественный и качественный состав молекул вещества, а также последовательность и порядок связи атомов. Изомерия: NH 3 OH*HOSO 2 и NH 4*HOSO 3; C 2 H 5 OH и CH 3 OCH 3; бутен-1, бутен-2, метилпропен, циклобутан и метилциклопропан).
 Кристаллохимическое строение порядок расположения и природа связи атомов в пределах элементарной ячейки, их взаимное влияние, а также распределение электронной плотности, величины эффективных зарядов. В узлах кристаллической решетки Na. Cl располагаются катионы натрия и анионы хлора, так, что каждый из них окружен шестью ионами другого.
Кристаллохимическое строение порядок расположения и природа связи атомов в пределах элементарной ячейки, их взаимное влияние, а также распределение электронной плотности, величины эффективных зарядов. В узлах кристаллической решетки Na. Cl располагаются катионы натрия и анионы хлора, так, что каждый из них окружен шестью ионами другого.
 Химические явления (реакция )превращение одних веществ в другие путем изменения состава и химического строения. Атомная масса - среднее значение массы атома химического элемента, выраженное в атомных единицах массы. За атомную единицу массы принята 1/12 часть массы атома изотопа углерода 12 С (1, 67 10 -24 г).
Химические явления (реакция )превращение одних веществ в другие путем изменения состава и химического строения. Атомная масса - среднее значение массы атома химического элемента, выраженное в атомных единицах массы. За атомную единицу массы принята 1/12 часть массы атома изотопа углерода 12 С (1, 67 10 -24 г).
 Моль- количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько их содержится в 12 г изотопа 12 С (число Авогадро, N = 6, 02 1023 ). A Молярная масса - масса 1 моль вещества. Численно равна молекулярной (атомной) массе, выраженной атомных единицах.
Моль- количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько их содержится в 12 г изотопа 12 С (число Авогадро, N = 6, 02 1023 ). A Молярная масса - масса 1 моль вещества. Численно равна молекулярной (атомной) массе, выраженной атомных единицах.
 Основные законы Закон постоянства состава - состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры состав вещества зависит от условий его получения и предыдущей обработки.
Основные законы Закон постоянства состава - состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры состав вещества зависит от условий его получения и предыдущей обработки.
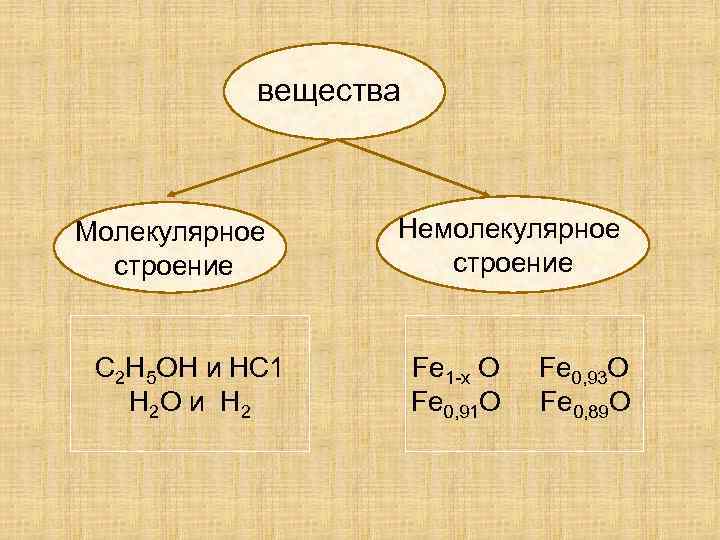 вещества Молекулярное строение С 2 Н 5 ОН и НС 1 Н 2 О и Н 2 Немолекулярное строение Fe 1 -x O Fe 0, 91 O Fe 0, 93 O Fe 0, 89 O
вещества Молекулярное строение С 2 Н 5 ОН и НС 1 Н 2 О и Н 2 Немолекулярное строение Fe 1 -x O Fe 0, 91 O Fe 0, 93 O Fe 0, 89 O
 Закон сохранения массы: Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции (М. В. Ломоносов, 1760). А. Эйнштейн (1905): E=mc 2 Закон Авогадро (1811): В равных объемах различных газов при одинаковых условиях содержится равное количество молекул
Закон сохранения массы: Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции (М. В. Ломоносов, 1760). А. Эйнштейн (1905): E=mc 2 Закон Авогадро (1811): В равных объемах различных газов при одинаковых условиях содержится равное количество молекул
 Следствия из закона Авогадро: 1. Молекулярная масса газа или пара равна произведению его плотности по отношению к любому другому газу на молекулярную массу последнего. 2. Один моль любого газа при нормальных условиях (Н. У. ) занимает объем 22, 4 литра (Vm). Н. У. : давление, Р=101, 3 к. Па, температура, Т=0 о. С, 273 К.
Следствия из закона Авогадро: 1. Молекулярная масса газа или пара равна произведению его плотности по отношению к любому другому газу на молекулярную массу последнего. 2. Один моль любого газа при нормальных условиях (Н. У. ) занимает объем 22, 4 литра (Vm). Н. У. : давление, Р=101, 3 к. Па, температура, Т=0 о. С, 273 К.
 Закон эквивалентов: Массы взаимодействующих веществ пропорциональны их эквивалентным массам. Эквивалент – условная или реальная частица, равнозначная одному катиону водорода в кислотно -основных процессах, или одному электрону в окислительновосстановительных реакциях
Закон эквивалентов: Массы взаимодействующих веществ пропорциональны их эквивалентным массам. Эквивалент – условная или реальная частица, равнозначная одному катиону водорода в кислотно -основных процессах, или одному электрону в окислительновосстановительных реакциях
 Молярная эквивалентная масса 1 моль-эквивалента вещества. Расчет молярных эквивалентных масс сложных веществ:
Молярная эквивалентная масса 1 моль-эквивалента вещества. Расчет молярных эквивалентных масс сложных веществ:


