23910___1.ppt
- Количество слайдов: 27
 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 7 класс Тимощенко Олег
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 7 класс Тимощенко Олег
 Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент определенный вид атомов
Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент определенный вид атомов

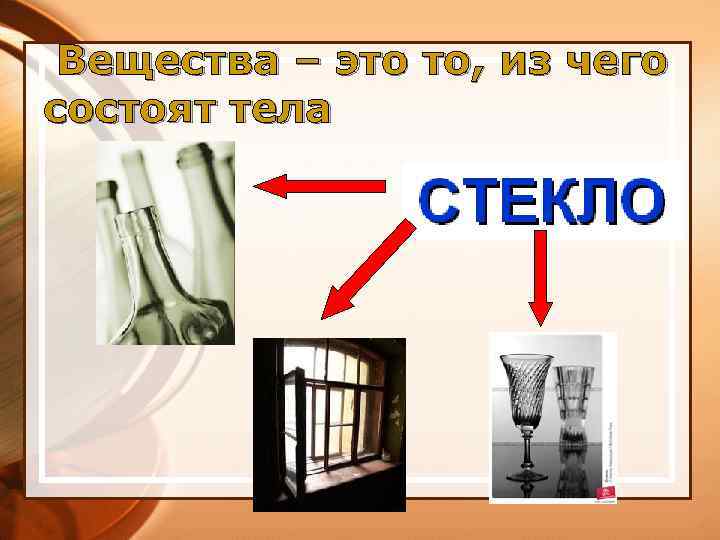 Вещества – это то, из чего состоят тела
Вещества – это то, из чего состоят тела
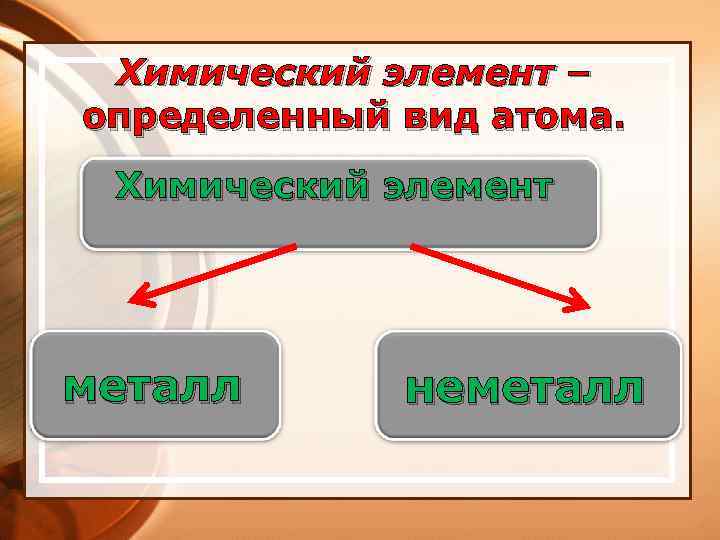 Химический элемент – определенный вид атома. Химический элемент металл неметалл
Химический элемент – определенный вид атома. Химический элемент металл неметалл
 Ион - Заряженная частица вещества NA+, Cl- , SO 4 2 -, Al 3+
Ион - Заряженная частица вещества NA+, Cl- , SO 4 2 -, Al 3+
 Вещества Простые Сложные это вещества, состоящие из атомов одного химического элемента Cu это вещества, состоящие из атомов двух или нескольких химических элементов H H H Cl
Вещества Простые Сложные это вещества, состоящие из атомов одного химического элемента Cu это вещества, состоящие из атомов двух или нескольких химических элементов H H H Cl
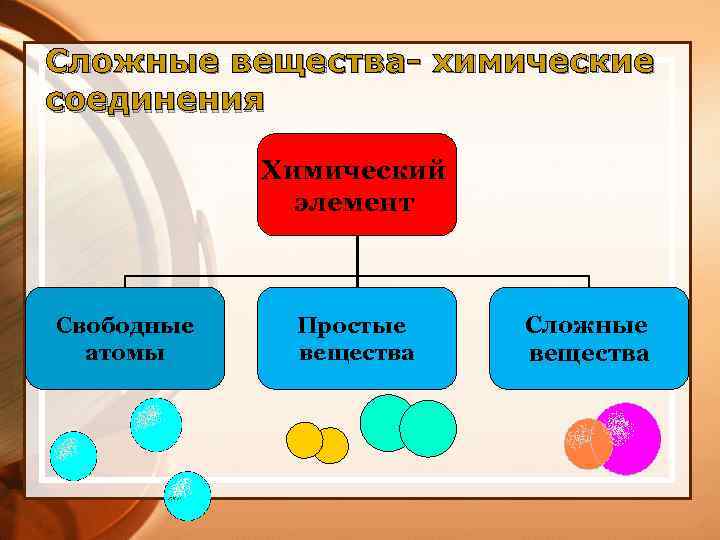 Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
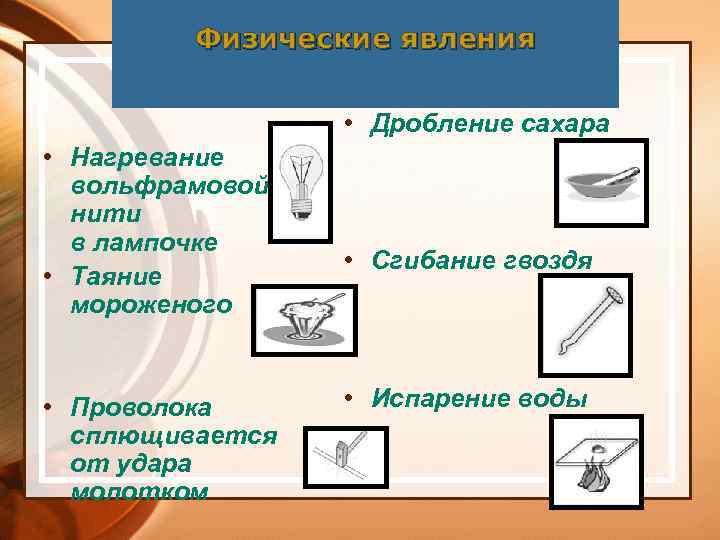 Физические явления • Дробление сахара • Нагревание вольфрамовой нити в лампочке • Таяние мороженого • Проволока сплющивается от удара молотком • Сгибание гвоздя • Испарение воды
Физические явления • Дробление сахара • Нагревание вольфрамовой нити в лампочке • Таяние мороженого • Проволока сплющивается от удара молотком • Сгибание гвоздя • Испарение воды
 Химические явления 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелеона 3. Протухание яйца 4. Ржавление гвоздя 5. Горение костра •
Химические явления 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелеона 3. Протухание яйца 4. Ржавление гвоздя 5. Горение костра •
 Признаки химической реакции 1. 2. 3. 4. 5. Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
Признаки химической реакции 1. 2. 3. 4. 5. Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
 ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: • В пределах одного периода слева направо металлические свойства ослабевают; • А неметаллические возрастают. ПОТОМУ ЧТО: 1. Растет число электронов на внешнем уровне; 2. Радиус атома уменьшается; 3. Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: • В пределах одной и той же группы сверху вниз металлические свойства усиливаются; • А неметаллические уменьшаются. ПОТОМУ ЧТО: 1. Число электронов на внешнем уровне одинаково; 2. Радиус атома увеличивается; 3. Число энергетических уровней в атомах растет.
ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: • В пределах одного периода слева направо металлические свойства ослабевают; • А неметаллические возрастают. ПОТОМУ ЧТО: 1. Растет число электронов на внешнем уровне; 2. Радиус атома уменьшается; 3. Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: • В пределах одной и той же группы сверху вниз металлические свойства усиливаются; • А неметаллические уменьшаются. ПОТОМУ ЧТО: 1. Число электронов на внешнем уровне одинаково; 2. Радиус атома увеличивается; 3. Число энергетических уровней в атомах растет.
 ВАЛЕНТНОСТЬ ЭЛЕМЕНТЫ 1 П Ш H, Na, Li, Mg, O, Ca, Al K, Ag Ba, Zn Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная.
ВАЛЕНТНОСТЬ ЭЛЕМЕНТЫ 1 П Ш H, Na, Li, Mg, O, Ca, Al K, Ag Ba, Zn Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная.
 Химические формулы • Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Химические формулы • Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
 Химическая формула.
Химическая формула.
 Индекс • показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н 2 О, НСl, СН 4, HNO 3, Cu. S, Na 3 PO 4, P 2 O 5, Na 2 SO 4
Индекс • показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н 2 О, НСl, СН 4, HNO 3, Cu. S, Na 3 PO 4, P 2 O 5, Na 2 SO 4
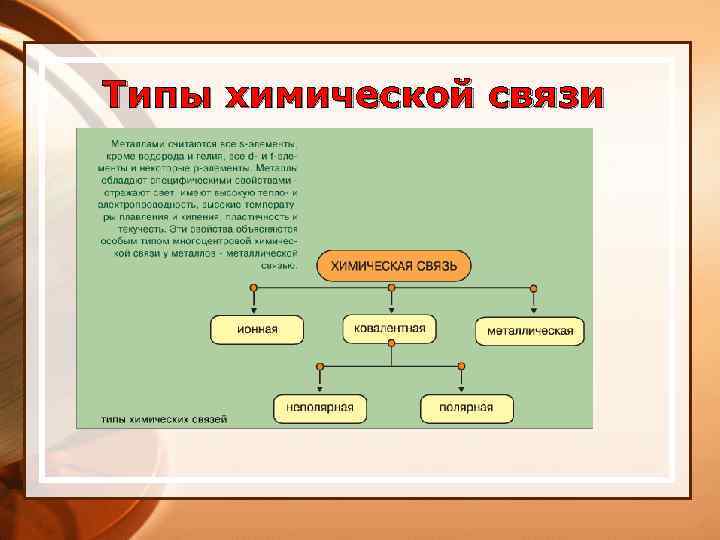 Типы химической связи
Типы химической связи

 Металлы Fe a Pb N Ba Zn Hg K Al Ag Cu Mn Ca Au Mg
Металлы Fe a Pb N Ba Zn Hg K Al Ag Cu Mn Ca Au Mg
 Неметаллы Cl S H F J Br N C P O Si
Неметаллы Cl S H F J Br N C P O Si
 Au 79 Порядковый (атомный) номер Относительная атомная масса А r- 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода (округляем до целого)
Au 79 Порядковый (атомный) номер Относительная атомная масса А r- 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода (округляем до целого)
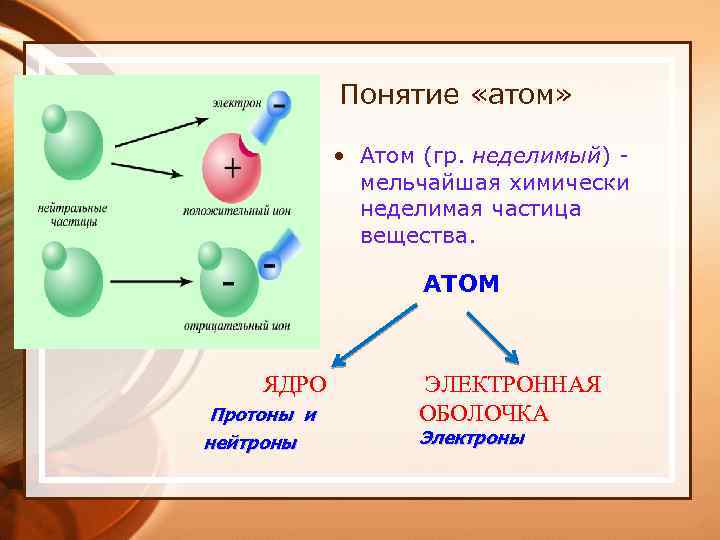 Понятие «атом» • Атом (гр. неделимый) мельчайшая химически неделимая частица вещества. ЯДРО Протоны и нейтроны АТОМ ЭЛЕКТРОННАЯ ОБОЛОЧКА Электроны
Понятие «атом» • Атом (гр. неделимый) мельчайшая химически неделимая частица вещества. ЯДРО Протоны и нейтроны АТОМ ЭЛЕКТРОННАЯ ОБОЛОЧКА Электроны
 ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: • Атом – это микрочастица, которая имеет форму шара. • Атом – это сложная система, состоящая из ядра и электронов. • Ядра находятся в центре атома и имеют очень маленький размер. • Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. • Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. • Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: • Атом – это микрочастица, которая имеет форму шара. • Атом – это сложная система, состоящая из ядра и электронов. • Ядра находятся в центре атома и имеют очень маленький размер. • Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. • Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. • Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.
 Как измерить вещество? • Необходимо точно знать число частиц вещества, т. е. его количество • Единица количества вещества – 1 моль, т. е. 23 частиц 6 ● 10
Как измерить вещество? • Необходимо точно знать число частиц вещества, т. е. его количество • Единица количества вещества – 1 моль, т. е. 23 частиц 6 ● 10
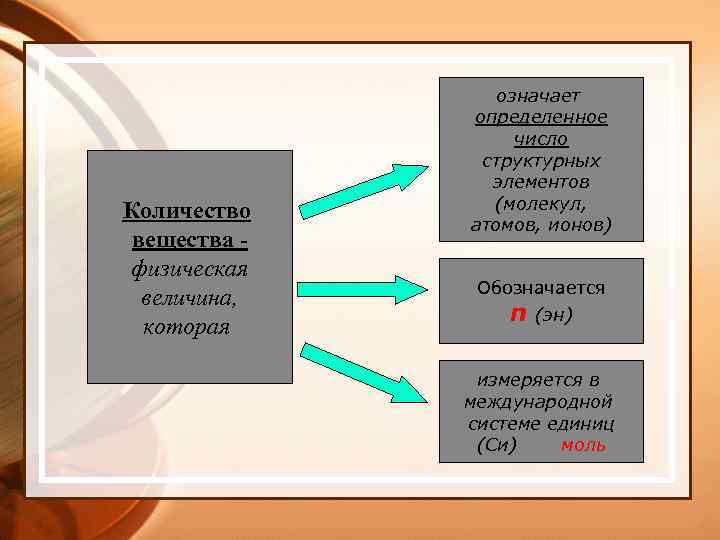 Количество вещества физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n (эн) измеряется в международной системе единиц (Си) моль
Количество вещества физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n (эн) измеряется в международной системе единиц (Си) моль
 Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.
Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.
 Спасибо за внимание!
Спасибо за внимание!


