Осн.понятия и законы.pptx
- Количество слайдов: 36
 Основные понятия и законы химии. Стехиометрия (от др. -греч. στοιχεῖον «элемент» + μετρέω «измерять» ) — раздел химии об элементарных соотношениях в веществе и между веществами в химических реакциях. Термин "стехиометрия" ввёл И. Рихтер в 1793 году.
Основные понятия и законы химии. Стехиометрия (от др. -греч. στοιχεῖον «элемент» + μετρέω «измерять» ) — раздел химии об элементарных соотношениях в веществе и между веществами в химических реакциях. Термин "стехиометрия" ввёл И. Рихтер в 1793 году.
 Вещество ( в философском смысле) – материальное образование, состоящее из элементарных частиц, имеющих массу покоя. Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними. Свойства веществ: физические химические - агрегатное состояние; - характеризуют химические явления, - цвет; происходящие с веществами, т. е. реакции, - плотность (ρ); которые характеризуют данное вещество. - электропроводность; - теплопроводность; - температура кипения; - температура плавления и т. д.
Вещество ( в философском смысле) – материальное образование, состоящее из элементарных частиц, имеющих массу покоя. Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними. Свойства веществ: физические химические - агрегатное состояние; - характеризуют химические явления, - цвет; происходящие с веществами, т. е. реакции, - плотность (ρ); которые характеризуют данное вещество. - электропроводность; - теплопроводность; - температура кипения; - температура плавления и т. д.
 Основы атомно – молекулярного учения. Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Основы атомно – молекулярного учения. Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
 Михаил Васильевич Ломоносов Джон Дальтон (8. 11. 1711 — 4. 04. 1765) (6. 09. 1766 — 27. 07. 1844) Существование атомов было доказано эмпирическим путём в конце 18 – начале 19 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
Михаил Васильевич Ломоносов Джон Дальтон (8. 11. 1711 — 4. 04. 1765) (6. 09. 1766 — 27. 07. 1844) Существование атомов было доказано эмпирическим путём в конце 18 – начале 19 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
 В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились.
 Основные положения атомномолекулярного учения: Все вещества, существующие в природе, представляют собой совокупность громадного числа частиц (атомов, молекул, ионов). В зависимости от типа частиц, все вещества условно подразделяют: Вещества Молекулярного строения Немолекулярного строения l Атомного Ионного Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула. Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Основные положения атомномолекулярного учения: Все вещества, существующие в природе, представляют собой совокупность громадного числа частиц (атомов, молекул, ионов). В зависимости от типа частиц, все вещества условно подразделяют: Вещества Молекулярного строения Немолекулярного строения l Атомного Ионного Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула. Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
 l Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.
l Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.
 l Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии. Агрегатные состояния вещества Твёрдое (Е вн. к<< Е вн. п) Жидкое (Евн. к ≈ Е вн. п) Газообразное (Евн. к >> Евн. п) В настоящее время выделяют ещё два агрегатных состояния вещества: плазма и жидкокристаллическое состояние
l Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии. Агрегатные состояния вещества Твёрдое (Е вн. к<< Е вн. п) Жидкое (Евн. к ≈ Е вн. п) Газообразное (Евн. к >> Евн. п) В настоящее время выделяют ещё два агрегатных состояния вещества: плазма и жидкокристаллическое состояние
 Вещество – совокупность большого числа частиц ( атомов, молекул, ионов…). Вещество чистое или индивидуальное – однородное вещество постоянного или переменного состава, обладающее постоянством физических и химических свойств. Чистое или индивидуальное вещество отличается от смеси веществ тем, что не может быть разделено на составные части физическими методами
Вещество – совокупность большого числа частиц ( атомов, молекул, ионов…). Вещество чистое или индивидуальное – однородное вещество постоянного или переменного состава, обладающее постоянством физических и химических свойств. Чистое или индивидуальное вещество отличается от смеси веществ тем, что не может быть разделено на составные части физическими методами
 Сколько вещества? оценить порцию вещества количественно можно : l по массе (m, г, кг) масса характеризует способность тела, участвовать в гравитационных взаимодействиях l по объему (V, см 3, дм 3) объем - пространственная характеристика тела l по числу частиц (N), ( , моль) количество вещества характеризует тело как совокупность частиц
Сколько вещества? оценить порцию вещества количественно можно : l по массе (m, г, кг) масса характеризует способность тела, участвовать в гравитационных взаимодействиях l по объему (V, см 3, дм 3) объем - пространственная характеристика тела l по числу частиц (N), ( , моль) количество вещества характеризует тело как совокупность частиц
 Моль – единица количества вещества l
Моль – единица количества вещества l
 Вещества атомного строения. Основные сведения о строении атома. Атомное ядро. Основной структурной единицей веществ атомного строения является атом. Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом. Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами. Нуклоны – общее название двух типов частиц, протонов и нейтронов. С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона. Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
Вещества атомного строения. Основные сведения о строении атома. Атомное ядро. Основной структурной единицей веществ атомного строения является атом. Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом. Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами. Нуклоны – общее название двух типов частиц, протонов и нейтронов. С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона. Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
 Относительная атомная масса l l l Аr - величина, показывающая во сколько раз масса атома больше 1/12 массы атома 12 С 1 а. е. м. – 1/12 массы атома 12 С Относительная молекулярная масса показывает во сколько раз масса молекулы больше 1/12 массы атома 12 С
Относительная атомная масса l l l Аr - величина, показывающая во сколько раз масса атома больше 1/12 массы атома 12 С 1 а. е. м. – 1/12 массы атома 12 С Относительная молекулярная масса показывает во сколько раз масса молекулы больше 1/12 массы атома 12 С
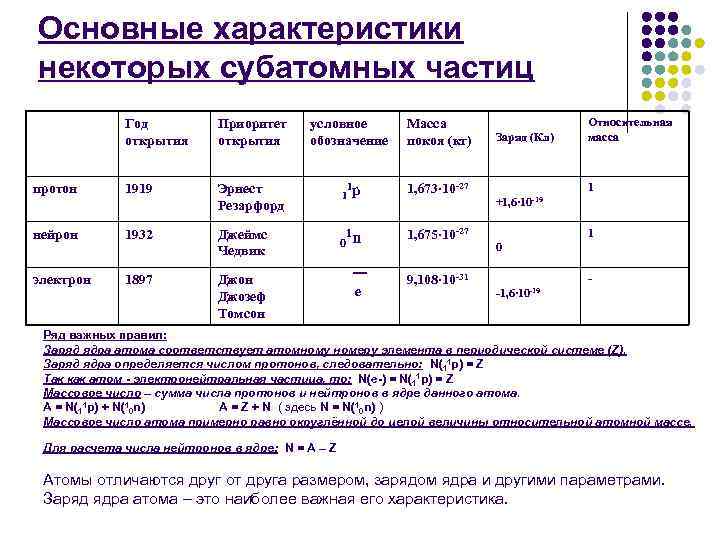 Основные характеристики некоторых субатомных частиц Год открытия Приоритет открытия протон 1919 Эрнест Резарфорд нейрон 1932 Джеймс Чедвик электрон 1897 Джон Джозеф Томсон условное обозначение Масса покоя (кг) Заряд (Кл) Относительная масса 1 1 р 1, 673∙ 10 -27 +1, 6∙ 10 -19 1 1 n 1, 675∙ 10 -27 0 1 e 9, 108∙ 10 -31 -1, 6∙ 10 -19 - 0 Ряд важных правил: Заряд ядра атома соответствует атомному номеру элемента в периодической системе (Z). Заряд ядра определяется числом протонов, следовательно: N(11 p) = Z Так как атом - электронейтральная частица, то: N(e-) = N(11 p) = Z Массовое число – сумма числа протонов и нейтронов в ядре данного атома. А = N(11 p) + N(10 n) А = Z + N ( здесь N = N(10 n) ) Массовое число атома примерно равно округлённой до целой величины относительной атомной массе. Для расчета числа нейтронов в ядре: N = A – Z Атомы отличаются друг от друга размером, зарядом ядра и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика.
Основные характеристики некоторых субатомных частиц Год открытия Приоритет открытия протон 1919 Эрнест Резарфорд нейрон 1932 Джеймс Чедвик электрон 1897 Джон Джозеф Томсон условное обозначение Масса покоя (кг) Заряд (Кл) Относительная масса 1 1 р 1, 673∙ 10 -27 +1, 6∙ 10 -19 1 1 n 1, 675∙ 10 -27 0 1 e 9, 108∙ 10 -31 -1, 6∙ 10 -19 - 0 Ряд важных правил: Заряд ядра атома соответствует атомному номеру элемента в периодической системе (Z). Заряд ядра определяется числом протонов, следовательно: N(11 p) = Z Так как атом - электронейтральная частица, то: N(e-) = N(11 p) = Z Массовое число – сумма числа протонов и нейтронов в ядре данного атома. А = N(11 p) + N(10 n) А = Z + N ( здесь N = N(10 n) ) Массовое число атома примерно равно округлённой до целой величины относительной атомной массе. Для расчета числа нейтронов в ядре: N = A – Z Атомы отличаются друг от друга размером, зарядом ядра и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика.
 Химический элемент – вид атомов, с определённым зарядом ядра. Химический элемент обозначается символом. По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г): Водород Hydrogenium H ; Ртуть Hydrargyrum Hg Эти буквенные обозначения называются химическими знаками или химическими символами. Большинство химических элементов в природе, представляет собой “смесь” атомов с одним и тем же зарядом ядра, но разным массовым числом. l Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т. е разным числом нейтронов в ядре. l Содержание изотопов элемента Х в природе может быть оценено в массовых или мольных долях.
Химический элемент – вид атомов, с определённым зарядом ядра. Химический элемент обозначается символом. По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г): Водород Hydrogenium H ; Ртуть Hydrargyrum Hg Эти буквенные обозначения называются химическими знаками или химическими символами. Большинство химических элементов в природе, представляет собой “смесь” атомов с одним и тем же зарядом ядра, но разным массовым числом. l Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т. е разным числом нейтронов в ядре. l Содержание изотопов элемента Х в природе может быть оценено в массовых или мольных долях.
 Понятия, характеризующие состав системы l
Понятия, характеризующие состав системы l
 Относительная атомная масса элемента находится с учетом природного изотопного состава: Ar(Х)=Ar(Х 1)∗ (X)+Ar(Х 2)∗ (X 2)+…+Ar(Хn) (Xn) Относительная атомная масса элемента – величина показывающая во сколько раз средняя масса атома элемента, найденная с учетом природного изотопного состава, больше 1/12 массы атома углерода 12 С.
Относительная атомная масса элемента находится с учетом природного изотопного состава: Ar(Х)=Ar(Х 1)∗ (X)+Ar(Х 2)∗ (X 2)+…+Ar(Хn) (Xn) Относительная атомная масса элемента – величина показывающая во сколько раз средняя масса атома элемента, найденная с учетом природного изотопного состава, больше 1/12 массы атома углерода 12 С.
 Закон постоянства состава. Бертолиды и дальтониды Закон постоянства состава (Ж. Л. Пруст, 1801— 1808 гг. ) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Закон выполняется для дальтонидов – веществ молекулярного строение ( постоянного состава), не выполняется для бертолидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде Fe. O (вместо более точной формулы Fe 1 -x. O).
Закон постоянства состава. Бертолиды и дальтониды Закон постоянства состава (Ж. Л. Пруст, 1801— 1808 гг. ) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Закон выполняется для дальтонидов – веществ молекулярного строение ( постоянного состава), не выполняется для бертолидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде Fe. O (вместо более точной формулы Fe 1 -x. O).
 Формула вещества - условная запись , отражающая состав вещества с помощью символов химических элементов и индексов l
Формула вещества - условная запись , отражающая состав вещества с помощью символов химических элементов и индексов l
 Относительная молекулярная масса вещества Мr – величина, показывающая , во сколько раз средняя масса молекулы или формульной единицы, найденная с учетом природного изотопного состава больше 1/12 массы атома углерода 12 С Молярная масса вещества М(г/моль) – масса 1 моль формульных единиц вещества, найденная с учетом природного изотопного состава
Относительная молекулярная масса вещества Мr – величина, показывающая , во сколько раз средняя масса молекулы или формульной единицы, найденная с учетом природного изотопного состава больше 1/12 массы атома углерода 12 С Молярная масса вещества М(г/моль) – масса 1 моль формульных единиц вещества, найденная с учетом природного изотопного состава
 Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи. Одним из первых его сформулировал древнегреческий философ Эмпедокл (V век до н. э. ): Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться. Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего. Позже аналогичный тезис высказывали Демокрит, Аристотель и Эпикур (в пересказе Лукреция Кара). Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. В 1630 году Жан Рэ (Jean Rey, 1583— 1645), доктор из Перигора, писал Мерсенну: Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи. Одним из первых его сформулировал древнегреческий философ Эмпедокл (V век до н. э. ): Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться. Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего. Позже аналогичный тезис высказывали Демокрит, Аристотель и Эпикур (в пересказе Лукреция Кара). Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. В 1630 году Жан Рэ (Jean Rey, 1583— 1645), доктор из Перигора, писал Мерсенну: Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
 Михайло Васильевич Ломоносов В отчете о своих работах за 1756 год Ломоносов записывает: «Между разными химическими опытами, которых журнал на 13 листах, деланы опыты в заплавленных накрепко стеклянных сосудах, чтобы исследовать: прибывает ли вес металлов от чистого жару. Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожженного металла остается в одной мере» .
Михайло Васильевич Ломоносов В отчете о своих работах за 1756 год Ломоносов записывает: «Между разными химическими опытами, которых журнал на 13 листах, деланы опыты в заплавленных накрепко стеклянных сосудах, чтобы исследовать: прибывает ли вес металлов от чистого жару. Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожженного металла остается в одной мере» .
 Антуан Лоран Лавуазье l l В 1773 году Лавуазье превращал в «известь» (окись) олово в герметически закрытом сосуде, нагревая металл при помощи большого зажигательного стекла. Общий вес сосуда с оловом после превращения олова в «известь» оставался неизмененным. Лавуазье нашел кроме того, что количество взятого воздуха после опыта уменьшается на 1/5 и что остающийся воздух не поддерживает горения и дыхания. Позже это позволило ученому определить состав воздуха. В конце XVIII века научное сообщество признало закон сохранения массы (закон Ломоносова-Лавуазье) и отказалось от теории флогистона.
Антуан Лоран Лавуазье l l В 1773 году Лавуазье превращал в «известь» (окись) олово в герметически закрытом сосуде, нагревая металл при помощи большого зажигательного стекла. Общий вес сосуда с оловом после превращения олова в «известь» оставался неизмененным. Лавуазье нашел кроме того, что количество взятого воздуха после опыта уменьшается на 1/5 и что остающийся воздух не поддерживает горения и дыхания. Позже это позволило ученому определить состав воздуха. В конце XVIII века научное сообщество признало закон сохранения массы (закон Ломоносова-Лавуазье) и отказалось от теории флогистона.
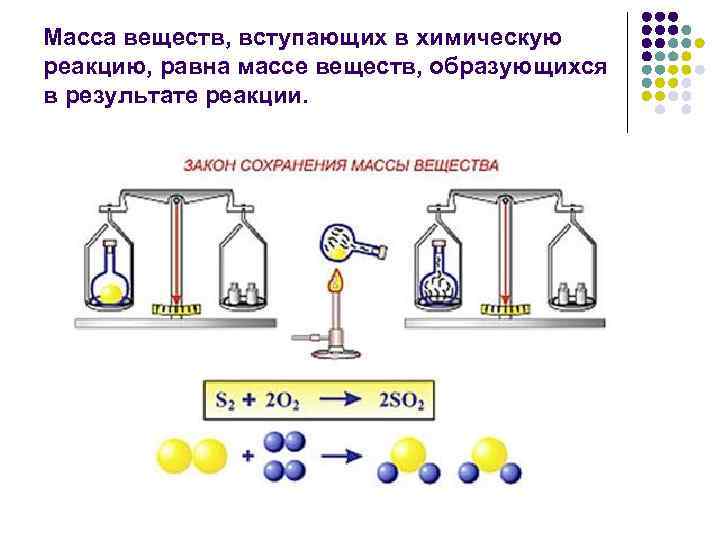 Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
 Уравнение химической реакции l l На основании этого закона химические реакции можно отобразить с помощью уравнений химических реакций, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ. СН 4+2 О 2=СО 2+2 Н 2 О 1 моль СН 4 сгорает в 2 -х моль О 2 получается 1 моль СО 2 и 2 моль Н 2 О На основании уравнений химических реакций проводятся стехиометрические расчеты.
Уравнение химической реакции l l На основании этого закона химические реакции можно отобразить с помощью уравнений химических реакций, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ. СН 4+2 О 2=СО 2+2 Н 2 О 1 моль СН 4 сгорает в 2 -х моль О 2 получается 1 моль СО 2 и 2 моль Н 2 О На основании уравнений химических реакций проводятся стехиометрические расчеты.
 Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. Альбертом Энштейном в работе 1905 года «К электродинамике движущихся тел» появилась формула E=mc 2, определяющая связь массы и энергии. Термохимическое уравнение реакции показывает тепловой эффект, соответствующий участию в реакции веществ в количествах равных стехиометрическим коэффициентам: СН 4 + 2 О 2 = СО 2 + 2 Н 2 О + 890 к. Дж При сгорании 1 моль метана убыль массы составит: 890000/(3*108)2= 9, 9*10 -12 кг
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. Альбертом Энштейном в работе 1905 года «К электродинамике движущихся тел» появилась формула E=mc 2, определяющая связь массы и энергии. Термохимическое уравнение реакции показывает тепловой эффект, соответствующий участию в реакции веществ в количествах равных стехиометрическим коэффициентам: СН 4 + 2 О 2 = СО 2 + 2 Н 2 О + 890 к. Дж При сгорании 1 моль метана убыль массы составит: 890000/(3*108)2= 9, 9*10 -12 кг
 Газовые законы l
Газовые законы l
 Закон объемных отношений l В 1808 Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал так называемый закон объемных отношений, согласно которому соотношение между объемами реагирующих газов выражается простыми целыми числами.
Закон объемных отношений l В 1808 Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал так называемый закон объемных отношений, согласно которому соотношение между объемами реагирующих газов выражается простыми целыми числами.
 Закон Авогадро «В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул» . Следствия: l При нормальных условиях, т. е. при 0 °C (273 К) и 101, 3 к. Па, объём 1 моля газа, равен 22, 4 л. Этот объём называют молярным объёмом газа Vm l отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов - относительная плотность газа и обозначается D. Так как молярные объемы всех газов одинаковы, то отношение молярных масс любой пары газов также равна этой постоянной: Относительная плотность газа X по газу Y: DY(X)=M(X)/M(Y) l
Закон Авогадро «В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул» . Следствия: l При нормальных условиях, т. е. при 0 °C (273 К) и 101, 3 к. Па, объём 1 моля газа, равен 22, 4 л. Этот объём называют молярным объёмом газа Vm l отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов - относительная плотность газа и обозначается D. Так как молярные объемы всех газов одинаковы, то отношение молярных масс любой пары газов также равна этой постоянной: Относительная плотность газа X по газу Y: DY(X)=M(X)/M(Y) l
 Смеси газов (X)= (Х)/ (смеси) (Х)=V(X)/V(смеси) (Х)= (Х) Средняя молярная масса смеси газов Х и. Y может быть найдена: M(смеси Х, Y)= (Х)M(X)+ (Y)M(Y) M(смеси Х, Y)= (X)M(X)+ (Y)M(Y) Молярная масса смеси газов – масса 1 моль молекул смеси, мольная или объемная доля каждого газа – это его количество в 1 моль смеси.
Смеси газов (X)= (Х)/ (смеси) (Х)=V(X)/V(смеси) (Х)= (Х) Средняя молярная масса смеси газов Х и. Y может быть найдена: M(смеси Х, Y)= (Х)M(X)+ (Y)M(Y) M(смеси Х, Y)= (X)M(X)+ (Y)M(Y) Молярная масса смеси газов – масса 1 моль молекул смеси, мольная или объемная доля каждого газа – это его количество в 1 моль смеси.
 Закон эквивалентов В конце 18 века И. Рихтер дал частную формулировку закона эквивалента для реакции нейтрализации, а в более общей форме закон сформулировал английский химик У. Волластон в 1807.
Закон эквивалентов В конце 18 века И. Рихтер дал частную формулировку закона эквивалента для реакции нейтрализации, а в более общей форме закон сформулировал английский химик У. Волластон в 1807.
 Закон эквивалентов в формулировке Рихтера, определял, в каких весовых отношениях соединяются кислоты с основаниями при образовании солей: Если одно и то же количество определенной кислоты нейтрализуется различными количествами двух или большого числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты. Отсюда следует, что кислоты и основания соединяются в определенных (эквивалентных) отношениях независимо от своей природы, а найденные таким образом пропорции являются физически постоянными.
Закон эквивалентов в формулировке Рихтера, определял, в каких весовых отношениях соединяются кислоты с основаниями при образовании солей: Если одно и то же количество определенной кислоты нейтрализуется различными количествами двух или большого числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты. Отсюда следует, что кислоты и основания соединяются в определенных (эквивалентных) отношениях независимо от своей природы, а найденные таким образом пропорции являются физически постоянными.
 Закон эквивалентов в 19 веке l l Вещества реагируют друг с другом в количествах пропорционально их химическим эквивалентам Эквивалент – масса вещества, равнозначная в химических реакциях 8 г кислорода или 1 г водорода
Закон эквивалентов в 19 веке l l Вещества реагируют друг с другом в количествах пропорционально их химическим эквивалентам Эквивалент – масса вещества, равнозначная в химических реакциях 8 г кислорода или 1 г водорода
 Современные понятия, связанные с законом эквивалентов l l Эквивалент – это реальная или условная частица, приходящаяся на 1 электрон, участвующий в реакции или обеспечивающий ее протекание. Эквивалент – это реальная или условная частица, которая в окислительновосстановительной реакции отдает или принимает один электрон, а в реакции ионного обмена или нейтрализации равнозначна одному Н+ или ОН-
Современные понятия, связанные с законом эквивалентов l l Эквивалент – это реальная или условная частица, приходящаяся на 1 электрон, участвующий в реакции или обеспечивающий ее протекание. Эквивалент – это реальная или условная частица, которая в окислительновосстановительной реакции отдает или принимает один электрон, а в реакции ионного обмена или нейтрализации равнозначна одному Н+ или ОН-
 Современные понятия, связанные с законом эквивалентов Фактор эквивалентности (1/z) – показывает, какую часть от формульной единицы составляет эквивалент Молярная масса эквивалента Х ( М(1/z. X)- масса вещества Х в количестве 1 моль эквивалента
Современные понятия, связанные с законом эквивалентов Фактор эквивалентности (1/z) – показывает, какую часть от формульной единицы составляет эквивалент Молярная масса эквивалента Х ( М(1/z. X)- масса вещества Х в количестве 1 моль эквивалента
 Современная формулировка закона эквивалентов l l l массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам); массы веществ, участвующих в химическом процессе, относятся как их эквивалентные массы; Количества вещества эквивалента участников реакции одинаково.
Современная формулировка закона эквивалентов l l l массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам); массы веществ, участвующих в химическом процессе, относятся как их эквивалентные массы; Количества вещества эквивалента участников реакции одинаково.


