1 Основные понятия электрохимии.ppt
- Количество слайдов: 32
 Основные понятия электрохимии Лекция 1
Основные понятия электрохимии Лекция 1
 Предмет электрохимии • • Объединяет два вида явлений 6 Электрические Химические Любой химический процесс связан с перегруппировкой химических частиц (атомных ядер и электронов), поэтому химические и электрические явления неразделимы
Предмет электрохимии • • Объединяет два вида явлений 6 Электрические Химические Любой химический процесс связан с перегруппировкой химических частиц (атомных ядер и электронов), поэтому химические и электрические явления неразделимы
 Окисли тельно-восстанови тельные реа кции (ОВР) • это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. • В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого (сопряженно). окислитель + e− ↔ сопряжённый восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем.
Окисли тельно-восстанови тельные реа кции (ОВР) • это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. • В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого (сопряженно). окислитель + e− ↔ сопряжённый восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем.
 Виды окислительно-восстановительных реакций • Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: • Н 2 S + Cl 2 → S + 2 HCl • Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2 H 2 O → 2 H 2 + O 2 • Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например: Cl 2 + H 2 O → HCl. O + HCl • Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например: NH 4 NO 3 → N 2 O + 2 H 2 O
Виды окислительно-восстановительных реакций • Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: • Н 2 S + Cl 2 → S + 2 HCl • Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2 H 2 O → 2 H 2 + O 2 • Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например: Cl 2 + H 2 O → HCl. O + HCl • Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например: NH 4 NO 3 → N 2 O + 2 H 2 O
 Окисление • В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
Окисление • В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
 Восстановление • Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Восстановление • Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
 Отличие ОВР от электрохимических реакций • Электрохимические процессы, как и окислительновосстановительные реакции (ОВР), связаны с изменением степени окисления веществ, участвующих в реакции. • Основное отличие ОВР от электрохимических процессов заключается в том, что процессы восстановления и окисления пространственно разделены и перенос электронов может быть зафиксирован как некоторый ток (в гальваническом элементе, при коррозии) или, наоборот, электрохимический процесс может происходить за счет внешнего источника тока (электролиз).
Отличие ОВР от электрохимических реакций • Электрохимические процессы, как и окислительновосстановительные реакции (ОВР), связаны с изменением степени окисления веществ, участвующих в реакции. • Основное отличие ОВР от электрохимических процессов заключается в том, что процессы восстановления и окисления пространственно разделены и перенос электронов может быть зафиксирован как некоторый ток (в гальваническом элементе, при коррозии) или, наоборот, электрохимический процесс может происходить за счет внешнего источника тока (электролиз).
 Основное отличие химических и электрохимических реакций • При электрохимической реакции большая часть энергии превращается в электрическую • При химической реакции – в тепловую энергию
Основное отличие химических и электрохимических реакций • При электрохимической реакции большая часть энергии превращается в электрическую • При химической реакции – в тепловую энергию
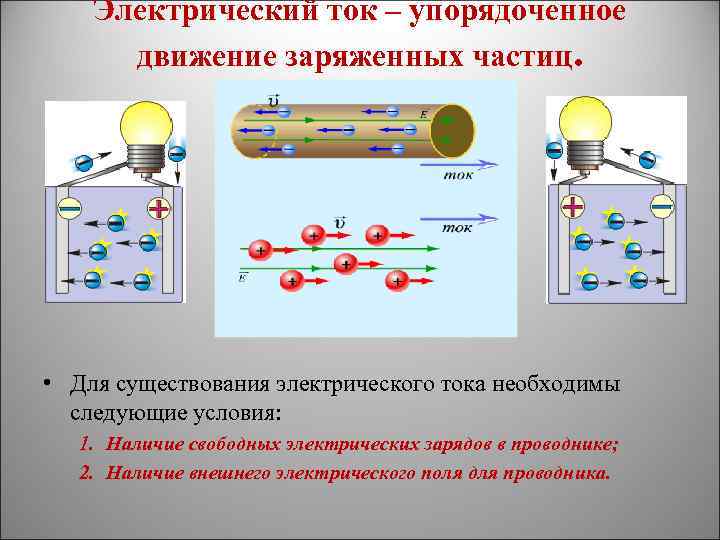 Электрический ток – упорядоченное движение заряженных частиц. • Для существования электрического тока необходимы следующие условия: 1. Наличие свободных электрических зарядов в проводнике; 2. Наличие внешнего электрического поля для проводника.
Электрический ток – упорядоченное движение заряженных частиц. • Для существования электрического тока необходимы следующие условия: 1. Наличие свободных электрических зарядов в проводнике; 2. Наличие внешнего электрического поля для проводника.
 Электрохимическая цепь • для протекания электрохимической реакции необходима • электрохимическая цепь, • существенными компонентами которой являются электроды и электролит (водный или неводный).
Электрохимическая цепь • для протекания электрохимической реакции необходима • электрохимическая цепь, • существенными компонентами которой являются электроды и электролит (водный или неводный).
 Электроды • Под электродами обычно понимают или собственно некий проводник или систему, состоящую из проводника, погруженного в раствор электролита • Электрод, который принимает электроны называется анодом • Электрод, на котором происходит реакция восстановления (отдача электронов) называется катодом
Электроды • Под электродами обычно понимают или собственно некий проводник или систему, состоящую из проводника, погруженного в раствор электролита • Электрод, который принимает электроны называется анодом • Электрод, на котором происходит реакция восстановления (отдача электронов) называется катодом
 Электродный потенциал • . При контакте металлического проводника с раствором электролита на его поверхности возникает некий заряд, за счет переноса электронов, что приводит к возникновению разности электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Эта разность называется электродным потенциалом.
Электродный потенциал • . При контакте металлического проводника с раствором электролита на его поверхности возникает некий заряд, за счет переноса электронов, что приводит к возникновению разности электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Эта разность называется электродным потенциалом.
 Определение электрохимии • Это раздел химической науки, в котором изучаются физико-химические свойства ионных систем, а также процессы и явления на границе раздела фаз с участием заряженных частиц. • Она изучает все формы взаимодействия между подвижными заряженными частицами в конденсированных фазах как в состоянии равновесия, так и протекании реакций на границах раздела фаз и в объеме фаз.
Определение электрохимии • Это раздел химической науки, в котором изучаются физико-химические свойства ионных систем, а также процессы и явления на границе раздела фаз с участием заряженных частиц. • Она изучает все формы взаимодействия между подвижными заряженными частицами в конденсированных фазах как в состоянии равновесия, так и протекании реакций на границах раздела фаз и в объеме фаз.
 Электролиты • Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. • К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. • К электролитам относятся соли, основания и кислоты. • Электролиты являются проводниками втрого рода. Передача электричества в них осуществляется движением положительных и отрицательных ионов • В проводниках первого рода (металлах) – движением электронного газа.
Электролиты • Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. • К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. • К электролитам относятся соли, основания и кислоты. • Электролиты являются проводниками втрого рода. Передача электричества в них осуществляется движением положительных и отрицательных ионов • В проводниках первого рода (металлах) – движением электронного газа.
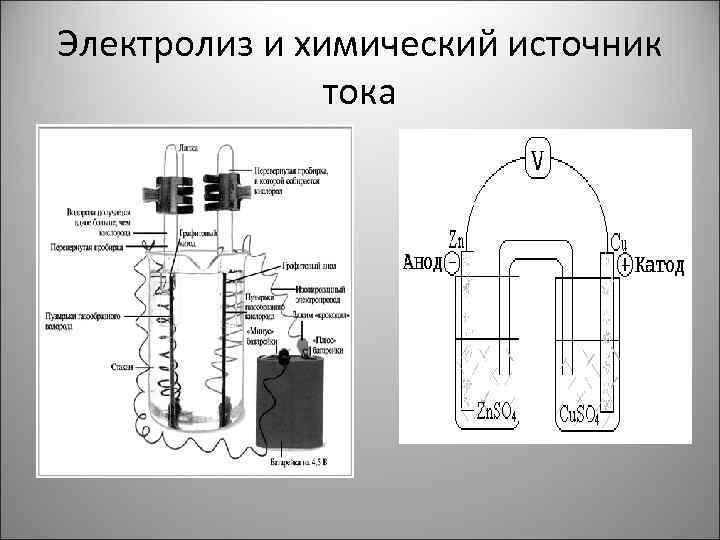 Электролиз и химический источник тока
Электролиз и химический источник тока
 Электролиз воды • Н 2 О = Н 2 + 0, 5 О 2 • происходит электрохимическая реакция - на катоде: • 2 Н 2 О = 2 ОН- + Н 2 ; • на аноде: • 2 Н 2 О = О 2 + 4 Н+
Электролиз воды • Н 2 О = Н 2 + 0, 5 О 2 • происходит электрохимическая реакция - на катоде: • 2 Н 2 О = 2 ОН- + Н 2 ; • на аноде: • 2 Н 2 О = О 2 + 4 Н+
 Модель Гротгуса (эстафетный механизм 1806 г. ) • передача иона водорода по цепочке связанных водородными связями молекул воды проходит в несколько стадий ( «эстафетный» механизм), • скорость «движения протонов в растворителе» определяется скоростью поляризации молекул растворителя. • В электролите существуют свободные заряженные частицы - ионы
Модель Гротгуса (эстафетный механизм 1806 г. ) • передача иона водорода по цепочке связанных водородными связями молекул воды проходит в несколько стадий ( «эстафетный» механизм), • скорость «движения протонов в растворителе» определяется скоростью поляризации молекул растворителя. • В электролите существуют свободные заряженные частицы - ионы
 Ионы • ионы (от греч. ion - идущий, странник), одноатомные или многоатомные частицы, несущие электрический заряд, например Н+, Li+, Аl 3+, NH 4+, F-, SO 42 -. Положительные ионы называют катионами (от греч. kation, буквально - идущий вниз), отрицательные - анионами (от греч. anion, буквально идущий вверх).
Ионы • ионы (от греч. ion - идущий, странник), одноатомные или многоатомные частицы, несущие электрический заряд, например Н+, Li+, Аl 3+, NH 4+, F-, SO 42 -. Положительные ионы называют катионами (от греч. kation, буквально - идущий вниз), отрицательные - анионами (от греч. anion, буквально идущий вверх).
 1. Растворы электролитов • Законы Рауля справедливы лишь для очень разбавленных растворов, при условии, что в растворе они не диссоциируют на ионы (т. е. они неэлектролиты). • Растворы электролитов (соли, кислоты, основания) обладают способностью проводить электрический ток. • В 1887 г. Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах электролитов превышает вычисленное по уравнению Росм = СМ·R·T Подобное отклонение измеренных величин от вычисленных наблюдается также для tкип и tзам растворов электролитов.
1. Растворы электролитов • Законы Рауля справедливы лишь для очень разбавленных растворов, при условии, что в растворе они не диссоциируют на ионы (т. е. они неэлектролиты). • Растворы электролитов (соли, кислоты, основания) обладают способностью проводить электрический ток. • В 1887 г. Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах электролитов превышает вычисленное по уравнению Росм = СМ·R·T Подобное отклонение измеренных величин от вычисленных наблюдается также для tкип и tзам растворов электролитов.
 Вант-Гофф Якоб Хендрик (1852 – 1911) • первая Нобелевская премия по химии, 1901 г.
Вант-Гофф Якоб Хендрик (1852 – 1911) • первая Нобелевская премия по химии, 1901 г.
 Доказательства существования ионов в растворе • Вант-Гофф ввел поправочный множитель i, названный изотоническим коэффициентом. Растворы с одинаковым осмотическим давлением называют изотоническими. • Вводя i в уравнения, получаем соотношения, пригодные для описания свойств разбавленных растворов всех веществ: Росм = i·СМ·R·T Ткип = i·Е·Сm Р = i·Р 0·N 1 Тзам = i·К·Сm • Изотонический коэффициент i зависит от природы раствора и его концентрации, но для одного и того же раствора значение i одинаково во всех 4 -х приведенных уравнениях. • В растворах электролитов изотонический коэффициент всегда больше 1
Доказательства существования ионов в растворе • Вант-Гофф ввел поправочный множитель i, названный изотоническим коэффициентом. Растворы с одинаковым осмотическим давлением называют изотоническими. • Вводя i в уравнения, получаем соотношения, пригодные для описания свойств разбавленных растворов всех веществ: Росм = i·СМ·R·T Ткип = i·Е·Сm Р = i·Р 0·N 1 Тзам = i·К·Сm • Изотонический коэффициент i зависит от природы раствора и его концентрации, но для одного и того же раствора значение i одинаково во всех 4 -х приведенных уравнениях. • В растворах электролитов изотонический коэффициент всегда больше 1
 Доказательства существования ионов в растворе • В растворах электролитов давление пара значительно превышает расчетное • Криоскопические и эбулиоскопические параметры также выше расчетных • Все реакции нейтрализации сопровождаются одинаковым тепловым эффектом = 57, 3 к. Дж/моль, что соответствует одному процессу: • Н+ + ОН- = Н 2 О
Доказательства существования ионов в растворе • В растворах электролитов давление пара значительно превышает расчетное • Криоскопические и эбулиоскопические параметры также выше расчетных • Все реакции нейтрализации сопровождаются одинаковым тепловым эффектом = 57, 3 к. Дж/моль, что соответствует одному процессу: • Н+ + ОН- = Н 2 О
 Основные положения теории Аррениуса • При растворении молекулы неорганических и органических кислот, оснований и солей, они диссоциируют на ионы. • Процесс диссоциации - обратимый
Основные положения теории Аррениуса • При растворении молекулы неорганических и органических кислот, оснований и солей, они диссоциируют на ионы. • Процесс диссоциации - обратимый
 Ограничения теории • Ионы в растворе ведут • Не обсуждаются себя подобно физические причины молекулам диссоциации идеального газа. • Ионы не взаимодействуют друг с другом
Ограничения теории • Ионы в растворе ведут • Не обсуждаются себя подобно физические причины молекулам диссоциации идеального газа. • Ионы не взаимодействуют друг с другом
 Степень диссоциации • Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита пользуются степенью электролитической диссоциации . • Степень электролитической диссоциации ( ) равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества: α = (Cдис/Собщ)· 100%
Степень диссоциации • Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита пользуются степенью электролитической диссоциации . • Степень электролитической диссоциации ( ) равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества: α = (Cдис/Собщ)· 100%
 • Изотонический коэффициент и степень диссоциации электролита связаны друг с другом. Пусть раствор содержит 1 моль электролита (т. е. число молекул равно NA). Если каждая молекула распадется на n ионов, то: число образующихся ионов = NA·n·α число недиссоциировавших молекул = = NA – NA·α = NA·(1 – α) Отношение общего числа молекул к числу молекул растворенного вещества дает изотонический коэффициент i: i = [NA·n·α + NA·(1 – α)] / NA = (n – 1)·α + 1 α = (i – 1) / (n – 1)
• Изотонический коэффициент и степень диссоциации электролита связаны друг с другом. Пусть раствор содержит 1 моль электролита (т. е. число молекул равно NA). Если каждая молекула распадется на n ионов, то: число образующихся ионов = NA·n·α число недиссоциировавших молекул = = NA – NA·α = NA·(1 – α) Отношение общего числа молекул к числу молекул растворенного вещества дает изотонический коэффициент i: i = [NA·n·α + NA·(1 – α)] / NA = (n – 1)·α + 1 α = (i – 1) / (n – 1)
 Сила электролитов • По степени диссоциации электролиты разделяют на сильные, слабые и средней силы: >30% ‑ сильные, 3%< <30% ‑ средние, <3% ‑ слабые. Все указанные значения относятся к 0, 1 М раствору. • Сильные электролиты: почти все соли, гидроксиды щелочных и щелочно-земельных металлов, HNO 3, H 2 SO 4, HCl, HI, HBr.
Сила электролитов • По степени диссоциации электролиты разделяют на сильные, слабые и средней силы: >30% ‑ сильные, 3%< <30% ‑ средние, <3% ‑ слабые. Все указанные значения относятся к 0, 1 М раствору. • Сильные электролиты: почти все соли, гидроксиды щелочных и щелочно-земельных металлов, HNO 3, H 2 SO 4, HCl, HI, HBr.
 Ионные равновесия в растворах электролитов • Диссоциация обратимый процесс, поэтому для диссоциации веществ в растворе справедливы общие законы равновесия: Kn. Am n. Km+ + m. An- Константа равновесия в этом случае называется константой диссоциации:
Ионные равновесия в растворах электролитов • Диссоциация обратимый процесс, поэтому для диссоциации веществ в растворе справедливы общие законы равновесия: Kn. Am n. Km+ + m. An- Константа равновесия в этом случае называется константой диссоциации:
 Закон разбавления Оствальда Пусть растворен в воде электролит КА, тогда КА К+ + А‑ Если растворен 1 моль электролита, то [K+] = [A‑] = α·CM= α·(n/V); [KA] = (1–α)·(n/V).
Закон разбавления Оствальда Пусть растворен в воде электролит КА, тогда КА К+ + А‑ Если растворен 1 моль электролита, то [K+] = [A‑] = α·CM= α·(n/V); [KA] = (1–α)·(n/V).
 Зависимость степени диссоциации от концентрации слабого электролита • Если <<1, то • Вывод: степень диссоциации слабого электролита при разбавлении возрастает. Для слабых электролитов • (Кд<10 -4 при СМ=0, 1 М) получим <3%. • Ионное равновесие можно сместить добавлением сильного электролита, имеющего одноименный ион.
Зависимость степени диссоциации от концентрации слабого электролита • Если <<1, то • Вывод: степень диссоциации слабого электролита при разбавлении возрастает. Для слабых электролитов • (Кд<10 -4 при СМ=0, 1 М) получим <3%. • Ионное равновесие можно сместить добавлением сильного электролита, имеющего одноименный ион.
 Ограничения • Уравнения справедливы только для растворов симметричных бинарных электролитов (типа Na. Cl) • Для несимметричных электролитов или их смеси математические соотношения закона действия масс усложняются • Теория Аррениуса применяется для трактовки ионных равновесий, лежащих в основе качественного и количественного анализа
Ограничения • Уравнения справедливы только для растворов симметричных бинарных электролитов (типа Na. Cl) • Для несимметричных электролитов или их смеси математические соотношения закона действия масс усложняются • Теория Аррениуса применяется для трактовки ионных равновесий, лежащих в основе качественного и количественного анализа
 Недостатки теории Аррениуса • Игнорирование взаимодействия ионов с диполями растворителя, отсутствие учета ион - дипольного взаимодействия, что приводит к отсутствию объяснения процесса образования ионов и устойчивости ионных систем • Игнорирование ион - ионного взаимодействия (сил кулоновского притяжения и отталкивания), что приводило к расчетным ошибкам
Недостатки теории Аррениуса • Игнорирование взаимодействия ионов с диполями растворителя, отсутствие учета ион - дипольного взаимодействия, что приводит к отсутствию объяснения процесса образования ионов и устойчивости ионных систем • Игнорирование ион - ионного взаимодействия (сил кулоновского притяжения и отталкивания), что приводило к расчетным ошибкам


