Kinetics-1-v1.pptx
- Количество слайдов: 25

Основные положения кинетики электродных процессов СПб. ГУ 2010 1

Лекция 1 Природа отдельных стадий электродного процесса и их последовательность; Процессы транспорта вещества, химические и электрохимические стадии; Зависимость скорости электродного процесса от потенциала электрода при медленном протекании электрохимической стадии; Уравнения теории замедленного разряда и вывод уравнений Тафеля; Кинетический вывод уравнения Нернста. 2
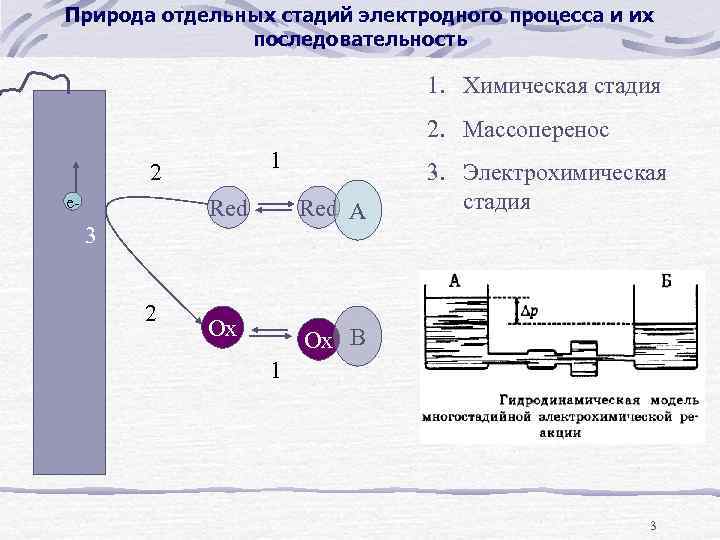
Природа отдельных стадий электродного процесса и их последовательность 1. Химическая стадия 2. Массоперенос 1 2 e- Red A Ox Ox B 3 2 3. Электрохимическая стадия 1 3

Электровосстановление ионов гидроксония из слабых растворов кислот в присутствии переменных концентраций солей щелочных металлов 2 H 3 O+ + 2 e H 2 (1. 1) 1. Диффузия Н 3 О+ к электроду; 2. (H 3 O+)s + e Hads (1. 1 а); 2 Hads H 2 (1. 1 b); и/или 3 -2. Hads Н 1/2 H 2 (1. 1 c); 3 -1. 4

Общие положения кинетики Результирующая скорость той или иной стадии есть разность таковых для прямого и обратного направления протекания этой стадии. Применительно к стадии собственно электрохимического превращения последнее означает что ее скорость, каковой является плотность тока i, записывается как разность между ее катодной ik и анодной ia составляющими: i = i k - i a ( 1. 2 ) Сдвиг потенциала при протекании тока, обусловленный медленностью стадии заряда-ионизации, называется электрохимической поляризацией или перенапряжением η 5
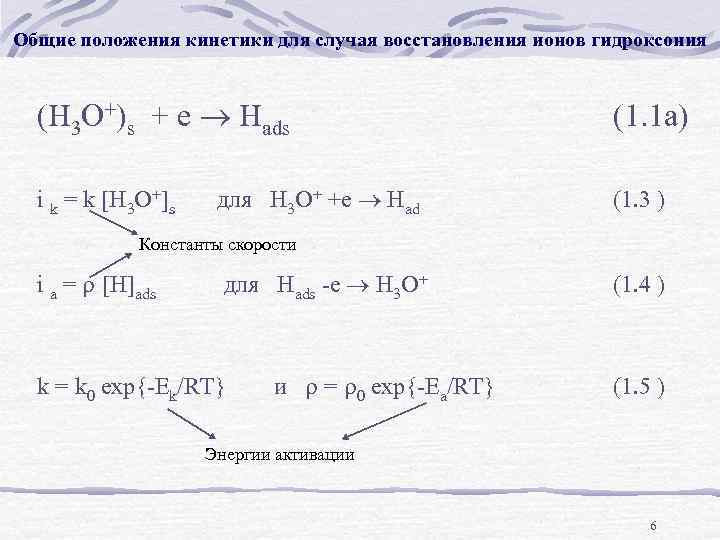
Общие положения кинетики для случая восстановления ионов гидроксония (H 3 O+)s + e Hads i k = k [H 3 O+]s для H 3 O+ +e Had (1. 1 а) (1. 3 ) Константы скорости i a = [H]ads для Hads -e H 3 O+ (1. 4 ) k = k 0 exp{-Ek/RT} и = 0 exp{-Ea/RT} (1. 5 ) Энергии активации 6

Метод потенциальных кривых (H 3 O+)s + e Hads “i” - initial (1. 1 а) “f” - finial Координата реакции (набор переменных, изменяющихся в процессе) В классическом подходе единственным путем перехода из начального состояния системы в конечное является постепенное наращивание энергии реагирующих частиц от значения Ui до значения Uif и последующее снижение ее до Uf с одновременным изменением координаты {r} до конечного значения "f". 7
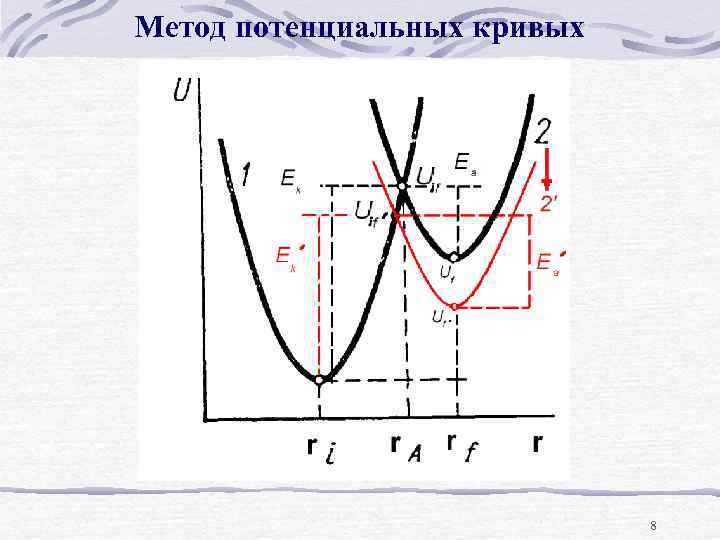
Метод потенциальных кривых 8

Метод потенциальных кривых Q = Ui - Uf (1. 6 ) Бренстед: сопоставление энергии активации такой реакции с ее тепловым эффектом на примере реакций нейтрализации алифатических кислот (RCOOH) основанием (Na. OH). Проводя реакции нейтрализации кислот, содержащих переменный заместитель R, и измеряя тепловой эффект этих реакций с параллельным определением энергий активации по уравнению Аррениуса : d(ln k)/d(1/T) = - E/R ( 1. 7 ) (см. уравнения (1. 5)), он установил свое знаменитое правило о наличии линейной связи между энергией активации и тепловым эффектом реакции: Энергия активации прямого процесса линейно убывает с ростом Q Ek = E 0 k - Q , ( 1. 8 a ) а для обратного возрастает Ea = E 0 a + Q ( 1. 8 b ) 9

Метод потенциальных кривых Ek = E 0 k - Q , ( 1. 8 a ) Ea = E 0 a + Q ( 1. 8 b ) E 0 k, E 0 a - значения энергий активации для реакций в соответствующих направлениях при нулевом тепловом эффекте; E 0 k = E 0 a = Е 0. 0< , <1 - коэффициенты переноса. Ea = Uif – Uf= E 0 a + Q Ek = Uif - Ui = E 0 k - Q Ea - Ek = Ui – Uf= Q + Q Но известно, что Q = Ui - Uf. (1. 6) + = 1 (1. 8 c ) 10

ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) В случае протекания электрохимических реакций с участием ионов и электронов величина теплового эффекта таких реакций должна включать работу электрических сил, осуществляемую при переходе от начального состояния к конечному. Поэтому по аналогии с обобщением понятия химический потенциал на случай заряженных частиц, приводящим к введению термина "электрохимический потенциал", для характеристики тепловых эффектов реакций переноса заряда вводится «обобщенный» тепловой эффект реакции, включающий изменение кулоновской (электрической) энергии системы реагирующих частиц при переходе от их начального к конечному состоянию. 11
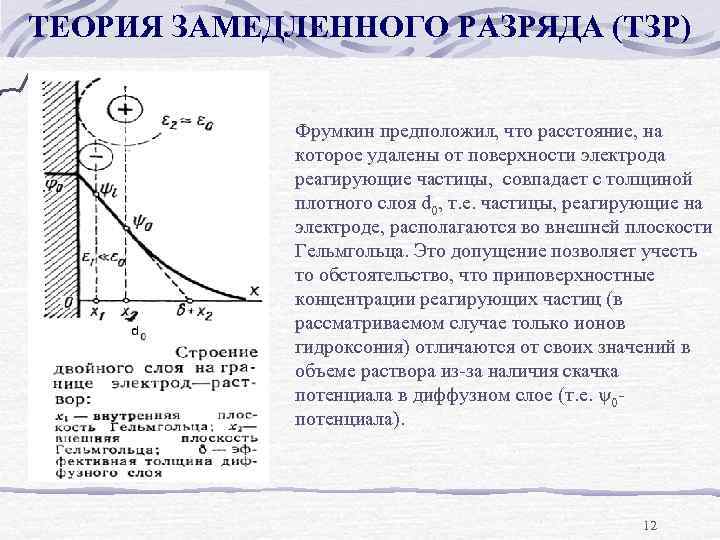
ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) e- Red Ox d 0 Фрумкин предположил, что расстояние, на которое удалены от поверхности электрода реагирующие частицы, совпадает с толщиной плотного слоя d 0, т. е. частицы, реагирующие на электроде, располагаются во внешней плоскости Гельмгольца. Это допущение позволяет учесть то обстоятельство, что приповерхностные концентрации реагирующих частиц (в рассматриваемом случае только ионов гидроксония) отличаются от своих значений в объеме раствора из-за наличия скачка потенциала в диффузном слое (т. е. 0 потенциала). 12

ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) в соответствии с законом Больцмана распределения заряженных частиц в электрическом поле (см. теорию двойного слоя) для [H 3 O+]s можно использовать соотношение: [H 3 O+]s = [H 3 O+]0 exp [-F 0/RT] выражение для скорости процесса (в электрических единицах) электровосстановления ионов гидроксония: j= -F{k 0 e -E 0/RTexp[ Q/RT][H 3 O+]0 - 0 e -E 0/RTexp[- Q/RT][Hads]} = - F{k 0'exp [ Q/RT] [H 3 O+]0 - '0 exp [- Q/RT] [Hads]} ( 2. 1 ) где использовано правило Бренстеда о линейной связи энергий активации прямого (Ek) и обратного (Ea) процессов с обобщенным тепловым эффектом реакции ( Q). 13

ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) для энергии начального состояния Ui (электрон в металле при потенциале последнего, равном Е, и ион гидроксония во внешней плоскости Гельмгольца при потенциале 0) можем записать Ui = Ui(nq) - FE + F 0 ( 2. 2 ) Для конечного состояния энергия адсорбированного на электроде атома водорода Uf не зависит ни от потенциала электрода, E, ни от 0, т. е. носит исключительно некулоновский характер (Uf (nq) ). В итоге Q = Ui-Uf = Ui(nq) - FЕ + F 0 - Uf(nq) = Qnq - F(Е- 0), ( 2. 3 ) где Qnq - составляющая полного теплового эффекта, обусловленная разностью некулоновских составляющих энергий начального и конечного состояний. 14

ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) Подставляя найденное Q в выписанное выше уравнение скорости процесса ( 2. 1), находим i = - F{k 0'exp[- (E- 0)F/RT][H 3 O+]0 exp{-F 0/RT} - '0 exp[ (E- 0)F/RT][Hads]} ( 2. 4 ) Проверим полученное уравнение на его соответствие термодинамике. Полагая при этом выполненным условие равновесия, что означает отсутствие в системе результирующего тока (j = 0), из (IV. 2. 4) после несложных преобразований нетрудно получить (k 0'[H 3 O+]0/ 0'[Hads])exp{( + ) 0 F/RT}exp{-F 0/RT}=exp{( + )FЕr /RT}, 15

ТЕОРИЯ ЗАМЕДЛЕННОГО РАЗРЯДА (ТЗР) С учетом ( + ) = 1 это соотношение дает после логарифмирования Еr = (RT/F){ln (k 0'/ 0') + ln ([H 3 O+]0/[Hads])} = Еr 0 + (RT/F)ln ([H 3 O+]0/[Hads]) ( 2. 5 ) где Еr 0=(RT/F)ln(k 0'/ 0') - стандартный равновесный потенциал (в расчете на один моль компонентов). уравнение Нернста для равновесного потенциала системы: H 3 O+ + e Hads 16

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде Если Е>>E (или Е<<E ), то можно пренебречь анодной (если речь идет об отрицательных 0 0 поляризациях) или катодной (в случае положительных) составляющей процесса. 1) Возьмём избыток фонового электролита, тогда 0 -потенциал практически равен нулю. i k =k 0' [H 3 O+]0 exp [- FЕ/RT] ( 2. 10 ) ln Е = (RT/a. F)ln (k 0' [H 3 O+]0) - (RT/a. F)ln i k ( 2. 10 a ) 17

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде Е = (RT/a. F)ln (k 0' [H 3 O+]0) — (RT/a. F)ln i k E =ak — bk ln ik ( 2. 10 a ) ( уравнение Тафеля ) Где ak = (RT/a. F)ln (k 0' [H 3 O+]0) bk = (RT/a. F) 18

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде Е = (RT/a. F)ln (k 0' [H 3 O+]0) — (RT/a. F)ln i k E =ak — bk ln ik ( 2. 10 a ) ( уравнение Тафеля ) Где ak = (RT/a. F)ln (k 0' [H 3 O+]0) bk = (RT/a. F) 19

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде Е>>E 0 (или Е<<E 0), т. e. необратимые условия 2) Переменная концентрация фонового электролита, тогда 0 -потенциал рассчитывается по теории ДЭС i k =k 0' exp [- (Е- 0)F/RT] [H 3 O+]0 exp {-F 0/RT} ln Е + (1 - ) 0/ = - (RT/ F) {ln i k - ln (k 0' [H 3 O+]0)} ( 2. 11 ) “исправленная тафелевская зависимость” 20

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде 1) Избыток фонового электролита, тогда -потенциал практически равен нулю. 0 Е = (RT/a. F)ln (k 0' [H 3 O+]0) - (RT/a. F)ln i k ( 2. 10 a ) 2) Переменная концентрация фонового электролита, тогда 0 -потенциал рассчитывается по теории ДЭС Е + (1 - a)y 0/a = - (RT/ F) {ln i k - ln (k 0' [H 3 O+]0)} ( 2. 11 ) “исправленная тафелевская зависимость” 21

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде Ур-е 2. 11 можно применять (1) в растворах чистых кислот (например HCl, HCl. O 4) без добавок соответствующих солей; (2) при заданной [H+] c переменными добавками соли. Е + (1 - a)y 0/a = - (RT/ F) {ln i k - ln (k 0' [H 3 O+]0)} Известно , что 0 = E/(1+ scd 0/ c ) | 0 | 2 RT/F вблизи т. н. з. , - 0 @ (2 RT/F) {ln( c/ scd 0) + ln(-Е)} для больших поляризаций, (c ={8 F 2 C 0/ s. RT}1/2 параметр Дебая) ( 2. 11 ) ( 2. 11 а) (2. 11 b) Т. к. разряд H 3 O+ происходит при Е< -1 В при т. н. з. -0. 422 В (н. к. э. ), то применяем уравнение 2. 11 b 22

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде После подстановки 2. 11 b в 2. 11 можно получить Е - [2 RT(1 - )/ F] {ln ( c/d 0) + (1/2) ln (RT/ s 8 F 2 c 0) + ln (-Е)} = - (RT/ F) {ln ik - ln (k 0' [H 3 O+]0)} ( 2. 12 ) 1) Чистая кислота: с0=скислоты 2) Кислота + соль (например, HCl + KCl), c 0=[H 3 O+]+[K+] 23

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде 1) Чистая кислота: с0=скислоты ln i = ln ([H 3 O+]0) + Const , Е=Сonst' ; [K+]0 = 0 k ( 2. 12 a ) 2) Кислота + соль (например, HCl + KCl), c 0=[H 3 O+]+[K+] ln i = ln([H 3 O+]0) - ln{[K+]0+[H 3 O+]0}+Const, Е=Const' ) k ( 2. 12 b где использовано условие + =1 24

Экспериментальная проверка теории замедленного разряда (ТЗР) для случая ЭВ ионов гидроксония на ртутном электроде 1) Чистая кислота: с0=скислоты = ( ln j k/ ln([H 3 O+]0))Е 2) Кислота + соль (например, HCl + KCl), c 0=[H 3 O+]+[K+] = ( ln j k/ ln([K+]0+[H 3 O+])Е Если получим + =1, то теоретические выводы верны. 3) Независимые измерения в растворах с избытком фона (т. е. при y 0 =0), тафелевский угол наклона bk = - ( Е/ lnjk) = -RT/a. F должен быть равен 51 м. В, что и наблюдается 25
Kinetics-1-v1.pptx