3Основные обратимые термодинамич.процессы.ppt
- Количество слайдов: 16

Основные обратимые термодинамические процессы

Исследование термодинамических процессов n n Устанавливают закономерности изменения состояния рабочего тела. Выявляют особенности превращения энергии

Изучение изменения состояния рабочего тела n n Выводят уравнение процесса и устанавливают соотношение между параметрами состояния рабочего тела; Определяют количество теплоты, подводимой к рабочему телу, внешнюю работу, совершаемую рабочим телом, и изменение его внутренней энергии.

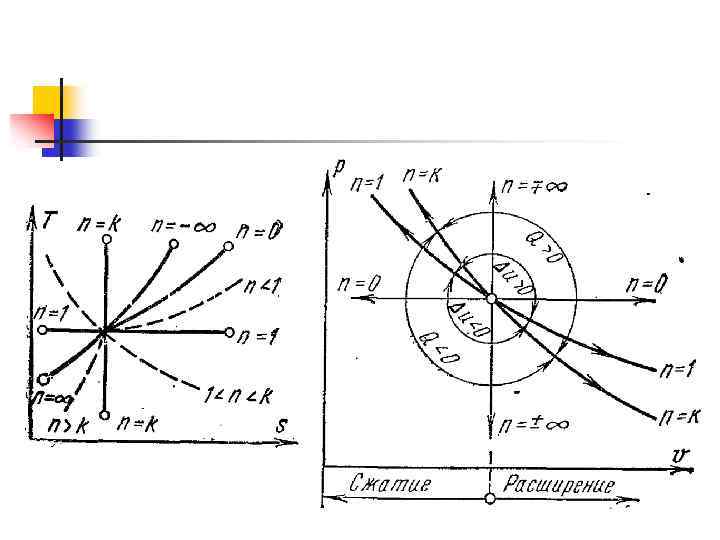
Классификация термодинамических процессов n n n Изохорный – при постоянном объеме; Изобарный – при постоянном давлении; Изотермический – при постоянной температуре; Адиабатный – при отсутствии теплообмена между рабочим телом и окружающей средой; Политропный – при постоянной теплоемкости.

Изохорный процесс v=const n Все тепло, подводимое к системе идет на изменение внутренней энергии системы. Δq= Δu n Уравнение процесса: n Первый закон термодинамики: n Энтропия: n Работа: внешняя работа Энтальпия: удельная располагаемая, полезная работа (работа проталкивания):
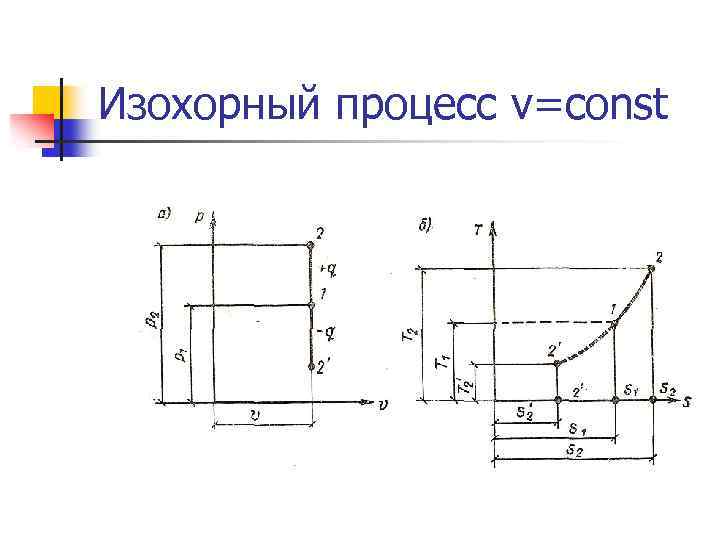
Изохорный процесс v=const

Изобарный процесс p=const n Теплота, сообщаемая системе, увеличивает её энтальпию. Δq= Δi n Уравнение процесса: Первый закон термодинамики: n Энтропия: n Работа: т. к. n n n Энтальпия: , то Так как PV=RT , то одновременно удельная располагаемая (полезная работа)
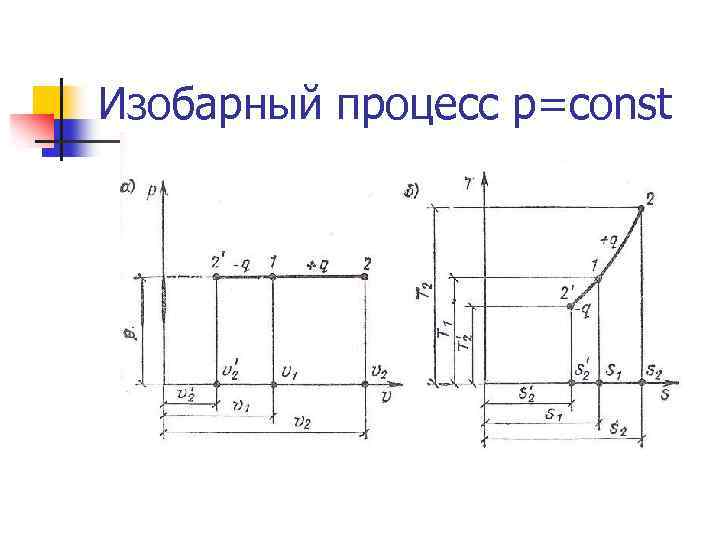
Изобарный процесс p=const

Изотермический процесс T=const n. Теплота, сообщаемая системе, тратится на совершение внешней работы. q=l n Уравнение процесса: n Первый закон термодинамики: n n Энтропия: Работа: Энтальпия: удельная располагаемая (полезная работа)
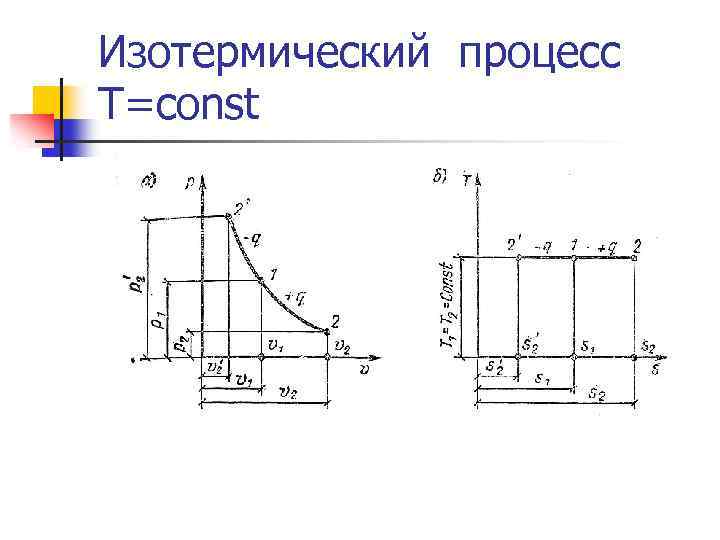
Изотермический процесс T=const

Адиабатный процесс n Внешняя работа совершается рабочим телом за счет изменения его внутренней энергии. n Уравнение процесса: n Первый закон термодинамики: l=-Δu=-cv Δt n Энтропия: ΔS=0; n Работа: Энтальпия: Δi=v·ΔP удельная располагаемая (полезная работа): l’=k·l
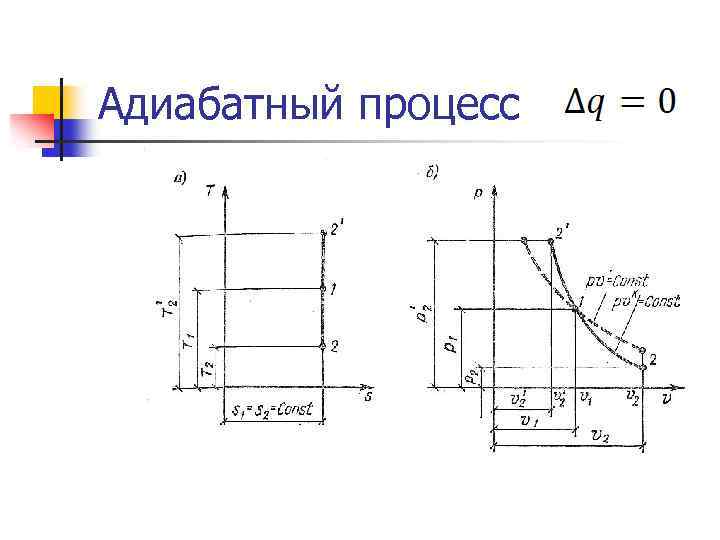
Адиабатный процесс

Политропный процесс n n n с=const Все процессы – частный случай политропного. Изохорный – Изобарный – Изотермический – Адиабатный -

Политропный процесс n Уравнение процесса: n Первый закон термодинамики: q=c·ΔТ Теплоемкость: Изменение внутренней энергии: Энтропия: Энтальпия: n Работа: n n n удельная располагаемая (полезная работа)
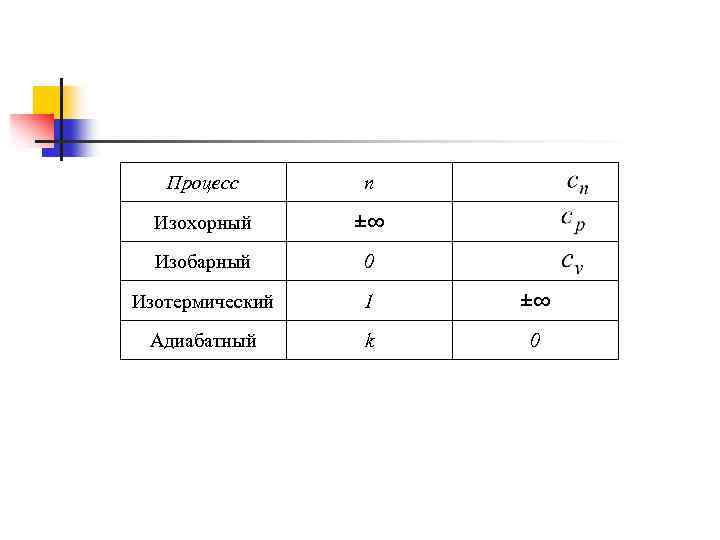
Процесс п Изохорный ±∞ Изобарный 0 Изотермический 1 ±∞ Адиабатный k 0
3Основные обратимые термодинамич.процессы.ppt