пат физ (2).pptx
- Количество слайдов: 24
Основные механизмы возбуждения и электромеханического сопряжения в сердце
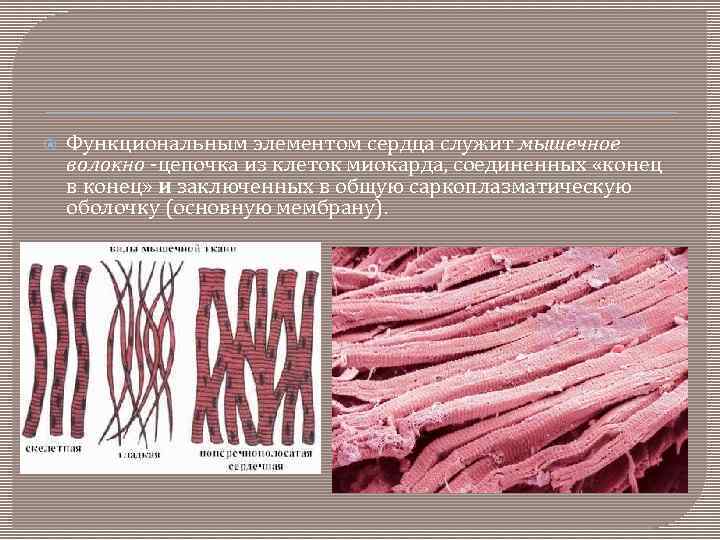
Функциональным элементом сердца служит мышечное волокно -цепочка из клеток миокарда, соединенных «конец в конец» и заключенных в общую саркоплазматическую оболочку (основную мембрану).
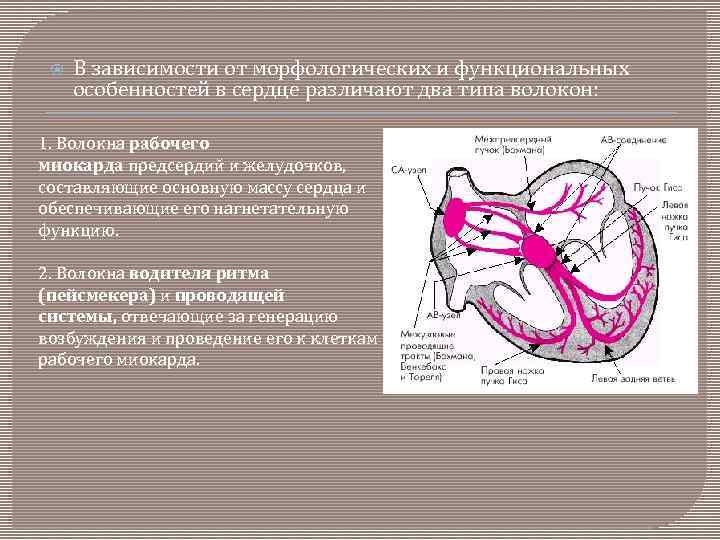
В зависимости от морфологических и функциональных особенностей в сердце различают два типа волокон: 1. Волокна рабочего миокарда предсердий и желудочков, составляющие основную массу сердца и обеспечивающие его нагнетательную функцию. 2. Волокна водителя ритма (пейсмекера) и проводящей системы, отвечающие за генерацию возбуждения и проведение его к клеткам рабочего миокарда.
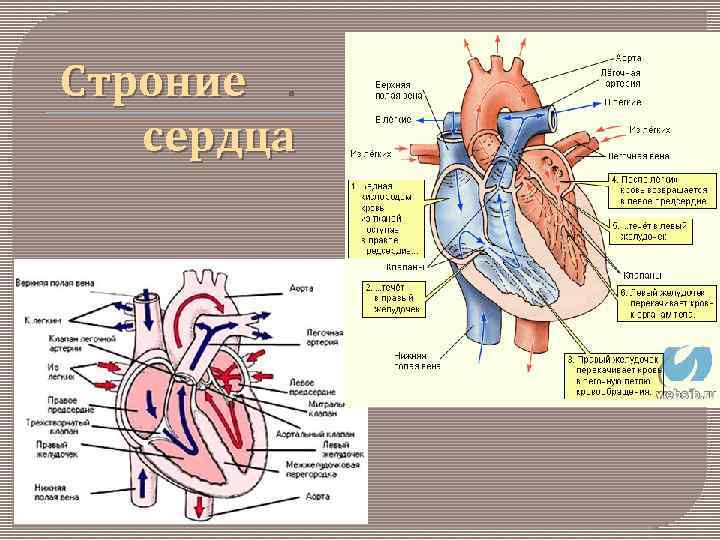
Строние . Строние сердца

Возникновение и распространение возбуждения Мышца сердца (миокард), подобно нервной ткани и скелетным мышцам, принадлежит к возбудимым тканям. Это означает, что волокна миокарда обладают потенциалом покоя, отвечают на надпороговые стимулы генерацией потенциалов действия и способны проводить эти потенциалы без затухания (бездекрементно). Межклеточные соединения в сердце (к которым относятся, в частности, так называемые вставочные диски, выявляемые при микроскопии) не препятствуют проведению возбуждения. Мышечная ткань предсердий и желудочков ведет себя как функциональный синцитий: возбуждение, возникающее в каком-либо из этих отделов, охватывает все без исключения невозбужденные волокна. Благодаря этой особенности сердце подчиняется закону «все или ничего» : на раздражение оно либо отвечает возбуждением всех волокон, либо (если раздражитель подпороговый) не реагирует вовсе. Этим оно отличается от нервов и скелетных мышц, где каждая клетка возбуждается изолированно, и поэтому только в тех клетках, на которые наносят надпороговые раздражения, возникают потенциалы действия.
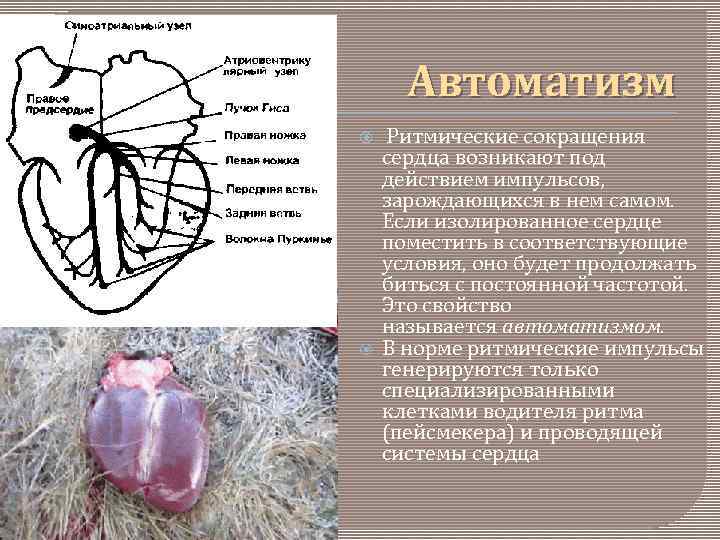
Автоматизм Ритмические сокращения сердца возникают под действием импульсов, зарождающихся в нем самом. Если изолированное сердце поместить в соответствующие условия, оно будет продолжать биться с постоянной частотой. Это свойство называется автоматизмом. В норме ритмические импульсы генерируются только специализированными клетками водителя ритма (пейсмекера) и проводящей системы сердца

Геометрия распространения возбуждения в сердце В норме водителем ритма служит синоатриальный (CA) узел, расположенный в стенке правого предсердия у места впадения в него верхней полой вены. Частота разрядов СА-узла в покое составляет около 70 в 1 мин. От этого узла возбуждение распространяется сначала по рабочему миокарду обоих предсердий. Единственный путь, по которому импульсы могут пройти к желудочкам; остальные участки атриовентрикулярного соединения состоят из невозбудимой соединительной ткани. При распространении возбуждения по проводящей системе оно на короткое время задерживается в атриовентрикулярном (AB) узле. Остальные отделы специализированной системы - пучок Гиса с его левой и правой ножками и их конечные разветвления - волокна Пуркинье - проводят импульсы довольно быстро (со скоростью примерно 2 м/с), поэтому различные отделы желудочков достаточно синхронно охватываются возбуждением. Скорость распространения импульса от субэндокардиальных окончаний волокон Пуркинье по рабочему миокарду составляет около 1 м/с.

Соподчинение водителей ритма Автоматические сокращения сердца зависят не только от деятельности САузла. Как указывалось выше, остальные отделы проводящей системы также способны спонтанно генерировать импульсы, однако собственная частота разрядов клеток этих отделов мала; она тем ниже, чем дальше от пейсмекера расположены клетки. Благодаря этому в нормальных условиях потенциал действия в этих клетках возникает в результате прихода возбуждения от более-часто разряжающихся верхних отделов, и их собственный автоматизм «не успевает» проявиться. Поскольку наибольшей частотой спонтанной активности обладает САузел, он служит пейсмекером первого порядка (ведущим).

Заместительные ритмы Если по той или иной причине возбуждение СА-узла не возникает либо (при синоатриальной блокаде) не может перейти на предсердие, роль водителя ритма берет на себя АВ-узел-пейсмекер второго порядка(частота АВ-ритма равна 40 -60/мин). Если же проведение возбуждения от предсердий к желудочкам полностью нарушено-полная (поперечная) блокада, то желудочки сокращаются в ритме пейсмекера третьего порядка, расположенного в вентрикулярной проводящей системе. СА-узел называют номотопным (нормально расположенным) центром, а очаги возбуждения в остальных отделах проводящей системы гетеротопными (ненормально расположенными) центрами
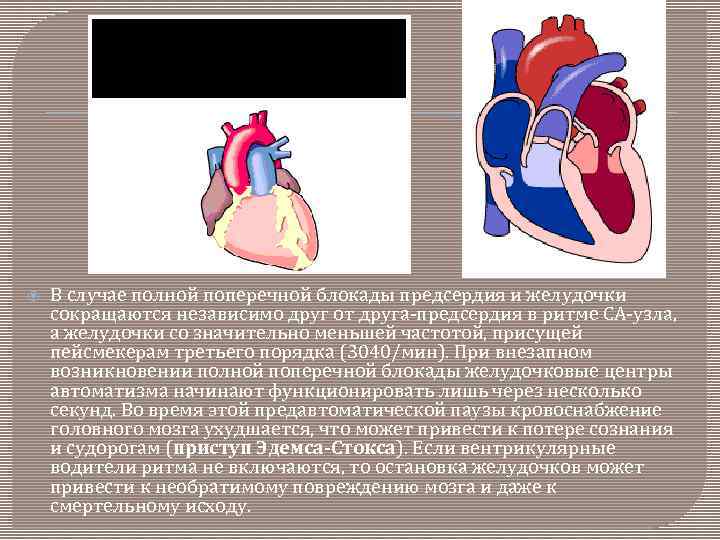
В случае полной поперечной блокады предсердия и желудочки сокращаются независимо друг от друга-предсердия в ритме СА-узла, а желудочки со значительно меньшей частотой, присущей пейсмекерам третьего порядка (3040/мин). При внезапном возникновении полной поперечной блокады желудочковые центры автоматизма начинают функционировать лишь через несколько секунд. Во время этой предавтоматической паузы кровоснабжение головного мозга ухудшается, что может привести к потере сознания и судорогам (приступ Эдемса-Стокса). Если вентрикулярные водители ритма не включаются, то остановка желудочков может привести к необратимому повреждению мозга и даже к смертельному исходу.

Искусственные водители ритма Даже в том случае, если автоматизм сердца полностью исчезает, возбудимость рабочего миокарда в течение некоторого времени сохраняется. Благодаря этому можно поддерживать кровообращение путем искусственного электрического раздражения желудочков. При необходимости импульсы тока можно подавать через интактную грудную клетку. В случае частых приступов Эдемса. Стокса, а также при полной поперечной блокаде с низкой частотой сокращений желудочков искусственное раздражение сердпа иногда применяют годами. В этом случае импульсы подаются к сердцу по проволочным электродам от миниатюрных водителей ритма, имплантируемых под кожу и работающих от батареек.
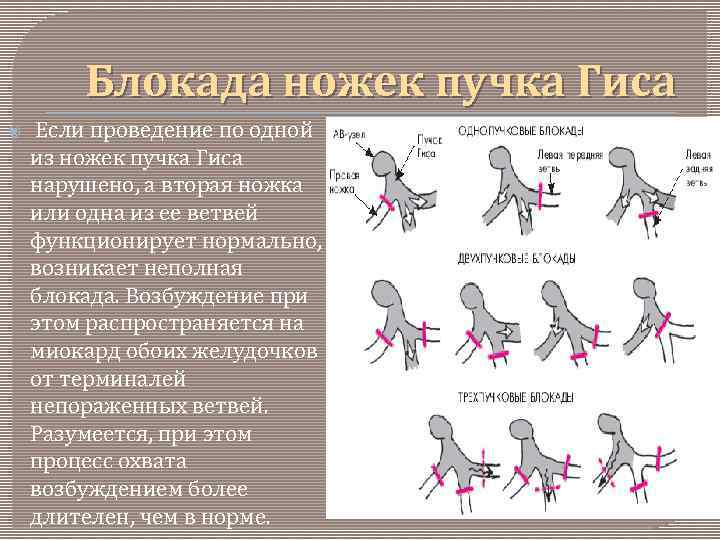
Блокада ножек пучка Гиса Если проведение по одной из ножек пучка Гиса нарушено, а вторая ножка или одна из ее ветвей функционирует нормально, возникает неполная блокада. Возбуждение при этом распространяется на миокард обоих желудочков от терминалей непораженных ветвей. Разумеется, при этом процесс охвата возбуждением более длителен, чем в норме.

Характеристики процесса возбуждения на клеточном уровне Как в нервных клетках и в волокнах скелетных мышщ, потенциал действия (ПД) в кардиомиоцитах начинается с быстрой реверсии мембранного потенциала от уровня покоя (примерно — 90 м. В) до пика ПД (примерно +30 м. В). За этой фазой быстрой деполяризации, продолжительность которой составляет лишь 1 -2 мс, следует более длительная фаза плато специфическая особенность клеток миокарда. Затем наступает фаза реполяризации, по окончании которой восстанавливается потенциал покоя. Длительность потенциала действия кардиомиоцитов составляет 200 -400 мс, т. е. более чем в 100 раз превышает соответствующую величину для скелетных мышц и нервных волокон. Как будет показано ниже, это имеет большое функциональное значение.
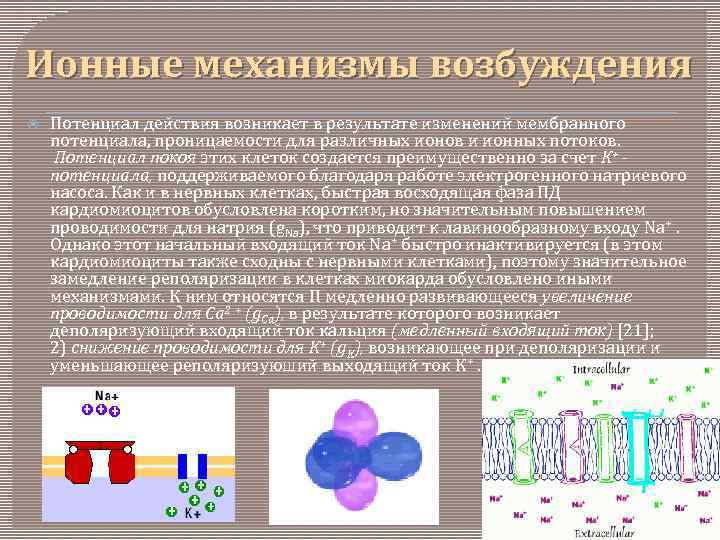
Ионные механизмы возбуждения Потенциал действия возникает в результате изменений мембранного потенциала, проницаемости для различных ионов и ионных потоков. Потенциал покоя этих клеток создается преимущественно за счет К+ потенциала, поддерживаемого благодаря работе электрогенного натриевого насоса. Как и в нервных клетках, быстрая восходящая фаза ПД кардиомиоцитов обусловлена коротким, но значительным повышением проводимости для натрия (g. Na), что приводит к лавинообразному входу Na+. Однако этот начальный входящий ток Na+ быстро инактивируется (в этом кардиомиоциты также сходны с нервными клетками), поэтому значительное замедление реполяризации в клетках миокарда обусловлено иными механизмами. К ним относятся Π медленно развивающееся увеличение проводимости для Ca 2 + (g. Ca), в результате которого возникает деполяризующий входящий ток кальция (медленный входящий ток) [21]; 2) снижение проводимости для К+ (g. K), возникающее при деполяризации и уменьшающее реполяризуюший выходящий ток К+.
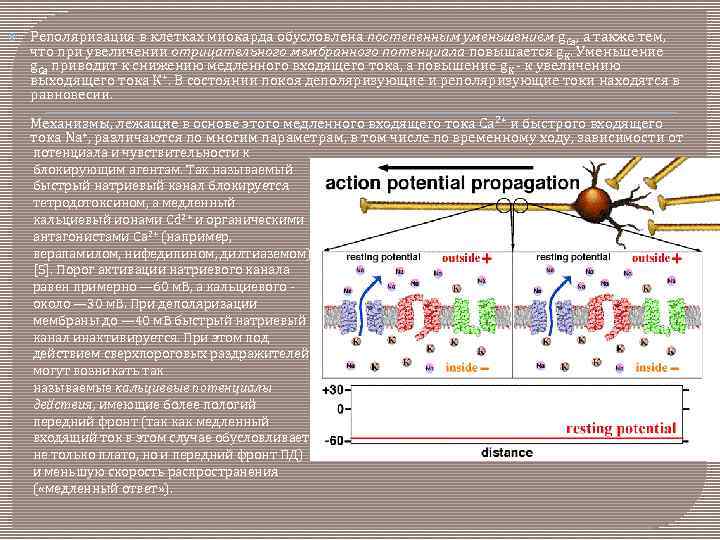
Реполяризация в клетках миокарда обусловлена постепенным уменьшением g. Ca, а также тем, что при увеличении отрицательного мембранного потенциала повышается g. K. Уменьшение g. Ca приводит к снижению медленного входящего тока, а повышение g K - к увеличению выходящего тока К+. В состоянии покоя деполяризующие и реполяризующие токи находятся в равновесии. Механизмы, лежащие в основе этого медленного входящего тока Са 2+ и быстрого входящего тока Na+, различаются по многим параметрам, в том числе по временному ходу, зависимости от потенциала и чувствительности к блокирующим агентам. Так называемый быстрый натриевый канал блокируется тетродотоксином, а медленный кальциевый ионами Cd 2+ и органическими антагонистами Са 2+ (например, верапамилом, нифедипином, дилтиаземом) [5]. Порог активации натриевого канала равен примерно — 60 м. В, а кальциевого - около — 30 м. В. При деполяризации мембраны до — 40 м. В быстрый натриевый канал инактивируется. При этом под действием сверхпороговых раздражителей могут возникать так называемые кальциевые потенциалы действия, имеющие более пологий передний фронт (так как медленный входящий ток в этом случае обусловливает не только плато, но и передний фронт ПД) и меньшую скорость распространения ( «медленный ответ» ).
Рефрактерность связана главным образом с инактивацией быстрых натриевых каналов, наступающей при длительной деполяризации. Эти каналы начинают восстанавливаться лишь после того, как мембрана реполяризуется примерно до уровня — 40 м. В. Таким образом, продолжительность рефрактерного периода, как правило, тесно связана с длительностью потенциала действия. Если ПД укорачивается или удлиняется, этому соответствуют такие же изменения периода рефрактерности. Однако препараты, обладающие местным анестезирующим действием, могут подавлять быстрые натриевые каналы и замедлять восстановление проницаемости после инактивации, вызывая тем самым удлинение рефрактерного периода, но не влияя на продолжительность потенциала действия.
Функциональное значение периода рефрактерности Длительный рефрактерный период предохраняет миокард от слишком быстрого повторного возбуждения. Такое возбуждение могло бы нарушить нагнетательную функцию сердца. Вместе с тем фаза рефрактерности препятствует круговому движению возбуждения по миокарду, которое привело бы к нарушению ритмичного чередования сокращения и расслабления. В норме рефрактерный период клеток миокарда больше, чем время распространения возбуждения по предсердиям или желудочкам. Поэтому после того, как волна возбуждения из САузла или гетеротопного очага охватит полностью весь миокард, она угасает; обратный входэтой волны невозможен, так как все сердце находится в состоянии рефрактерности.

Зависимость длительности потенциала действия от частоты Как показано на рисунке, потенциал действия, возникающий сразу после окончания периода относительной рефрактерности предыдущего цикла возбуждения, характеризуется обычной крутизной переднего фронта и амплитудой. Однако длительность ПД значительно уменьшена. Таким образом, существует тесная связь между продолжительностью потенциала действия и длительностью интервала между началом этого ПД и концом предыдущего, т. е. между длительностью и частотой ПД. На рис. 19. 6 приведена оригинальная запись для полоски желудочка человека, иллюстрирующая эту зависимость. Описанный эффект обусловлен главным образом тем, что g. K после окончания реполяризации еще повышена и лишь через некоторое время постепенно возвращается к исходному уровню (рис. 19. 4). В том случае, если интервал между ПД мал. это повышение проницаемости для К+ приводит к ускорению реполяризации в очередных циклах возбуждения.
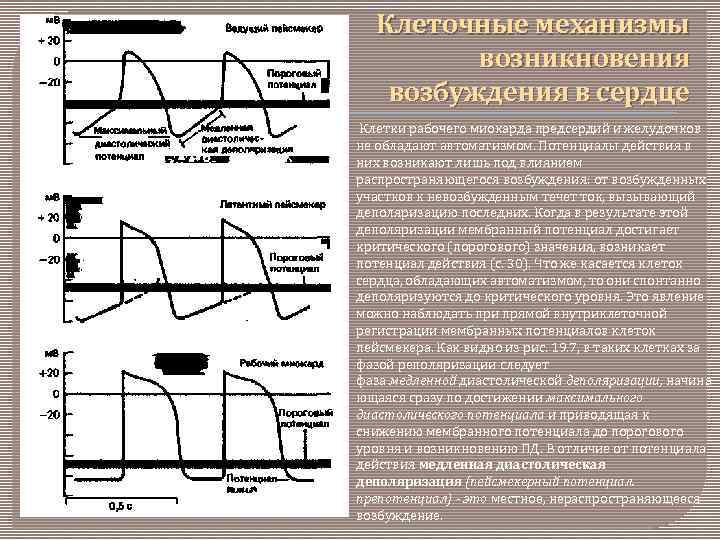
Клеточные механизмы возникновения возбуждения в сердце Клетки рабочего миокарда предсердий и желудочков не обладают автоматизмом. Потенциалы действия в них возникают лишь под влиянием распространяющегося возбуждения: от возбужденных участков к невозбужденным течет ток, вызывающий деполяризацию последних. Когда в результате этой деполяризации мембранный потенциал достигает критического (порогового) значения, возникает потенциал действия (с. 30). Что же касается клеток сердца, обладающих автоматизмом, то они спонтанно деполяризуются до критического уровня. Это явление можно наблюдать при прямой внутриклеточной регистрации мембранных потенциалов клеток пейсмекера. Как видно из рис. 19. 7, в таких клетках за фазой реполяризации следует фаза медленной диастолической деполяризации, начина ющаяся сразу по достижении максимального диастолического потенциала и приводящая к снижению мембранного потенциала до порогового уровня и возникновению ПД. В отличие от потенциала действия медленная диастолическая деполяризация (пейсмекерный потенциал. препотенциал) - это местное, нераспространяющееся возбуждение.
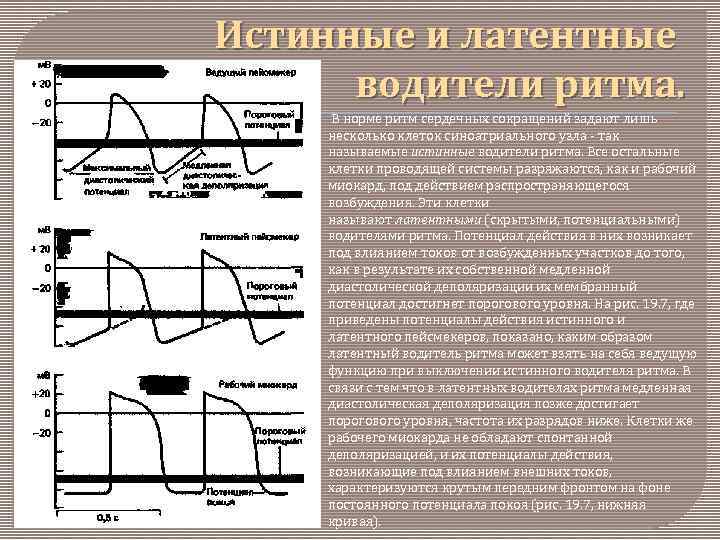
Истинные и латентные водители ритма. В норме ритм сердечных сокращений задают лишь несколько клеток синоатриального узла - так называемые истинные водители ритма. Все остальные клетки проводящей системы разряжаются, как и рабочий миокард, под действием распространяющегося возбуждения. Эти клетки называют латентными (скрытыми, потенциальными) водителями ритма. Потенциал действия в них возникает под влиянием токов от возбужденных участков до того, как в результате их собственной медленной диастолической деполяризации их мембранный потенциал достигнет порогового уровня. На рис. 19. 7, где приведены потенциалы действия истинного и латентного пейсмекеров, показано, каким образом латентный водитель ритма может взять на себя ведущую функцию при выключении истинного водителя ритма. В связи с тем что в латентных водителях ритма медленная диастолическая деполяризация позже достигает порогового уровня, частота их разрядов ниже. Клетки же рабочего миокарда не обладают спонтанной деполяризацией, и их потенциалы действия, возникающие под влиянием внешних токов, характеризуются крутым передним фронтом на фоне постоянного потенциала покоя (рис. 19. 7, нижняя кривая).
Что же касается клеток желудочковой проводящей системы, то у них фоновая натриевая проницаемость в норме мала. В связи с этим мембранный потенциал сразу после окончания ПД достигает довольно высокого уровня, что обусловливает значительное восстановление быстрого натриевого тока. Далее начинается диастолическая деполяризация, которая в этих клетках обусловлена особым ионным каналом, не действующим в клетках СА-узла; этот канал активируется лишь при существенной поляризации и пропускает как Na+, так и К+ [16]. Передний фронт ПД в этих клетках крутой, так как создается быстрым входящим натриевым током.
Эктопические водители ритма Способностью к спонтанному возбуждению обладают более примитивные клетки, а не высокоспециализированные рабочие кардиомиоциты. На ранних стадиях эмбрионального развития этой способностью обладают все клетки закладки сердца. По мере дифференцировки клеток предсердий и желудочков автоматизм у них исчезает и появляется устойчивый высокий потенциал покоа. Однако при некоторых патологических состояниях, связанных с частичной деполяризацией мембран (катэлектротон, растяжение, гипокалиемия, действие ионов Ва 2+), стабильность потенциала покоя у этих клеток утрачивается, и в результате в них может появляться диастолическая деполяризация, характерная для водителей ритма. При определенных условиях их разряды могут влиять на ритм сердца. Вместе с тем деполяризация, вызванная повышением уровня К+, не приводит к повышению автоматизма, так как одновременно увеличивается проводимость для К+, что подавляет спонтанную активность. Центр автоматизма, не относящийся к проводящей системе, называется эктопическим очагом (или фокусом).
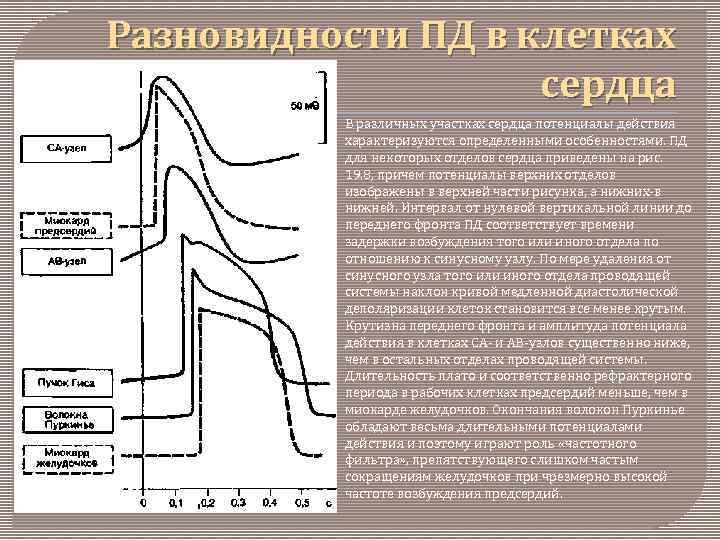
Разновидности ПД в клетках сердца В различных участках сердца потенциалы действия характеризуются определенными особенностями. ПД для некоторых отделов сердца приведены на рис. 19. 8, причем потенциалы верхних отделов изображены в верхней части рисунка, а нижних-в нижней. Интервал от нулевой вертикальной линии до переднего фронта ПД соответствует времени задержки возбуждения того или иного отдела по отношению к синусному узлу. По мере удаления от синусного узла того или иного отдела проводящей системы наклон кривой медленной диастолической деполяризации клеток становится все менее крутым. Крутизна переднего фронта и амплитуда потенциала действия в клетках CA- и АВ-узлов существенно ниже, чем в остальных отделах проводящей системы. Длительность плато и соответственно рефрактерного периода в рабочих клетках предсердий меньше, чем в миокарде желудочков. Окончания волокон Пуркинье обладают весьма длительными потенциалами действия и поэтому играют роль «частотного фильтра» , препятствующего слишком частым сокращениям желудочков при чрезмерно высокой частоте возбуждения предсердий.
Спасибо За Внимание
пат физ (2).pptx