Основные_классы_неорганических_соединений.pptx
- Количество слайдов: 22
 Основные классы неорганических соединений Простые вещества металлы - Na, Al, Fe неметаллы - S, Cl 2, H 2 Сложные вещества оксиды - Ca. O, Zn. O, CO 2 основания - Na. OH, Cu(OH)2 кислоты - HCl, HNO 3, H 2 SO 4 соли - Na. Cl, KMn. O 4
Основные классы неорганических соединений Простые вещества металлы - Na, Al, Fe неметаллы - S, Cl 2, H 2 Сложные вещества оксиды - Ca. O, Zn. O, CO 2 основания - Na. OH, Cu(OH)2 кислоты - HCl, HNO 3, H 2 SO 4 соли - Na. Cl, KMn. O 4
 ОКСИДЫ Оксиды - сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента Не являются оксидами Н 2 О 2 – пероксид водорода OF 2 – фторид кислорода КO 2 – cупероксид калия Номенклатура оксидов Fe 2 O 3 - оксид железа(III), Cl 2 O- оксид хлора(I).
ОКСИДЫ Оксиды - сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента Не являются оксидами Н 2 О 2 – пероксид водорода OF 2 – фторид кислорода КO 2 – cупероксид калия Номенклатура оксидов Fe 2 O 3 - оксид железа(III), Cl 2 O- оксид хлора(I).
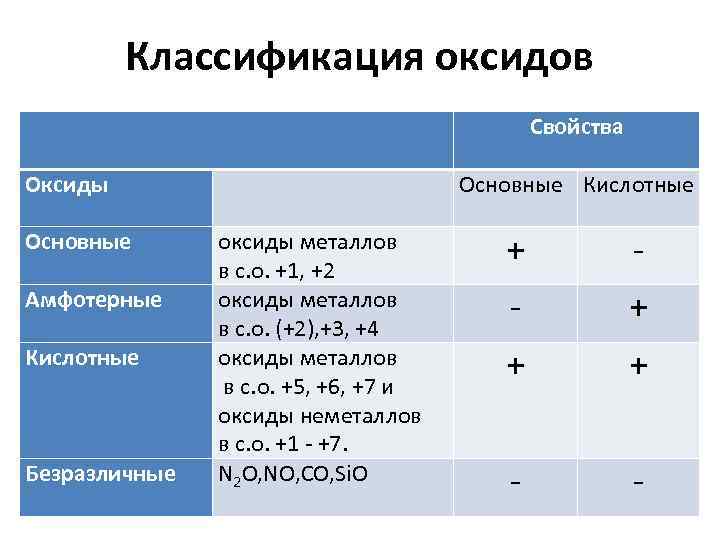 Классификация оксидов Оксиды Основные оксиды металлов в с. o. +1, +2 оксиды металлов в с. o. (+2), +3, +4 оксиды металлов в с. o. +5, +6, +7 и оксиды неметаллов в с. o. +1 - +7. N 2 O, NO, CO, Si. O Амфотерные Кислотные Безразличные Свойства Основные Кислотные + - - + + + - -
Классификация оксидов Оксиды Основные оксиды металлов в с. o. +1, +2 оксиды металлов в с. o. (+2), +3, +4 оксиды металлов в с. o. +5, +6, +7 и оксиды неметаллов в с. o. +1 - +7. N 2 O, NO, CO, Si. O Амфотерные Кислотные Безразличные Свойства Основные Кислотные + - - + + + - -
 Получение оксидов Горение простых веществ: C + O 2 = CO 2 2 Ca + O 2 = 2 Ca. O Горение (обжиг) сложных веществ: CH 4 + 2 O 2 = CO 2 + 2 H 2 O 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 Разложение сложных веществ: Ca. CO 3 → Ca. O + CO 2 2 Fe(OH)3 → Fe 2 O 3 + 3 H 2 O
Получение оксидов Горение простых веществ: C + O 2 = CO 2 2 Ca + O 2 = 2 Ca. O Горение (обжиг) сложных веществ: CH 4 + 2 O 2 = CO 2 + 2 H 2 O 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 Разложение сложных веществ: Ca. CO 3 → Ca. O + CO 2 2 Fe(OH)3 → Fe 2 O 3 + 3 H 2 O
 Химические свойства основных оксидов Основные оксиды (Na 2 O, Ca. O, Cu. O) реагируют: с водой Ca. O + H 2 O = Ca(OH)2 (IА и IIА, кр. Be, Mg) Cu. O + H 2 O с кислотными оксидами Сa. O + CO 2 = Ca. CO 3 с кислотами Ca. O + 2 HCl = Ca. Cl 2 + H 2 O
Химические свойства основных оксидов Основные оксиды (Na 2 O, Ca. O, Cu. O) реагируют: с водой Ca. O + H 2 O = Ca(OH)2 (IА и IIА, кр. Be, Mg) Cu. O + H 2 O с кислотными оксидами Сa. O + CO 2 = Ca. CO 3 с кислотами Ca. O + 2 HCl = Ca. Cl 2 + H 2 O
 Химические свойства кислотных оксидов Кислотные оксиды (CO 2, P 2 O 5, Cr. O 3) реагируют: c водой (кроме Si. O 2) SO 2 + H 2 O = H 2 SO 3 Si. O 2 + H 2 O с основными оксидами SO 2 + Ca. O = Ca. SO 3 с основаниями SO 2 + 2 Na. OH = Na 2 SO 3 + H 2 O
Химические свойства кислотных оксидов Кислотные оксиды (CO 2, P 2 O 5, Cr. O 3) реагируют: c водой (кроме Si. O 2) SO 2 + H 2 O = H 2 SO 3 Si. O 2 + H 2 O с основными оксидами SO 2 + Ca. O = Ca. SO 3 с основаниями SO 2 + 2 Na. OH = Na 2 SO 3 + H 2 O
 Химические свойства амфотерных оксидов Амфотерные оксиды (Zn. O, Al 2 O 3, Cr 2 O 3, Be. O) не реагируют с водой Zn. O + H 2 O реагируют с кислотами Zn. O + 2 HCl = Zn. Cl 2 + H 2 O реагируют с щелочами при нагревании или сплавлении Zn. O + 2 Na. OH → Na 2 Zn. O 2 + H 2 O в разбавленных растворах Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4]
Химические свойства амфотерных оксидов Амфотерные оксиды (Zn. O, Al 2 O 3, Cr 2 O 3, Be. O) не реагируют с водой Zn. O + H 2 O реагируют с кислотами Zn. O + 2 HCl = Zn. Cl 2 + H 2 O реагируют с щелочами при нагревании или сплавлении Zn. O + 2 Na. OH → Na 2 Zn. O 2 + H 2 O в разбавленных растворах Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4]
 ОСНОВАНИЯ Основания - сложные вещества, состоящие из атомов металла и гидроксильных групп; Основания - электролиты, образующие при диссоциации в качестве анионов только гидроксид ионы Номенклатура: Na. OH - гидроксид натрия Fe(OH)3 - гидроксид железа(III)
ОСНОВАНИЯ Основания - сложные вещества, состоящие из атомов металла и гидроксильных групп; Основания - электролиты, образующие при диссоциации в качестве анионов только гидроксид ионы Номенклатура: Na. OH - гидроксид натрия Fe(OH)3 - гидроксид железа(III)
 Классификация оснований растворимые (щелочи) нерастворимые амфотерные однокислотные двухкислотные трехкислотные Na. OH, KOH. Fe(OH)2, Mg(OH)2, Ni(OH)2, Сr(OH)2 Zn(OH)2, Al(OH)3, Be(OH)2, Cr(OH)3 Na. OH, KOH Ba(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3,
Классификация оснований растворимые (щелочи) нерастворимые амфотерные однокислотные двухкислотные трехкислотные Na. OH, KOH. Fe(OH)2, Mg(OH)2, Ni(OH)2, Сr(OH)2 Zn(OH)2, Al(OH)3, Be(OH)2, Cr(OH)3 Na. OH, KOH Ba(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3,
 Получение оснований Получение щелочей: 2 Na + 2 H 2 O = 2 Na. OH + H 2 Na 2 O + 2 H 2 O = 2 Na. OH Na. H + H 2 O = Na. OH + H 2 Получение нерастворимых и амфотерных оснований: Fe. SO 4 + 2 Na. OH = Fe(OH)2 + Na 2 SO 4 Al. Cl 3 + 3 Na. OH = Al(OH)3 + 3 Na. Cl
Получение оснований Получение щелочей: 2 Na + 2 H 2 O = 2 Na. OH + H 2 Na 2 O + 2 H 2 O = 2 Na. OH Na. H + H 2 O = Na. OH + H 2 Получение нерастворимых и амфотерных оснований: Fe. SO 4 + 2 Na. OH = Fe(OH)2 + Na 2 SO 4 Al. Cl 3 + 3 Na. OH = Al(OH)3 + 3 Na. Cl
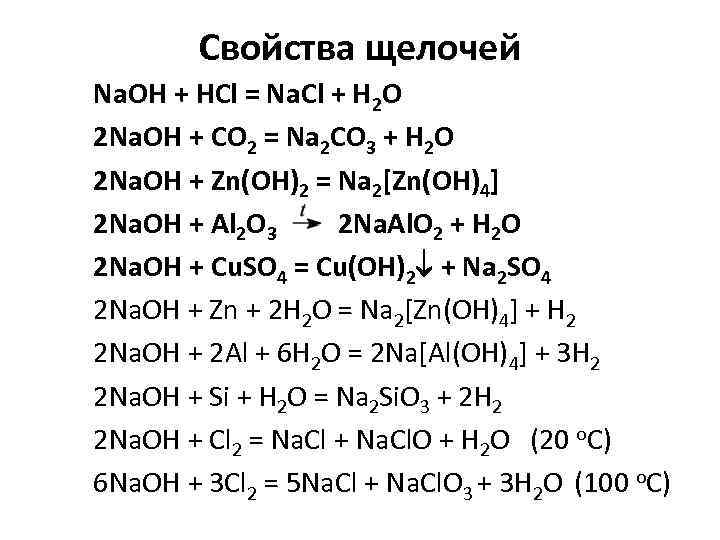 Свойства щелочей Na. OH + HCl = Na. Cl + H 2 O 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4] 2 Na. OH + Al 2 O 3 2 Na. Al. O 2 + H 2 O 2 Na. OH + Cu. SO 4 = Cu(OH)2 + Na 2 SO 4 2 Na. OH + Zn + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 Na. OH + 2 Al + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 2 Na. OH + Si + H 2 O = Na 2 Si. O 3 + 2 H 2 2 Na. OH + Cl 2 = Na. Cl + Na. Cl. O + H 2 O (20 о. С) 6 Na. OH + 3 Cl 2 = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (100 о. С)
Свойства щелочей Na. OH + HCl = Na. Cl + H 2 O 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4] 2 Na. OH + Al 2 O 3 2 Na. Al. O 2 + H 2 O 2 Na. OH + Cu. SO 4 = Cu(OH)2 + Na 2 SO 4 2 Na. OH + Zn + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 Na. OH + 2 Al + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 2 Na. OH + Si + H 2 O = Na 2 Si. O 3 + 2 H 2 2 Na. OH + Cl 2 = Na. Cl + Na. Cl. O + H 2 O (20 о. С) 6 Na. OH + 3 Cl 2 = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (100 о. С)
 Свойства нерастворимых и амфотерных оснований Свойства нерастворимых оснований: Fe(OH)2 + H 2 SO 4 = Fe. SO 4 + 2 H 2 O Fe(OH)2 Fe. O + H 2 O Свойства амфотерных оснований: Al(OH)3 + 3 HCl = Al. Cl 3 + 3 H 2 O Al(OH)3 + Na. OH = Na[Al(OH)4]) 2 Al(OH)3 Al 2 O 3 + 3 H 2 O
Свойства нерастворимых и амфотерных оснований Свойства нерастворимых оснований: Fe(OH)2 + H 2 SO 4 = Fe. SO 4 + 2 H 2 O Fe(OH)2 Fe. O + H 2 O Свойства амфотерных оснований: Al(OH)3 + 3 HCl = Al. Cl 3 + 3 H 2 O Al(OH)3 + Na. OH = Na[Al(OH)4]) 2 Al(OH)3 Al 2 O 3 + 3 H 2 O
 КИСЛОТЫ Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты - электролиты, образующие при диссоциации в качестве катионов только катионы водорода. Номенклатура кислот и кислотных остатков: HCl. O хлорноватистая Cl. O- гипохлорит HCl. O 2 хлористая Cl. O 2 - хлорит HCl. O 3 хлорноватая Cl. O 3 - хлорат HCl. O 4 хлорная Cl. O 4 - перхлорат HCl хлороводородная Cl- хлорид
КИСЛОТЫ Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты - электролиты, образующие при диссоциации в качестве катионов только катионы водорода. Номенклатура кислот и кислотных остатков: HCl. O хлорноватистая Cl. O- гипохлорит HCl. O 2 хлористая Cl. O 2 - хлорит HCl. O 3 хлорноватая Cl. O 3 - хлорат HCl. O 4 хлорная Cl. O 4 - перхлорат HCl хлороводородная Cl- хлорид
 Номенклатура кислот и кислотных остатков HF HBr HI H 2 S H 2 SO 4 H 2 SO 3 HNO 2 H 3 PO 4 H 2 CO 3 H 2 Si. O 3 CH 3 COOH фтороводороная бромоводороная иодоводородная серная сернистая азотная азотистая фосфорная угольная кремниевая уксусная FBr. IS 2 SO 42 SO 32 NO 3 NO 2 PO 43 CO 32 Si. O 32 CH 3 COO- фторид бромид иодид сульфат сульфит нитрат нитрит ортофосфат карбонат силикат ацетат
Номенклатура кислот и кислотных остатков HF HBr HI H 2 S H 2 SO 4 H 2 SO 3 HNO 2 H 3 PO 4 H 2 CO 3 H 2 Si. O 3 CH 3 COOH фтороводороная бромоводороная иодоводородная серная сернистая азотная азотистая фосфорная угольная кремниевая уксусная FBr. IS 2 SO 42 SO 32 NO 3 NO 2 PO 43 CO 32 Si. O 32 CH 3 COO- фторид бромид иодид сульфат сульфит нитрат нитрит ортофосфат карбонат силикат ацетат
 Классификация и получение кислот Классификация кислот. одноосновные HCl двухосновные H 2 S трехосновные H 3 PO 4 кислородосодержащие HNO 3 бескислородные HСl Получение кислот CO 2 + H 2 O = H 2 CO 3 (кроме Si. O 2) Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3 H 2 + Cl 2 = 2 HCl
Классификация и получение кислот Классификация кислот. одноосновные HCl двухосновные H 2 S трехосновные H 3 PO 4 кислородосодержащие HNO 3 бескислородные HСl Получение кислот CO 2 + H 2 O = H 2 CO 3 (кроме Si. O 2) Na 2 Si. O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 Si. O 3 H 2 + Cl 2 = 2 HCl
 Химические свойства кислот Fe + 2 HCl = Fe. Cl 2 + H 2 (Fe в ряду напр. до Н) Cu + HCl (Cu в ряду напр. после Н) 2 HCl + Cu. O = Cu. Cl 2 + H 2 O 2 HCl + Cu(OH)2 = Cu. Cl 2 + 2 H 2 O 2 HCl + Zn. O = Zn. Cl 2 + H 2 O 3 HCl + Al(OH)3 = Al. Cl 3 + 3 H 2 O 2 HCl + Na 2 CO 3 = 2 Na. Cl + H 2 O + CO 2 HCl + Ag. NO 3 = Ag. Cl + HNO 3 HCl + Na. NO 3
Химические свойства кислот Fe + 2 HCl = Fe. Cl 2 + H 2 (Fe в ряду напр. до Н) Cu + HCl (Cu в ряду напр. после Н) 2 HCl + Cu. O = Cu. Cl 2 + H 2 O 2 HCl + Cu(OH)2 = Cu. Cl 2 + 2 H 2 O 2 HCl + Zn. O = Zn. Cl 2 + H 2 O 3 HCl + Al(OH)3 = Al. Cl 3 + 3 H 2 O 2 HCl + Na 2 CO 3 = 2 Na. Cl + H 2 O + CO 2 HCl + Ag. NO 3 = Ag. Cl + HNO 3 HCl + Na. NO 3
 СОЛИ Соли - сложные вещества, состоящие из атомов металла и кислотного остатка. Соли - электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
СОЛИ Соли - сложные вещества, состоящие из атомов металла и кислотного остатка. Соли - электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
 Номенклатура солей Na 2 HPO 4 гидрофосфат натрия Ca(H 2 PO 4)2 дигидрофосфат кальция Al. OHSO 4 гидроксид сульфат алюминия KMg. F 3, фторид калия магния Na. Cl Na. F фторид хлорид натрия Na. NH 4 HPO 4 гидрофосфат аммония натрия Na 2[Zn(OH)4] тетрагидроксоцинкат натрия
Номенклатура солей Na 2 HPO 4 гидрофосфат натрия Ca(H 2 PO 4)2 дигидрофосфат кальция Al. OHSO 4 гидроксид сульфат алюминия KMg. F 3, фторид калия магния Na. Cl Na. F фторид хлорид натрия Na. NH 4 HPO 4 гидрофосфат аммония натрия Na 2[Zn(OH)4] тетрагидроксоцинкат натрия
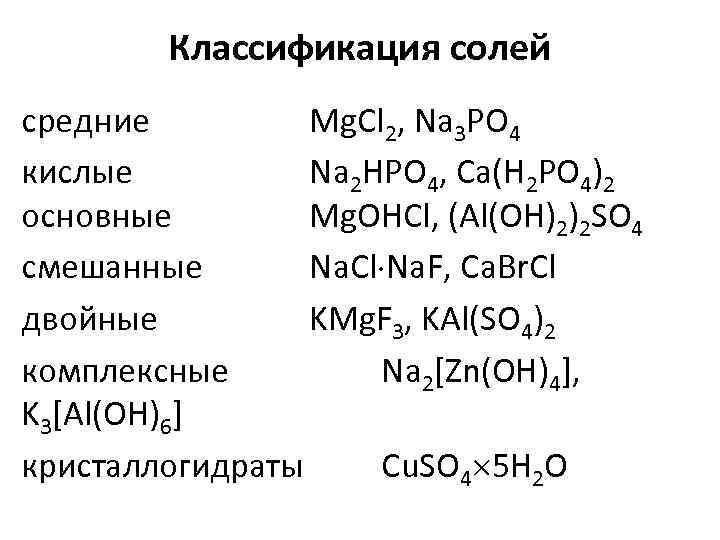 Классификация солей средние Mg. Cl 2, Na 3 PO 4 кислые Na 2 HPO 4, Ca(H 2 PO 4)2 основные Mg. OHCl, (Al(OH)2)2 SO 4 смешанные Na. Cl Na. F, Ca. Br. Cl двойные KMg. F 3, KAl(SO 4)2 комплексные Na 2[Zn(OH)4], K 3[Al(OH)6] кристаллогидраты Сu. SO 4 5 H 2 O
Классификация солей средние Mg. Cl 2, Na 3 PO 4 кислые Na 2 HPO 4, Ca(H 2 PO 4)2 основные Mg. OHCl, (Al(OH)2)2 SO 4 смешанные Na. Cl Na. F, Ca. Br. Cl двойные KMg. F 3, KAl(SO 4)2 комплексные Na 2[Zn(OH)4], K 3[Al(OH)6] кристаллогидраты Сu. SO 4 5 H 2 O
 Получение солей Cu + 2 H 2 SO 4 конц. = Cu. SO 4 + SO 2 + 2 H 2 O Cu + 2 Ag. NO 3 = Cu(NO 3)2 + 2 Ag Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. O + SO 3 = Cu. SO 4 Cu(OH)2 + H 2 SO 4 = Cu. SO 4 + 2 H 2 O Cu. CO 3 + H 2 SO 4 = Cu. SO 4 + H 2 O + CO 2 Cu. Cl 2 + Ag 2 SO 4 = Cu. SO 4 + 2 Ag. Cl
Получение солей Cu + 2 H 2 SO 4 конц. = Cu. SO 4 + SO 2 + 2 H 2 O Cu + 2 Ag. NO 3 = Cu(NO 3)2 + 2 Ag Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Cu. O + SO 3 = Cu. SO 4 Cu(OH)2 + H 2 SO 4 = Cu. SO 4 + 2 H 2 O Cu. CO 3 + H 2 SO 4 = Cu. SO 4 + H 2 O + CO 2 Cu. Cl 2 + Ag 2 SO 4 = Cu. SO 4 + 2 Ag. Cl
 Химические свойства солей Cu. SO 4 + Fe = Cu + Fe. SO 4 (Fe до Cu в ряду напряжений) Pb + Zn. Cl 2 (Pb после Zn в ряду напряжений) Cu. SO 4 + 2 Na. OH = Cu(OH)2 + Na 2 SO 4 (образуется осадок) Cu. SO 4 + H 2 S = Cu. S + H 2 SO 4 (образуется осадок) Cu. SO 4 + Ba. Cl 2 = Ba. SO 4 + Cu. Cl 2 (образуется осадок)
Химические свойства солей Cu. SO 4 + Fe = Cu + Fe. SO 4 (Fe до Cu в ряду напряжений) Pb + Zn. Cl 2 (Pb после Zn в ряду напряжений) Cu. SO 4 + 2 Na. OH = Cu(OH)2 + Na 2 SO 4 (образуется осадок) Cu. SO 4 + H 2 S = Cu. S + H 2 SO 4 (образуется осадок) Cu. SO 4 + Ba. Cl 2 = Ba. SO 4 + Cu. Cl 2 (образуется осадок)
 Разложение солей при нагревании Ca(HCO 3)2 → Ca. CO 3 + H 2 O + CO 2 (при 100 o. C) Ca. CO 3 → Ca. O + CO 2 (при 1000 o. C) 2 Na. NO 3 → 2 Na. NO 2 + O 2 (до Mg в ряду напряжений) 2 Pb(NO 3)2 → 2 Pb. O + 4 NO 2 + O 2 (от Mg до Cu в ряду напр. ) 2 Ag. NO 3 → 2 Ag + 2 NO 2 + O 2 (после Cu в ряду напр. ) NH 4 Cl → NH 3 + HCl NH 4 NO 3 → N 2 O + 2 H 2 O (ОВР) NH 4 NO 2 → N 2 + 2 H 2 O (ОВР) (NH 4)2 Cr 2 O 7 → N 2 + Cr 2 O 3 + 4 H 2 O (реакция “вулкан”) 4 KCl. O 3 → KCl + 3 KCl. O 4 (при 400 o. C) 2 KCl. O 3 → 2 KCl + 3 O 2 (в присутствии Mn. O 2) 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2
Разложение солей при нагревании Ca(HCO 3)2 → Ca. CO 3 + H 2 O + CO 2 (при 100 o. C) Ca. CO 3 → Ca. O + CO 2 (при 1000 o. C) 2 Na. NO 3 → 2 Na. NO 2 + O 2 (до Mg в ряду напряжений) 2 Pb(NO 3)2 → 2 Pb. O + 4 NO 2 + O 2 (от Mg до Cu в ряду напр. ) 2 Ag. NO 3 → 2 Ag + 2 NO 2 + O 2 (после Cu в ряду напр. ) NH 4 Cl → NH 3 + HCl NH 4 NO 3 → N 2 O + 2 H 2 O (ОВР) NH 4 NO 2 → N 2 + 2 H 2 O (ОВР) (NH 4)2 Cr 2 O 7 → N 2 + Cr 2 O 3 + 4 H 2 O (реакция “вулкан”) 4 KCl. O 3 → KCl + 3 KCl. O 4 (при 400 o. C) 2 KCl. O 3 → 2 KCl + 3 O 2 (в присутствии Mn. O 2) 2 KMn. O 4 → K 2 Mn. O 4 + Mn. O 2 + O 2


