10. Оксиды, соли, кислоты, основания.ppt
- Количество слайдов: 24
 «ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
«ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
 ОКСИДЫ ОСНОВАНИЯ СОЛИ КИСЛОТЫ
ОКСИДЫ ОСНОВАНИЯ СОЛИ КИСЛОТЫ


 Классификация оснований ОСНОВАНИЯ Одноосновные Na. ОН, Li. ОН, NН 4 ОН х ч по ти мос вори раст воде в по с рок д у ги упп исл гр ьны ил Двухосновные Са(ОН)2 Растворимые, или Амфотерные Al(OH)3, Fe(OH)3 Трехосновные Fe(ОН)3 щелочи Li. ОН, Nа. ОН, Са(ОН)2 Малорастворимые Fe(ОН)2, Сu(ОН)2
Классификация оснований ОСНОВАНИЯ Одноосновные Na. ОН, Li. ОН, NН 4 ОН х ч по ти мос вори раст воде в по с рок д у ги упп исл гр ьны ил Двухосновные Са(ОН)2 Растворимые, или Амфотерные Al(OH)3, Fe(OH)3 Трехосновные Fe(ОН)3 щелочи Li. ОН, Nа. ОН, Са(ОН)2 Малорастворимые Fe(ОН)2, Сu(ОН)2
 Классификация кислот Двухосновные Н 2 SO 4, Н 2 S Трехосновные Н 3 РО 4, Н 3 Аs. О 4 по основности Одноосновные НСl, НNО 3 Сильные Н 2 SO 4, НNО 3 Слабые Н 2 SО 3, Н 2 СО 3 по силе КИСЛОТЫ Бескислородные НСN, Н 2 S по содержанию кислорода Кислородсодержащие НСl. О, Н 2 СО 3
Классификация кислот Двухосновные Н 2 SO 4, Н 2 S Трехосновные Н 3 РО 4, Н 3 Аs. О 4 по основности Одноосновные НСl, НNО 3 Сильные Н 2 SO 4, НNО 3 Слабые Н 2 SО 3, Н 2 СО 3 по силе КИСЛОТЫ Бескислородные НСN, Н 2 S по содержанию кислорода Кислородсодержащие НСl. О, Н 2 СО 3
 Классификация солей по составу Средние Ba. SO 4 Кислые Na. HCO 3 Смешанные Ca. Cl. Br СОЛИ Двойные KNa. SO 4 Основные Al(OH)2 Cl Комплексные [Ag(NH 3)2]Cl
Классификация солей по составу Средние Ba. SO 4 Кислые Na. HCO 3 Смешанные Ca. Cl. Br СОЛИ Двойные KNa. SO 4 Основные Al(OH)2 Cl Комплексные [Ag(NH 3)2]Cl

 ПОЛУЧЕНИЕ ОСНОВАНИЙ 1. Взаимодействие активных металлов с водой Me + Н 2 O = Ме. ОН + Н 2 2. Взаимодействие оксидов активных металлов с водой Me. О + Н 2 O = Ме. ОН 3. Электролиз расплавов солей (получение Na. OH, KOH в промышленности) Na. Cl + H 2 O = Na. ОН + HСl Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl
ПОЛУЧЕНИЕ ОСНОВАНИЙ 1. Взаимодействие активных металлов с водой Me + Н 2 O = Ме. ОН + Н 2 2. Взаимодействие оксидов активных металлов с водой Me. О + Н 2 O = Ме. ОН 3. Электролиз расплавов солей (получение Na. OH, KOH в промышленности) Na. Cl + H 2 O = Na. ОН + HСl Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl
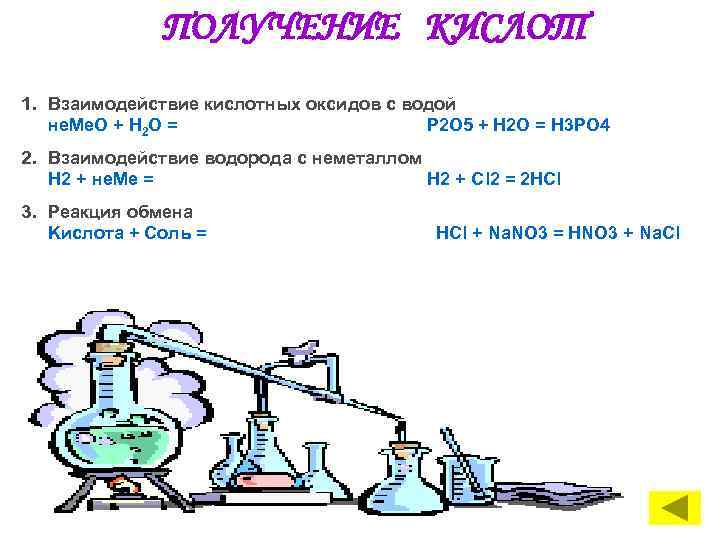 ПОЛУЧЕНИЕ КИСЛОТ 1. Взаимодействие кислотных оксидов с водой не. Me. О + Н 2 O = P 2 O 5 + H 2 O = H 3 PO 4 2. Взаимодействие водорода с неметаллом Н 2 + не. Ме = Н 2 + Сl 2 = 2 HCl 3. Реакция обмена Kислота + Cоль = HCl + Na. NO 3 = HNO 3 + Na. Cl
ПОЛУЧЕНИЕ КИСЛОТ 1. Взаимодействие кислотных оксидов с водой не. Me. О + Н 2 O = P 2 O 5 + H 2 O = H 3 PO 4 2. Взаимодействие водорода с неметаллом Н 2 + не. Ме = Н 2 + Сl 2 = 2 HCl 3. Реакция обмена Kислота + Cоль = HCl + Na. NO 3 = HNO 3 + Na. Cl
 ПОЛУЧЕНИЕ СОЛЕЙ Взаимодействием: • Металла с неметаллом • Основного оксида с кислотным оксидом • Основного оксида с кислотой Са. О + 2 НСl = Ca. Cl 2 + H 2 О • Кислотного оксида с основанием CO 2 + Ca(OH)2 = Ca. CO 3 + H 2 O • Кислоты с основанием (р. нейтрализации) 2 HCl + Ca(OH)2 = Ca. Cl 2 + 2 H 2 O • Соли с кислотой Na. Cl + HNO 3 = Na. NO 3 + HCl • Соли с щелочью Na. Cl + KOH = Na. OH + KCl • Соли с солью Na. Cl + Ag. NO 3 = Na. NO 3 + Ag. Cl • Металла с солью (см. ряд активности металлов)Na + Ag. NO 3 = Na. NO 3 + Ag • Металла с кислотой (см. ряд активн. металлов) Са + Сl 2 = Са. Сl Са. О + СО 2 = Са. СО 3 Са + 2 НСl = Ca. Cl 2 + H 2
ПОЛУЧЕНИЕ СОЛЕЙ Взаимодействием: • Металла с неметаллом • Основного оксида с кислотным оксидом • Основного оксида с кислотой Са. О + 2 НСl = Ca. Cl 2 + H 2 О • Кислотного оксида с основанием CO 2 + Ca(OH)2 = Ca. CO 3 + H 2 O • Кислоты с основанием (р. нейтрализации) 2 HCl + Ca(OH)2 = Ca. Cl 2 + 2 H 2 O • Соли с кислотой Na. Cl + HNO 3 = Na. NO 3 + HCl • Соли с щелочью Na. Cl + KOH = Na. OH + KCl • Соли с солью Na. Cl + Ag. NO 3 = Na. NO 3 + Ag. Cl • Металла с солью (см. ряд активности металлов)Na + Ag. NO 3 = Na. NO 3 + Ag • Металла с кислотой (см. ряд активн. металлов) Са + Сl 2 = Са. Сl Са. О + СО 2 = Са. СО 3 Са + 2 НСl = Ca. Cl 2 + H 2
 Химические свойства основных оксидов • 1. Основный оксид + кислота соль + вода Ca. O +2 HNO 3 Ca(NO 3)2 + H 2 O 2. Основный оксид + кислотный оксид соль Mg. O + N 2 O 5 Mg(NO 3)2 3. Основный оксид + вода щелочь K 2 O + H 2 O 2 KOH
Химические свойства основных оксидов • 1. Основный оксид + кислота соль + вода Ca. O +2 HNO 3 Ca(NO 3)2 + H 2 O 2. Основный оксид + кислотный оксид соль Mg. O + N 2 O 5 Mg(NO 3)2 3. Основный оксид + вода щелочь K 2 O + H 2 O 2 KOH
 Химические свойства кислотных оксидов • 1. Кислотный оксид + основание соль + вода O 5 + 6 Li. OH P 2 2 Li 3 PO 4 + 3 H 2 O 2. Кислотный оксид+ основный оксид соль SO 3 + Ca. O Ca. SO 4 SO 2 + H 2 O H 2 SO 3 3. Кислотный оксид + вода кислота
Химические свойства кислотных оксидов • 1. Кислотный оксид + основание соль + вода O 5 + 6 Li. OH P 2 2 Li 3 PO 4 + 3 H 2 O 2. Кислотный оксид+ основный оксид соль SO 3 + Ca. O Ca. SO 4 SO 2 + H 2 O H 2 SO 3 3. Кислотный оксид + вода кислота
 Химические свойства амфотерных оксидов • 1. Взаимодействуют с сильными кислотами Zn. O + 2 HCl Основный оксид Кислот а Zn. Cl 2 + H 2 O 2. Взаимодействуют со щелочами Zn. O +2 Na. OH Кислотный оксид Na 2 Zn. O 2 + H 2 O Основание Zn. O + 2 Na. OH + H 2 O Na 2 Zn(OH)4
Химические свойства амфотерных оксидов • 1. Взаимодействуют с сильными кислотами Zn. O + 2 HCl Основный оксид Кислот а Zn. Cl 2 + H 2 O 2. Взаимодействуют со щелочами Zn. O +2 Na. OH Кислотный оксид Na 2 Zn. O 2 + H 2 O Основание Zn. O + 2 Na. OH + H 2 O Na 2 Zn(OH)4
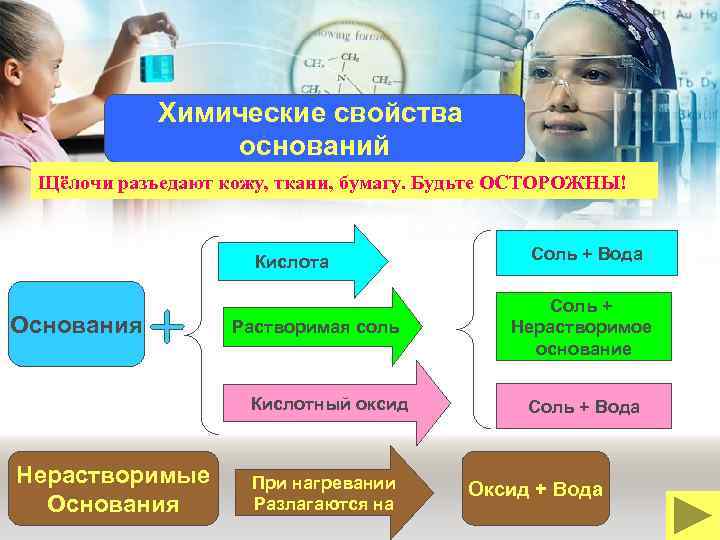 Химические свойства оснований Щёлочи разъедают кожу, ткани, бумагу. Будьте ОСТОРОЖНЫ! Кислота Основания Растворимая соль Кислотный оксид Нерастворимые Основания При нагревании Разлагаются на Соль + Вода Соль + Нерастворимое основание Соль + Вода Оксид + Вода
Химические свойства оснований Щёлочи разъедают кожу, ткани, бумагу. Будьте ОСТОРОЖНЫ! Кислота Основания Растворимая соль Кислотный оксид Нерастворимые Основания При нагревании Разлагаются на Соль + Вода Соль + Нерастворимое основание Соль + Вода Оксид + Вода
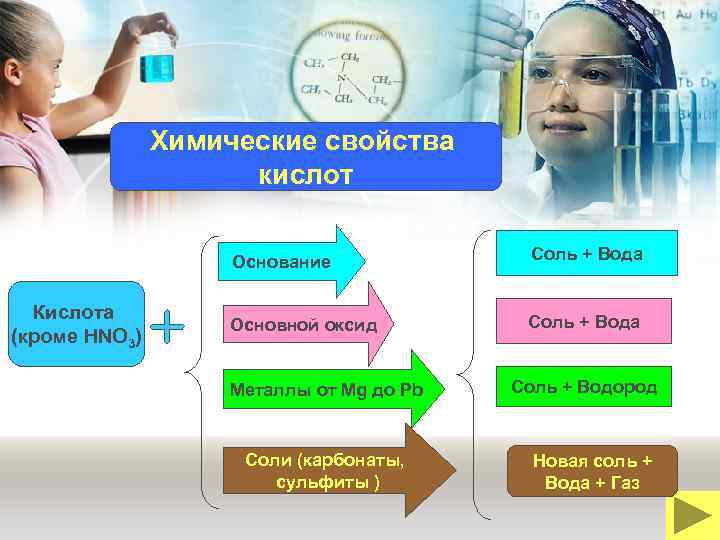 Химические свойства кислот Основание Кислота (кроме HNO 3) Соль + Вода Основной оксид Соль + Вода Металлы от Mg до Pb Соли (карбонаты, сульфиты ) Соль + Водород Новая соль + Вода + Газ
Химические свойства кислот Основание Кислота (кроме HNO 3) Соль + Вода Основной оксид Соль + Вода Металлы от Mg до Pb Соли (карбонаты, сульфиты ) Соль + Водород Новая соль + Вода + Газ
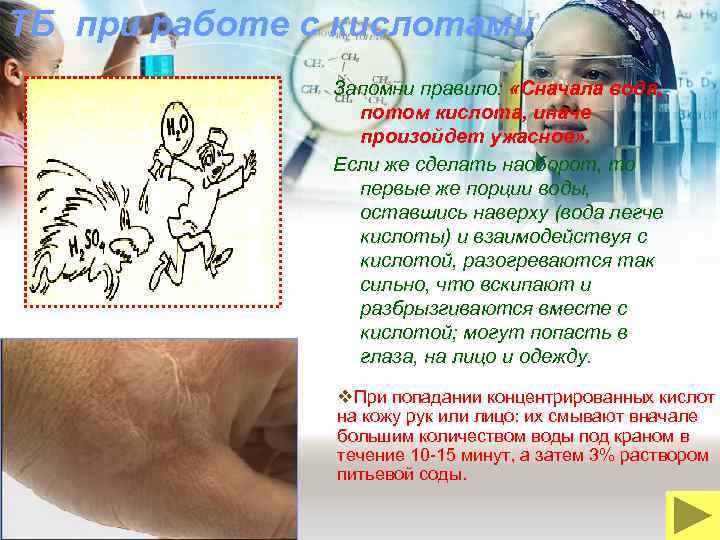 ТБ при работе с кислотами Запомни правило: «Сначала вода, потом кислота, иначе произойдет ужасное» . Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду. v. При попадании концентрированных кислот на кожу рук или лицо: их смывают вначале большим количеством воды под краном в течение 10 -15 минут, а затем 3% раствором питьевой соды.
ТБ при работе с кислотами Запомни правило: «Сначала вода, потом кислота, иначе произойдет ужасное» . Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду. v. При попадании концентрированных кислот на кожу рук или лицо: их смывают вначале большим количеством воды под краном в течение 10 -15 минут, а затем 3% раствором питьевой соды.

 Химические свойства солей Щелочь Металл Соль Кислота Соль Новая соль + Нерастворимое основание Новая соль + Металл Новая соль + Вода + Газ Новая соль + Нерастворимая соль
Химические свойства солей Щелочь Металл Соль Кислота Соль Новая соль + Нерастворимое основание Новая соль + Металл Новая соль + Вода + Газ Новая соль + Нерастворимая соль
 Применение оксидов • Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо. Песок, состоящий преимущественно состоит из Si. O 2, используют при производстве стекла. • Некоторые оксиды являются основой для красок: Zn. O – белой, Fe 2 O 3 – коричневой, Cr 2 O 3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
Применение оксидов • Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо. Песок, состоящий преимущественно состоит из Si. O 2, используют при производстве стекла. • Некоторые оксиды являются основой для красок: Zn. O – белой, Fe 2 O 3 – коричневой, Cr 2 O 3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.