Лекция 12 Основные категории кристаллохимии.ppt
- Количество слайдов: 21
 Основные категории кристаллохимии • Морфотропия • Изоморфизм • Полиморфизм
Основные категории кристаллохимии • Морфотропия • Изоморфизм • Полиморфизм
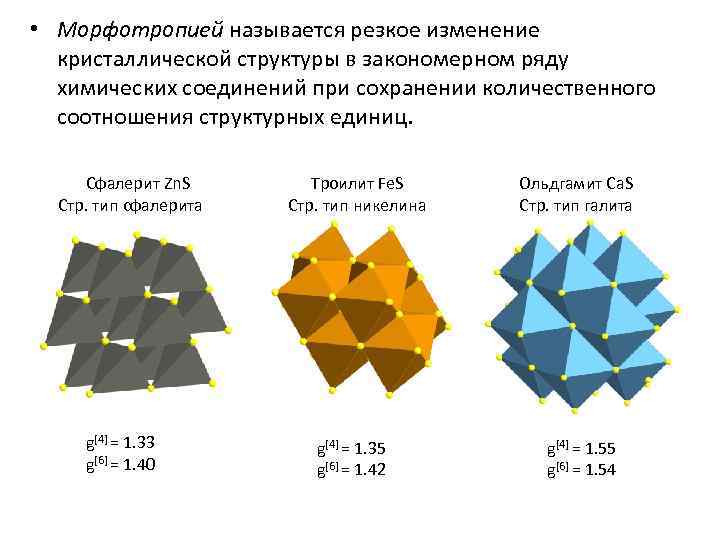 • Морфотропией называется резкое изменение кристаллической структуры в закономерном ряду химических соединений при сохранении количественного соотношения структурных единиц. Сфалерит Zn. S Стр. тип сфалерита g[4] = 1. 33 g[6] = 1. 40 Троилит Fe. S Стр. тип никелина g[4] = 1. 35 g[6] = 1. 42 Ольдгамит Ca. S Стр. тип галита g[4] = 1. 55 g[6] = 1. 54
• Морфотропией называется резкое изменение кристаллической структуры в закономерном ряду химических соединений при сохранении количественного соотношения структурных единиц. Сфалерит Zn. S Стр. тип сфалерита g[4] = 1. 33 g[6] = 1. 40 Троилит Fe. S Стр. тип никелина g[4] = 1. 35 g[6] = 1. 42 Ольдгамит Ca. S Стр. тип галита g[4] = 1. 55 g[6] = 1. 54
![Анальцим Na 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Ia Анальцим Na 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Ia](https://present5.com/presentation/3/26680876_174300566.pdf-img/26680876_174300566.pdf-3.jpg) Анальцим Na 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Ia 3 d Бикитаит Li 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Cmcm
Анальцим Na 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Ia 3 d Бикитаит Li 2[Al 2 Si 4 O 12]*2 H 2 O Топологическая симметрия Cmcm
 Изоморфизм – взаимное замещение химически различных компонентов в эквивалентных позициях кристаллической структуры (Урусов) Полиморфизм – способность вещества изменять кристаллическую структуру по изменении термодинамических условий
Изоморфизм – взаимное замещение химически различных компонентов в эквивалентных позициях кристаллической структуры (Урусов) Полиморфизм – способность вещества изменять кристаллическую структуру по изменении термодинамических условий
 Критерии устойчивости структурного типа Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением
Критерии устойчивости структурного типа Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением
 Критерий отношения радиусов двух шаров разного размера, из которых шары 1 -го вида образуют плотнейшую упаковку (правило Магнуса. Гольдшмитда). R 2/R 1 = g’ ≈ 0. 225 – идеальная тетраэдричская координация g’ ≈ 0. 414 – идеальная октаэдрическая координация. g = (R 1 + R 2)/R 1 = g’ + 1. Если величина g имеет промежуточное значение 1. 225 < g < 1. 414, то принято считать, что шар радиуса R 2 расположен в тетраэдрическом окружении. При 1. 414 < g < 1. 732 шар радиуса R 2 располагается в октаэдрической пустоте. При g > 1. 732 КЧ шара радиуса R 2 повышается до 8. При g = 2 R 1 = R 2 (плотнейшая упаковка одинаковых шаров).
Критерий отношения радиусов двух шаров разного размера, из которых шары 1 -го вида образуют плотнейшую упаковку (правило Магнуса. Гольдшмитда). R 2/R 1 = g’ ≈ 0. 225 – идеальная тетраэдричская координация g’ ≈ 0. 414 – идеальная октаэдрическая координация. g = (R 1 + R 2)/R 1 = g’ + 1. Если величина g имеет промежуточное значение 1. 225 < g < 1. 414, то принято считать, что шар радиуса R 2 расположен в тетраэдрическом окружении. При 1. 414 < g < 1. 732 шар радиуса R 2 располагается в октаэдрической пустоте. При g > 1. 732 КЧ шара радиуса R 2 повышается до 8. При g = 2 R 1 = R 2 (плотнейшая упаковка одинаковых шаров).
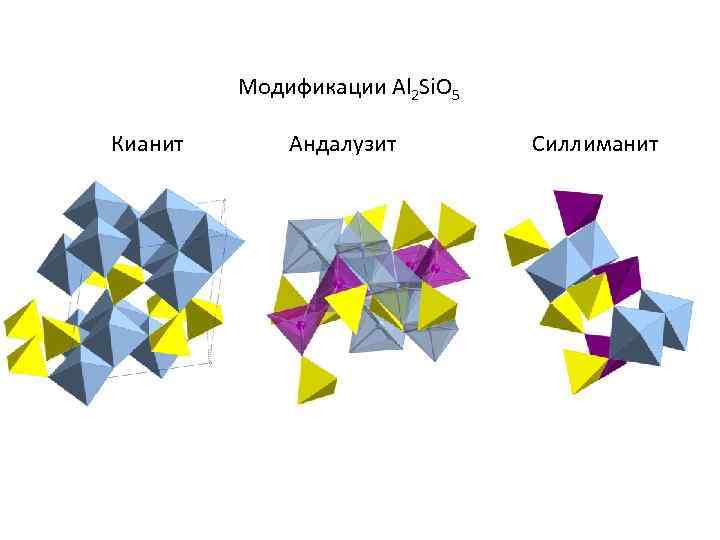 Модификации Al 2 Si. O 5 Кианит Андалузит Силлиманит
Модификации Al 2 Si. O 5 Кианит Андалузит Силлиманит
 (Bi 3 O 3)3(B 2 O 3)5
(Bi 3 O 3)3(B 2 O 3)5
 Критерии устойчивости структурного типа Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением 2. В устойчивой существенно ионной структуре валентность каждого аниона, взятая с обратным знаком, точно или приближенно равна сумме валентных усилий катионов первой координационной сферы:
Критерии устойчивости структурного типа Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением 2. В устойчивой существенно ионной структуре валентность каждого аниона, взятая с обратным знаком, точно или приближенно равна сумме валентных усилий катионов первой координационной сферы:
 Ba. Na. Sc(BO 3)2
Ba. Na. Sc(BO 3)2
 Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением 2. В устойчивой существенно ионной структуре валентность каждого аниона, взятая с обратным знаком, точно или приближенно равна сумме валентных усилий катионов первой координационной сферы. 3. Устойчивость кристаллической структуры снижается при наличии общих ребер и особенно граней КП 4. Высоковалентные и особенно мелкие катионы стремятся не иметь общих анионов 5. Число разных по конструкции структурных фрагментов стремится к минимуму
Правила Л. Полинга для существенно ионных кристаллов 1. Расстояние катион–анион в КП определяется суммой ионных радиусов, а КЧ – их отношением 2. В устойчивой существенно ионной структуре валентность каждого аниона, взятая с обратным знаком, точно или приближенно равна сумме валентных усилий катионов первой координационной сферы. 3. Устойчивость кристаллической структуры снижается при наличии общих ребер и особенно граней КП 4. Высоковалентные и особенно мелкие катионы стремятся не иметь общих анионов 5. Число разных по конструкции структурных фрагментов стремится к минимуму
 Основной закон кристаллохимии (Гольдшмидта): Структура кристалла определяется количественным соотношением его структурных единиц, отношением их размеров и их поляризационными свойствами
Основной закон кристаллохимии (Гольдшмидта): Структура кристалла определяется количественным соотношением его структурных единиц, отношением их размеров и их поляризационными свойствами
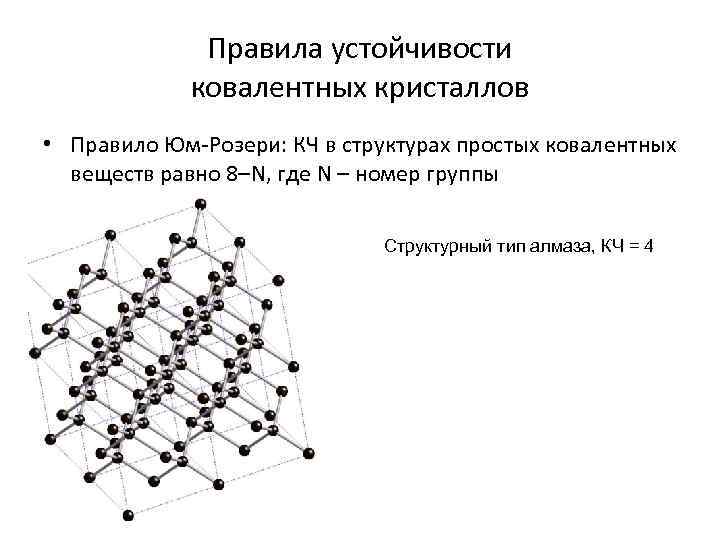 Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип алмаза, КЧ = 4
Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип алмаза, КЧ = 4
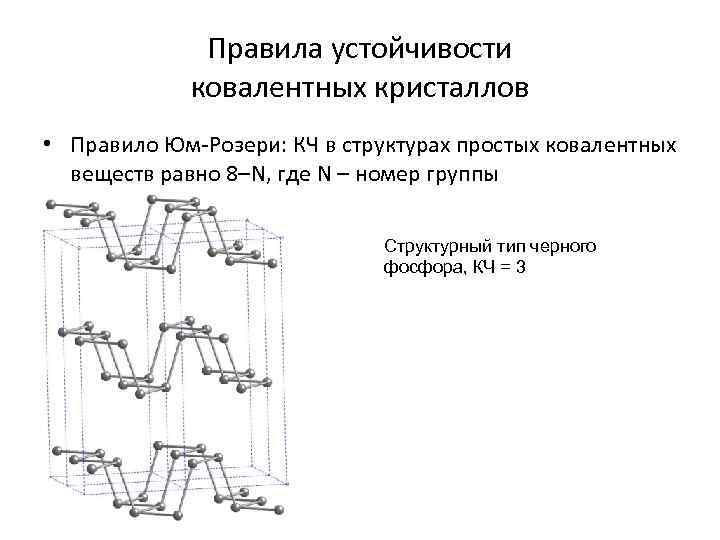 Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип черного фосфора, КЧ = 3
Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип черного фосфора, КЧ = 3
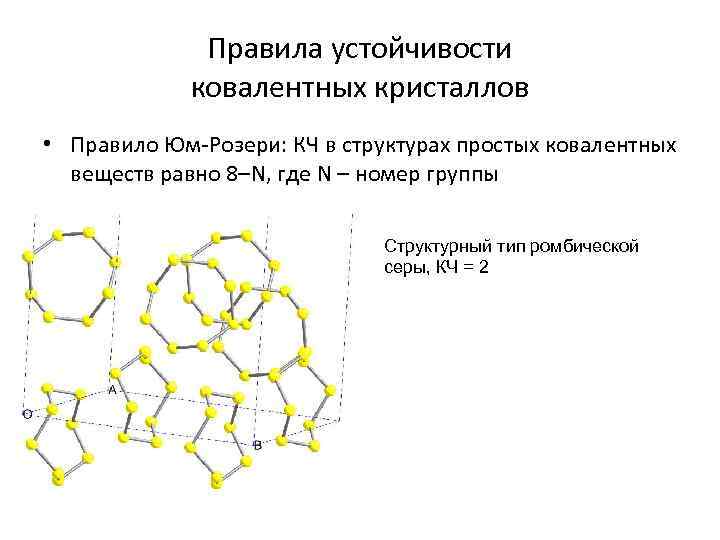 Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип ромбической серы, КЧ = 2
Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип ромбической серы, КЧ = 2
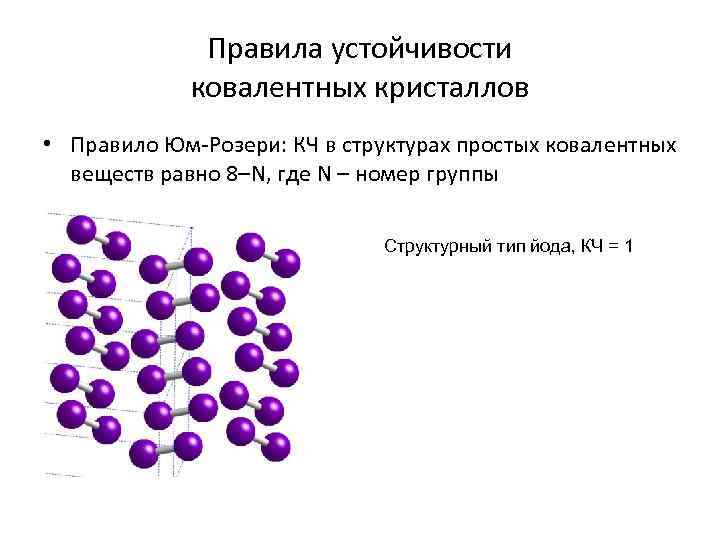 Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип йода, КЧ = 1
Правила устойчивости ковалентных кристаллов • Правило Юм-Розери: КЧ в структурах простых ковалентных веществ равно 8–N, где N – номер группы Структурный тип йода, КЧ = 1
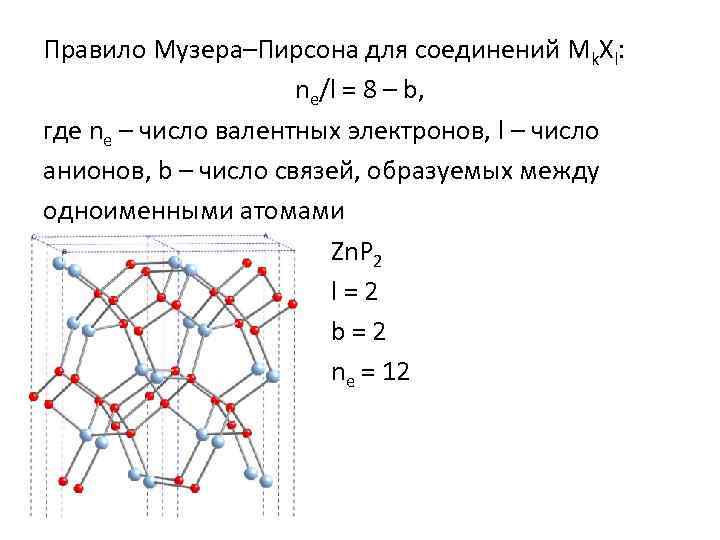 Правило Музера–Пирсона для соединений Mk. Xl: ne/l = 8 – b, где ne – число валентных электронов, l – число анионов, b – число связей, образуемых между одноименными атомами Zn. P 2 l=2 b=2 ne = 12
Правило Музера–Пирсона для соединений Mk. Xl: ne/l = 8 – b, где ne – число валентных электронов, l – число анионов, b – число связей, образуемых между одноименными атомами Zn. P 2 l=2 b=2 ne = 12
 Правила Партэ (для тетраэдрических структур халькогенидов) b. L/m = ne/m – 4, где b. L – число неподеленных пар, m – число атомов на формулу ne/l = 8 – (k/l)b. MM + b. XX, где k – число катионов, l – число анионов, b. MM и b. XX – числа связей катион–катион (и неподеленных электронных пар катионов) и анион–анион.
Правила Партэ (для тетраэдрических структур халькогенидов) b. L/m = ne/m – 4, где b. L – число неподеленных пар, m – число атомов на формулу ne/l = 8 – (k/l)b. MM + b. XX, где k – число катионов, l – число анионов, b. MM и b. XX – числа связей катион–катион (и неподеленных электронных пар катионов) и анион–анион.
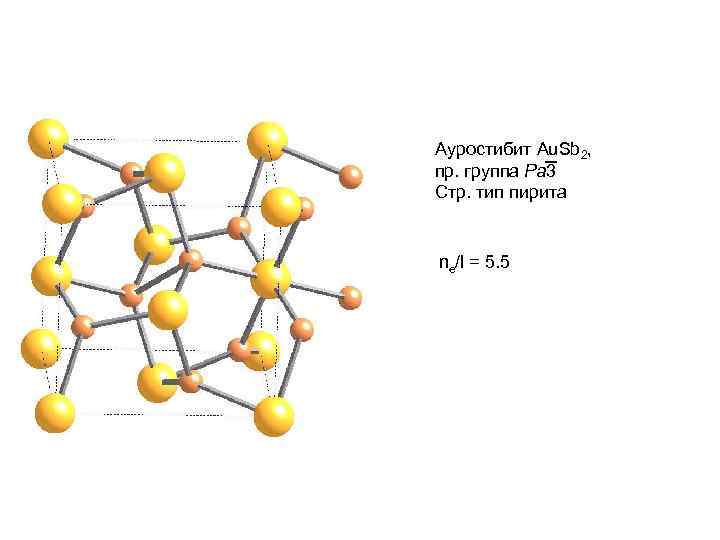 Ауростибит Au. Sb 2, пр. группа Pa 3 Стр. тип пирита ne/l = 5. 5
Ауростибит Au. Sb 2, пр. группа Pa 3 Стр. тип пирита ne/l = 5. 5
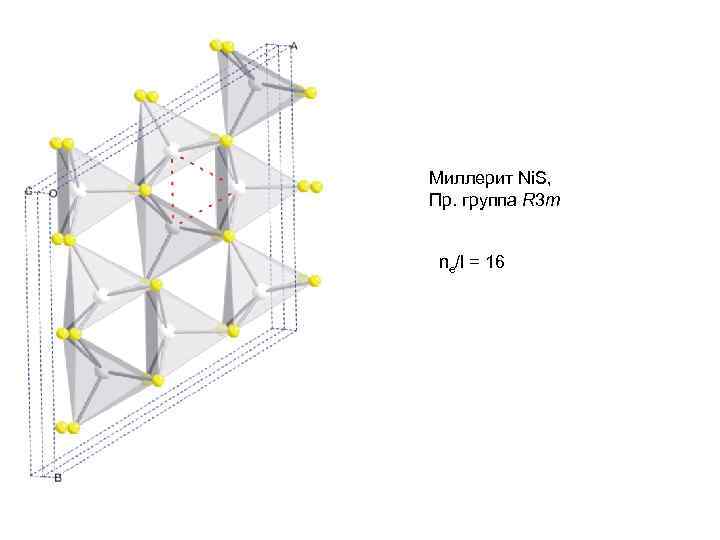 Миллерит Ni. S, Пр. группа R 3 m ne/l = 16
Миллерит Ni. S, Пр. группа R 3 m ne/l = 16
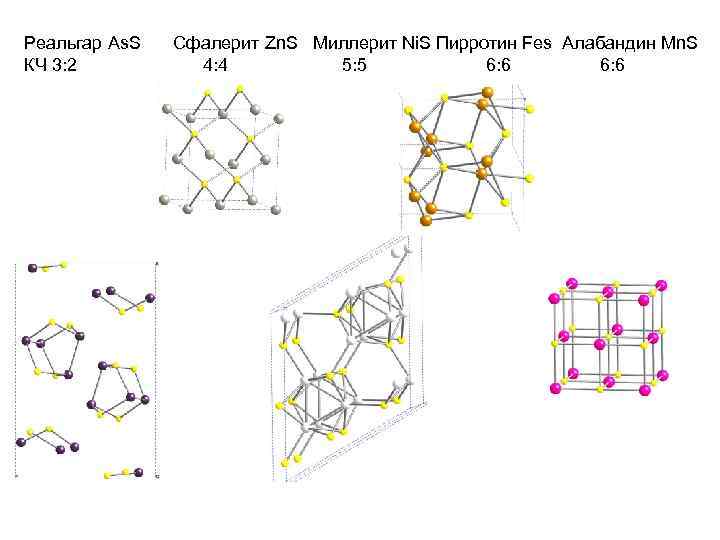 Реальгар As. S КЧ 3: 2 Сфалерит Zn. S Миллерит Ni. S Пирротин Fes Алабандин Mn. S 4: 4 5: 5 6: 6
Реальгар As. S КЧ 3: 2 Сфалерит Zn. S Миллерит Ni. S Пирротин Fes Алабандин Mn. S 4: 4 5: 5 6: 6


