 Основное уравнение МКТ газов. Температура Вывод основного уравнения МКТ 1. Модель идеального газа. молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. 2. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура). 3. Пусть имеется N частиц (атомов или молекул) каждая массой m 0 в некотором кубическом сосуде. 4. Молекулы движутся хаотически, то события, состоящие в движении в одном из шести направлений пространства, совпадающих с осями декартовой системы координат, равновероятностны. 5. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона. Каждая из частиц, сталкивающихся со стенкой, передаёт ей импульс ΔP = 2 m 0υx.
Основное уравнение МКТ газов. Температура Вывод основного уравнения МКТ 1. Модель идеального газа. молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. 2. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура). 3. Пусть имеется N частиц (атомов или молекул) каждая массой m 0 в некотором кубическом сосуде. 4. Молекулы движутся хаотически, то события, состоящие в движении в одном из шести направлений пространства, совпадающих с осями декартовой системы координат, равновероятностны. 5. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона. Каждая из частиц, сталкивающихся со стенкой, передаёт ей импульс ΔP = 2 m 0υx.

 6. Если площадь стенки S , а концентрация - n , то количество частиц, сталкивающихся со стенкой S за время Δt равно Δ N = n. SυxΔt /2 (половина частиц двигаются по оси х – ов). 7. Так как давление p = F/S , а F= ΔP * Δ N / Δt - суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим 8. В состоянии равновесия скорости молекул разбросаны не только по направлению, но и по величине, т. е. величины υx различны. В полученной формуле предполагается усредненное значение квадрата проекции скорости молекул . Можно показать, что 9. Теперь формулу для давления газа можно записать в виде
6. Если площадь стенки S , а концентрация - n , то количество частиц, сталкивающихся со стенкой S за время Δt равно Δ N = n. SυxΔt /2 (половина частиц двигаются по оси х – ов). 7. Так как давление p = F/S , а F= ΔP * Δ N / Δt - суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим 8. В состоянии равновесия скорости молекул разбросаны не только по направлению, но и по величине, т. е. величины υx различны. В полученной формуле предполагается усредненное значение квадрата проекции скорости молекул . Можно показать, что 9. Теперь формулу для давления газа можно записать в виде
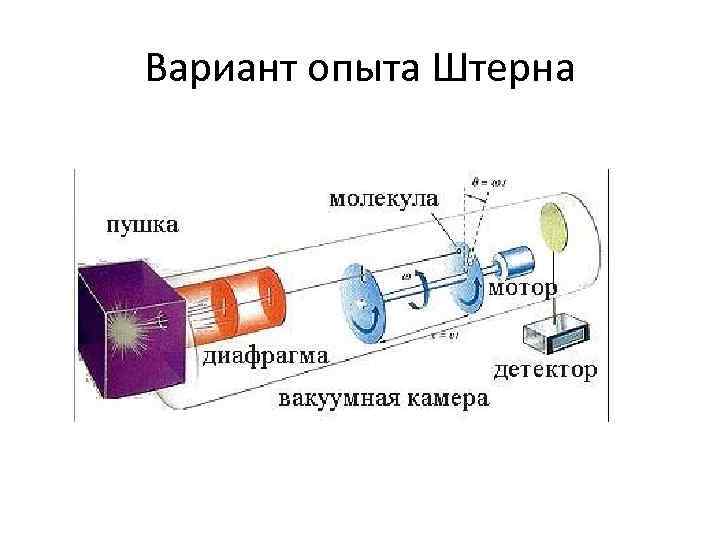 Вариант опыта Штерна
Вариант опыта Штерна
 10. Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой: 11. Последнее равенство вытекает из формулы: 12. Формула для среднего давления газа на стенку сосуда запишется в виде Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m 0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов. Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
10. Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой: 11. Последнее равенство вытекает из формулы: 12. Формула для среднего давления газа на стенку сосуда запишется в виде Это уравнение устанавливает связь между давлением p идеального газа, массой молекулы m 0, концентрацией молекул n, средним значением квадрата скорости и средней кинетической энергией поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов. Таким образом, давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
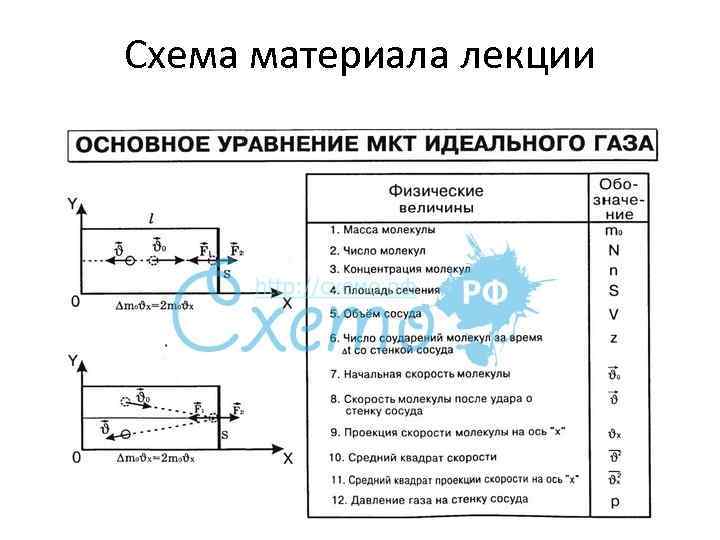 Схема материала лекции
Схема материала лекции
 Схема материала лекции
Схема материала лекции