lecture_6_zblizennya_2011.pptx
- Количество слайдов: 63

Основні причини високої ефективності ферментів зближення реагентів при сорбції їх в активному центрі, цей фактор еквівалентний підвищенню концентрації реагуючих речовин; специфічна орієнтація сорбованого в активному центрі субстрату, сприятлива для взаємодії з каталітичною ділянкою активного центру; утворення хімічних зв'язків між субстратом і каталітичною ділянкою активного центру, що направляє реакцію по енергетично найбільш легкому шляхові; здійснення всіх основних хімічних перетворень субстрату «внутрішньомолекулярно» – у складі фермент-субстратного комплексу; виняткова гнучкість молекули ферменту, що дозволяє активному центру приймати на кожній стадії перетворення фермент-субстратного комплексу будову, що сприяє досягненню максимальної швидкості даної стадії реакції. Кожна попередня стадія підготовлює найкращі умови для наступної.

Основні каталітичні стратегії • Каталіз зближенням • Ковалентний каталіз • Кислотно-основний каталіз • Електростатичний каталіз (за участю іонів металів)

Каталітичні стратегії • Каталіз зближенням • Фермент здатний зв'язувати молекулу субстрату таким чином, що зв'язок, що атакується ферментом, виявляється не тільки розташованим в безпосередній близькості від каталітичної групи, але й правильно орієнтований відносно неї. У результаті ймовірність того, що комплекс ЕS досягне перехідного стану, сильно збільшується. • Для реакцій, що включають 2 субстрати, швидкість реакції зростає при їх зближенні в правильній орієнтації. • Кислотно-основний каталіз • В активному центрі ферменту можуть перебувати групи специфічних амінокислотних залишків, які є донорами або акцепторами протонів.

Каталітичні стратегії • Ковалентний каталіз заснований на атаці нуклеофільних (негативно заряджених) або електрофільних (позитивно заряджених) груп активного центру ферменту молекулами субстрату з формуванням ковалентного зв'язку між субстратом і коферментом або функціональною групою амінокислотного залишку ( як правило, однією) активного центру ферменту. • Каталіз за участю іонів металів – Іони металів можуть відігравати роль електрофільних каталізаторів, стабілізуючи негативний заряд на проміжному етапі реакції.
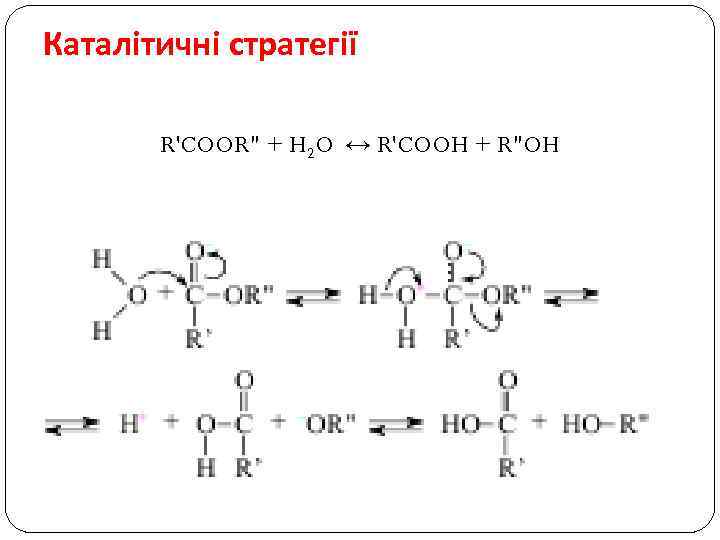
Каталітичні стратегії R'COOR" + H 2 O ↔ R'COOH + R"OH
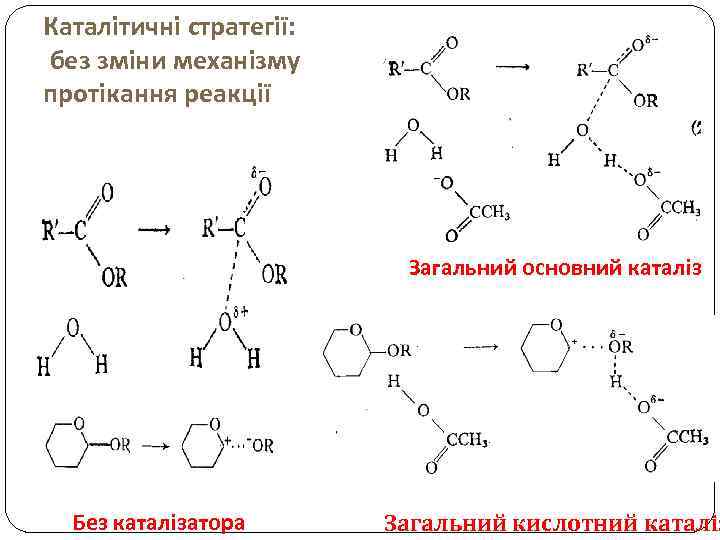
Каталітичні стратегії: без зміни механізму протікання реакції Загальний основний каталіз Без каталізатора Загальний кислотний каталіз
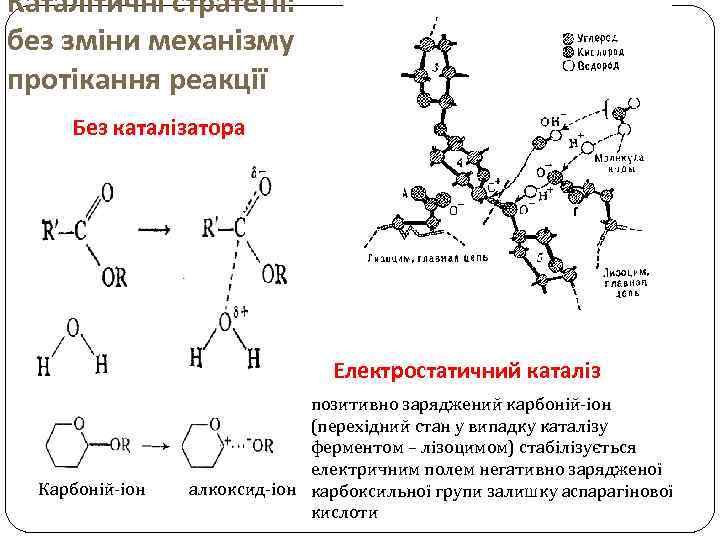
Каталітичні стратегії: без зміни механізму протікання реакції Без каталізатора Електростатичний каталіз Карбоній-іон позитивно заряджений карбоній-іон (перехідний стан у випадку каталізу ферментом – лізоцимом) стабілізується електричним полем негативно зарядженої алкоксид-іон карбоксильної групи залишку аспарагінової кислоти
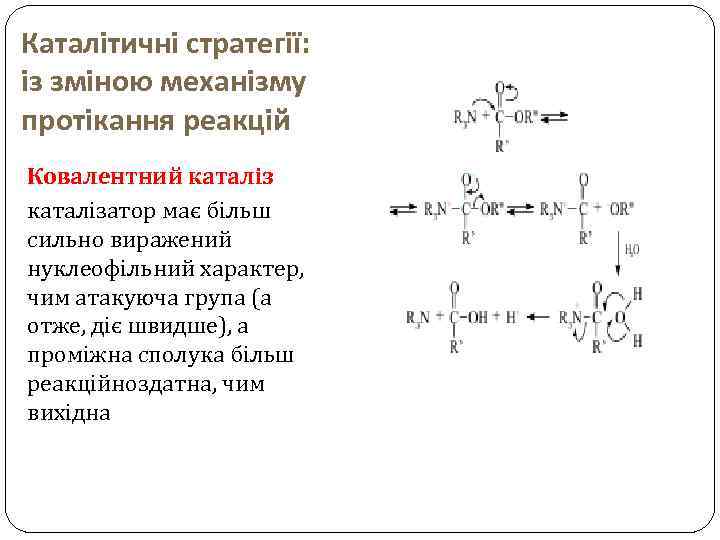
Каталітичні стратегії: із зміною механізму протікання реакцій Ковалентний каталізатор має більш сильно виражений нуклеофільний характер, чим атакуюча група (а отже, діє швидше), а проміжна сполука більш реакційноздатна, чим вихідна
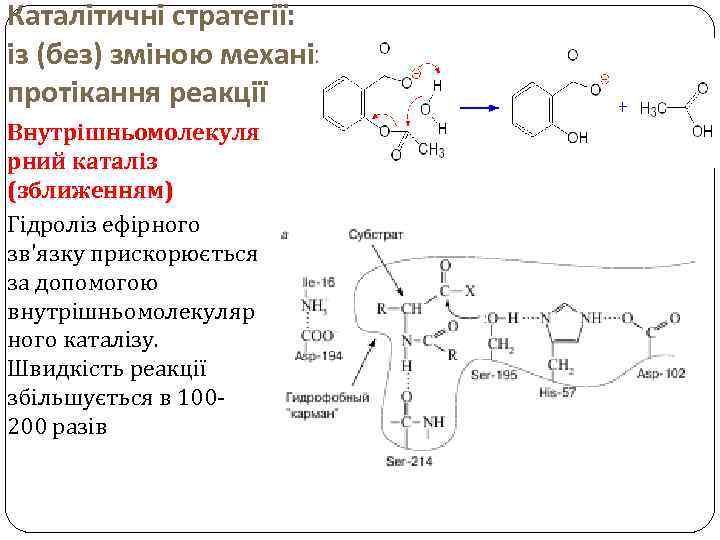
Каталітичні стратегії: із (без) зміною механізму протікання реакції Внутрішньомолекуля рний каталіз (зближенням) Гідроліз ефірного зв'язку прискорюється за допомогою внутрішньомолекуляр ного каталізу. Швидкість реакції збільшується в 100200 разів

Каталіз зближенням Механізм зближення й орієнтації при "внутрішньомолекулярному" перетворенні комплексу між реагентами. Механізми напруження й індукованої відповідності. Концепції деформації.

Каталіз зближенням Ферменти відіграють роль матриці, що наближує субстрати в реакційному центрі. - зближення субстрату з каталітичною групою чи іншими субстратами; - правильна орієнтація для формування зв’язку; - “Замороження” трансляційних та ротаційних рухів. Реакції в розчині ⇒зближення реагуючих молекул ⇒зменшення ентропії Ферментативні реакції в межах ES комплексу ⇒ ефективна концентрація каталітичних груп висока в порівнянні з реакцією в розчині ⇒виграш в енергії оплачений енергією зв'язування субстрату ферментом Зменшення ентропії поступального й обертового руху відбувається не на хімічній стадії реакції.
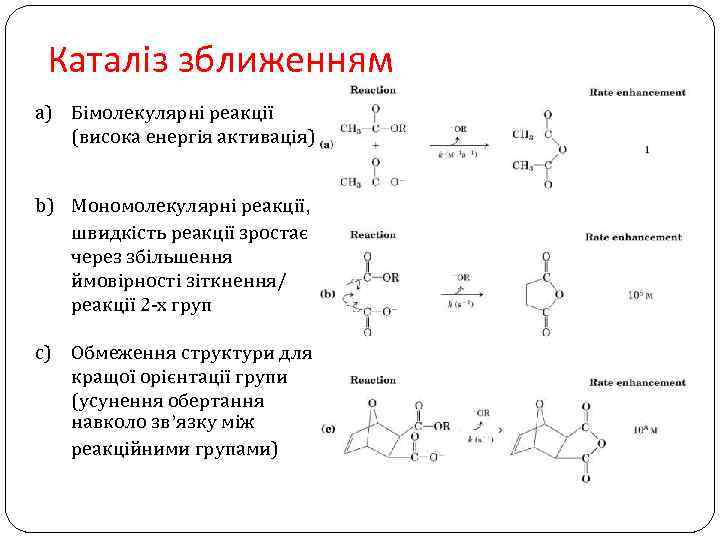
Каталіз зближенням a) Бімолекулярні реакції (висока енергія активація) b) Мономолекулярні реакції, швидкість реакції зростає через збільшення ймовірності зіткнення/ реакції 2 -х груп c) Обмеження структури для кращої орієнтації групи (усунення обертання навколо зв’язку між реакційними групами)
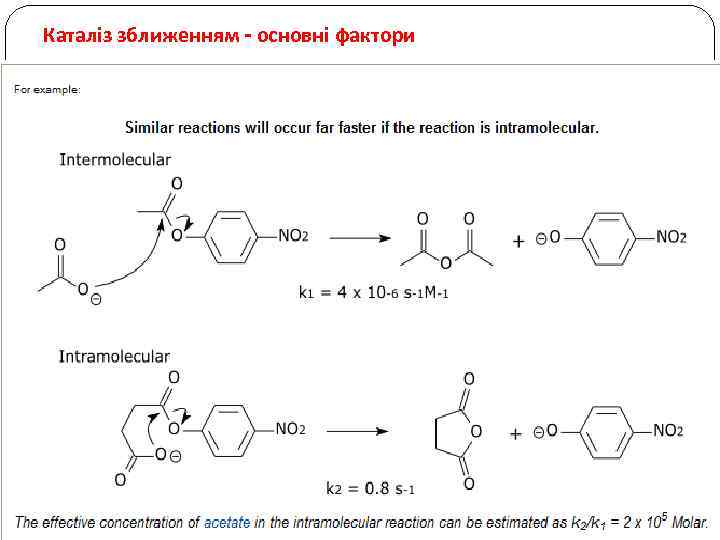
Каталіз зближенням - основні фактори
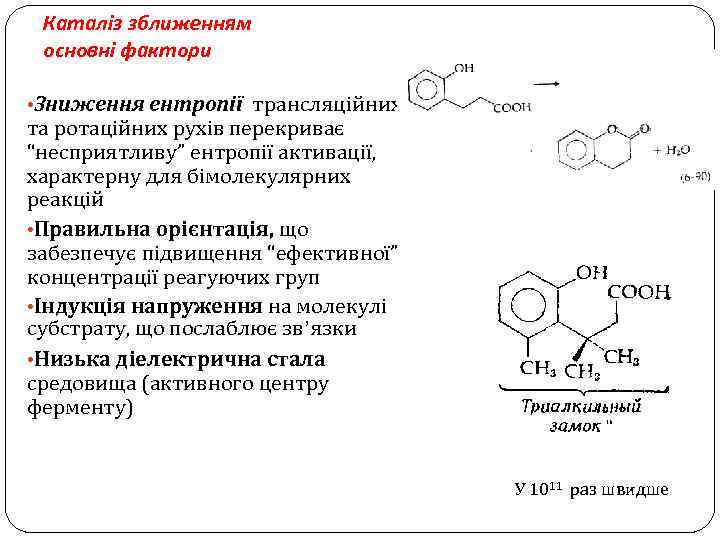
Каталіз зближенням основні фактори • Зниження ентропії трансляційних та ротаційних рухів перекриває “несприятливу” ентропії активації, характерну для бімолекулярних реакцій • Правильна орієнтація, що забезпечує підвищення “ефективної” концентрації реагуючих груп • Індукція напруження на молекулі субстрату, що послаблює зв’язки • Низька діелектрична стала средовища (активного центру ферменту) У 1011 раз швидше

Моделі ES взаємодії пояснюють специфічність “хороший” субстрат зв’язується правильно – теорії продуктивного зв’язування “хороший” субстрат деформує фермент – теорії індукованої відповідності “хороший” субстрат деформується ферментом – теорії напруження і деформації
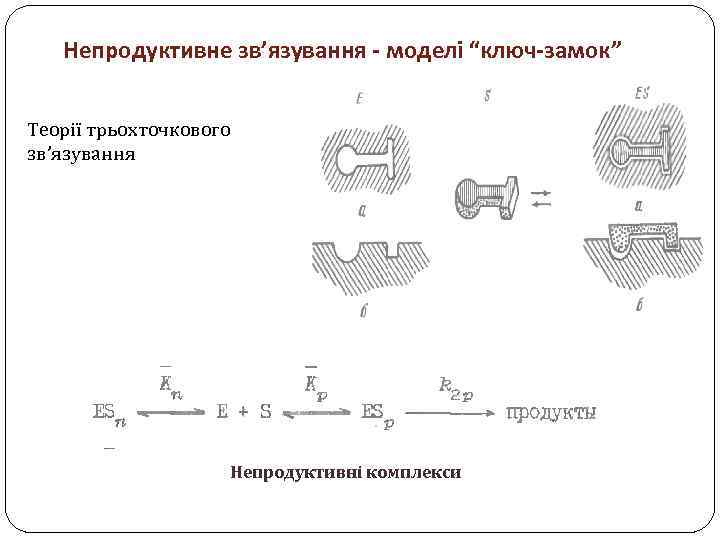
Непродуктивне зв’язування - моделі “ключ-замок” Теорії трьохточкового зв’язування Непродуктивні комплекси
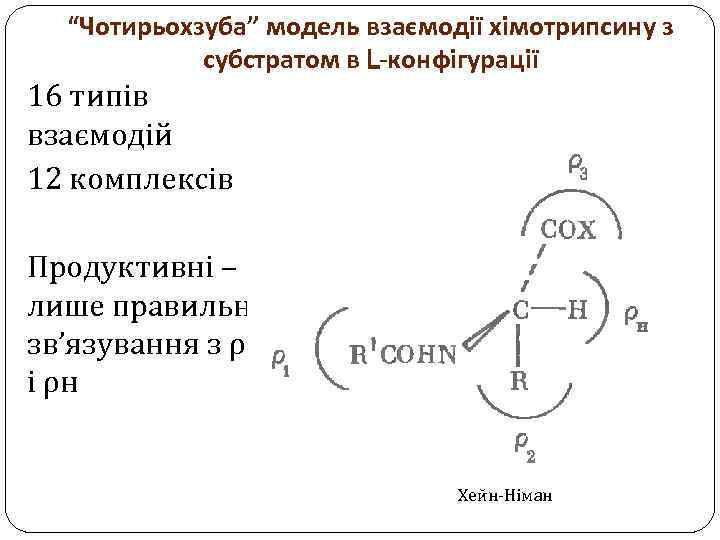
“Чотирьохзуба” модель взаємодії хімотрипсину з субстратом в L-конфігурації 16 типів взаємодій 12 комплексів Продуктивні – лише правильне зв’язування з ρ3 і ρн Хейн-Німан
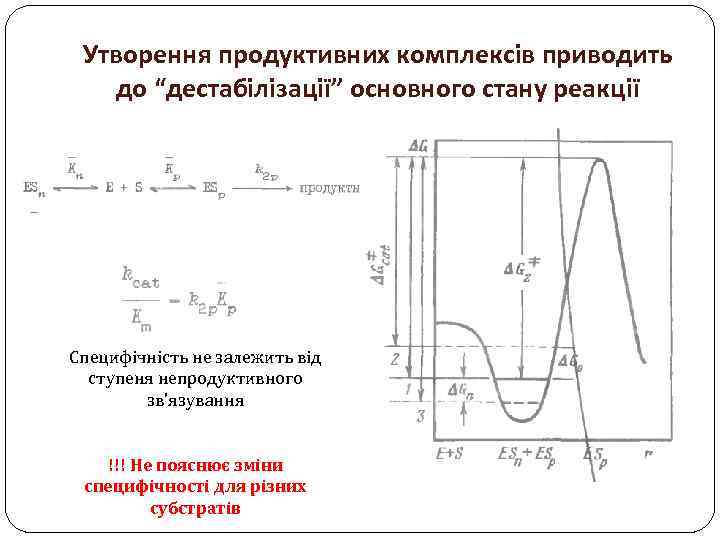
Утворення продуктивних комплексів приводить до “дестабілізації” основного стану реакції Специфічність не залежить від ступеня непродуктивного зв’язування !!! Не пояснює зміни специфічності для різних субстратів
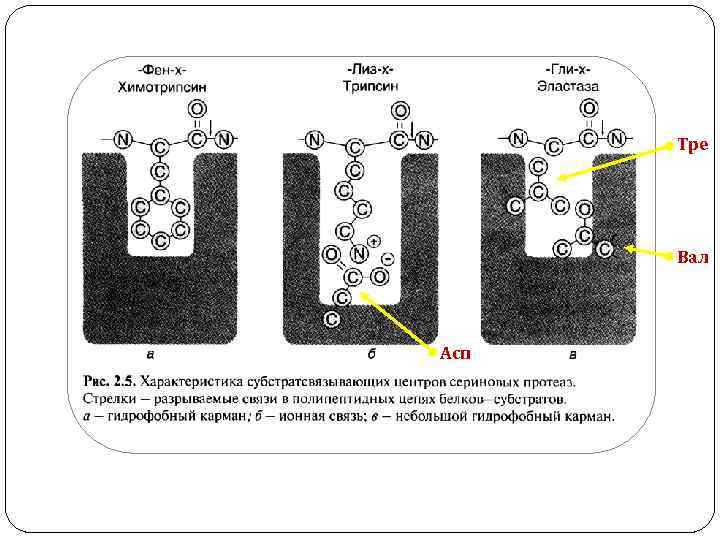
Тре Вал Асп
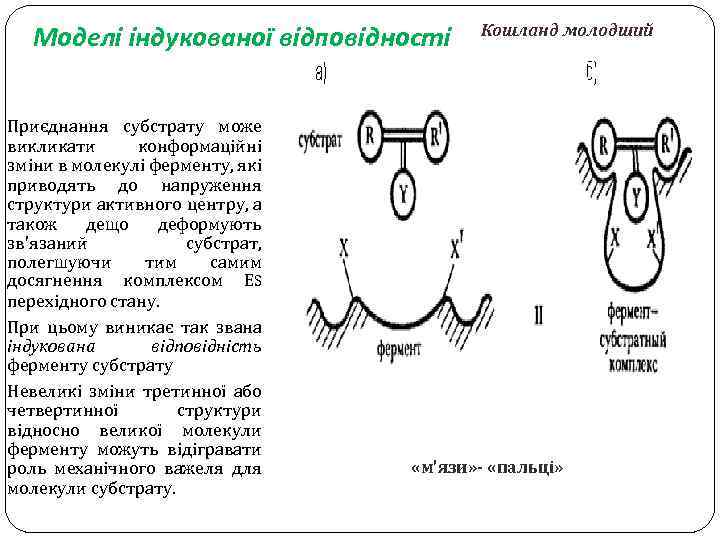
Моделі індукованої відповідності Приєднання субстрату може викликати конформаційні зміни в молекулі ферменту, які приводять до напруження структури активного центру, а також дещо деформують зв'язаний субстрат, полегшуючи тим самим досягнення комплексом ЕS перехідного стану. При цьому виникає так звана індукована відповідність ферменту субстрату Невеликі зміни третинної або четвертинної структури відносно великої молекули ферменту можуть відігравати роль механічного важеля для молекули субстрату. Кошланд молодший «м’язи» - «пальці»
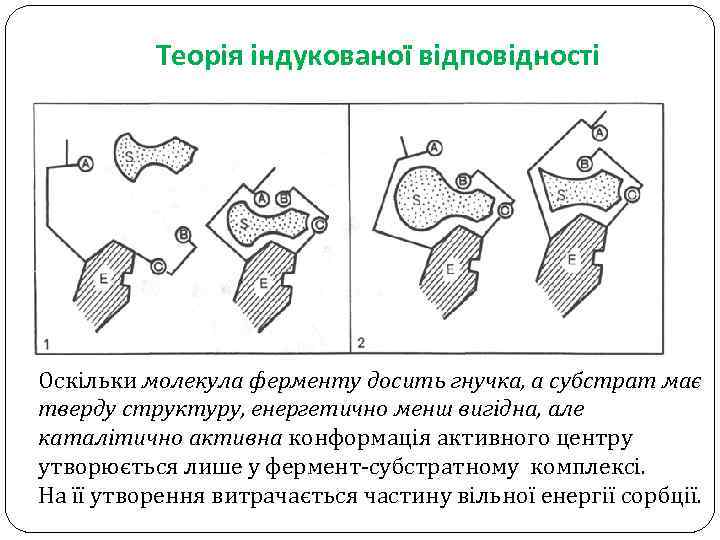
Теорія індукованої відповідності Оскільки молекула ферменту досить гнучка, а субстрат має тверду структуру, енергетично менш вигідна, але каталітично активна конформація активного центру утворюється лише у фермент-субстратному комплексі. На її утворення витрачається частину вільної енергії сорбції.
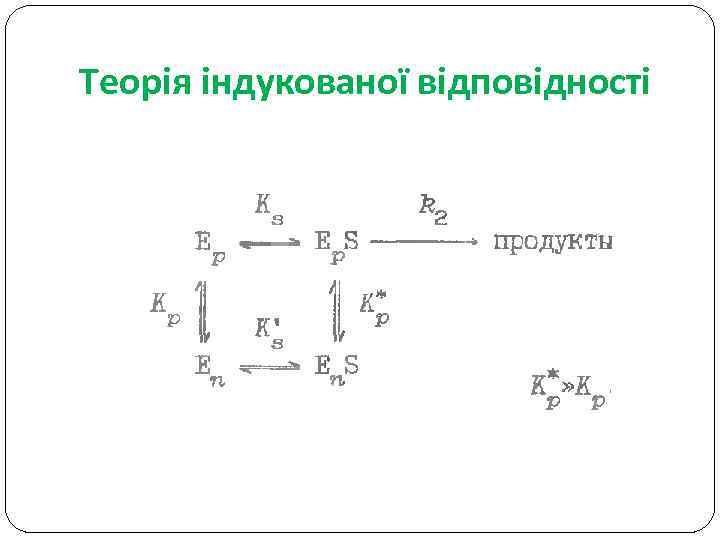
Теорія індукованої відповідності
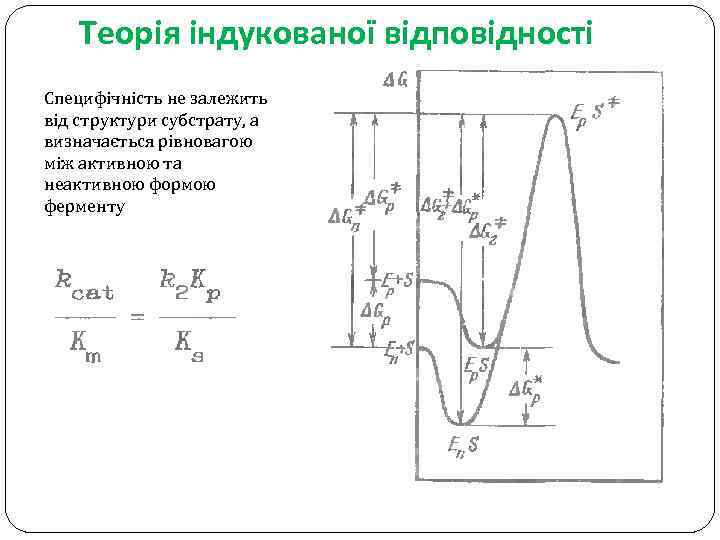
Теорія індукованої відповідності Специфічність не залежить від структури субстрату, а визначається рівновагою між активною та неактивною формою ферменту

теорія індукованої відповідності Гексокіназа переносить фосфатну групу з АТФ на глюкозу. Але ця ж фосфатна група може бути перенесена й на воду; однак цього не відбувається. 1) До зв'язування із субстратом фермент перебуває в "відкритій" формі (у якій він може захопити субстрат з води, але не здатний провести його фосфорилювання). 2) Після зв'язування із субстратом домени повертаються, щілина закривається, вода з неї витісняється, а усі компоненти каталітичного центру сходяться разом: фермент - переходить в "закриту", каталітично-активну форму, але вода витиснута з активного центру й тому не конкурує із субстратом за фосфорилювання. 3) Після каталітичного акту фермент знову відкривається, і фосфорильований субстрат виходить.
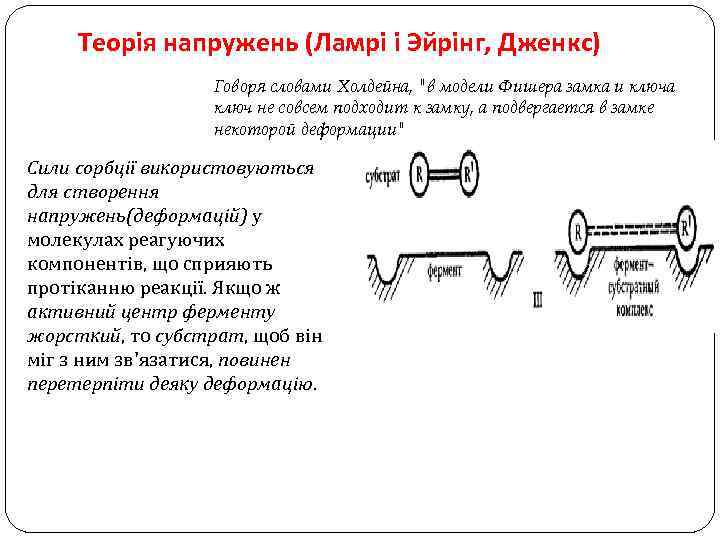
Теорія напружень (Ламрі і Эйрінг, Дженкс) Говоря словами Холдейна, "в модели Фишера замка и ключа ключ не совсем подходит к замку, а подвергается в замке некоторой деформации" Сили сорбції використовуються для створення напружень(деформацій) у молекулах реагуючих компонентів, що сприяють протіканню реакції. Якщо ж активний центр ферменту жорсткий, то субстрат, щоб він міг з ним зв'язатися, повинен перетерпіти деяку деформацію.
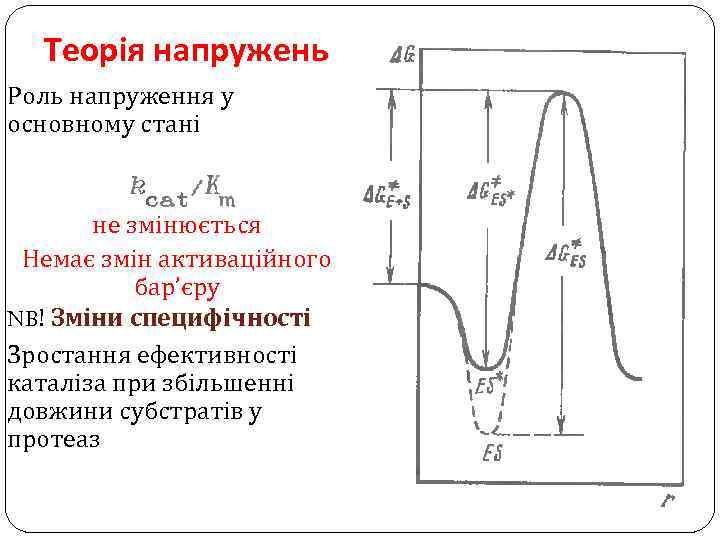
Теорія напружень Роль напруження у основному стані не змінюється Немає змін активаційного бар’єру NB! Зміни специфічності Зростання ефективності каталіза при збільшенні довжини субстратів у протеаз

Еволюція уявлень Геометричні деформації молекули субстрату “диба” напруження як наслідок десольватаційних, ентропійних та електростатичних ефектів

Порівняння моделей ES взаємодії
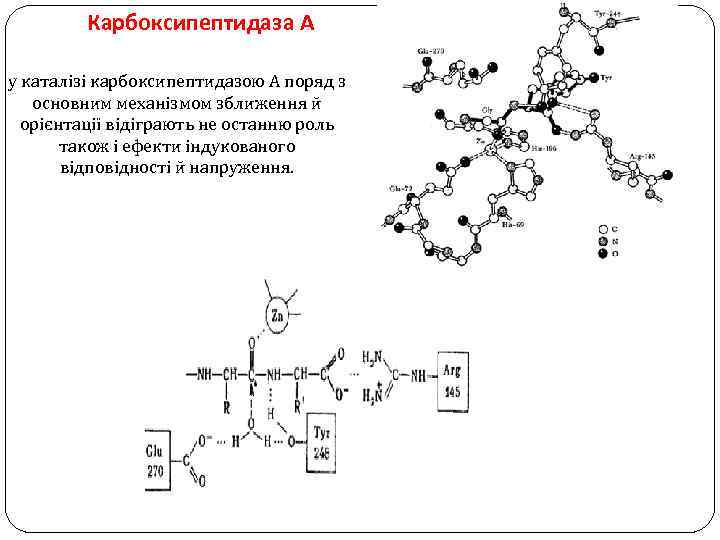
Карбоксипептидаза А у каталізі карбоксипептидазою А поряд з основним механізмом зближення й орієнтації відіграють не останню роль також і ефекти індукованого відповідності й напруження.

Каталітичні стратегії Кислотно-основний каталіз – у хімічній реакції є задіяними кислотні (донори протонів ) чи основні (акцептори протонів) групи. Функціональні групи амінокислотних залишків, що входять до складу активного центру, мажуть проявляти властивості кислот чи лугів. Найчастіше це Цис, Тир, Сер, Ліз, Глу, Асп, Гіс У ході реакції відбувається приєднання чи від’єднання Н+ до субстрату, у результаті чого утворюється іонізована молекула субстрату (+ чи -), що у подальшому може взаємодіяти за речовинами розчину чи піддаватись внутрішньомолекулярним перебудовам.

Кислотно-основний каталіз Кислотний каталіз Прискорюється кислотами Специфічний – активація S відбувається під впливом іонів гідроксонію Н 3 О + Загальний - S активується будь-яким донором Н+ (окрім Н 3 О-)- узагальнені кислоти Брюнстеда Електрофільний – відбувається у присутності кислот Льюіса (сполуки, що є акцепторами ел. пари) Основний каталіз Прискорюється основами Специфічний - активація S відбувається за участю гідроксильних іонів ОН Загальний – під впливом узагальнених основ Брюнстеда Нуклеофільний - у присутності основ Льюіса (сполуки, що є донорами ел. пари)

Інші випадки кислотно-основного каталіза Загальний кислотно-основний каталіз – якщо ініціаторами виступають одночасно кислота та основа Загальний електрофільно-нуклеофільний каталіз – відбувається в присутності кислот та основ Льюіса “Пуш-пульний” механізм (“тягни-штовхай”) – якщо на субстрат одночасно діють 2 каталізатора з різними властивостями, що призводить до зміщення ел. пари чи протона

Кислотно-основний каталіз Сутність загального кислотно-основного каталізу зводиться до стабілізації перехідного стану реакції за рахунок більш сприятливого розподілу електронів між зв'язками, що утворюються та розриваються

Кислотно-основний каталіз Причини, у силу яких ефекти загального кислотноосновного каталізу можуть виявитися у ферментативних системах більш ефективними, чим в неферментативних реакціях. 1. В активних центрах ферментів у рамках відносно твердої третинної структури білка взаємодіючі функціональні групи вже у вихідному стані реакції в набагато більшому ступені зближені й зорієнтовані, чим в більшості неферментативних внутрішньомолекулярних процесів. 2. Аполярне ( зокрема, дегідратоване) мікросередовище деяких активних центрів повинне сприяти десольватації (хоча б частковій) электрофільних і нуклеофільних центрів, що підсилює їхню взаємодію.
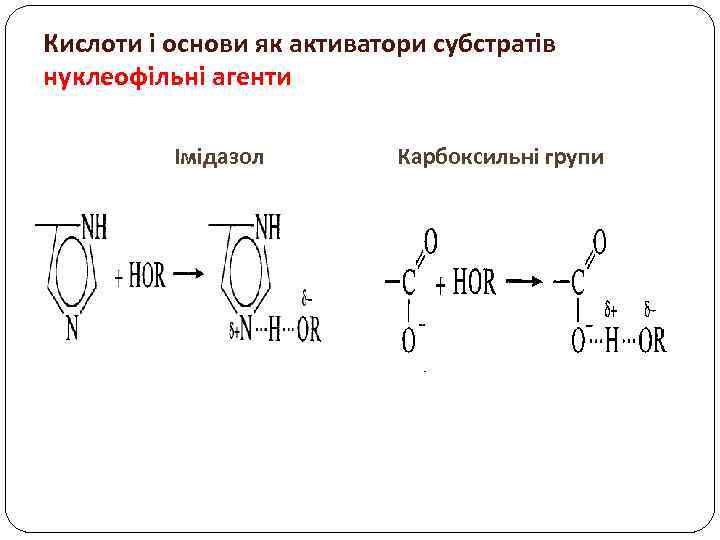
Кислоти і основи як активатори субстратів нуклеофільні агенти Імідазол Карбоксильні групи
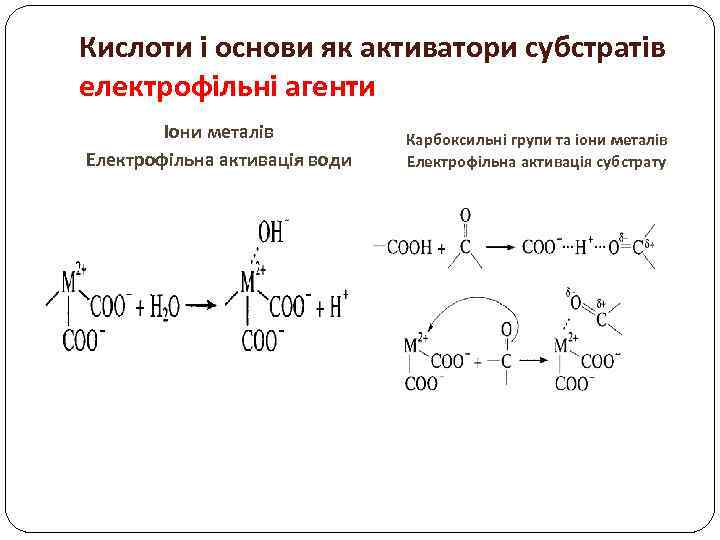
Кислоти і основи як активатори субстратів електрофільні агенти Іони металів Електрофільна активація води Карбоксильні групи та іони металів Електрофільна активація субстрату

Відмінність між нуклеофільним та загальним основним каталізом нуклеофільний загальний основний М’які нуклеофіли, що Жорсткі основи, що не легко поляризуються Сильні основи поляризуються Слабкі основи Граница между нуклеофильностью и основностью очень тонкая: основность - способность веществ (частиц) отщеплять протон (чем способность выше, тем сила основания выше - определяется константой равновесия BH (или B-)+ HA = BH 2 (или BH) + A-). Нуклеофильность - способность смещать электронную плотность по отношению к частицам с пустой орбиталью - электрофилам (могут быть заряжены положительно или нейтральными).
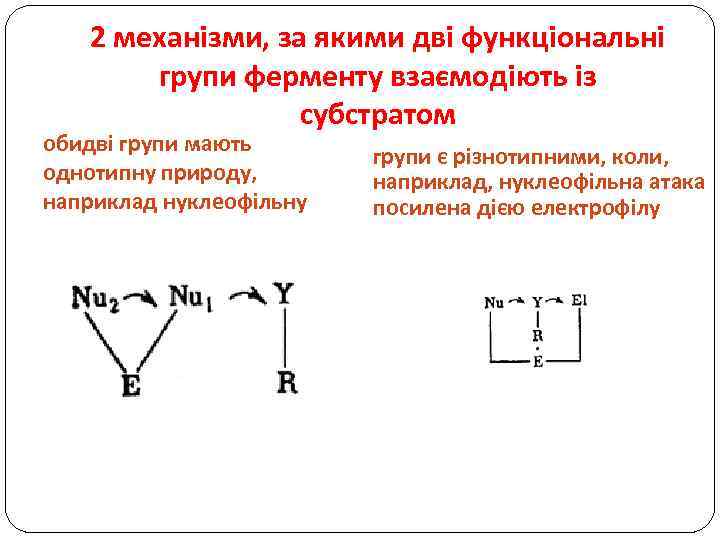
2 механізми, за якими дві функціональні групи ферменту взаємодіють із субстратом обидві групи мають однотипну природу, наприклад нуклеофільну групи є різнотипними, коли, наприклад, нуклеофільна атака посилена дією електрофілу
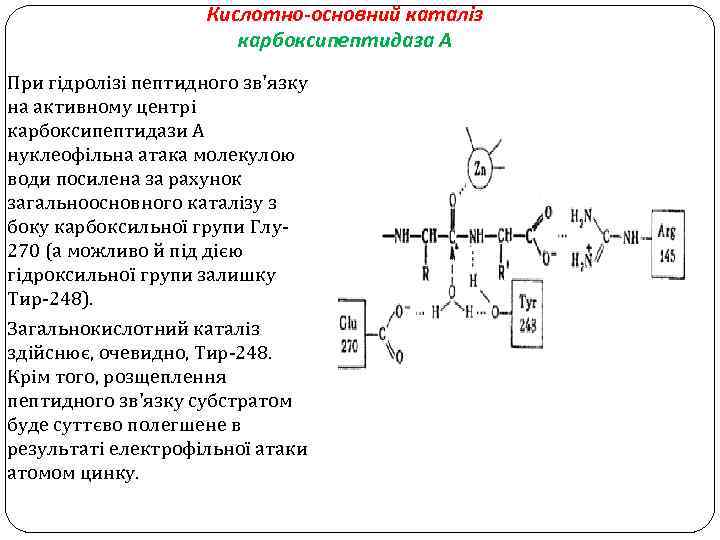
Кислотно-основний каталіз карбоксипептидаза А При гідролізі пептидного зв'язку на активному центрі карбоксипептидази А нуклеофільна атака молекулою води посилена за рахунок загальноосновного каталізу з боку карбоксильної групи Глу270 (а можливо й під дією гідроксильної групи залишку Тир-248). Загальнокислотний каталіз здійснює, очевидно, Тир-248. Крім того, розщеплення пептидного зв'язку субстратом буде суттєво полегшене в результаті електрофільної атаки атомом цинку.
Кислотно-основний каталіз РНКаза Н
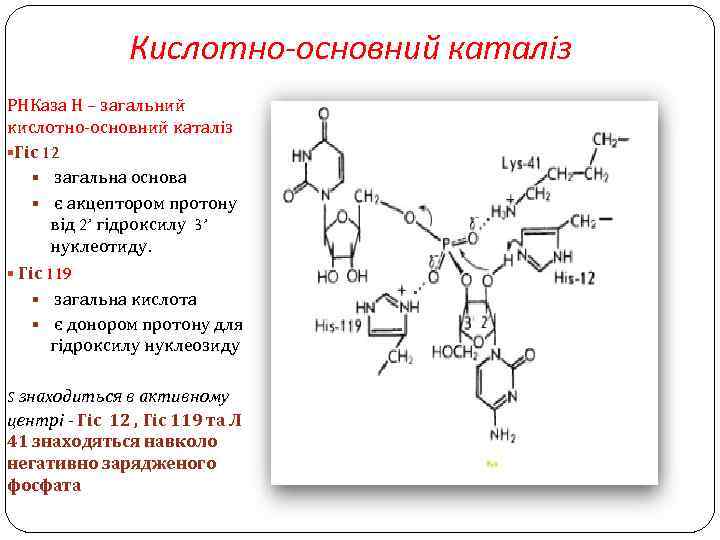
Кислотно-основний каталіз РНКаза Н – загальний кислотно-основний каталіз §Гіс 12 § загальна основа § є акцептором протону від 2’ гідроксилу 3’ нуклеотиду. § Гіс 119 § загальна кислота § є донором протону для 5’ гідроксилу нуклеозиду. S знаходиться в активному центрі - Гіс 12 , Гіс 119 та Ліз 41 знаходяться навколо негативно зарядженого фосфата
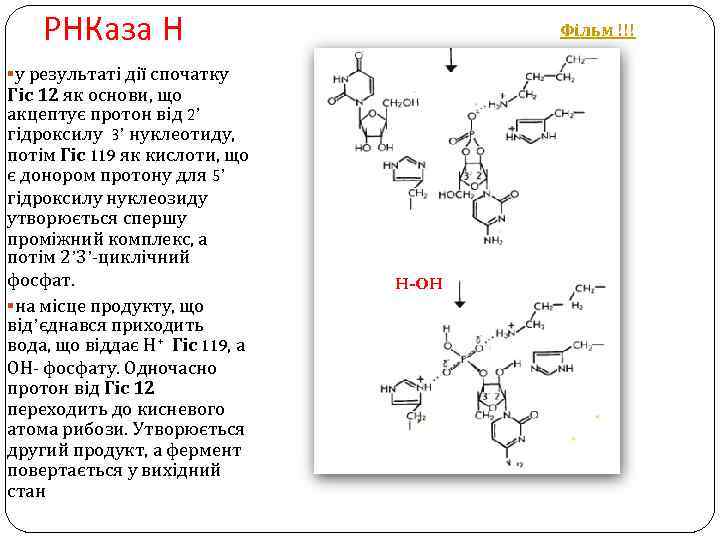
РНКаза Н Фільм !!! §у результаті дії спочатку Гіс 12 як основи, що акцептує протон від 2’ гідроксилу 3’ нуклеотиду, потім Гіс 119 як кислоти, що є донором протону для 5’ гідроксилу нуклеозиду утворюється спершу проміжний комплекс, а потім 2’ 3’-циклічний фосфат. §на місце продукту, що від’єднався приходить вода, що віддає Н+ Гіс 119, а ОН- фосфату. Одночасно протон від Гіс 12 переходить до кисневого атома рибози. Утворюється другий продукт, а фермент повертається у вихідний стан H-OH
лізоцим
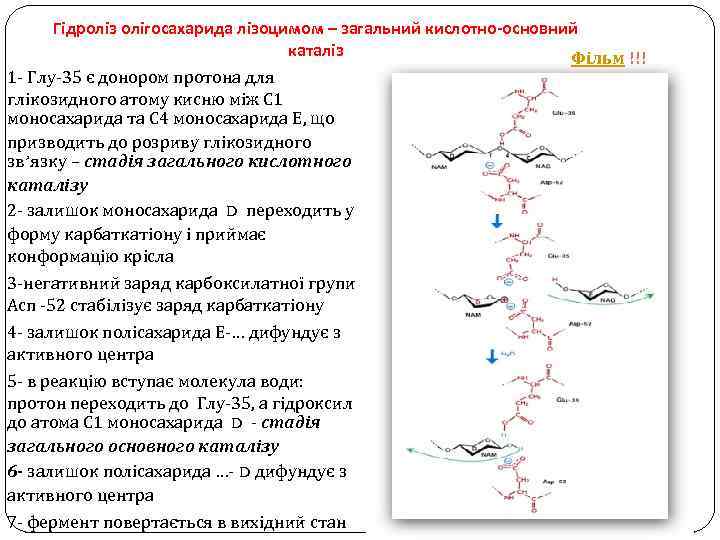
Гідроліз олігосахарида лізоцимом – загальний кислотно-основний каталіз Фільм !!! 1 - Глу-35 є донором протона для глікозидного атому кисню між С 1 моносахарида та С 4 моносахарида Е, що призводить до розриву глікозидного зв’язку – стадія загального кислотного каталізу 2 - залишок моносахарида D переходить у форму карбаткатіону і приймає конформацію крісла 3 -негативний заряд карбоксилатної групи Асп -52 стабілізує заряд карбаткатіону 4 - залишок полісахарида Е-… дифундує з активного центра 5 - в реакцію вступає молекула води: протон переходить до Глу-35, а гідроксил до атома С 1 моносахарида D - стадія загального основного каталізу 6 - залишок полісахарида …- D дифундує з активного центра 7 - фермент повертається в вихідний стан
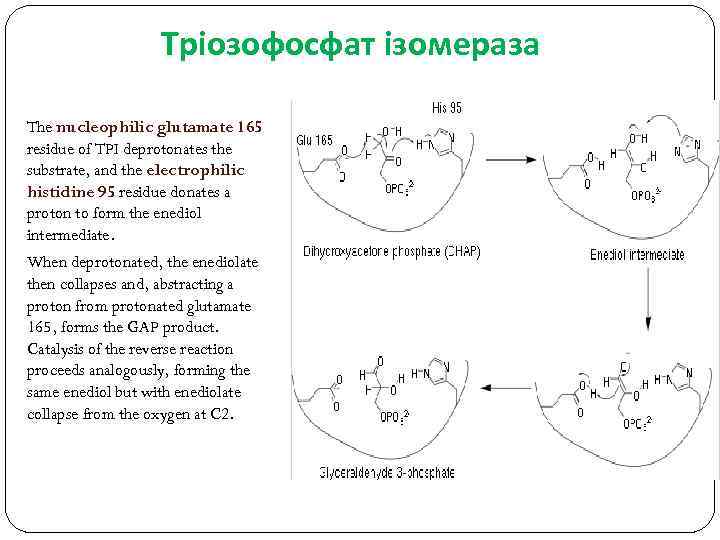
Тріозофосфат ізомераза The nucleophilic glutamate 165 residue of TPI deprotonates the substrate, and the electrophilic histidine 95 residue donates a proton to form the enediol intermediate. When deprotonated, the enediolate then collapses and, abstracting a proton from protonated glutamate 165, forms the GAP product. Catalysis of the reverse reaction proceeds analogously, forming the same enediol but with enediolate collapse from the oxygen at C 2.

Кислотно-основний каталіз При участі великої кількості нуклеофільних і електрофільних груп можлива велика кількість їх комбінацій. Ця різноманітність окремих механізмів породила численні теорії каталізу, які, однак, відрізняються лише використовуваними термінами, як, наприклад, "естафетна передача заряду" ( для механізму 1), "пушпульна" взаємодія (або ж принцип " тягни-штовхай") для механізму 2, "ланцюг переносу заряду (або зв'язку)".

Ковалентний каталіз • Полягає в атаці нуклеофільних (негативно заряжених) чи електрофільних (позитивно заряжених) груп активного центра фермента молекулами субстрата з формуванням ковалентного зв’язку між субстратом і коферментом або функціональною групою аміокислотного залишка активного центра фермента. • Перевага використання залишка в активному центрі замість молекули води полягає в тому, що формування ковалентного зв’язку призводить до мономолекулярної реакції, що є ентропічно вигіднішою за бімолекулярну реацію • Ковалентний каталіз відбувається в 2 етапи: формування та розпад ковалентної проміжної ланки, а не

Ковалентний електрофільний каталіз Електрофіл – катіон чи речовина, що при реакції віддає пару електронів на утворення нового зв’язку Електрофільність визначається: 1. Кислотністю і здатністю до поляризації та відновлення 2. Природою субстрату, що атакується Для ферментів – обмежене значення Н. : іони металів, піридоксальфосфату Катіонний електрофіл Нейтральний електрофіл
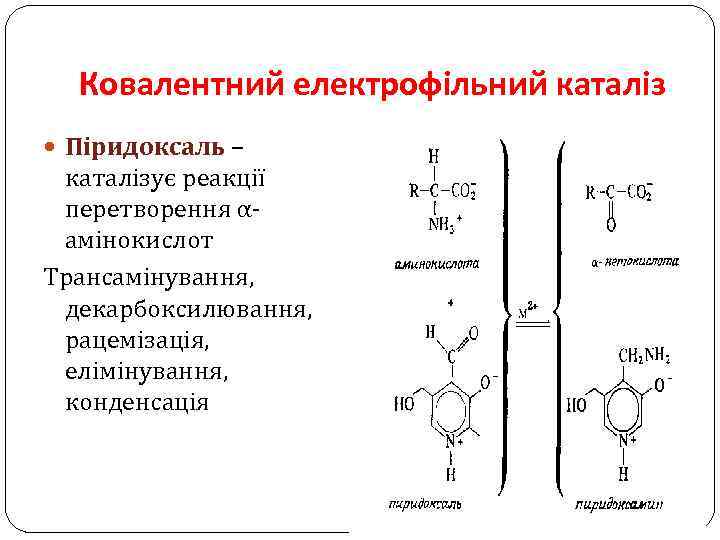
Ковалентний електрофільний каталіз Піридоксаль – каталізує реакції перетворення αамінокислот Трансамінування, декарбоксилювання, рацемізація, елімінування, конденсація
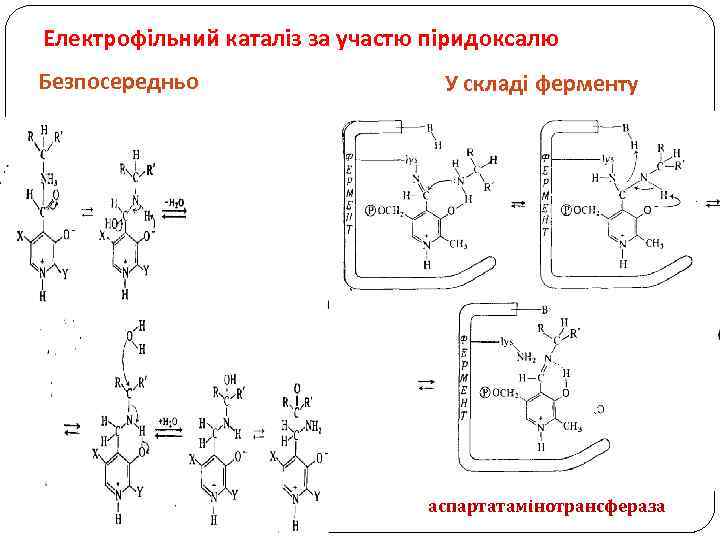
Електрофільний каталіз за участю піридоксалю Безпосередньо У складі ферменту аспартатамінотрансфераза

Типи ковалентного каталізу нуклеофільний Нуклеофіл – аніон чи речовина, що при реакції віддає пару електронів на утворення нового зв’язку Нуклеофільність визначається: 1. основністю і здатністю до поляризації та окислення 2. природою субстрату, що атакується Нуклеофільність зростає, якщо поблизу знаходиться сильний електронегативний атом (альфа-ефект) R−X + Y− → R−Y + X− (аніонний нуклеофіл) R−X + Y−Z → R−Y + X−Z (нейтральний нуклеофіл)

Ковалентний нуклеофільний каталіз Типи нуклеофілів, що входять до складу апоферментів Апофермент 1. Спиртова (алкоксидна ) група серина чи треоніна 2. Сульфгідрильна група цистеїна Діють в присутності загальних основ, що підвищують їх нуклеофільність Кофермент Тіамінпірофосфат Тетрагідрофолієва кислота, тощо
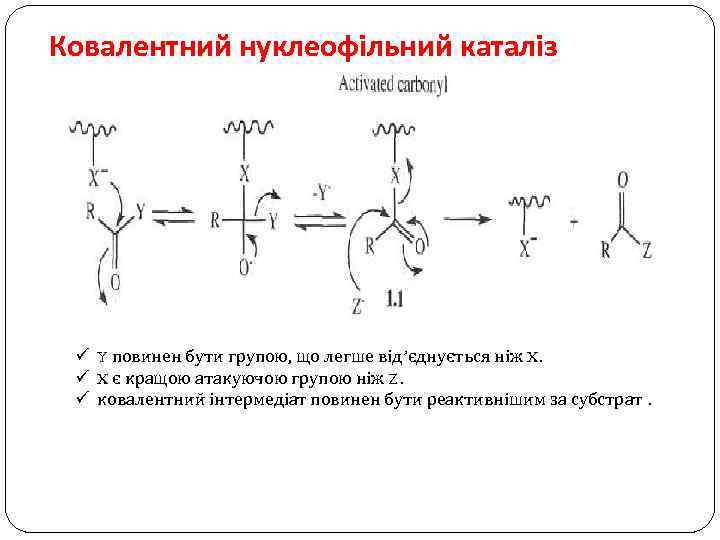
Ковалентний нуклеофільний каталіз ü Y повинен бути групою, що легше від’єднується ніж X. ü X є кращою атакуючою групою ніж Z. ü ковалентний інтермедіат повинен бути реактивнішим за субстрат.
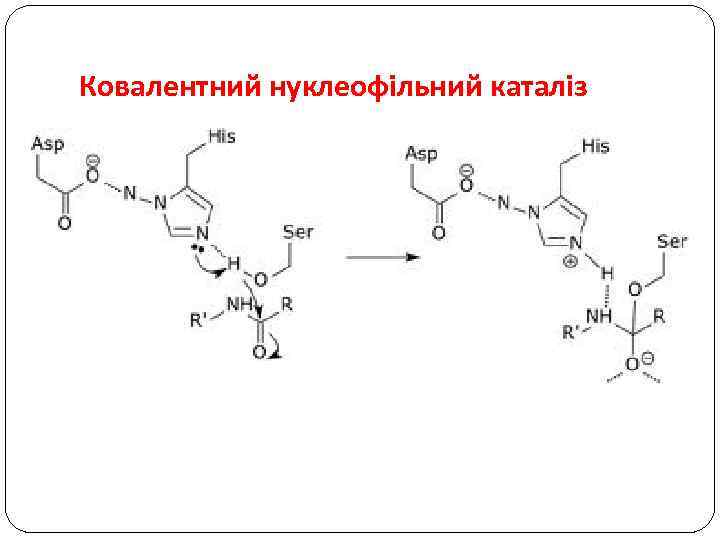
Ковалентний нуклеофільний каталіз
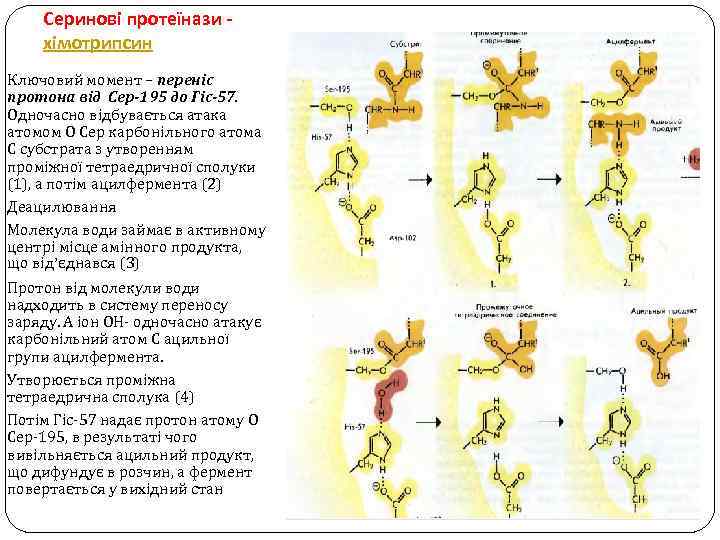
Серинові протеїнази хімотрипсин Ключовий момент – переніс протона від Сер-195 до Гіс-57. Одночасно відбувається атака атомом О Сер карбонільного атома С субстрата з утворенням проміжної тетраедричної сполуки (1), а потім ацилфермента (2) Деацилювання Молекула води займає в активному центрі місце амінного продукта, що від’єднався (3) Протон від молекули води надходить в систему переносу заряду. А іон ОН- одночасно атакує карбонільний атом С ацильної групи ацилфермента. Утворюється проміжна тетраедрична сполука (4) Потім Гіс-57 надає протон атому О Сер-195, в результаті чого вивільняється ацильний продукт, що дифундує в розчин, а фермент повертається у вихідний стан
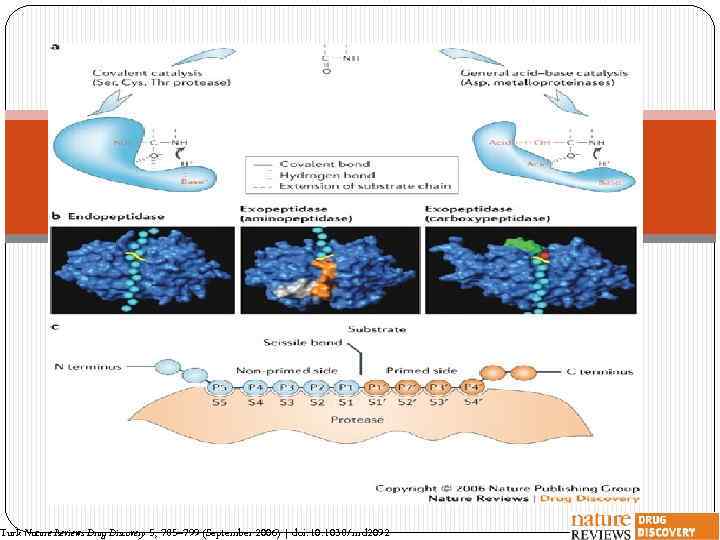
Turk Nature Reviews Drug Discovery 5, 785– 799 (September 2006) | doi: 10. 1038/nrd 2092

Електростатичний каталіз Електростатичні взаємодії беруть участь у стабілізації перехідного стану субстрату у активному центрі ферменту. Зв’язки можуть бути утвореними кислотними чи лужними амінокислотними залишками, що входять до складу активного центру (Lys, Arg, Asp, Glu ) або металічними кофакторами. Електростатичні взаємодії можуть бути використаними для стабілізації кофактора у активному центрі ферменту. Можлива безпосередня участь електростатичних взаємодій у каталізі (активація атакуючих нуклеофілів, води тощо). Сила електростатичних взаємодій у активному центрі значно більша у порівнянні з водним середовищем, що зумовлено ефектами мікрооточення.

Роль металів у функціонуванні ферментів 2/3 ферментів є металоферментами Са 2+ - містять ферменти системи згортання крові Fe 2+ , Cu 2+ , Mn 2+ - оксидоредуктази Mg 2+ - кінази Se 2+ - глутатіонпероксидаза Zn 2+ - РНК-полімераза, алкогольдегідрогеназа

Роль металів у функціонуванні ферментів Стабілізують молекули субстрату 2. Стабілізують активний центр ферменту і третинну та четвертинну структури білкової частини 3. Беруть участь в ферментативному каталізі: 1. електрофільні активатори субстрату; 2. електрофільні активатори води 1.
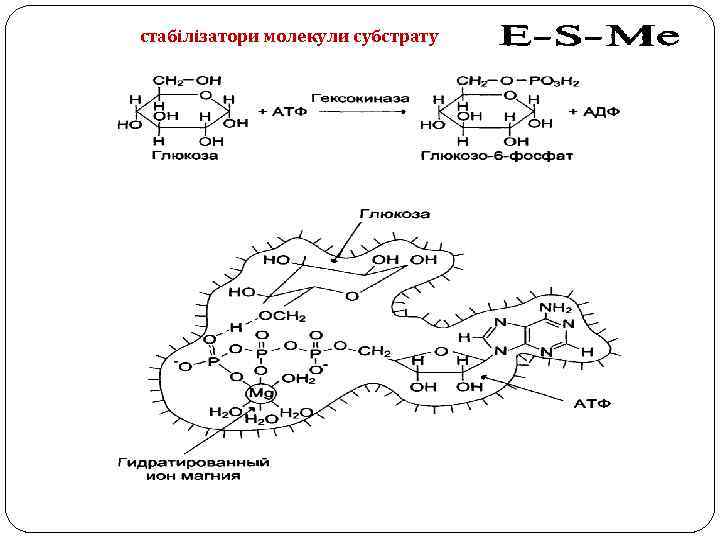
стабілізатори молекули субстрату
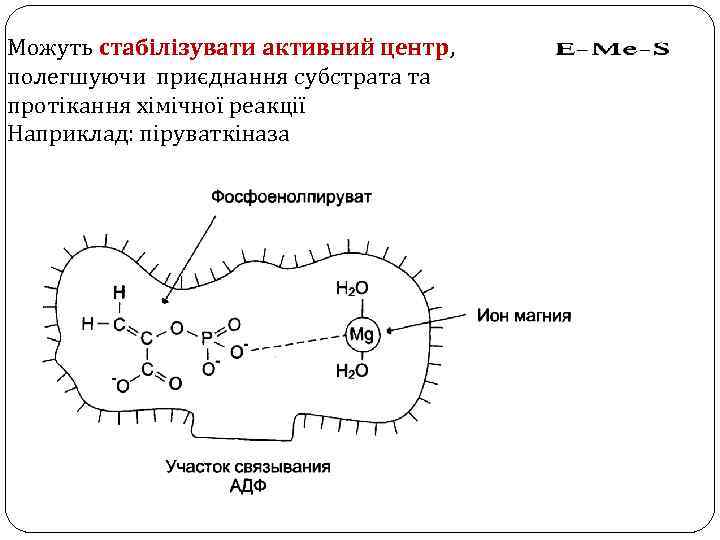
Можуть стабілізувати активний центр, полегшуючи приєднання субстрата та протікання хімічної реакції Наприклад: піруваткіназа
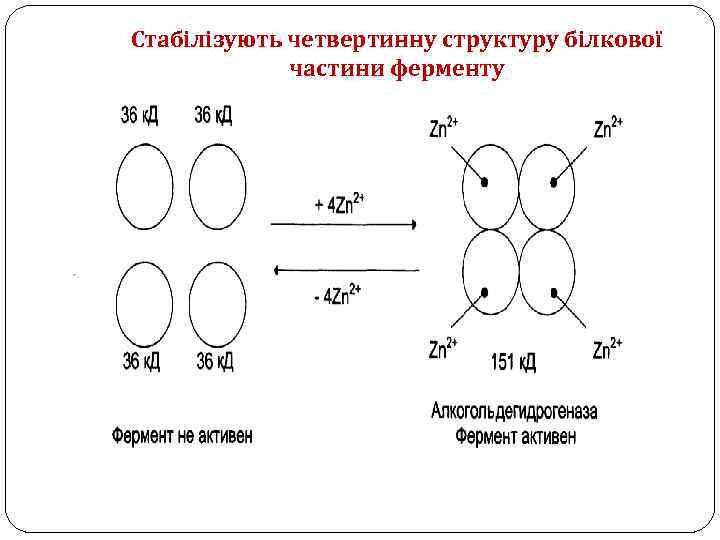
Стабілізують четвертинну структуру білкової частини ферменту
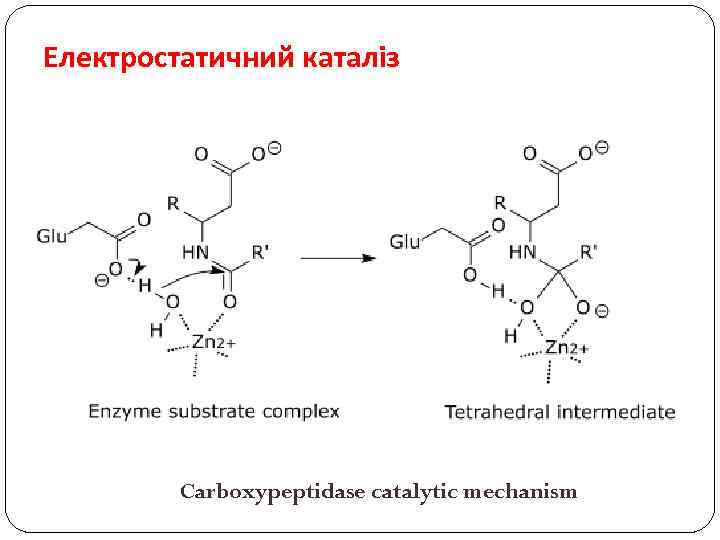
Електростатичний каталіз Carboxypeptidase catalytic mechanism
lecture_6_zblizennya_2011.pptx