 ОСНОВАНИЯ
ОСНОВАНИЯ
 Основания -это сложные вещества, состоящие из ионов металлов и гидроксильных групп (-ОН). Me(OH)n Общая формула оснований n - число ОН- групп, численно равное значению заряда иона (степени окисления) металла.
Основания -это сложные вещества, состоящие из ионов металлов и гидроксильных групп (-ОН). Me(OH)n Общая формула оснований n - число ОН- групп, численно равное значению заряда иона (степени окисления) металла.
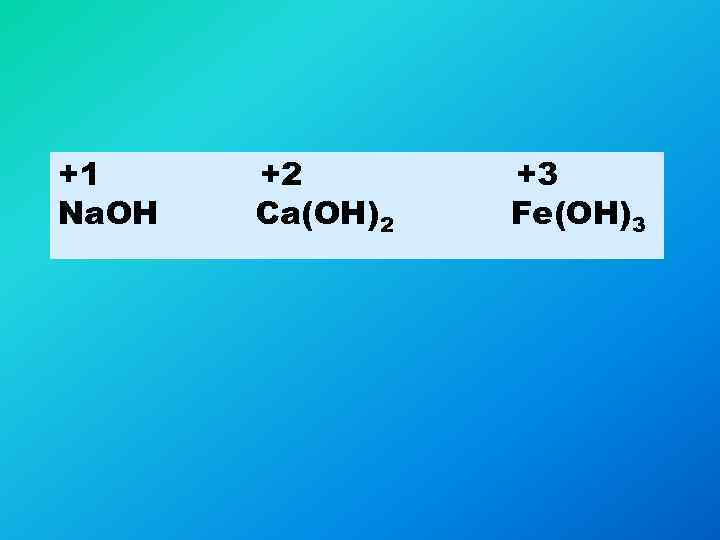 +1 Na. OH +2 Ca(OH)2 +3 Fe(OH)3
+1 Na. OH +2 Ca(OH)2 +3 Fe(OH)3
 Названия оснований Na. ОН гидроксид натрия Ca(OH)2 гидроксид кальция Fe(OH)3 гидроксид железа (III)
Названия оснований Na. ОН гидроксид натрия Ca(OH)2 гидроксид кальция Fe(OH)3 гидроксид железа (III)
 Тривиальные названия КОН едкое кали Na. OH едкий натр Ca(OH)2 гашеная известь, в растворе - известковая вода
Тривиальные названия КОН едкое кали Na. OH едкий натр Ca(OH)2 гашеная известь, в растворе - известковая вода
 Основаниям соответствуют оксиды металлов в той же степени окисления. Например: Na. OH – Na 2 O Ca(OH)2 – Ca. O Fe(OH)3 – Fe 2 O 3 Fe(OH)2 - Fe. O
Основаниям соответствуют оксиды металлов в той же степени окисления. Например: Na. OH – Na 2 O Ca(OH)2 – Ca. O Fe(OH)3 – Fe 2 O 3 Fe(OH)2 - Fe. O
 Классификация оснований Основания Растворимые (Щелочи) Na. OH, КОН, Ba(OH)2 Нерастворимые Cr(OH)2, Mn(OH)2, Fe(OH)3
Классификация оснований Основания Растворимые (Щелочи) Na. OH, КОН, Ba(OH)2 Нерастворимые Cr(OH)2, Mn(OH)2, Fe(OH)3
 Физические свойства оснований Основания - твердые вещества, различной растворимости в воде и различного цвета. Ba(OH)2 Na. OH Ca(OH)2 Cu(OH)2 Li. OH Co(OH)2
Физические свойства оснований Основания - твердые вещества, различной растворимости в воде и различного цвета. Ba(OH)2 Na. OH Ca(OH)2 Cu(OH)2 Li. OH Co(OH)2
 Химические свойства щелочей 1. Действие щелочей на индикаторы Индикаторы - вещества, изменяющие цвет в зависимости от среды. лакмус метилоранж фенолфталеин
Химические свойства щелочей 1. Действие щелочей на индикаторы Индикаторы - вещества, изменяющие цвет в зависимости от среды. лакмус метилоранж фенолфталеин
 Диссоциация оснований. 1) Na. OH ↔ Na+ + OH 2) Ba(OH)2 ↔ Ba 2+ + 2 OHOH- определяют щелочную среду раствора.
Диссоциация оснований. 1) Na. OH ↔ Na+ + OH 2) Ba(OH)2 ↔ Ba 2+ + 2 OHOH- определяют щелочную среду раствора.
 2. Взаимодействие с кислотами. Na. OH + HCl = Na. Cl + H 2 O реакция нейтрализации взаимодействие щелочей с кислотами
2. Взаимодействие с кислотами. Na. OH + HCl = Na. Cl + H 2 O реакция нейтрализации взаимодействие щелочей с кислотами
 3. Взаимодействие щелочей с кислотными оксидами. 2 Na. OH + SO 3 = Na 2 SO 4 + H 2 O Ca(OH)2 + CO 2 = Ca. CO 3↓ + H 2 O
3. Взаимодействие щелочей с кислотными оксидами. 2 Na. OH + SO 3 = Na 2 SO 4 + H 2 O Ca(OH)2 + CO 2 = Ca. CO 3↓ + H 2 O
 4. Разложение нерастворимых оснований при нагревании. t Cu(OH)2 = Cu. O + H 2 O
4. Разложение нерастворимых оснований при нагревании. t Cu(OH)2 = Cu. O + H 2 O
 Качественная реакция на СО 2 известковая вода мутнеет при пропускании углекислого газа: Са(ОН)2 + СО 2 = Са. СО 3↓ + Н 2 О
Качественная реакция на СО 2 известковая вода мутнеет при пропускании углекислого газа: Са(ОН)2 + СО 2 = Са. СО 3↓ + Н 2 О
 Получение оснований растворимых нерастворимых 1. Активный металл + вода 1. Соль (в растворе)+ щелочь = = щелочь + водород = нерастворимое основание + + другая соль 2 Na + 2 H 2 O= 2 Na. OH + H 2↑ 2. Оксид активного металла + вода = щелочь Ca. O + H 2 O = Ca(OH)2 Fe. Cl 3 + 3 Na. OH = =Fe(OH)3↓ + 3 Na. Cl
Получение оснований растворимых нерастворимых 1. Активный металл + вода 1. Соль (в растворе)+ щелочь = = щелочь + водород = нерастворимое основание + + другая соль 2 Na + 2 H 2 O= 2 Na. OH + H 2↑ 2. Оксид активного металла + вода = щелочь Ca. O + H 2 O = Ca(OH)2 Fe. Cl 3 + 3 Na. OH = =Fe(OH)3↓ + 3 Na. Cl